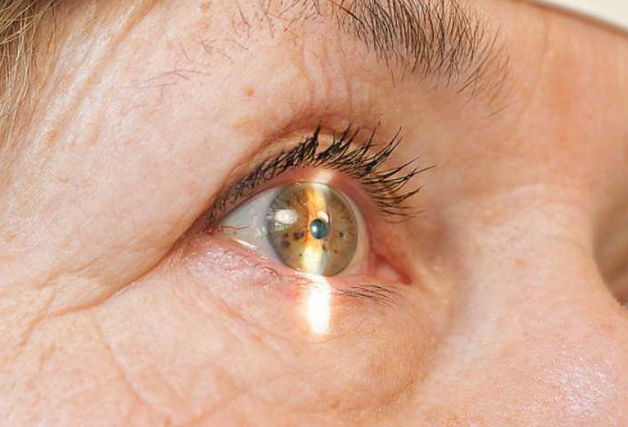
Разрыв пигментного эпителия сетчатки
Козина Е.В., Малафеев А.В., Заболотний А.Г., Рудь Л.И.
Актуальность. Интравитреальное введение A-VEGF-препарата на сегодняшний день является эффективным и безопасным методом лечения влажной формы возрастной макулодистрофии (ВМД). В России единственным зарегистрированным A-VEGF-препаратом для интраокулярного введения является Луцентис®.
В клинической практике различные морфологические изменения влажной ВМД могут по-разному реагировать на купирование экссудативного процесса в макуле под действием блокаторов фактора роста эндотелия сосудов человека. Так, например, при лечении ВМД с высокой отслойкой пигментного эпителия (ПЭ) в течение 1-2 мес. после инъекции может развиваться разрыв ПЭ. Известно, что разрыв ПЭ развивается в результате тангенциальной тракции на границе между неотслоенным и отслоенным ПЭ. По данным зарубежных авторов, частота развития таких изменений на фоне A-VEGF-терапии составляет 0,6% [Smith B.T. et al., 2009]. Подобные изменения могут приводить к существенному снижению остроты зрения.
Оптическая когерентная томография (ОКТ) сетчатки, позволяющая проводить качественный (морфология и рефлективность сигнала) и количественный (толщина сетчатки и ее объем в зоне сканирования) анализы сетчатой оболочки, является высокоинформативным методом обследования пациентов с влажной формой ВМД.
Цель. Ретроспективно определить ОКТ критерии потенциального развития разрыва ПЭ при A-VEGF-терапии пациентов с влажной ВМД, сопровождающейся высокой отслойкой пигментного эпителия (ПЭ), для прогнозирования возможного исхода лечения и определения оптимального режима введения препарата.
Материал и методы. Выполнен ретроспективный анализ результатов лечения 450 глаз с влажной формой ВМД, подтвержденной данными ОКТ, флюоресцентной ангиографии (ФАГ) и офтальмоскопии, интравитреальным введением A-VEGF-препарата, курсом ежемесячных инъекций. Проведен качественный анализ исходной ОКТ в группе I — с разрывами ПЭ после A-VEGF-терапии (4 глаза), и в группе II — с прилеганием высокой отслойки ПЭ (5 глаз) после A-VEGF-терапии. Возраст пациентов — от 70 до 83 лет. ОКТ макулярной зоны сетчатки проводилась на аппарате SOCT CIRRUS HD (Carl Zeiss) с разрешающей способностью 5 мкм, до начала лечения и через 1 мес. после инъекции. ФАГ выполнялась при необходимости по стандартной методике.
Результаты и обсуждение. В общей группе пациентов наличие высокой отслойки ПЭ было выявлено у 42 чел., что составило 9%, определено 4 разрыва ПЭ через 1 мес. после интравитреального введения A-VEGF-препарата, что составило 0,9%. Все пациенты с разрывом ПЭ, по данным исходной ОКТ, имели высокую отслойку ПЭ.
Из данных, представленных в табл. 1, видно, что во всех исследуемых глазах 1 группы в макулярной зоне по данным первичной ОКТ имелись экранирование мембраны Бруха и складчатая форма элевации ПЭ не выше 500 мкм. Дефект пигментного эпителия выявлен только в 1 случае, экссудативные отслойки нейроэпителия во всех случаях были локальными. Данные ОКТ пациентов 2 группы характеризовались наличием распространенных отслоек нейроэпителия, высоких пузырных отслоек ПЭ (до 800 мкм), визуализацией дефекта в ПЭ и наличием зон прорастания хориоидальной неоваскуляризации (ХНВ) в ПЭ распространенностью более 1000 мкм.
Острота зрения пациентов первой группы в исходе лечения снизилась до 0,1 (табл. 2). Функциональные результаты пациентов второй группы — острота зрения повысилась в среднем на 0,15.
Выводы. ОКТ критериями прогнозирования риска разрыва ПЭ, приводящего к стойкому снижению остроты зрения при A-VEGF-терапии пациентов с влажной ВМД, являются: 1. Выраженность субретинальной экссудации: локальные отслойки нейроэпителия распространенностью не более 300 мкм; экранирование мембраны Бруха. 2. Форма отслойки ПЭ: складчатость; высота — до 500 мкм. 3. Состояние ПЭ: отсутствие дефектов в ПЭ; зоны прорастания ХНВ в ПЭ распространенностью менее 700 мкм.
Наличие у пациента ОКТ признаков риска разрыва ПЭ требует повышенной осторожности в планировании необходимости A-VEGF-терапии, а также выбора индивидуального режима повторных инъекций.
Источник
Пигментный эпителий сетчатки представляет собой слой клеток, локализованных вне нервной ее оболочки. Этот слой образуют специфические светочувствительные элементы ткани, которые обеспечивают важнейшие функции органа зрения.
Отслойка пигментного эпителия возникает из-за нарушения нормального прилегания пигментного эпителия к мембране Бруха. Патология может возникать по причине воспалительных, сосудистых или дистрофические процессов. Существование отслойки может быть длительным, практически без динамики процесса, может исчезать спонтанно, может из-за инвазии сосудов хориоидеи трансформироваться в геморрагическую отслойку. Правда, чаще всего проникновение серозной жидкости из-под отслоенного пигментного эпителия в субретинальное пространство провоцирует возникновение серозной отслойки нейроэпителия сетчатки. Кроме того, не исключается разрыв отслоенного участка пигментного эпителия (спонтанный либо по причине интенсивной лазеркоагуляции). Это приводит к резкому снижению зрительных функций.
Отслойка пигментного эпителия – процесс, как правило, односторонний. Чаще возникает у молодых мужчин.
Признаки заболевания и критерии диагностики
При частичном отслоение макулярной области сенсорной сетчатки от пигментного эпителия прозрачной и чистой серозной жидкостью возникает расплывчатость зрения либо туман перед глазами. Видимые предметы искривлены и уменьшаются в размерах. Колебание остроты зрения по таблицам определяется в границах 1,0 — 0,4. Исследование с решеткой Амслера выявляет искривление прямых линий, нередко обнаруживается присутствие скотомы.
Для диагностики заболевания назначают следующие офтальмологические исследования:
- Визометрия.
- Офтальмоскопия.
- Периметрия
- Флуоресцентная ангиография.
- Тестирование с сеткой Амслера.
Кроме того, назначают обязательные лабораторные анализы: общий анализ крови
и мочи; кровь на RW и сахар.
Может понадобиться проведение ЭКГ и консультация терапевта.
При отслойке пигментного эпителия, края отслойки видно четче, чем в случае центральной серозной хориоретинопатии. Данный процесс характерен для центральной серозной хориоретинопатии и возрастной макулодистрофии.
Лечение
Для лечения отслойки пигментного эпителия сетчатки, пациента обязательно помещают в офтальмологический стационар, сроком на 14 дней, где к нему могут быть применены консервативные и хирургические методы.
Цель лечения – добиться анатомического прилегания сетчатки, уменьшения размеров центральной скотомы, повышения остроты зрения.
Консервативное лечение заболевания, как правило, включает инъекции (субконъюнктивально) кортикостероидов, применение ангиопротекторов и антиоксидантов, прием неспецифических противовоспалительных средств и диуретиков. Назначается осмотерапия, препараты с сосудорасширяющими и антигистаминными свойствами.
При отсутствии эффекта от применения консервативной терапии в течение 3-х недель либо в случае рецидива заболевания, проводится лазеркоагуляция. Также она может быть проведена спустя 2 месяца при положительной динамике от консервативной терапии либо в случае необходимости очень быстрого восстановления зрения, что связано с профессией пациента.
Общая нетрудоспособность пациента составляет 3-4 недели. После выписки из стационара ему показана диспансеризация.
Противопоказаны физические нагрузки, работа с наклоном туловища, сотрясением или вибрацией, а также с воздействием отравляющих и токсических веществ. Людям, занимающимся умственным трудом, необходимо сокращение объема работы.
Среди возможных осложнений заболевания – его рецидив.
Источник
Шеремет Н.Л., Микаелян А.А., Андреев А.Ю., Плюхова А.А., Федоров А.А., Андреева Н.А., Киселев С.Л.
Актуальность
Ретинальный пигментный эпителий (РПЭ) представляет собой монослой клеток, который играет существенную роль в функционировании и жизнедеятельности фоторецепторов (ФР) и всей нейросенсорной сетчатки в целом. Дегенеративные изменения РПЭ наблюдаются при наследственных заболеваниях сетчатки, а также возрастной макулярной дегенерации (ВМД) и других заболеваний, связанных с РПЭ, которые приводят к необратимой потери зрения и слепоте у взрослых.
РПЭ выполняет ряд важных функций для поддержания полноценной работы сетчатки. Помимо транспорта питательных веществ и выведения продуктов жизнедеятельности из ФР, он выполняет фагоцитоз наружных сегментов ФР, транспортировку и регенерацию зрительного пигмента. Таким образом, любые нарушения в трофике и функционировании РПЭ приводят к вторичному повреждению ФР, а это, соответственно, к нарушению правильного функционирования всего зрительного аппарата.
Одним из многообещающих методов лечения дегенераций сетчатки считается трансплантация стволовых клеток (СК). В качестве источника стволовых клеток рассматривались эмбриональные стволовые клетки (чЭСК) и индуцированные плюрипотентные стволовые клетки (иПСК) [3].
В ходе проведения многочисленных экспериментальных исследований трансплантации СК были проведены на разных видах животных. Многие возможные типы клеток были протестированы на модели крысы RCS (The Royal College of Surgeons) с наследственной дегенерацией сетчатки, связанной с мутацией в гене merTK, с положительным результатом [5]. Однако пересадка СК грызунам проводится путем транссклерального подхода через хориоидею. При таком введении внешний гематоретинальный барьер нарушается, что может привести к воспалительным и иммунным реакциям, интра- и постоперационным кровоизлияниям, к ошибочной интерпретации результатов [8].
По сравнению с грызунами, кролики считаются более подходящими животными для трансплантации СК, поскольку глаз кролика больше по размеру, что позволяет выполнять хирургическую технику при помощи приборов и инструментов, идентичных клиническим условиям [4]. При этом в естественных условиях можно полноценно оценивать состояние трансплантированных клеток и контролировать их в динамике [7].
Поскольку трансплантация РПЭ направлена на лечение дегенеративно-дистрофических заболеваний сетчатки, необходимо разработать модель этих патологических состояний на животных.
Цель
Создание экспериментальной модели повреждения пигментного эпителия сетчатки.
Материал и методы
В исследование были включены 10 кроликов (10 глаз) в возрасте 2,5-3,5 мес. и весом 2,5-3,5 кг. В соответствии с правилами «О работе с экспериментальными животными» кроликам оперировали только один глаз. Все кролики были разделены на 2 группы:
1 группа (5 кроликов, 5 глаз): субретинальная инъекция сбалансированного солевого раствора (BSS) через pars plana без лазеркоагуляции и витрэктомии;
2 группа (5 кроликов, 5 глаз): субретинальная инъекция BSS выполнялась после предварительной витрэктомии, операция заканчивалась лазеркоагуляцией сетчатки вокруг места инъекции.
На 1, 3, 5, 15 и 21 день после операции проводилась офтальмоскопия, оптическая когерентная томография (ОКТ; томограф RTVue-100), на 5, 15 и 21 день – аутофлюоресценция (АФ; Heidelberg Engineering GmbH, Германия).
За 30 минут до операции кроликам инстилировали Proxymetacaine для местной анестезии и Tropicamide для расширения зрачка. В качестве наркоза применяли внутримышечные инъекции Tiletamine Hydrochloride/Zolazepam Hydrochloride в комбинации с Xylazine Hydrochloride в соотношении 60% к 40% (0,5 мл на кролика весом 3 кг).
1-ая группа: конъюнктива вскрыта ножницами и отсепарована от склеры на 1 и 10 часах, в 3 мм от лимба в образовавшиеся окна установлены 2 порта 25G, введен световод, оптическая система операционного микроскопа сфокусирована на диске зрительного нерва, в 5 мм от которого в темпоральном направлении произведена субретинальная инъекция 50 мкл BSS, операцию заканчивали наложением 2-х узловых швов (шелк 8/0).
2-ая группа: операция начиналась вышеописанным образом, порты устанавливались на 1, 4 и 10 часах. Подключена инфузионная система, введен световод, оптическая система сфокусирована на диске зрительного нерва, введен витреотом 25G. После выполнения центральной витрэктомии витреальная полость прокрашена суспензией Triamcinolone, индуцирована отслойка задней гиалоидной мембраны, витрэктомия выполнена в максимально полном объеме. В 5 мм от ДЗН в темпоральном направлении произведена инъекция 50 мкл BSS, образовавшийся в результате инъекции «пузырь» отдавливался в сторону от места вкола перфторорганическим соединением (ПФОС) для предотвращения рефлюкса. Вокруг места введения проведена эндолазеркоагуляция. ПФОС удалён методом пассивной аспирации. Операцию заканчивали наложением 2-х узловых швов (шелк 8/0).
В течение 7 дней после операции были проведены в/м инъекции Dexamethasone (2 мг/кг) и местно в течение 10 дней 3 р/д в оба глаза Dexamethasone/Neomycin/Polymyxin B.
Животные выводились из эксперимента методом воздушной эмболии под общим эфирным наркозом (согласно приказу МинВуза СССР № 724 от 13.11.1984 г.).
Результаты
По результатам исследования в 1-й группе после субретинального введения раствора BSS: у 3-х кроликов на 2-ой день операции была локальная отслойка нейроэпителия, у 1-го – тотальная отслойка и у 1-го – сетчатка прилежала. Однако в последующие дни у двух кроликов начались пролиферативные процессы в СТ в виде деструкции СТ, тяжей и тракций.
По данным офтальмоскопии у 2-й группы на 1-3 день после операции на глазном дне видна локальная отслойка нейроэпителия, расположенная ниже места вкола и небольшой разрыв (место вкола), окруженный лазеркоагулятами. На 5-21 день отмечается прилегание локальной отслойки нейроэпителия, атрофия сетчатки разной степени выраженности.
По данным ОКТ на 1-й и 3-й день после операции отмечается локальная отслойка нейроэпителия в области образованного пузыря, слои сетчатки и комплекс РПЭ / мембрана Бруха (МБ) рядом с отслойкой не изменены. На 5-й день – локальная отслойка полностью прилегла, дезорганизация в эллипсоидной зоне. На 15-й день – истончение всех слоев сетчатки, атрофия наружных слоев сетчатки, слои не дифференцируются. На 21-й день выявлена атрофия слоев сетчатки, дезорганизация комплекса ФР/РПЭ/МБ. По данным коротковолновой АФ (BAF) на 5, 15 и 21 день в области расположения пузыря отмечается множество гипер- и гипофлуоресцентных точек, свидетельствующих об изменениях в РПЭ. В интра- и послеоперационном периоде у животных 2-й группы осложнений не наблюдалось. Заявка на изобретение «Способ трансплантации стволовых клеток при повреждении пигментного эпителия сетчатки в эксперименте» № 2018133863 от 26.09.2018 г.
Обсуждение
Лечение дегенеративно-дистрофических заболеваний сетчатки на сегодняшний день остается одной из важных проблем, которая требует изучения. Как уже было отмечено, наиболее многообещающим методом лечения считается трансплантация СК. Для адекватного понимания эффективности трансплантации и интеграции СК в субретинальное пространство необходимо, в первую очередь, создать модель повреждения сетчатки, близкую по характеристикам клиническим случаям. Многими авторами были разработаны способы моделирования этих патологических состояний на животных с помощью химического, механического и светового повреждения [1]. Одни авторы для развития атрофии РПЭ крысам внутривенно вводили раствор натрия йодата (NaIO3) в различной дозировке [6]. Другие авторы для изучения поражения сетчатки методом трансвитреального введения через pars plana индуцировали субретинальные пузыри с помощью фосфат-буферного раствора (PBS) или BSS [2].
Однако существующие модели повреждения имеют некоторые недостатки. Проведенное нами исследование подтвердило результаты предыдущих авторов, при которых субретинальное введение BSS приводит к дегенерации сетчатки, однако в их работах риск отслойки сетчатки и пролиферативных процессов в сетчатке без предварительной витрэктомии был высокий. Такие же результаты были получены в данной работе в 1-ой экспериментальной группе. Из-за того, что плотность СТ выше, чем плотность введенного раствора, а также то, что у кролика СТ плотно спаяно с сетчаткой, проведение операции без предварительной витрэктомии не позволяет эффективно выполнять субретинальные инъекции и повышает риск возникновения пролиферативных процессов в сетчатке.
В исследованиях 2-ой экспериментальной группы мы продемонстрировали новый способ моделирования повреждения РПЭ, показали, что удаление СТ во время операции может уменьшить риск послеоперационных осложнений, введение ПФОС позволяет нивелировать обратный рефлюкс введённого раствора в стекловидное тело и сместить пузырь дальше от места вкола и, таким образом, тампонировать его. Лазеркоагуляция сетчатки вокруг места вкола «закрывает» отверстие и позволяет предупредить отслойку сетчатки в месте инъекции. Последующее удаление ПФОС необходимо для исключения дополнительного токсического воздействия на сетчатку, повышения внутриглазного давления и затруднения визуализации в послеоперационном периоде при проведении офтальмоскопии, спектральной ОКТ и АФ.
Выводы
Таким образом, субретинальное введение BSS без предварительной витрэктомии приводит к неконтролируемым осложнениям в виде отслойки сетчатки и пролиферативным процессам. Предложенный новый способ субретинального введения BSS позволяет моделировать дегенерацию РПЭ с последующей дегенерацией всех слоев сетчатки. Способ отличается отсутствием осложнений и позволяет в естественных условиях контролировать нейросенсорные слои сетчатки в течение длительного времени.
Источник
Павловский О.А.
В последние десятилетия патология витреомакулярнго интерфейса занимает ведущие позиции в структуре слабовидения взрослого населения развитых стран [2,4]. Одним из таких нарушений, приводящих к необратимому ухудшению зрения, являются макулярные разрывы. С точки зрения морфологии, макулярный разрыв представляет собой дефект нейросенсорной части сетчатки округлой формы в фовеолярной зоне с преимущественным появлением вертикального тракционного компонента. Частота встречаемости данной патологии среди лиц старше 55 лет составляет от 1% до 3% по разным литературным данным [1]. Причем частота встречаемости среди женского населения значительно выше [7]. Главной проблемой диагностики макулярных разрывов является бессимптомное течение на ранней стадии заболевания. Однако, при образовании разрыва до интерфейса пигментного эпителия сетчатки отмечаются выраженное снижение остроты зрения, метаморфопсии, выпадение центрального зрения с формированием скотомы [3].
Впервые МР были описаны в Германии Н. Кnарр в 1869 году. H. Kuhnt (1900 г.), рассматривал макулярный разрыв, как дегенеративный процесс, включающий сосудистые нарушения, которые ведут к атрофии сетчатки, а затем и формированию разрыва. В 1995 году J.D.Gass предложил теорию развития и классификацию макулярных разрывов[8]. В соответствии с теорией, ведущую роль в патогенезе макулярных разрывов отводят витреоретинальным тракциям. На основе этой теории была разработана наиболее используемая в настоящее время классификация макулярных разрывов с разделением на 4 стадии: стадия 1а характеризуется появлением желтого пятна в фовеоле с уменьшением глубины центральной ямки; стадия 1б проявляется образованием желтого кольца в фовеоле с исчезновением нормального фовеолярного рефлекса; стадия 2 характеризуется формированием сквозного дефекта сетчатки диаметром менее 400 μм с прикреплением задней гиалоидной мембраны к поверхности сетчатки; при стадии 3 сквозной дефект сетчатки увеличивается в диаметре и становится более 400 μм, прикрепление задней гиалоидной мембраны сохраняется; стадия 4 – это сквозной дефект сетчатки диаметром более 400 μм с полностью отслоившейся от поверхности сетчатки задней гиалоидной мембраной. Из данной классификации видно, что она основана лишь на офтальмоскопических данных. Представление о развитии данной патологии изменилось с появлением оптической когерентной томографии (ОКТ), что позволило взглянуть на морфологические и структурные изменения сетчатой оболочки при данной патологии [6]. На сегодняшний день существует несколько классификаций МР в зависимости от морфологии изменения центрального отдела сетчатки. Нижеприведенная классификация Gass дополнена по ОКТ признакам.
При ОКТ диагностике выявляются следующее признаки: деформация контура фовеолярного углубления и локальная отслойка нейроэпителия от внутреннего ядерного слоя. В результате образуется псевдокиста, имеющая вид гипорефлективной полости на внутренней поверхности фовеолы. Также определяется задняя гиалоидная мембрана, которая имеет адгезию к внутренней стенки образованной кисты (рис. 1).
При ОКТ диагностике выявляют:
деформацию поверхности сетчатки,
дефект наружного слоя сетчатки, края которого отделены от пигментного слоя эпителия сетчатки, а “крышечка” остается целостной (рис. 2).
Стадия 2. При ОКТ диагностике выявляют следующее:
деформация профиля сетчатки,
дефект “крышечки” с сохранением фиксации на одном из краев дефекта нейроэпителия задней гиалоидной мембраны,
начинают выявлять кистозный отек краев дефекта сетчатки,
диаметр отверстия до 200 мкм.
Стадия 3. При ОКТ-диагностике выявляют следующее:
резкую деформацию профиля сетчатки,
дефект всего нейроэпителия,
“крышечку”, фиксированную к задней гиалоидной мембране, которая полностью отслоена от сетчатой оболочки,
кистозный отек сетчатки и увеличение толщины сетчатки в области краев разрыва.
Стадия 4 (рис. 3). При ОКТ исследовании определяется:
резкая деформация профиля сетчатки,
наружный ядерный слой, наружная пограничная мембрана и линия сочленения наружных и внутренних сегментов фоторецепторов прерываются,
кистозный отек краев сетчатки и увеличение толщины сетчатки в области краев разрыва,
наличие субретинальной жидкости под краями отверстия.
Классификация в зависимости от глубины дефекта:
сквозные разрывы (рис. 4),
ламеллярные разрывы (рис. 5).
Классификация по этиологии:
первичные,
вторичные (травматические, на фоне осложненной миопии высокой степени, эпиретинальной мембраны, неоваскулярной мембраны).
Классификация в зависимости от величины разрыва:
малые (меньше 250 мкм),
средние (250-400 мкм),
большие (более 400 мкм), а также по наличию или отсутствию витреомакулярной тракции.
Особенностью вышеприведенных классификаций является возможность выбора тактики оперативного лечения при каждом случае в индивидуальном порядке. Тем не менее, остается ряд вопросов связанных с развитием макулярного разрыва в первой стадии. Некоторые офтальмохирурги считают, что в основе дебюта данного заболевания лежит ламеллярное макулярное отверстие. Согласно различным теориям ламеллярный разрыв может быть результатом спонтанной констрикции эпиретинальной мембраны, результатом витреомакулярной тракции или разрыва стенки кисты при кистозном отеке. При этом, до появления макулярного разрыва у пациентов может выявляется отсутствие нормального фовеолярного рефлекса[5]. При проведении ОКТ определяется деформация профиля сетчатки, часто присутствуют эпиретинальные мембраны, на уровне наружного плексиформного слоя визуализируется асимметричная горизонтальная щель, на уровне ядерных слоев могут определятся мелкие оптически пустые полости, связанные с отеком, наружный ядерный слой, наружная пограничная мембрана, линия сочленения наружных и внутренних сегментов фоторецепторов и комплекс пигментного эпителия – хориокапилляров сохранены.
Второй конкурирующей теорией развития макулярного разрыва является феномен образования макулярного псевдоотверстия. При этом, на фоне четко очерченного, глубокого, контура фовеа при ОКТ выявляется, что наружный ядерный слой и наружная пограничная мембрана, а также линия сочленения наружных и внутренних сегментов фоторецепторов и комплекса пигментного эпителия – хориокапилляров сохранены.
Не смотря на то, что при развитии витреоретинальной хирургии в 65% случаев проводится успешное лечение макулярных разрывов, этиопатогенетические аспекты данного процесса остаются не решенными. Так, спорным моментом остается целесообразность полного удаления внутренней пограничной мембраны и отсутствие хирургической заинтересованности к экстракции гиалоида. Например, Байбородов Я.В. [3] предлагает проведение операции только с удалением адгезии стекловидного тела без удаления внутренней пограничной мембраны. Последние несколько лет стала популярна методика использования аутокрови для закрытия сквозных дефектов [4], тем не менее, эффективность данной технологии остается дискуссионной. Основным фактором выбора тактики оперативного лечения является классификационная составляющая дефекта макулярной зоны, т.к. она позволяет определить наибольшую целесообразность применения того или иного метода лечения в определенной стадии заболевания.
Таким образом, отсутствие заинтересованности внутренней пограничной мембраны в патологическом процессе и участие гиалоида во всех стадиях патологического процесса определяет необходимость разработки нового подхода к оперативному лечению без полного удаления пограничной мембраны.
Источник