Проблемы при первичной глаукоме
Discussing glaucoma problems.
Report at the conference «Actual problems of glaucoma»
Report at the conference «Actual problems of glaucoma»
A.P. Nesterov
Russian State Medical University
Article reveals problems of glaucoma pathogenesis, progression risk factors and main directions of glaucoma treatment which need improvement.
До настоящего времени нет четкого и общепризнанного определения глаукомы. До середины прошлого столетия глаукома ассоциировалась с повышением внутриглазного давления. В дальнейшем было показано, что повышение давления в глаукомном глазу вызвано ухудшением оттока водянистой влаги (ВВ) из глаза [8]. Повышенное ВГД и низкие показатели коэффициента легкости оттока (КЛО) рассматривали, как кардинальные признаки глаукомы [5].
Характерные для глаукомы нарушения зрительных функций и изменения головки зрительного нерва (ГЗН) относили к последствиям, обусловленными патогенным действием повышенного ВГД. Для постановки диагноза хронической глаукомы и назначения гипотензивной терапии было достаточно сочетания повышенного ВГД с низкими значениями КЛО [5].
Во второй половине ХХ века накопилось много фактов, указывающих на то, что определение глаукомы не укладывается в изложенную выше простую схему. Многие исследователи пришли к выводу, что глаукомная оптическая нейропатия (ГОН) – последствие дефицита кровоснабжения ГЗН. Были описаны и детально изучены феномены доброкачественной офтальмогипертензии без нарушения зрительных функций при продолжительном наблюдении [2, 9] и нормотензивной глаукомы с прогрессирующими глаукомного типа дефектами зрения и ДЗН [7].
Эти наблюдения послужили основанием для пересмотра определения глаукомы. Так, R. Ritch, M.B. Shields и Th. Krupin в книге, опубликованной в 1996 г. [13], определяют глаукому, как оптическую нейропатию, характеризующуюся специфическими изменениями поля зрения и головки зрительного нерва. Повышенное ВГД они рассматривают только как фактор риска. Аналогичное определение содержится и в методических рекомендациях Европейского глаукомного общества, изданных в 1998 г. [14].
В этих и во многих других современных работах диагноз глаукомы рекомендуется ставить только при обнаружении симптомов оптической нейропатии, а гипотензивное лечение при отсутствии этих симптомов назначать при повышении ВГД, по крайней мере, до 30 или даже до 35 мм рт. ст.
Такой подход к диагностике глаукомы и к назначению гипотензивного лечения представляется сомнительным. Ранние и вместе с тем клинически распознаваемые признаки характерных для глаукомы изменений зрительных функций и ДЗН обнаруживаются современными методами исследования только после гибели значительной части ганглиозных клеток сетчатки, нередко через несколько лет после начала заболевания [11], а ранняя и успешная гипотензивная терапия существенно снижает опасность перехода офтальмогипертензии в развитую стадию глаукомы [2].
Определение
Термин «глаукома» объединяет большую группу заболеваний глаза (более 60) различного генеза, которая в продвинутой стадии болезни характеризуется развитием оптической нейропатии с типичными изменениями зрительных функций, головки зрительного нерва (ГЗН) и внутренних слоев сетчатки. В ранней стадии диагноз глаукомы может быть поставлен в каждом конкретном случае с учетом имеющихся факторов риска и патогенных факторов.
Этапы патогенеза глаукомы
Независимо от клинико–патогенетической формы глаукомного процесса его развитие, как правило, проходит следующие этапы:
– нарушение оттока водянистой влаги (ВВ) из глаза;
– повышение внутриглазного давления (ВГД) за пределы индивидуального толерантного уровня;
– ишемия ГЗН;
– атрофия зрительного нерва и ганглиозных клеток сетчатки.
При этом ишемия ГЗН может быть последствием повышения ВГД или иметь независимое происхождение и только усиливаться под влиянием офтальмогипертензии [2].
В дальнейшем, в докладе освещены проблемы, связанные преимущественно с первичной открытоугольной глаукомой (ПОУГ) ввиду преобладания этой клинико–патогенетической формы в практике врача–офтальмолога.
ПОУГ относят к мультифакториальным заболеваниям с пороговым эффектом. Мультифакториальные заболевания отличаются тем, что отсутствует определенная первопричина болезни.
В таких случаях следует определить основные структуры–мишени, факторы риска (ФР), антириска (ФАР) и патогенные факторы (ПФ), взаимодействие которых формирует этапы патогенеза, обусловливает возникновение и течение болезни. У различных больных можно обнаружить неодинаковые ФР, ФАР и ПФ. Поэтому ПОУГ следует отнести к гетерогенным заболеваниям.
Структуры–мишени при первичной
открытоугольной глаукоме (ПОУГ)
Основными первичными мишенями ПОУГ являются структуры дренажной системы глаза (ДСГ) и головки зрительного нерва. Ганглиозные клетки сетчатки и их аксоны поражаются вторично.
Трабекулярная диафрагма и шлеммов канал
Дренажная система глаза – это трабекулярная диафрагма (ТД), шлеммов канал и коллекторные канальцы. Трабекулярная диафрагма состоит из нескольких перфорированных и покрытых эндотелием пластин, разделенных щелями и слоя неперфорированной (юкстаканаликулярной) ткани (ЮКТ), примыкающей к эндотелию внутренней стенки шлеммова канала. В здоровых глазах основное сопротивление оттоку ВВ оказывает ЮКТ и эндотелий внутренней стенки шлеммова канала [10, 12].
В глазах с ПОУГ толщина этого слоя увеличивается, в нем нарушается структура эластических волокон и появляются очаговые микрофибриллярные отложения, ухудшающие фильтрующую способность ТД. Последние исследования показывают, что ТД обладает способностью к ауторегуляции оттока ВВ за счет активной деятельности своих клеточных структур. В условиях гипоксии эта способность снижается или исчезает полностью.
Шлеммов канал (ШК) – циркулярная, с неравномерным просветом щель в фиброзной оболочке глаза, покрытая эндотелием и отделенная от передней камеры ТД. На изолированных от глаза и фиксированных препаратах ширина канала составляет 300–500 мкм, высота просвета в среднем около 25 мкм [10]. В живом глазу высота просвета канала величина динамичная, зависящая от разности давлений по обе стороны от ТД. При ухудшении фильтрации ВВ через ТД разность давлений увеличивается и диафрагма прогибается кнаружи, суживая просвет канала. Смещение ТД в просвет ШК на 25 мкм достаточно для возникновения функциональной блокады канала в отдельных его участках. Фильтрация ВВ через сегменты ТД, прилежащие к блокированным участкам ШК, также останавливается или резко снижается [10]. Поскольку ВВ является единственным источником снабжения трабекулярной ткани кислородом и нутриентами, то в этих сегментах ТД усиливаются дистрофические процессы.
Головка зрительного нерва
ГЗН – короткий отрезок зрительного нерва, включающий его внутриглазную часть и небольшой орбитальный участок нерва, получающих кровоснабжение от возвратных ветвей задних коротких цилиарных артерий. Различают ретинальный, преламинарный, ламинарный и ретробульбарный отделы ГЗН. Начальной мишенью глаукомы в ГЗН является решетчатая пластинка склеры (РПС), которая перегораживает склеральный канал зрительного нерва. Как и ТД, многослойная, перфорированная РП прогибается кзади при повышении разности давлений по обе ее стороны. Деформация РП приводит к ущемлению в ее канальцах пучков аксонов ганглиозных клеток сетчатки и к блокаде аксонального транспорта (АТ) нейротрофических факторов из церебральных структур [1, 13].
Ишемия и гипоксия ГЗН [9], также как и повышенное ВГД, может блокировать аксональный транспорт. Продолжительная блокада АТ индуцирует апоптоз, прогрессирующую гибель ганглиозных клеток сетчатки и без деформации РПС [6]. При глаукоме повышенное ВГД служит причиной и деформации РПС, и (по крайней мере, частично) ишемии ГЗН.
Факторы риска, антириска и патогенные факторы
Факторы риска можно разделить на системные и локальные, и, как правило, они носят стационарный характер. К ним относятся наследственная предрасположенность, индивидуальные особенности анатомии дренажной системы, ГЗН и сосудистых структур глаза, миопия, артериальная гипотензия, сахарный диабет, гипотиреоз, дисциркуляторная энцефалопатия.
Глаз – часть ЦНС, поэтому ишемические поражения некоторых подкорковых структур (верхнее двухолмие среднего мозга, ядра наружного коленчатого тела), генерирующие церебральные трофические факторы, являются факторами риска возникновения и развития глаукомы. Связь мозга с сетчаткой осуществляется с помощью аксонального транспорта (АТ) трофических факторов к ГКС.
Факторы антириска, препятствующие возникновению и развитию глаукомы, изучены недостаточно. К ним относят некоторые анатомические и физиологические особенности (заднее положение в углу передней камеры ТД и шлеммова канала, малые размеры ГЗН, высокие показатели внутриглазной гемодинамики, сохранность аккомодации, гиперметропия). Факторы антириска особенно выражены у пациентов с доброкачественной офтальмогипертензией [2].
Цилиарная мышца осуществляет почти непрерывный массаж ТД, а сосудистая сеть мышцы служит одним из источников снабжения ВВ и ТД кислородом и нутриентами. Возникновение и прогрессирование глаукомы и пресбиопии не случайно совпадают по времени. Ранняя пресбиопия – фактор риска развития глаукомы, а поздняя – фактор антириска.
Патогенные факторы имеют прогрессирующий характер и входят в комплекс патогенетических механизмов глаукомы. Действие различных ФР и ПФ суммируется, но ПФ могут и потенцировать (взаимно усиливать) общий патогенный эффект.
К основным потенцирующим факторам при ПОУГ относят ухудшение оттока ВВ из глаза, вызванное дистрофическими изменениями трабекулярной диафрагмы и функциональным блоком шлеммова канала, повышение ВГД за пределы индивидуального толерантного уровня, ишемию и гипоксию ГЗН [2, 13, 14].
Индивидуальные варианты толерантного давления (тВГД) могут быть шире или уже статистически нормальных значений ВГД, тВГД снижается при уменьшении ликворного давления в ретробульбарном отделе зрительного нерва, при ишемии и гипоксии ГЗН и при ослаблении механической структуры ГЗН (особенно решетчатой пластинки склеры) [1, 2].
Общепризнанного метода определения индивидуального тВГД в настоящее время не существует, и его принято заменять понятием «целевое давление (цВГД)». Целевое ВГД – предполагаемый, безопасный для конкретного больного уровень давления. Наиболее распространенная рекомендация заключается в снижении ВГД на 30% от того уровня, при котором наблюдалась прогрессирование глаукомной оптической нейропатии [14].
К потенцирующим патогенным факторам следует отнести также эксфолиативный синдром (ЭС), который может носить местный и системный характер. Эксфолиативные отложения в экстрацеллюлярном матриксе трабекулярного аппарата и кровеносных сосудов ухудшают отток ВВ из глаза и усиливают процессы ишемии и гипоксии в пораженных тканях.
Вторичные патогенные факторы
Ущемление пучков нервных волокон в канальцах деформированной РПС и ишемия ГЗН прерывают поступление церебральных трофических факторов к ГКС и индуцирует процесс их гибели путем апоптоза.
В условиях хронической гипоксии ослабляется естественная антиоксидантная система, в тканях глаза увеличивается концентрация свободных радикалов кислорода, накапливаются продукты перекисного окисления и возбуждающие аминокислоты (глутамат и аспартат) [10].
Возникает глутамат–кальциевый каскад реакций, приводящий к накоплению ионов кальция в гиалоплазме ГКС, образованию опасных нейротоксинов и гибели нервных клеток (возможно, не только путем апоптоза, но и микронекрозов) [13].
Участие не всех приведенных выше ФР и ПФ в патогенезе ПОУГ можно считать доказанным. Не вполне изучены взаимодействие этих факторов и их удельный вес в патогенетической цепи глаукомы.
Внутриглазные жидкости
Внутриглазные жидкости (ВЖ) – водянистая влага (ВВ), стекловидное тело (СТ) и увеальная жидкость (УЖ) – накапливают продукты патологического метаболизма в условиях ишемии и гипоксии внутриглазных структур. Поэтому замедление циркуляции ВЖ можно рассматривать как фактор риска, участвующий в патогенезе глаукомы.
ВВ – основной источник кислорода и нутриентов для ТА, хрусталика и роговицы. Замедление циркуляции влаги служит причиной гипоксии трабекулярной ткани и накопления в водянистой влаге продуктов перекисного окисления липидов, глутамата и эндотелина.
Наиболее крупным и стабильным депо тех же опасных метаболитов служит СТ, которое контактирует как с сетчаткой, так и с ДЗН. Так же, как и в ВВ, в СТ глаукомных глаз накапливаются промежуточные и конечные продукты перекисного окисления липидов и глутамат.
Следует отметить отсутствие эффективного гематоофтальмического барьера между УЖ и структурами ГЗН. Свободные радикалы кислорода, продукты ПОЛ, вазопрессорные гормоны, вероятно, проникают из увеальной жидкости в преламинарный отдел ГЗН.
Проблемы терапии глаукомы
Глаз – относительно автономный орган, защищенный от внешних воздействий фиброзной оболочкой и ГОБ. Поэтому местные методы фармакотерапии эффективнее общих способов введения лекарственных препаратов. Особенно полезны методики с накоплением препаратов в «депо», которыми служат внутриглазные жидкости.
Глазные капли успешно используют ВВ в качестве депо для ЛП при лечении заболеваний переднего отдела глаза. Разработанные в нашей клинике методы «адресной терапии» заболеваний заднего сегмента глаза с накоплением препаратов в СТ через искусственно созданные «окна» в ГОБ успешно используются для лечения глаукомной оптической нейропатии [4].
К методам адресной терапии относится и технология СИКИС, при которой ЛП вводится в коллагеновую губку, помещенную в теноновом пространстве [3]. Прошли успешную проверку и новые методы аутобиотерапии ГОН, основанные на использовании ограниченного и управляемого воспаления [4]. Возникающие в микровоспалительных фокусах вазоактивные вещества поступают в «депо» (СТ или в коллагеновую губку) и затем в ишемические зоны сетчатки и ГЗН, восстанавливая нарушенное кровообращение.
Ниже приведены основные направления лечения глаукомы, нуждающиеся в усовершенствовании:
1. Разработка методики определения индивидуального толерантного (целевого) ВГД.
2. Снижение и стабилизация ВГД на толерантном (целевом) уровне.
3. Улучшение кровоснабжения глазных структур, восстановление ауторегуляции кровообращения в ГЗН и сетчатке.
4. Усовершенствование фармако– и физиотерапевтических нейропротекторных технологий.
5. Улучшение методов диспансеризации и мониторинга больных глаукомой.
Несмотря на определенные успехи современные методы терапии глаукомы страдают незаконченностью, недостаточной эффективностью и часто не отвечают требованиям доказательной медицины. Чем больше успехов, тем больше нерешенных проблем.
Проводимые во многих офтальмологических центрах исследования по этим направлениям позволят приблизить решение сложных проблем патогенеза и патогенетического лечения глаукомы.
Литература
1. Волков В.В. Глаукома при псевдонормальном давлении. – М. Медицина –2001. – 350 с.
2. Нестеров А.П. Глаукома. – М.Медицина – 1995. – 246 с.
3. Нестеров А.П., Басинский С.Н.// Вестн. офтальмол. – 1991. – № 5. – С. 11–14.
4. Нестеров А.П. Егоров Е.А., Егоров А.Е., Свирин А.В.// Клин. офтальмол. – 2002. – № 1. – С. 3–5.
5. Becker B.// Trans. Acad Ophtalmol. – 1961. – v. 65. – P. 156–162.
6. Flammer J. In: Ocular Blood Flow. – 1995. – Basel, Karger, – P. 12–40.
7. Geijssen H.S. Studies on Normal Pressure Glaucoma. – Amstelveen, Kugler, – 1991.
8. Goldmann H.// Docum. Ophthalmol. – 1951. – N 5–6. – P. 278–320.
9. Hayreh S.S.: In «Glaucoma – conception of the diseases. – Stuttgart, Tieme. – P. 104–137.
10. Nesterov A.P. In: «Glaucoma» ( Editor J.N. Cairns). – London, Grune & Stratton. – Vol. 1. P. 329–368.
11. Quigley H.A., Addics S.M., Green W.R.// Arch. Ophthalmol. – 1982.– Vol. 99. – P. 2159–2162.
12. Rohen J.V.// Ophthalmology. – 1983. – Vol. 90. – 758–765.
13. The Glaucomas ( R.Ritch, M.B.Shields, Th.Krupin editors).– St. Louis, Mosby.– Vol. 1, P. 1–5.
14. Terminology and Guidlains for Glaucoma. European Glaucoma Society, Savona 1998, 115 P.
Источник
Статье посвящена проблеме медикаментозного лечения первичной открытоугольной глаукомы и разработке индивидуального подхода. Рассматривается возможность применения программного приложения для расчета толерантного внутриглазного давления у пациентов с первичной открытоугольной глаукомой.
Актуальность
Глаукома остается одной из главных причин слепоты и слабовидения и является в настоящее время одной из актуальнейших проблем офтальмологии.
По данным Всемирной организации здравоохранения, число больных глаукомой в мире колеблется от 60,5 млн до 105 млн человек, причем в ближайшие 10 лет оно увеличится еще на 10 млн [1, 2].
Во многих высокоразвитых странах мира на долю глаукомы приходится 13–28% всей слепоты [3–9]. Среди причин слепоты и слабовидения в России глаукома занимает первое место. В нозологической структуре инвалидности доля глаукомы возросла с 20 до 28%, а в контингенте инвалидов пенсионного возраста — до 40% [3, 5, 10].
Определение толерантного внутриглазного давления
Повышенное внутриглазное давление (ВГД) является основным фактором риска развития глаукомной оптической нейропатии (ГОН) и снижения зрительных функций у больных первичной глаукомой. В настоящее время в литературе широко используются термины «индивидуальное», «толерантное», «интолерантное» и «целевое ВГД».
Впервые определение толерантного ВГД при глаукоме
было предложено А.М. Водовозовым в 1975 г. Индивидуально переносимое (толерантное, P tl) давление — максимальный уровень офтальмотонуса, не оказывающий повреждающего действия на внутренние структуры глазного яблока [11–17]. Толерантное ВГД можно определить у больных глаукомой по достоверному улучшению зрительных функций при медикаментозном снижении офтальмотонуса. Постоянное или периодическое повышение офтальмотонуса выше толерантного давления является основным фактором риска развития ГОН и снижения зрительных функций у больных первичной открытоугольной глаукомой (ПОУГ) [18].
Увеличение суточных колебаний ВГД на 1 мм рт. ст. приводит к увеличению риска прогрессирования ПОУГ на 30%. Снижение ВГД на 1 мм рт. ст. позволяет снизить риск прогрессирования глаукомы на 19% [19]. Доказано, что снижение повышенного офтальмотонуса до индивидуального уровня ВГД у больных ПОУГ способствует длительному сохранению зрительных функций [13, 17].
Цели лечения больных глаукомой: сохранение зрительных функций; достижение терапевтического эффекта при минимальном числе препаратов с минимумом побочных действий; сохранение качества жизни при доступных затратах [1, 2].
Эффективность лечения больных ПОУГ следует оценивать по следующим критериям: 1) нормализация офтальмотонуса — по достижении индивидуального ВГД; 2) стабилизация зрительных функций — по данным периметрии; 3) отсутствие прогрессирования ГОН — по данным оптической когерентной томографии (ОКТ) диска зрительного нерва (ДЗН) и сетчатки.
Целевое ВГД — условно выбранный офтальмологом безопасный уровень ВГД, который определяется как 20–30–40% снижение от исходного значения офтальмотонуса. В настоящее время целевое давление определяется с учетом стадии глаукомы (табл. 1) [1, 2]. Недостатком определения целевого давления является то, что не учитываются индивидуальные особенности пациента.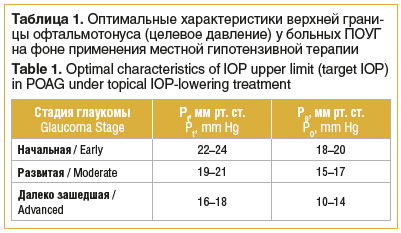
Верхняя граница индивидуальной нормы ВГД (толерантное ВГД) зависит в основном от диастолического уровня артериального давления (АД) в плечевой артерии и возраста пациента [17]. Таблица с соответствующими значениями доступна в литературе и приводится в Национальном руководстве по глаукоме для практикующих врачей [1, 2].
Таким образом, для достижения стабилизации
глаукомного процесса необходимо, чтобы офтальмотонус на фоне медикаментозного лечения у больных ПОУГ был ниже уровня толерантного давления на 2,5 мм рт. ст., а суточные колебания ВГД не превышали толерантное давление [17].
Применение программного приложения для определения толерантного ВГД
Для определения значения толерантного истинного ВГД у больных ПОУГ разработано программное обеспечение под Windows и для мобильных устройств Toliop на операционных системах IOS 8–10 и Аndroid. Данные программные продукты при расчете толерантного ВГД учитывают, помимо возраста и диастолического АД в плечевой артерии, также стадию глаукомы и офтальмобиометрические показатели: переднезадний размер глаза и толщину роговицы в центральной оптической зоне [11, 20–24], прогнозируют скорость прогрессирования глаукомы по величине индекса интолерантности (I int):
![]()
При величине I int менее 5,0 мм рт. ст. прогнозируется медленное прогрессирование глаукомного процесса, при I int свыше 5 мм рт. ст. — быстрое прогрессирование.
Для определения толерантного давления с помощью программного обеспечения необходимо ввести данные пациента: возраст, значения систолического и диастолического АД в плечевой артерии, фактическое ВГД (P0) на момент обследования, переднезадний размер глазного яблока, толщину роговицы в центральной оптической зоне и стадию глаукомы.
На рисунке 1 продемонстрирован пример расчета толерантного ВГД у пациента 60 лет. Толерантное ВГД (P0 tl) на OD равно 15,8 мм рт. ст., на OS — 11,7 мм рт. ст. Более низкое значение толерантного давления на левом глазу обусловлено «тонкой» роговицей в центральной оптической зоне и переднезадним размером глазного яблока, который был равен 26,7 мм. I int на OS равен 6,3 мм рт. ст., что указывает на вероятность быстрого прогрессирования глаукомы. Данный расчет можно распечатать и (или) сохранить в архиве. Время на внесение данных о пациенте и определение толерантного ВГД составляет 30 с.
Определение толерантного ВГД имеет важное значение для оценки и прогнозирования динамики зрительных функций у больных ПОУГ.
По данным исследователей, при стабилизированной глаукоме (1549 глаз, 94,6% случаев) среднее значение I int составило —1,5±0,04 мм рт. ст. Из них у 94,4% больных ПОУГ (1463 глаза) I int был меньше нуля и выражался отрицательным числом. У 5,6% больных ПОУГ (86 глаз) I int был менее 2 мм рт. ст. Это подтверждает, что для стабилизации зрительных функций необходимо, чтобы ВГД не превышало толерантное давление [17].
Определение уровня индивидуального ВГД у больного ПОУГ позволяет врачу:
своевременно скорректировать лечение для достижения индивидуальной нормы;
прогнозировать стабилизацию или прогрессирование глаукомного процесса, а также скорость прогрессирования ПОУГ;
своевременно направлять пациента на лазерное или хирургическое лечение глаукомы.
Важно знать, что прогрессирование глаукомы на фоне медикаментозного лечения может отмечаться при нормальных значениях офтальмотонуса в 36–42% случаев, когда колебания ВГД превышают уровень толерантного [17]. Если колебания офтальмотонуса не превышают толерантное ВГД, стабилизация зрительных функций наблюдается у больных ПОУГ в 94,6% случаев [17].
Принципы выбора местной гипотензивной терапии
Применение местных гипотензивных препаратов возможно в комбинации друг с другом, а также в сочетании с лазерными и хирургическими методами лечения.
Во время лечения необходимо снизить повышенное ВГД до уровня индивидуальной нормы, суточные колебания офтальмотонуса не должны превышать значений толерантного ВГД.
Лечение начинают с монотерапии лекарственным средством первого выбора [25].
При неэффективности или плохой переносимости пациентом лечения выполняют замену на лекарственный препарат из другой фармакологической группы или переходят к комбинированной терапии.
При комбинированной терапии не следует использовать более двух лекарственных средств одновременно, предпочтительно их применение в виде фиксированных комбинаций [26].
При проведении комбинированной терапии не следует применять препараты из одной фармакологической группы (два разных β-адреноблокатора, два разных простагландина).
Следует учитывать наличие противопоказаний к применению лекарственных препаратов у пациента, их переносимость и безопасность, наличие консервантов, содержащихся в лекарственном препарате, особенно при длительном лечении.
Для исключения тахифилаксии и побочных действий лекарственного препарата своевременно проводить плановую замену 2–3 раза в год на лекарственные средства из другой фармакологической группы.
Адекватность лечения регулярно проверяется исследованием состояния ДЗН и зрительных функций (при начальной стадии — 1 раз в 6 мес., при развитой и далеко зашедшей глаукоме — 1 раз в 3–4 мес.). Контроль ВГД проводится ежемесячно.
При снижении повышенного офтальмотонуса на фоне комбинированного медикаментозного лечения до уровня индивидуального ВГД больным с начальной стадией ПОУГ можно рекомендовать проведение селективной лазерной трабекулопластики (СЛТ) с целью улучшения оттока водянистой влаги (ВВ), возможности возврата на монотерапию или отмены антиглаукомных препаратов, улучшения качества жизни пациента и повышения приверженности больного лечению.
При неэффективности комбинированной медикаментозной терапии, когда колебания офтальмотонуса превышают уровень толерантного ВГД, больным ПОУГ следует рекомендовать хирургическое лечение глаукомы.
На рисунке 2 приводится алгоритм лечения пациентов с ПОУГ.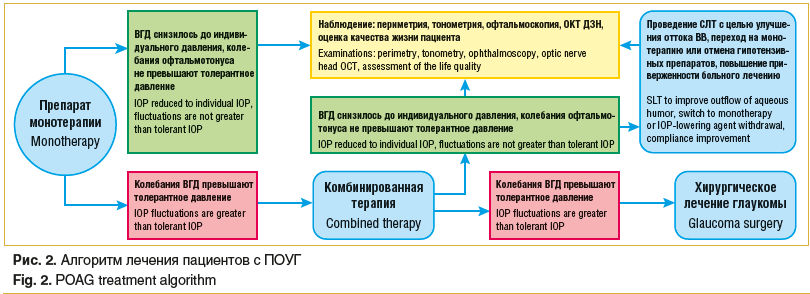
В таблице 2 представлены фармакологические группы для лечения глаукомы. Для снижения повышенного офтальмотонуса до индивидуального ВГД у больных ПОУГ предпочтение следует отдавать препаратам, которые эффективно снижают ВГД за счет улучшения оттока ВВ.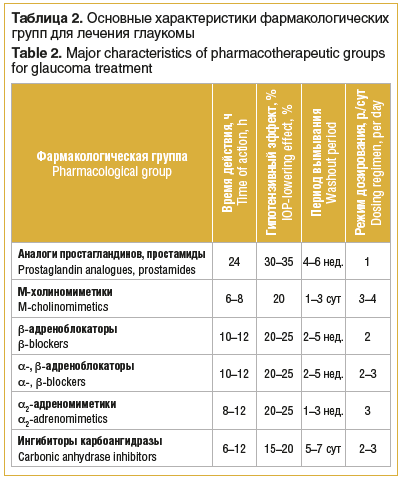
Многочисленные исследования показали, что в качестве препаратов первого выбора у пациентов с ПОУГ наиболее целесообразно использовать аналоги простагландинов и простамиды.
Аналоги простагландинов и простамиды — пролекарства, которые обладают выраженным гипотензивным действием: снижают офтальмотонус на 30–35% от исходного уровня за счет улучшения преимущественно увеосклерального пути оттока ВВ. К аналогам простагландина F2a относятся: латанопрост 0,005%, травопрост 0,004% и тафлупрост 0,0015%, к простамидам — биматопрост 0,03%.
Латанопрост представляет собой пролекарство в форме сложного изопропилового эфира — аналога простагландина F2α, обладающего высокой селективностью по отношению к FP-подтипу простаноидных рецепторов. После попадания в ткань роговицы латанопрост полностью гидролизуется эстеразами (считается, что никакими иными способами препарат в глазу не метаболизируется). Вслед за этим кислота латанопроста поступает в переднюю камеру глаза. Латанопрост не обладает биологической активностью до тех пор, пока не подвергнется гидролизу в роговице и не превратится в свободную гидрофильную кислоту латанопроста. Отмечалось, что латанопрост имеет очень низкую тропность к простаноидным рецепторам, отвечающим за воспалительные реакции, и высокую тропность к тем простаноидным рецепторам, которые обеспечивают снижение ВГД. Гипотензивный эффект латанопроста (как и других препаратов этой группы) достигается за счет усиления в основном увеосклерального пути оттока внутриглазной жидкости. Латанопрост никак не влияет на ее продукцию. Также не было выявлено какого-либо воздействия латанопроста на сосуды сетчатки или проницаемость гематоретинального барьера [27].
Латанопрост оказывает длительное гипотензивное действие (24 ч) после инстилляции, закапывается в нижний конъюнктивальный свод по 1 капле 1 р./сут (вечером). Такая большая длительность эффекта может быть объяснена, в частности, высокой липофильностью пролекарства и последующим накоплением в роговице активной деэтерифицированной формы препарата [27]. Латанопрост хорошо переносится, хотя иногда может вызывать гиперемию конъюнктивы легкой степени, и его использование не связано с системными побочными эффектами. Некоторые пациенты отмечают усиление пигментации радужки, усиление роста ресниц и гиперпигментацию кожи век.
Несмотря на появление на рынке в начале XXI в. других, помимо латанопроста, препаратов из группы аналогов простагландинов, наиболее часто назначаемым антиглаукомным препаратом в США и Великобритании, например, до сих пор является латанопрост [27]. Следует уточнить, что появившиеся в 2012 г. дженерики Ксалатана обеспечили значимый вклад в эту «популярность» латанопроста, но при описании результатов большинства клинических исследований под латанопростом почти всегда следует понимать оригинальный Ксалатан, который часто выбирается в качестве эталона для сравнения благодаря хорошо изученному и подтвержденному практикой эффекту.
Следует принимать во внимание, что хотя оригинальный препарат и дженерики считаются биоэквивалентными, это не должно приравниваться к их терапевтической эквивалентности, которая может различаться вследствие использования в дженериках иных буферов и консервантов, уровня рН, вязкости и осмолярности раствора. Эти параметры препарата могут существенно влиять на биодоступность и клиническую эффективность лекарственного средства.
Зарегистрированный в России в 2017 г. препарат Трилактан (SOLOPHARM («Гротекс», Россия)) производится из той же фармацевтической субстанции, что и оригинальный препарат («Хиноин Завод Фармацевтических и Химических Продуктов» ЗАО, Венгрия). Трилактан не отличается от оригинального препарата вспомогательными веществами, консервантами, неактивными ингредиентами и т. д., что делает его клиническую эффективность более прогнозируемой и соответствующей ожидаемой офтальмологом эффективности.
В проведенном А.О. Татаринцевой исследовании применения препарата Трилактан оценивались степень гипотензивного эффекта и выраженность нежелательных явлений у 47 пациентов с ПОУГ на разных стадиях заболевания. Снижение офтальмотонуса было достигнуто у всех пациентов (р>0,05). Лечение переносилось хорошо. Местные и системные побочные эффекты при применении Трилактана не отличались от возможных побочных эффектов других препаратов данной группы по составу и частоте встречаемости [28].
Результаты исследования, выполненного в клинике Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова», по изучению гипотензивной эффективности аналогов простагландина F2α представлены в таблице 3.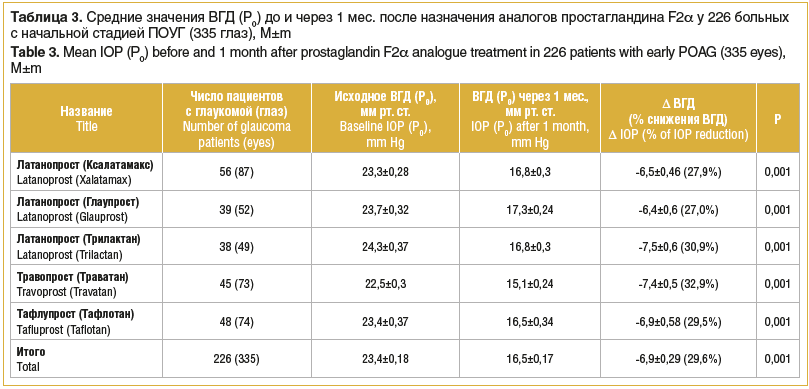
Из таблицы 3 видно, что гипотензивная эффективность латанопроста колеблется от 27% (Глаупрост) до 30,9% (Трилактан, SOLOPHARM, Россия).
А.В. Корнеева и соавт. в своем исследовании с участием 120 пациентов с ПОУГ (150 глаз) продемонстрировали, что препарат Трилактан показал хороший, сопоставимый с оригинальным препаратом, гипотензивный эффект как в монотерапии, так и в комбинации с другими гипотензивными препаратами. Снижение ВГД в группе первичных пациентов составило 31% от исходного уровня, в группе пациентов на гипотензивной терапии при добавлении Трилактана произошло снижение ВГД на 20% от исходного уровня. В группе пациентов, ранее получавших оригинальный латанопрост, уровень ВГД достоверно не изменился. Стабильное снижение и поддержание ВГД на необходимом уровне прослеживались на протяжении всего срока наблюдения и были сопоставимы с таковыми при применении оригинального препарата [29].
Широкое использование латанопроста, а затем и остальных аналогов простагландинов вывело медикаментозную терапию глаукомы на качественно иной уровень, позволив сочетать высокую терапевтическую эффективность в снижении офтальмотонуса с комфортным для пациента режимом инстилляции препарата, что способствует повышению приверженности лечению. В настоящее время латанопрост остается эффективным, безопасным и хорошо переносимым препаратом, который следует рассматривать в качестве возможного варианта лечения у всех пациентов с повышенным уровнем ВГД.
Заключение
На современном этапе исследование толерантного и индивидуального ВГД имеет клиническое значение в диагностике, лечении и мониторинге больных ПОУГ, позволяет у больных глаукомой с «нормальными» значениями ВГД определить, что офтальмотонус в 37–42% случаев превышает толерантное ВГД — находится в зоне повышенного интолерантного ВГД. Индивидуальный подход к лечению, учитывающий толерантное давление, по нашим данным, дал возможность у больных с начальной стадией ПОУГ на фоне медикаментозного лечения добиться стабилизации глаукомного процесса на 513 глазах из 528 в 97,1% случаев, на фоне лазерного лечения на 538 глазах из 575 — в 93,6% случаев, после хирургического лечения на 498 глазах из 535 — в 93,1% случаев. Индивидуальный подход к лечению больных ПОУГ на основе определения толерантного ВГД позволил своевременно и обоснованно увеличить количество лазерных операций на 68,9%, хирургических операций — на 23,5% [17].
Таким образом, благодаря индивидуальному подходу к лечению больных ПОУГ врач может своевременно оценивать эффективность лечения и принимать решение о его достаточности, когда колебания офтальмотонуса находятся в пределах границ среднестатистической нормы, но превышают толерантное давление.
Сведения об авторах:
Балалин Сергей Викторович — д.м.н., заведующий научным отделом Волгоградского филиала;
Фокин Виктор Петрович — д.м.н., профессор, директор Волгоградского филиала.
ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России. 400138, Россия, г. Волгоград, ул. Землячки, д. 80.
Контактная информация: Балалин Сергей Викторович, e-mail: sergej-balalin@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 23.10.2018.
About the authors:
Sergey V. Balalin — MD, PhD, Head of the Scientific Department of the Volgograd branch;
Viktor P. Fokin—MD, PhD, Professor, Director of the Volgograd branch.
S. Fyodorov Eye Microsurgery Federal State Institution, Volgograd branch. 80, Zemlyachki str., Volgograd, 400138, Russian Federation. Contact information: Sergey V. Balalin, e-mail: s.v.balalin@gmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 23.10.2018.
Источник