Импланты в сетчатку глаза
В 2018 году 39 миллионов человек остаются слепыми. Из-за наследственных заболеваний, старения тканей, инфекций или травм. Одна из главных причин — это болезни сетчатки. Но наука развивается так быстро, что фантастика переходит из книг в лаборатории и операционные, снимая барьер за барьером. Ниже мы рассмотрим, какое будущее ждет офтальмологию, как будут лечить (и уже лечат), возвращать зрение, диагностировать недуги и восстанавливать глаза после операций.
Киборгизация: бионические глаза
Главный тренд офтальмологии будущего — бионические глаза. В 2018 году уже существуют 4 успешных проекта, и искусственные глаза сейчас — далеко не картинка из футуристического фэнтези.
Самый интересный проект — это Argus II от Second Sight. Устройство состоит из импланта, очков, камеры, кабеля и видеопроцессора. Имплант, имеющий передатчик, вживляется в сетчатку. Носимая с очками камера фиксирует изображения, которые процессор обрабатывает, генерируя сигнал, передатчик импланта принимает его и стимулирует клетки сетчатки. Так реконструируется зрение. Разработка изначально предназначалась для больных макулодистрофией. Это возрастное заболевание, оно сопровождается слабым кровоснабжением центра сетчатки и приводит к слепоте.
В чем недостаток технологии? Устройство стоит баснословные 150 тысяч долларов и не возвращает зрение полностью, лишь позволяя различать силуэты фигур. По состоянию на 2017 год 250 человек носят Argus II, что, безусловно, ничтожно мало.
У Argus II есть аналоги. Например, Boston Retinal Implant. Он тоже создан специально для пациентов с макулодистрофией и пигментным ретинитом (разложением фоторецепторов сетчатки). Он работает по похожему принципу, направляя сигналы нервным клеткам и создавая схематичное изображение объекта. Стоит назвать и IRIS, созданный для пациентов на последних стадиях деградации сетчатки. IRIS состоит из видеокамеры, носимого процессора и стимулятора. От них отличается Retina Implant AG. Имплант улавливает фотоны и активирует зрительный нерв, при этом устройство обходится без внешней камеры.
Импланты в головном мозге
Как ни странно, лечить зрение можно, не касаясь глаз. Для этого достаточно вживить в мозг чип, который будет стимулировать короткими электрическими разрядами зрительную кору. В этом направлении работает упомянутый выше Second Sight. Компания разработала альтернативную версию Argus II, которая совсем не затрагивает глаза и работает с мозгом напрямую. Девайс будет стимулировать нервные клетки током, извещая мозг о потоке света.
Искусственная сетчатка
Мы сказали, что пигментный ретинит поражает фоторецепторы сетчатки, из-за чего человек перестает воспринимать свет и слепнет. Это заболевание кодируется генетически. Сетчатка состоит из миллионов рецепторов. Мутация лишь в одном из 240 генов запускает их гибель и портит зрение, даже если связанные с ней зрительные нейроны будут целы. Как быть в этом случае? Имплантировать новую сетчатку. Искусственный аналог состоит из электропроводящего полимера с шелковой подложкой, завернутого в полимерный полупроводник. Когда падает свет, полупроводник поглощает фотоны. Вырабатывается ток и электрические разряды касаются нейронов сетчатки. Эксперимент с мышами показал, что при освещенности в 4-5 лк (Люксов), как в начале сумерек, мыши с имплантами реагируют на свет так же, как и здоровые грызуны. Томография подтвердила, что зрительная кора мозга крыс была активна. Неясно, будет ли разработка полезной для людей. Итальянский технологический институт (IIT) обещает отчитаться о результатах опытов в 2018 году.
Ошибка в коде
Носимые, вшиваемые и встраиваемые устройства — не единственная надежда офтальмологии. Для того, чтобы вернуть зрение, можно переписать генетический код, из-за ошибки в котором человек начал слепнуть. Метод CRISPR, который базируется на инъекции раствора с вирусом, несущим правильный вариант ДНК, излечивает наследственные заболевания. Исправление кода позволяет бороться с возрастной дегенерацией сетчатки, а также с амаврозом Лебера — крайне редким недугом, убивающим светочувствительные клетки. В мире им страдает около 6 тысяч человек. Препарат Luxturna обещает покончить с ним. Он содержит раствор с правильной версией гена RPE65, шифрующим структуру необходимых белков. Это инъекционный препарат — его вводят в глаз микроскопической иглой.
Диагностика и восстановление после операции
Сопровождающий нас повсюду смартфон — прекрасный инструмент для быстрой и точной диагностики. Например, синхронизированный со смартфоном офтальмоскоп Peek Vision позволяет делать снимки сетчатки где и когда угодно. А Google в 2016 году представил алгоритм анализа изображений, основанный на искусственном интеллекте, который позволяет выявлять признаки диабетической ретинопатии на снимках сетчатки. Алгоритм отыскивает мельчайшие аневризмы, указывающие на патологию. Диабетическая ретинопатия — это тяжелое поражение сосудов сетчатой оболочки глаза, ведущее к слепоте.
Будущее — за быстрым восстановлением после операций. Интересен препарат Cacicol, представленный турецкими исследователями в 2015 году. Их разработка снимает боль, повышенную чувствительность и жжение после операции на глазах. Препарат уже опробовали клинически: пациенты, которым сшивали роговицу (этот метод используется при лечении ее истончения — кератоконуса), отмечали снижение побочных эффектов.
Каким будет зрение будущего?
Уже сейчас офтальмология достигла поразительных успехов: прежде неизлечимую слепоту можно обратить, а наследственные заболевания побороть, переписав несколько участков генетического кода. В каком направлении будет идти развитие? Попробуем предположить:
Лучше предотвратить, чем лечить. Окулист в смартфоне и нейронная сеть, ставящая диагноз, обещают заметно сократить риск запущенных и едва излечимых болезней глаз. Дополненная реальность (AR) позволит распространять медицинские знания в игровой и необременительной форме. Уже сейчас есть приложения AR, моделирующие последствия катаракты и глаукомы. Знание, как известно, сила. Заменить, если нельзя вылечить. Киборгизация — это ключевой медицинский тренд. Нынешние разработки хороши, но они реконструируют зрение лишь отчасти, позволяя различать размытые контуры. В ближайшие 10 лет технология будет идти по пути повышения качества изображения и детализации. Важная задача — избавиться от носимых компонентов: камеры, очков, кабеля. Имплант должен стать мягче и, можно сказать, дружелюбнее для тканей человека, чтобы не ранить их. Вероятно, чипы без внешних вспомогательных элементов, вживляемые прямо в мозг — это самая перспективная ветка киборгизации зрения. Дешевле и доступнее: 150 тысяч долларов за устройство пока делают бионические глаза очень далекими от рынка и недосягаемыми для большинства больных. Следующий шаг — сделать их максимально доступными. Восстановление за часы: вживление чипов, коррекция сетчатки и даже исправление ДНК требуют хирургического вмешательства. Оно оставляет резь, жжение, фантомные боли и другие неприятные следствия. Препараты будущего будут регенерировать поврежденные ткани за часы. Фантастическое зрение для всех: мгновенный снимок с помощью глаза и сетчатка, подключенная к интернету, только сейчас выглядят как научная фантастика.
Источник
Возвращать зрение слепым людям – давняя мечта человечества. Успехи современной офтальмологии помогают полностью восстановить зрение при катаракте, замедлить его падение при глаукоме, навсегда устранить близорукость и астигматизм. Однако вернуть зрение пациентам с дегенеративными заболеваниями сетчатки врачи пока не могут. Именно для таких пациентов разработаны импланты сетчатки. О том, что это за устройства и каковы их возможности, узнайте вместе с Medaboutme.
Как все начиналось
Первая попытка электрической стимуляции зрительной системы для лечения слепоты была сделана еще в XVIII веке в Париже французским врачом и ученым Шарлем Ле Руа. Его незрячий пациент утверждал, что испытал зрительные ощущения и «увидел» вспышки при прохождении электрического тока через намотанную вокруг головы проволоку. Впоследствии эти вспышки были названы фосфенами.
После врачи неоднократно отмечали появление вспышек перед глазами при стимуляции электродами коры головного мозга в затылочной области. Здесь сосредоточены нейроны, которые воспринимают и анализируют зрительную информацию.
В 1978 году американский ученый Билл Добель показал принципиальную возможность восстановления утраченного зрения путем электрической стимуляции головного мозга. Для формирования изображения он использовал видеокамеру. Затем картинка трансформировалась в электрический сигнал и передавалась на зрительную кору. Во время работы этого устройства слепой пациент не только видел вспышки света, но и различал крупные буквы.
А вот группа американских исследователей под руководством Марка Хумаюна пошла другим путем. Для получения зрительного образа было решено стимулировать сохранные клетки сетчатки. Это привело к созданию первого зрительного импланта Argus.
Первая операция по его имплантации была проведена в 1999 году. А в 2013 году устройство Argus II получило разрешение FDA для коммерческого использования. На сегодняшний день его носят более 350 пациентов, двое из которых россияне.
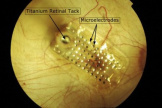
Чтобы четко представить работу импланта, следует вспомнить анатомию сетчатки глаза человека. Она состоит из 10 слоев клеток и имеет инвертированное строение. Это значит, что свет должен пройти сквозь все слои и отразиться от внутреннего слоя. Лишь затем световой сигнал воспринимается нервными клетками, обрабатывается и передается в мозг.
В передаче света в мозг участвуют пять типов нейронов. Три из них находятся в сетчатке. Первыми свет воспринимают фоторецепторы. Это хорошо известные всем палочки и колбочки.
Однако их жизнедеятельность невозможна без самого внутреннего слоя сетчатки — пигментного эпителия. Палочки и колбочки тесно взаимодействуют с этим слоем. Он поглощает избыток света, попавшего на сетчатку, питает фоторецепторы, помогает их восстановлению, участвует в выведении продуктов обмена.
Следующими типом нейронов является вышележащий слой биполярных клеток. При попадании света на фоторецептор в результате фотохимической реакции изменяется его трансмембранный электрический потенциал. Это возбуждение передается биполярным клеткам.
Они, в свою очередь, возбуждают ганглиозную клетку. Это третий тип нейронов на пути света в мозг. Отростки ганглиозных клеток формируют зрительный нерв и несут информацию в подкорковый отдел мозга — таламус. Здесь происходит последнее переключение импульса. Конечный, пятый нейрон зрительного пути расположен в зрительной коре.
Показания к имплантации
При дегенеративных заболеваниях сетчатки происходят серьезные нарушения в строении и функции слоя фоторецепторов и пигментного эпителия. Однако остальные слои продолжают работать. Идея искусственной сетчатки состоит в стимуляции здоровых клеток с помощью массива микроэлектродов. Он выполняет функции погибших фоторецепторов.
По этой причине импланты сетчатки могут помочь далеко не всем слабовидящим. Например, при глаукоме происходит гибель ганглиозных клеток. А имеющиеся устройства имитируют лишь работу фоторецепторного слоя. При отслойке сетчатки устройство также бессильно.
Кроме того, пациент должен видеть в течение долгого времени в прошлом. Ведь искусственное изображение получается очень размытым. Поэтому больной не столько видит, сколько догадывается, что за предмет перед ним. По этой причине у слепых от рождения людей этот метод неэффективен. Он показан лишь при пигментной дегенерации сетчатки и атрофической форме возрастной макулярной дистрофии.

Пигментная дегенерация сетчатки — заболевание, которое характеризуется прогрессирующим сужением полей зрения и ночной слепотой. Причиной является мутация в гене, кодирующем синтез родопсина. Это главный белок, воспринимающий свет. Он расположен в наружных сегментах фоторецепторов-палочек.
Из-за нарушения обмена веществ наблюдаются дистрофические изменения в палочках, их укорочение. На поздних этапах происходит гибель этих клеток. В пигментном эпителии имеется гипертрофия, атрофия и дезорганизация клеток. Исходом болезни часто является полная слепота.
Атрофическая форма возрастной макулярной дистрофии связана со старением организма и дегенеративными процессами в пигментном эпителии центральной зоны сетчатки. Из-за этого страдают и фоторецепторы. Заболевание проявляется искажением контуров предмета, невозможностью четко его видеть, затруднениями при чтении.
Устройство и виды зрительных протезов
Все зрительные протезы можно разделить на 2 типа в зависимости от расположения стимулирующих электродов. Они могут располагаться в глазнице (как в полости глаза, так и на зрительном нерве) или вживляться внутрь мозга.
С технической точки зрения протезы сетчатки обычно состоят из 4 основных компонентов: фотоэлектрического преобразователя, внешней электроники, внутренней электроники и массива стимулирующих электродов. Первый компонент нужен для восприятия визуальной информации. Он представляет собой видеокамеру или массив фотодиодов, который имплантируется в сетчатку.
Внешняя и внутренняя электроника предназначены для обработки полученных данных и участвуют в формировании электрических импульсов, передаваемых на микроэлектроды для стимуляции сетчатки. Связь между этими двумя частями происходит с помощью кабеля или элекромагнитного излучения. Стимулирующие электроды передают полученную информацию в сохранные части зрительного пути.
При установке внутримозговых имплантов требуется нейрохирургическое вмешательство. Их ношение сопряжено с высоким риском инфекционных осложнений. Однако этот метод позволяет помочь пациентам с глаукомой, с тяжелым травматическим повреждением глаза и даже людям, лишенным органа зрения. В настоящее время эти устройства находятся на стадии доклинических испытаний.
Самые распространенные протезы сетчатки
Argus II
Лидером по распространенности являются американские импланты серии Argus. Их разработчик и производитель — американская компания Second Sight Medical Products, Inc. Система Argus II состоит из 5 элементов: видеокамеры, видеопроцессора, двух индукционных катушек, внутренней электроники импланта, и, наконец, массива стимулирующих электродов.
Видеокамера и наружная индукционная катушка крепятся к очкам. Камера снимает изображение и передает его на видеопроцессор. Здесь оно обрабатывается для передачи путем индукции. Наружная индукционная катушка передает информацию об изображении на внутреннюю катушку. Последняя кабелем связана с внутренней электроникой. Оба этих элемента расположены поверх склеры.
Внутренняя электроника генерирует стимулирующие импульсы, а также может диагностировать имплант. Отсюда импульсы через многожильный кабель поступают внутрь глаза, где достигают массива электродов. Они передают изображение на биполярные клетки сетчатки. Далее оно поступает в мозг обычным путем.
Массив включает 60 электродов, изготовленных из платины и размещенных на полиимидной пленке размером 5,5 х 6 квадратных миллиметров. Это обеспечивает поле зрения в 20°. Максимальная острота зрения составляет 0,016. При такой остроте зрения пациент может верно сосчитать пальцы врача в 50-70 см от лица. К сожалению, ни один имплант не дает возможности различать цвета.
Комментарий эксперта

Христо Тахчиди, директор Научно-исследовательского центра офтальмологии ФГБОУ ВО РНИМУ им. Н.И.Пирогова, руководитель первой имплантации системы Argus II в России
В июне и декабре 2017 года в России были успешно проведены две операции по имплантации зрительного протеза Argus II. Успех этой операции — это успех отечественной офтальмологии. Мы сумели войти в мировую когорту единичных клиник, которые прикоснулись к теме общения с мозгом. Она выводит нас на понимание взаимоотношений с мозгом, это перспектива для большой науки.
Вы много читаете, и мы это ценим!
Оставьте свой email, чтобы всегда получать важную информацию и сервисы для сохранения вашего здоровья
Alpha IMS
Этот протез разработан в Германии научной группой под руководством профессора Эберхарда Цреннера. На сегодняшний день его используют более 40 пациентов. Максимальная острота их зрения — 0,034. Во время работы импланта они могут распознавать силуэты людей, очертания зданий, расположение окон и дверных проемов, а также видеть стрелки на настенных часах.
От предыдущей конструкции Alpha IMS отличает отсутствие видеокамеры. Вместо нее под сетчатку имплантирован массив фотодиодов, который и воспринимают изображение. Фокусировка выполняется оптической системой глаза.
Свет, проходя сквозь сетчатку, падает на массив из 1500 независимых друг от друга пикселей. Каждый из них включает в себя фотодиод, усилитель фототока, генератор стимулирующего напряжения и стимулирующий электрод.
Электрический ток, возбужденный светом в фотодиоде, усиливается и преобразуется с помощью генератора в электрические импульсы. Они через нитрид-титановые электроды стимулируют биполярные клетки сетчатки. Имплант получает питание от двух индукционных катушек. Внутренняя катушка связана с массивом фотодиодов с помощью кабеля, проходящего через склеру.
В 2013 году устройство Alpha IMS прошло сертификацию CE для коммерческого использования в Европе. Через 3 года была сертифицирована улучшенная модель импланта — Retina Implant AMS, в которой количество пикселей увеличено до 1600.
Проблемы имплантов сетчатки
Все зрительные протезы имеют существенные недостатки. Именно над их устранением будут работать ученые в ближайшем будущем. Условно их можно разделить на нейрофизиологические, хирургические и инженерные.
- Нейрофизиологические проблемы связаны с постепенным нарушением структуры и функции не только слоя фоторецепторов, но и сетчатки в целом. После гибели фоторецепторов часть биполярных клеток прорастает отростками в соседние слои в поисках возбуждающего сигнала, часть гибнет. Между нейронами устанавливаются новые синаптические связи, отличные от физиологических. Это ведет к спонтанной активности нервных клеток. Она может стать помехой для проведения искусственного сигнала и ухудшать качество зрения.
- К хирургическим проблемам относят вероятное помутнение оптических сред глаза, длительность и техническую сложность имплантации, риск повреждения устройства при установке, сложность его фиксации. Кроме того, существует риск послеоперационных осложнений: внутриглазного воспаления, отслойки сетчатки, различных кровоизлияний.
- Самая большая инженерная проблема состоит в том, что все зрительные импланты обладают небольшим разрешением и малым углом обзора (40°— 50°). Для его расширения до нормы (150°) придется увеличить площадь массива электродов до 20 квадратных сантиметров. Имплантация такой конструкции крайне затруднительна. Поэтому ведется работа по совершенствованию дизайна массива электродов. Другие проблемы сводятся к поиску материалов, устойчивых к коррозии, обеспечению неподвижности протеза.
Кроме того, повсеместное распространение этой технологии сдерживает очень высокая цена устройства. Она составляет примерно 8,5 миллионов рублей. Операция с последующей реабилитацией обходится примерно в эту же сумму.
Шаг к медицине будущего
Импланты сетчатки пока еще далеки от совершенства. Зрение больного с таким протезом очень отдаленно напоминает зрение здорового человека. При этом надо понимать, что это устройство заменяет не всю сетчатку, а лишь один ее слой на очень небольшой площади. О массовой их имплантации сегодня речь не идет.
Однако первый шаг уже сделан, и словосочетание «искусственная сетчатка» больше не кажется фантастическим. Над разработкой новых проектов сегодня работают около 100 научных групп. И рано или поздно совместные усилия врачей, инженеров, физиков, нейрофизиологов, математиков, программистов приведут к созданию полноценного искусственного глаза.
Использованы фотоматериалы Shutterstock
Источник



