В сетчатку ингибиторы ангиогенеза
Щуко А.Г., Зайцева Н.В., Злобин И.В., Малышев В.В.
Группа заболеваний, связанных с неоваскуляризацией сетчатки и патологической сосудистой проницаемостью, составляет значительную часть патологии органа зрения. Большинство из них, такие как влажная возрастная макулярная дегенерация (ВМД), диабетический макулярный отёк (ДМО), окклюзия вен сетчатки, хориоидальная неоваскуляризация (ХНВ) при осложненной миопии, неоваскулярная глаукома и др., часто становятся причиной слабовидения и необратимой слепоты, причем, как правило, у лиц преимущественно молодого, трудоспособного возраста [2, 5, 11, 12]. Традиционные методы лечения: термическая лазеркоагуляция, витреальная хирургия, интравитреальное введение кортикостероидов позволяют лишь уменьшить риск потери зрения [7, 13, 14]. Во многом это обусловлено тем, что патогенез этих заболеваний до конца не изучен и, соответственно, не разработаны патогенетически обоснованные методы лечения. Исследованиями последних лет убедительно доказано, что одним из определяющих факторов неоангиогенеза при этих заболеваниях является нарушение баланса между про- и антиангиогенными факторами с увеличением выработки именно проангиогенных и, прежде всего, фактора роста эндотелия сосудов (Vascular Endothelial Growth Factor, VEGF) [6, 8-10, 15, 16].

Рис. 1. ФАГ и ОСТ пациентки с миопической ХНВ: а) до лечения, выраженная активность ХНВ, Vis 0,03 -8,5 дптр =0,2; б) после 3 инъекций луцентиса, активность ХНВ подавлена, Vis 0,04 -8,5 дптр =0,6
Рис. 2. OCT и ФАГ пациента с фокальным диабетическим макулярным отеком: а) до лечения определяется выраженный фокальный отек, на ФАГ в проекции отека определяются участки гиперфлюоресценции с зонами ликеджа; б) ОСТ и ФАГ после 2 инъекций луцентиса, острота зрения повысилась с 0,5 до 0,7
Интравитреальное введение ингибиторов VEGF показало свою эффективность в лечении различных заболеваний органа зрения, связанных с патологическим ангиогенезом и нарушением сосудистой проницаемости [1, 6]. Вместе с тем, имеются лишь отдельные, несистематизированные исследования по оценке эффективности блокаторов VEGF при миопической хориоидальной неоваскуляризации и макулярных отеках сосудистого генеза [3, 4, 15].
Цель
Оценка результатов применения ранибизумаба (луцентис, Genentech/Novartis) при лечении хориоидальной неоваскуляризации, обусловленной патологической миопией, диабетического макулярного отека и окклюзии ретинальных вен, осложненной макулярным отеком.
Материал и методы
Всего обследовано 77 пациентов, получивших в качестве лечения от 1 до 7 интравитреальных инъекций луцентиса. Возраст больных колебался от 19 до 76 лет, мужчин было 15 (19,5%), женщин — 62 (80,5%), из них 37 пациентов (38 глаз) — с миопией, осложненной хориоидальной неоваскуляризацией, 25 пациентов (33 глаза) — с диабетическим макулярным отёком (ДМО) и 15 пациентов (15 глаз) с макулярным отеком, обусловленным окклюзией ретинальных вен.
Все пациенты были обследованы с применением стандартных офтальмологических методов. Кроме того, всем пациентам проводилась оптическая когерентная томография высокого разрешения (ОСТ) (HD-OCT, OCT 4.000 Cirrus, Humphrey-Zeiss, San Leandro, CA), протокол Macular cube 512×128 и флюоресцентная ангиография (ФАГ) (FA TRS 50 DX, Topcon, Япония). Определялись толщина сетчатки в центре (фовеа) (ТСЦ), максимальная толщина сетчатки в центре (ТСЦ max), объём макулы, длина и высота субретинальной неоваскулярной мембраны (СНМ), наличие гиперфлюоресценции и зон ликеджа красителя. Интравитреальные инъекции луцентиса всем пациентам проводились в условиях стерильной операционной. После обработки операционного поля под местной инстилляционной анестезией инъекционной иглой 30G в проекции плоской части цилиарного тела в 3,5-4,0 мм от лимба через двухступенчатый самогерметизирующийся прокол склеры в стекловидное тело вводилось 0,05 мл (0,5 мг) луцентиса [1]. В послеоперационном периоде обязательно назначались антибактериальные препараты в инстилляциях в течение 5-7 дней после инъекции. Повторные инъекции луцентиса выполнялись с интервалом в 1 мес. Оценка эффективности лечения проводилась через 1 мес. после заключительной инъекции. Сроки наблюдения составили в среднем более 6 мес. Результаты обработаны статистически с применением методов непараметрической статистики [Гланц С., 1999].
Результаты и обсуждение
Хориоидальная неоваскуляризация (ХНВ), обусловленная патологической миопией. Обследовано 37 пациентов (38 глаз) с миопией, осложненной ХНВ, из них мужчин — 3, женщин — 34. Степень близорукости в среднем была -10,6 дптр (от -1,0 до -16,5 дптр), длина глаза составляла от 24,2 до 30,5 мм.
В результате проведенного исследования выявлено, что миопическая ХНВ имеет существенные отличия от других видов ХНВ, например, при ВМД: она связана с очагом атрофии или с лаковыми трещинами (зонами ишемии), субретинальная неоваскулярная мембрана (СНМ) имеет малые размеры, локализация ее часто юкстафовеолярная, но отёк распространяется на фовеолу, при этом отслойка пигментного и нейроэпителия не выражена. В среднем на курс лечения потребовалось 2,2 инъекции луцентиса (от 1 до 5).
Из таблицы 1 следует, что в результате лечения произошло улучшение остроты зрения пациентов в среднем почти в 2 раза (табл. 1). Следует отметить, что в 50% случаев (на 16 глазах) острота зрения после лечения составила 0,5 и выше. Толщина сетчатки в центре уменьшилась на 30%, а длина и высота СНМ — на 20%. У всех пациентов после лечения произошла полная резорбция субретинальной и интраретинальной жидкости, отек исчез, изменились характеристики самой неоваскулярной мембраны: уменьшились ее размеры, произошло ее уплотнение за счет процессов фиброзирования, активность ХНВ была полностью подавлена, что подтверждалось данными ФАГ: на ангиограммах в поздней фазе исследования ликедж не выявлен. Полученные результаты были стабильными на протяжении всего периода наблюдения (рис. 1).
Таким образом, интравитреальные инъекции луцентиса являются эффективным методом лечения ХНВ при патологической миопии. Важно отметить, что критерием окончания лечения должно являться полное прекращение активности ХНВ по данным ФАГ.
Диабетический макулярный отек (ДМО). Обследовано 25 пациентов (33 глаза) с диабетическим макулярным отёком. Мужчин было 8, женщин — 17. В исследование были включены пациенты как с фокальным, так и с диффузным макулярным отёком. Количество интравитреальных инъекций в среднем составило 1,7 (от 1 до 5).
Из таблицы 2 видно, что в результате лечения острота зрения повысилась на 0,09±0,02 (табл. 2). Наибольший положительный эффект отмечен после первой инъекции, когда центральное зрение улучшилось в среднем на 0,05-0,07. Последующие введения препарата давали меньшую прибавку остроты зрения. В целом острота зрения улучшилась в 24 (72,7%) случаях, не изменилась в 9 (27,3%). Чем ниже была исходная острота зрения, тем в меньшей степени происходило улучшение зрительных функций. Так, прибавка зрения на 2 и более строки отмечена только у больных с дооперационной остротой зрения 0,2 и выше. У пациентов с меньшей остротой зрения прибавка не превышала 0,1, что, вероятно, объясняется более выраженной гибелью ретинальной ткани. ТСЦ уменьшилась в среднем на 116,4 мкм (25%) через 1 мес. после первой инъекции и составила 346±30,3 мкм после финальной. Уменьшение толщины сетчатки сопровождалось уменьшением диаметра интраретинальных кист, частичным рассасыванием твёрдых экссудатов. При фокальном ДМО на фоне лечения происходило постепенное уменьшение размеров очагов экссудации вплоть до их полного исчезновения (рис. 2). При диффузном отёке по мере уменьшения толщины сетчатки отмечено дробление обширной зоны патологического процесса на отдельные локальные очаги и переход фактически в форму более благоприятного фокального отёка, что позволило в 6 случаях в последующем применить фокальную лазеркоагуляцию.
Таким образом, полученные результаты показывают, что интравитреальное введение луцентиса позволяет стабилизировать или улучшить остроту зрения при диабетическом макулярном отёке.
Окклюзия вен сетчатки, осложненная макулярным отеком. Обследовано 15 пациентов (15 глаз) с макулярным отеком, обусловленным окклюзией ветвей ретинальных вен, из них мужчин — 4, женщин — 11. Количество интравитреальных инъекций в среднем составило 1,3 (от 1 до 2).
В результате лечения отмечено повышение остроты зрения в среднем почти в 2 раза (табл. 3). Острота зрения 0,65 и выше была достигнута у 10 пациентов (66,7%). Несмотря на уменьшение отека, у 2 пациентов острота зрения не изменилась и осталась низкой, что можно объяснить выраженными дегенеративными изменениями ретинальной ткани и давностью заболевания. Следует отметить, что во всех случаях толщина сетчатки значительно уменьшилась и практически приблизилась к норме (рис. 3). Это позволило в дальнейшем при необходимости провести лазеркоагуляцию сетчатки у 7 чел.
Полученные результаты показывают, что интравитреальное введение луцентиса при окклюзии вен сетчатки позволяет повысить остроту зрения, уменьшить отек сетчатки и тем самым реабилитировать пациентов в максимально короткие сроки. Вследствие чего луцентис может быть рекомендован как препарат 1-го выбора в сочетании с лазеркоагуляцией сетчатки.
Заключение
Результаты проведенных исследований убедительно показывают, что применение ингибиторов ангиогенеза является высокоэффективным методом лечения патологических состояний, сопровождающихся неоваскуляризацией и патологической проницаемостью сосудистой стенки. Необходимо проведение дальнейших исследований для определения оптимальной дозы препарата и режима его введения.
Источник

Клетки злокачественных опухолей, так же, как и здоровые клетки, нуждаются в постоянном доступе к кислороду и питательным веществам. Опухоль не может расти, если в организме не формируются новые кровеносные сосуды, которые насыщают и питают её. Процессы образования новых кровеносных сосудов получили название «ангиогенез». Препараты, подавляющие процессы ангиогенеза (ингибиторы ангиогенеза), препятствуют этим процессам, не дают образовываться новым сосудам, тем самым замедляя или останавливая рост опухоли.
В отличие от других противоопухолевых препаратов, например, широко применяющихся химиотерапевтических агентов, ингибиторы ангиогенеза не оказывают прямого губительного влияния на опухолевые клетки. Вместо этого они зачастую воздействуют на клетки, окружающие опухоль и помогающие ей расти. По мере размножения клеток опухоли и роста её размеров, потребности раковых клеток в кислороде и питательных веществах непрерывно возрастают. Они посылают своеобразные «сигналы» которые запускают процессы ангиогенеза. На Рисунке 1 схематично представлен процесс образования новых сосудов.
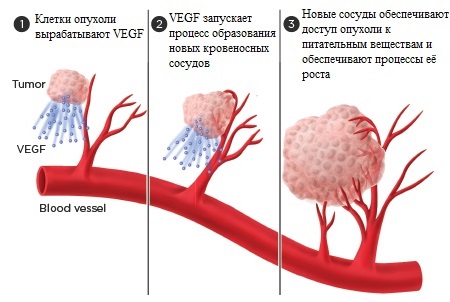
Рисунок 1. Образование новых сосудов под влиянием VEGF. VEGF — фактор роста эндотелия
В норме организм использует подобные сигналы в случаях, когда возникает кислородное голодание тканей. Если опухоли удается «обмануть» организм, в ответ на эти сигналы начинаются процессы образования новых кровеносных сосудов, которые дают опухоли возможности для дальнейшего роста и метастазирования. Если эти процессы нарушаются под действием лекарств – новые сосуды не образуются. Голодание опухолевых клеток усугубляется и они погибают. Этот принцип и лежит в основе применения ингибиторов ангиогенеза.
Ингибиторы ангиогенеза относятся к так называемой «таргетной» (целенаправленной) терапии. Они оказывают минимальное воздействие на нормальные клетки, вследствие чего риск развития нежелательных явлений на фоне их применения относительно невысок. Впервые препараты этого класса появились в конце 1990-ых годов, первым ингибитором ангиогенеза, внедренным в клиническую практику, стал бевацизумаб. Бевацизумаб представляет собой моноклональное антитело – специально сконструированный белок, способный избирательно связываться с молекулой, которая осуществляет передачу сигнала для образования новых сосудов. Эта молекула получила название фактор роста эндотелия (VEGF) В настоящее время бевацизумаб успешно применяется в лечении различных злокачественных опухолей, включая немелкоклеточный рак легкого, рак толстой кишки, почки, некоторых опухолей мозга и т. д. Другими препаратами, блокирующими работу VEGF, является афлиберцепт и рамуцирумаб. Подобно бевацизумабу, они связывают эту молекулу и препятствуют образованию новых сосудов в опухоли. Наиболее часто бевацизумаб и схожие с ним препараты применяются в комбинации с химиотерапией. В ряде исследований было показано, что добавление ингибиторов ангиогенеза к химиотерапии способствует увеличению её эффективности.
В дальнейшем были разработаны другие препараты, работающие по такому же принципу. В клиническую практику вошли такие лекарства, как сорафениб, который применяется для лечения рака печени и почки, пазопаниб и сунитиниб, играющие важнейшую роль в лечении рака почки, а также другие препараты.
Необходимо отметить, что ингибиторы ангиогенеза не являются «золотой пулей», позволяющей гарантированно остановить рост опухоли. В некоторых случаях они способны эффективно сдерживать рост опухолевых клеток, тогда как в других они не оказывают такого эффекта. В настоящее время не существует способов предсказать эффективность их применения до начала лечения.
Неясным также остается вопрос как долго следует проводить лечение препаратами этой группы. Поиск ответов на эти вопросы в настоящее время проводится в клинических исследованиях.
Применение ингибиторов ангиогенеза может сопровождаться серьезными побочными эффектами. В том числе, на фоне их применения может отмечаться значительное и стойкое повышение артериального давления, кроме того может повышаться риск развития тромбозов, кровотечений и повреждения стенок кишечника. Тем не менее, в большинстве случаев эти побочные эффекты могут быть скорректированы в случае своевременного распознавания.
Подводя итог, можно отметить, что ингибиторы ангиогенеза играют важную роль в процессе лечения многих заболеваний. Их правильное применение позволяет значительно продлить жизнь пациентам.
Источник

При лечении влажной макулодистрофии целью является предотвращение роста аномальных кровеносных сосудов путем блокирования стимуляторов роста новых сосудов, а также разрушающее воздействие на существующую неоваскулярную сеть с целью прекращения кровотечения. Добиваться этого при существовавших ранее методах не представлялось возможным.
В настоящее время для лечения пациентов с макулодистрофией стал препарат Луцентис, который в июне 2006 года был утвержден FDA, как уникальное средство для лечения возрастной макулярной дегенерации, а в 2008 году — зарегистрирован и в России.
С 2010 года наша Клиника применяет препарат Луцентис в клинической практике. В состав препарата Луцентис входят особые по своим свойствам молекулы действующего вещества — ранибизумаба, которые помогают пациентам восстановить зрение.
Почему Луцентис эффективен?
Луцентис был специально разработан для применения в офтальмологии, что обеспечивает его высокую эффективность и безопасность. Препарат снижает избыточную стимуляцию роста аномальных сосудов при возрастной макулярной дегенерации, нормализует толщину сетчатки, действует на связь только с активными изоформами фактора роста новых сосудов, обеспечивая патогенетический подход к терапии. Луцентис быстро и полностью проникает во все слои сетчатки, таким образом уменьшает макулярный отек и предотвращает увеличение размера поражения, прогрессию роста «не здоровых» сосудов и новые кровоизлияния.
Улучшите зрение с помощью инъекций Луцентиса в нашей клинике!
Лечение при помощи Луцентиса позволяет не только замедлять прогрессирующее падение зрения, но и улучшить остроту зрения у многих пациентов с макулодистрофией.
Оставьте свой номер телефона.
Вам перезвонит администратор клиники.

Запишитесь на прием
Стоимость введения Луцентиса
35000 руб.
Введение Луцентиса
Препарат Луцентис вводится в стекловидное тело в дозе 0,5 мг (0,05мл). Сначала проводятся 3 последовательные ежемесячные инъекции Луцентиса (фаза «стабилизации»), затем количество инъекций рекомендует врач в зависимости от состояния зрительных функций и степени заболевания (фаза «поддержания»). Интервал между введениями доз составляет как минимум 1 месяц.

Результаты
Результаты применения препарата препарата впечатляют: по статистике 90% пациентов, получавших инъекции луцентиса, сохранили зрение, а 70% пациентов — улучшили зрение. Однако добиться таких показателей возможно только при строгом соблюдении всего технологического процесса: проведении тщательного диагностического обследования зрительной системы, квалифицированного выполнения самой инъекции препарата, последующего динамического наблюдения с использованием высокотехнологичной аппаратуры — оптического когерентного томографа и цифровой фундус- камеры (прибора для проведения флуоресцентной ангиографии).
Луцентис обеспечивает быстрое и долговременное улучшение зрения, независимо от типа неоваскуляризации. Основное улучшение зрения наблюдается в первые 3 месяца терапии. Некоторые пациенеты отмечали улучшения уже в первые 2-7 дней от начала лечения.
В нашей Клинике лечение при помощи препарата Луцентис проводится с соблюдением всех необходимых стандартов. Перед началом лечения пациент проходит обязательное компьютеризированное диагностическое обследование зрения. По результатам которого, врач может составить полное представление о состоянии зрительной системы конкретного пациента, удостовериться в необходимости лечения, разработать индивидуальный график введения инъекций и сделать прогноз того, каким будет состояние зрения после курса процедур.
Лечение при помощи Луцентиса в нашей Клинике проводится сертифицированными офтальмологами, имеющими опыт выполнения интравитреальных инъекций. Внутриглазная инъекция препарата проводится амбулаторно, что не требует пребывания в стационаре.
Инъекции Луцентиса выполняются 1 раз в месяц (курс составит 3 инъекции). Обычно после этого наступает фаза стабилизации. Однако 2-3 раза в год необходимо посещать своего офтальмолога.
Памятка пациенту, получающему лечение препаратом ЛУЦЕНТИС.
Источник
Интравитреальная инъекция является одним из наиболее популярных, но в тоже время и наиболее эффективных методов лечения офтальмологических заболеваний. Впервые интравитреальное введение было выполнено Ohm J. в 1911 году с целью тампонады сетчатки стерильным воздухом. В 40-х годах XX века интерес к этой процедуре начал расти, были выполнены экспериментальные исследования интравитреального применения антибактериальных препаратов при лечении воспалительных заболеваний глаз. В 1970-х годах проведены работы по лечению пролиферативной витреоретинопатии методом интравитреальной инъекции антионеопластических препаратов. В 80-90-х годах было исследовано интравитреальное введение антивирусных средств.

В последнее же десятилетие широкое распространение получило интравитреальное введение ингибитора ангиогенеза, представляющий собой высокоэффективный метод лечения заболеваний сетчатки глаза, сопровождающихся ростом новообразованных патологических сосудов.
Так по мере развития научных представлений о патогенезе глазных болезней и совершенствования технологий фармакологической промышленности интравитреальное введение препарата стало вариантом выбора при лечении различной патологии органа зрения, а перечень используемых препаратов существенно расширился.
Что такое интравитреальное введение препарата
Изнутри полость глазного яблока заполнена прозрачной гелеобразной субстанцией, называемой стекловидным телом. Интравитреальная инъекция подразумевает введение лекарственного препарата в полость глазного яблока с помощью иглы. Большинство лекарственных препаратов, при использовании их в форме глазных капель или мазей, не достигают сетчатки. В то время как основная часть офтальмологической патологии требует доставки лекарств непосредственно к ретинальной области.
Достичь необходимого эффекта можно только посредством интравитреального введения препарата, поскольку наличие особого клеточного барьера не позволяет медикаментам, введенным в вену или мышцу, попасть к сетчатке. Этот лечебный метод играет важнейшую роль в терапии многих глазных заболеваний. Каждое заболевание требует введения определенных препаратов, о которых речь пойдет ниже.

Перечень лекарственных препаратов и показания к такому их введению продолжают постоянно расширяться, а научные исследования в данном направлении проводятся во всем мире и в настоящее время.
Показания к интравитреальной инъекции
Перечень показаний к интравитреальному введению лекарственных препаратов определяются индивидуально в зависимости от имеющегося у каждого конкретного пациента глазного заболевания. С помощью этого метода можно успешно лечить тяжелые и потенциально приводящие к полной или частичной потере зрения заболевания глазного дна, такие как:
- Сенильная макулярная дегенерация, влажная форма.
- Клинически значимый макулярный отек, являющийся следствием пролиферативной диабетической ретинопатии.
- Эндофтальмиты.
- Увеиты.
- Окклюзия центральной вены сетчатки или ее ветвей.
- Хориоидальная неоваскулярная мембрана, возникшая вторично вследствие множественной ретинальной патологии.
- Кистозный отек макулы.
Преимущества и недостатки метода
Как и любой лечебный метод, интравитреальное введение лекарственных препаратов имеет свои плюсы и минусы. Неоспоримым преимуществом является целевая доставка, большая вероятность полноценного терапевтического эффекта и относительно невысокие риски системных нежелательных реакций. Эти преимущества и получаемый терапевтический эффект являются очень «заманчивыми» для специалистов-офтальмологов. Однако риски возникновения возможных осложнений всегда должны быть на второй чаше весов.
Наиболее серьезным осложнением процедуры является бактериальная контаминация и возникающий вследствие инъекции эндофтальмит. Последние научные исследования в данной области определяют риск возникновения эндофтальмита как 0,051% при выполнении каждой конкретной инъекции. Однако, при соблюдении медперсоналом всех асептических мероприятий, риски бактериальной контаминации сводятся к минимуму.
Другие документально подтвержденные осложнения включают:
- Отслойку сетчатки.
- Стойкую внутриглазную гипертензию.
- Субконъюнктивальные или внутриглазные кровоизлияния.
- Повреждения хрусталика.
- Развитие или прогрессирование уже имеющейся катаракты.
- Гипотонию, аллергические или анафилактические реакции.
При планировании интравитреального введения лекарственных препаратов пациенту необходимо подробно объяснить все преимущества метода, а также риски и возможные осложнения. К процедуре приступают только после получения добровольного информированного согласия пациента.
Техника выполнения процедуры
Интравитреальные инъекции проводятся амбулаторно, то есть после процедуры пациент в госпитализации не нуждается, и может после кратковременного наблюдения и получения врачебных назначений идти домой. Ввиду малого диаметра используемой иглы ее введение в полость глаза сопровождается минимальным дискомфортом, вследствие чего применение анестезирующих глазных капель обычно вполне достаточно для операционного комфорта пациента. В редких случаях используется субконъюнктивальная инъекция лидокаина с целью дополнительного обезболивания. Для профилактики бактериальной контаминации производится обработка конъюнктивального мешка йодсодержащим антисептиком. Используется только стерильный хирургический инструментарий, а также врач выполняет тщательную обработку рук и использует стерильные перчатки. Интравитреальное введение ингибитора ангиогенеза, стероидных препаратов или антибиотиков проводится по стандартной методике.
В качестве ретрактора используется векорасширитель. Он необходим для предотвращения непроизвольных морганий глазом, что может помешать работе врача. Предоперационное введение антибиотика остается на усмотрение лечащего врача и чаще применяется при наличии сопутствующих инфекционных состояний, в частности, блефарита. Однако в ходе научных исследований не получено достоверных данных о снижении рисков эндофтальмита при предоперационном использовании антибактериальных препаратов. Для интравитреального введения препаратов используются иглы толщиной 27-30G. Место инъекции должно быть в 3,5-4 мм от лимба для людей с собственным хрусталиком. Для пациентов после замены хрусталика расстояние должно быть 3-3,5 мм. Эти расстояния основаны на анатомических особенностях глазного яблока: игла должна пройти в особом месте, называемом по-латыни pars plana, минуя хрусталик и сетчатку. В процессе инъекции пациента просят смотреть в противоположную сторону от квадранта, в котором производится вмешательство. После попадания иглы в полость стекловидного тела производится небыстрое введение препарата.
После выполнения манипуляции хирург должен убедиться в наличии адекватной циркуляции по ретинальной артерии. Иногда для того чтобы удостовериться в отсутствии осложнений необходима послеоперационная офтальмоскопия. Послеоперационная антибиотикопрофилактика также остается на усмотрение хирурга-офтальмолога. Первичный мониторинг внутриглазного давления осуществляется сразу после инъекции, затем по прошествии 5-10-минутного промежутка. Если через 20 минут снижение не наблюдается, рекомендовано использование гипотензивных препаратов. После соблюдения всех мер предосторожности пациент может покинуть офтальмологическую клинику.
Интравитреальное введение Луцентиса
Луцентис представляет собой ингибитор ангиогенеза, действующим веществом которого является ранибизумаб. Механизм действия Луцентиса при его интравитреальном введении обусловлен блокадой рецепторов, необходимых для адгезии и связывания эндотелиального сосудистого фактора роста. Ранибизумаб, взаимодействуя с рецепторами на поверхности эндотелиальных клеток, предотвращает клеточную пролиферацию, просачивание жидкости и образование аномальных кровеносных сосудов.
Луцентис получил широкое применение в антиангиогенной терапии неоваскулярной формы сенильной дегенерации сетчатки, макулярном отеке, ассоциированном с окклюзией ретинальной вены, диабетической ретинопатии и возникающем на ее фоне отеке макулы. Наиболее часто используемая дозировка – 0,5 мг Луцентиса 1 раз в месяц. Длительность курса лечения определяет лечащий врач, обычно она составляет около 6 месяцев.

Интравитреальное введение Авастина
Данный препарат также относится к группе антивазопролиферативных агентов, действующим веществом которого является бевацизумаб. Ранее такого рода моноклональные антитела использовались для лечения онкологической патологии, в частности, злокачественных опухолей желудка и кишечника. Позже была доказана эффективность бевацизумаба при его интравитреальном введении в качестве ингибитора ангиогенеза в терапии диабетической ретинопатии и влажной формы дистрофии сетчатки.
Механизм действия аналогичен с таковым ранибизумаба (Луцентиса). Авастин позволяет приостановить процессы формирования новых кровеносных сосудов и просачивание жидкости через сосудистую стенку, что помогает пациентам, как можно дольше сохранить зрительные функции.

Интравитреальное введение «Озурдекса»
«Озурдекс» представляет собой препарат для интравитреальной инъекции, содержащий 0,7 мг стероидного гормона дексаметазона. Целью интравитреального введения «Озурдекса» являет подавление воспалительной реакции посредством подавления множества воспалительных цитокинов. Клинически это проявляется в уменьшении отека, отложения фибрина, минимизация капиллярного пропотевания и миграции воспалительных клеток.
Показаниями к интравитреальному использованию «Озурдекса» является окклюзия ретинальной вены (основного ствола или ветвей), увеит заднего сегмента глаза и диабетический макулярный отек. Вопрос о повторной инъекции «Озурдекса» решается после оценки динамики состояние глазного дна. Вводимый препарат обладает пролонгированным эффектом.

Интравитреальное введение Гемазы
Химическое вещество, содержащее в данном препарате – проурокиназа. Оно относится к фибринолитическим средствам, то есть обладает способностью трансформировать плазминоген в плазмин, тем самым подвергая лизису уже сформировавшиеся тромбы. Для интравитреального введения используется 500 МЕ активного вещества.
Показания к применению: частичный гемофтальм или субтотальный и тотальный гемофтальм без признаков отслойки сетчатки по результатам ультразвукового исследования, окклюзия центральной вены или артерии сетчатки или их ветвей, суб-, интра- и преретинальные кровоизлияния. При локальном использовании риски системной кровоточивости минимальны или вовсе отсутствуют. Препарат противопоказан при связанных с гипокоагуляцией заболеваниях крови, а также при выраженной печеночной недостаточности.
Интравитреальная инъекция Кеналога
Действующим веществом препарата Кеналог является триамцинолон. Это синтетический глюкокортикостероидный гормон. Его эффект основан на подавлении ангиогенеза, воспалительных реакций посредством блокировки миграции и пролиферации клеток воспаления. Стероиды также блокируют выработку эндотелиального фактора роста, стабилизируют клеточные мембраны и снижают сосудистую проницаемость, что важно для лечения обширного спектра офтальмологических заболеваний.
Интравитреальное введение Кеналога показано при диабетическом и кистозном макулярном отеке, окклюзии ретинальной вены, а также при влажной форме возрастной дистрофии сетчатки.

Интравитреальная инъекция антибиотика
Введение антибактериальных препаратов интравитреально представляет собой наиболее эффективный способ лечения эндофтальмита. Интравитреальное введение антибиотиков является единственным способом достижения их терапевтической концентрации в полости стекловидного тела, так как гематоретинальный барьер не позволяет препаратам из системного кровотока проникать в полость глазного яблока. При своевременном применении возможно получение хорошего лечебного эффекта и сохранение высоких зрительных функций.
Для лечения бактериального эндофтальмита, вызванного грамположительной флорой, используются такие препараты, как Ванкомицин и Цефазолин. При грамотрицательных возбудителях рекомендовано применение Цефтазидима, Амикацина и Гентамицина. Иногда антибактериальные препараты комбинируют с интравитреальным введением кортикостероидов.
Интравитреальное введение Эйлеа
Эйлеа также является ингибитором ангиогенеза, действующим веществом которого является афлиберцепт. Каждый шприц с раствором Эйлеа содержит 40 мг активного вещества. Афлиберцепт является моноклональным антителом, обладающим выраженными антипролиферативными свойствами.
Механизм действия заключается в связывании и предотвращении активации эндотелиального ростового фактора и плацентарного фактора роста. Таким образом, эффект препарата также заключается в блокаде неоваскуляризации и предотвращении макулярного отека.
Показания к использованию афлиберцепта: влажная форма макулярной дегенерации, ассоциированный с тромбозом ретинальной вены отек макулы, диабетическая ретинопатия.

Цена интравитреального введения препаратов
Стоимость интравитреальных инъекций зависит от категории сложности, состояния глаза на момент инъекции и вводимого лекарственного препарата. Цена варьирует от 14000 до 85000 рублей. Окончательную стоимость, вид лекарственного средства, показания к введению и длительность курса лечения определяет лечащий врач. Также нельзя забывать о необходимости предоперационных лабораторных и инструментальных обследований.
Интравитреальные инъекции лекарственных препаратов – уникальный и эффективный метод доставки лекарств к сетчатке глаза. Благодаря этой процедуре удается предотвратить прогрессирование многих серьезных заболеваний, потенциально вызывающих постепенную или острую потерю зрения. А возможность выполнения этой манипуляции на амбулаторном этапе, ее безопасность и относительная простота выполн