Синдром сухого глаза глаукома
Может ли проактивное выявление ССГ влиять на прогрессирование глаукомы?

Голубев Сергей Юрьевич
К.м.н., врач-офтальмолог, филиал Военно-медицинской академии им С.М. Кирова, представитель TFOS* в России.

Бржеский Владимир Всеволодович
Д. м. н., завведующий кафедрой офтальмологии ФГБОУ ВО СПбГПМУ Минздрава Росии
*TFOS: Tear Film & Ocular Surface Society — Международное общество исследователей слезной пленки
Глаукома – группа заболеваний со схожими признаками, включающими поражение головки зрительного нерва и сужение поля зрения.
Причиной глаукомы чаще всего является повышенное внутриглазное давление. Исход глаукомы в отсутствие лечения – прогрессирующее сужение поля зрения и слепота.
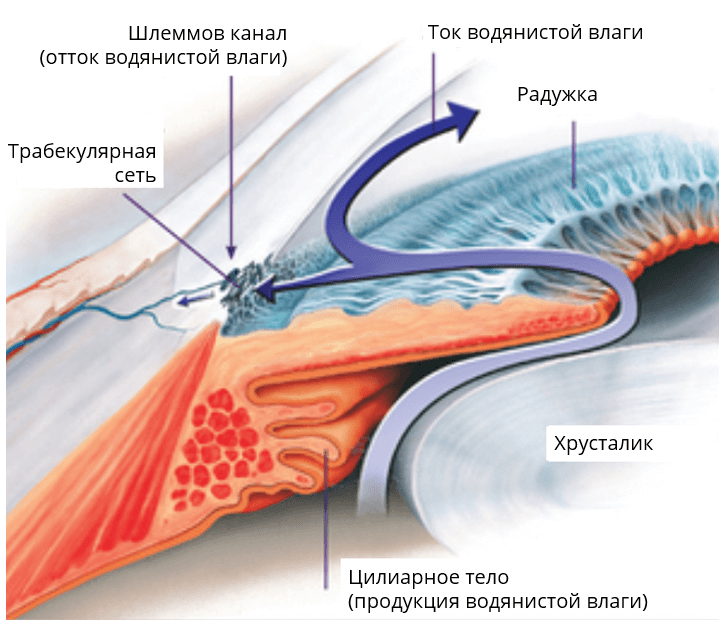
Лечение глаукомы основано на снижении внутриглазного давления для профилактики или задержки необратимых изменений зрительного нерва. Для этого в арсенале современного специалиста имеется несколько вариантов – медикаментозная терапия, лазерное или хирургическое вмешательство.
Методом первого выбора является использование местных антиглаукомных препаратов. На амбулаторном приеме задача специалиста в ведении этой группы пациентов – отслеживать эффективность назначенной терапии, соблюдение пациентом рекомендаций и динамику зрительных функций1.
Как проактивный подход к оценке состояния глазной поверхности может помочь улучшить качество жизни и способствовать сохранению зрительных функций пациентов с глаукомой?
Распространенность ССГ среди пациентов с глаукомой
И глаукома, и синдром сухого глаза (ССГ) – заболевания, чаще встречающиеся у «возрастных» пациентов. Однако если в исследованиях среди пациентов старше 50 лет частота ССГ варьирует от 3,9 до 34% , то по результатам многоцентрового эпидемиологического исследования, включившего более 20000 пациентов с глаукомой синдром сухого глаза был выявлен у 52.6%2,3.
В чем причина ССГ у пациентов с глаукомой?
Лечение глаукомы – постоянное использование антиглаукомных капель с кратностью закапывания от одного до нескольких раз в сутки, иногда – комбинации нескольких препаратов, на протяжении многих лет.
При этом и действующее вещество, и сопутствующие компоненты могут негативно влиять на слезную пленку и глазную поверхность4. В списке препаратов, способных индуцировать или ухудшать симптоматику ССГ, практически все группы антиглаукомных капель. При этом компонентом, наиболее тесно связанным с развитием ССГ, исследования называют консервант5.
В статье Hollo et al ССГ, сопутствующий глаукоме, определяется следующим образом:
дисбаланс гомеостаза глазной поверхности, вызванный токсическим эффектом длительного применения местных препаратов, что ведет к нарушению стабильности слезной пленки, повреждению эпителия и воспалению глазной поверхности4
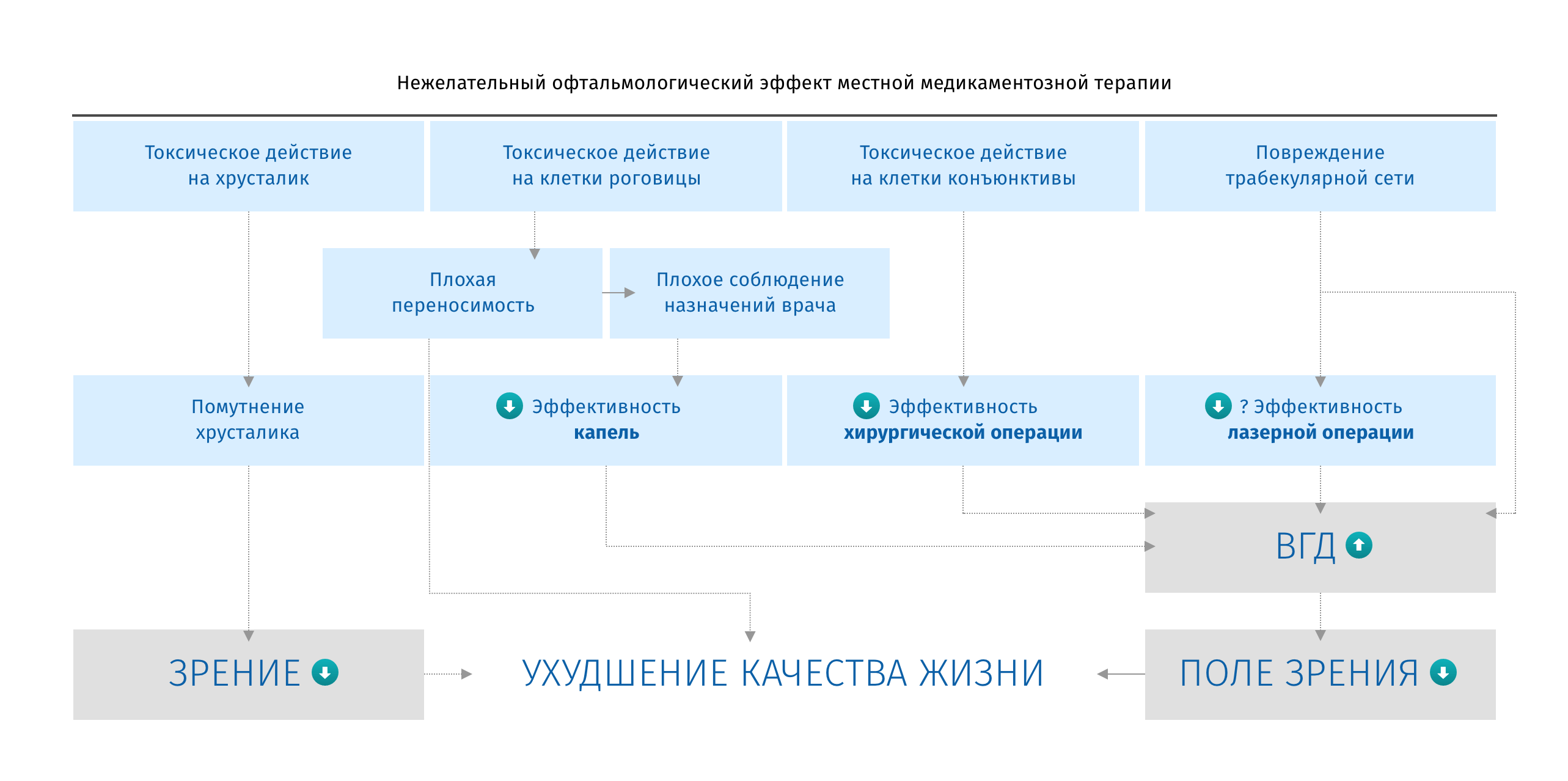
Нежелательные офтальмологические эффекты местной медикаментозной терапии глаукомы. Источник: Preservative-free Treatment in Glaucoma Is a Sensible and Realistic Aim for the Future. Marina Hopes, David Broadway. European Ophthalmic Review, 2010
Консерванты в глазных каплях: осторожно, БАХ!
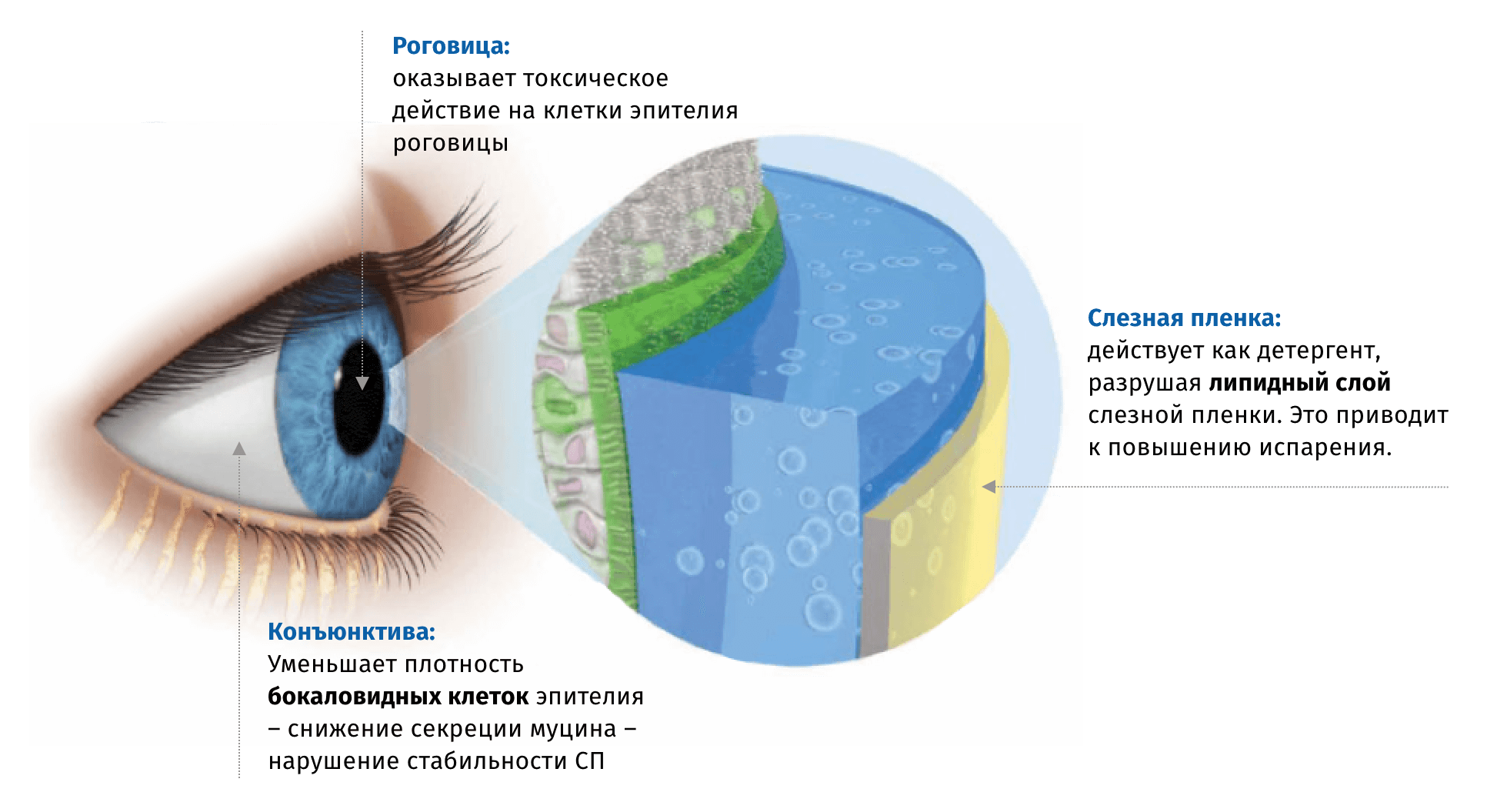
Наличие консерванта в глазных каплях предотвращает микробную контаминацию содержимого флакона. Чаще всего в офтальмологических препаратах используется Бензалкония Хлорид (БАХ), который обладает высокой активностью в отношении большинства патогенных микроорганизмов в достаточно низкой концентрации, однако способен оказывать токсическое воздействие на клетки поверхности глаза, особенно при частом и длительном применении6.
Механизм негативного воздействия БАХ на ткани поверхности глаза связывают в непосредственным токсическим воздействием на клетки эпителия, а также с его детергентными свойствами,способствующими разрушению липидного слоя слезной пленки6.
Кроме того, ряд исследований связывает БАХ с токсическим действием на клетки трабекулярной сети и эпителия хрусталика7,8.
Выраженность негативного действия БАХ на ткани глаза зависит от кратности и продолжительности закапывания. Степень тяжести симптомов ССГ напрямую связана с количеством применяющихся местных препаратов. Исследование Rossi et al. показало зависимость частоты ССГ от количества применяемых препаратов: использование в схеме лечения 3х препаратов – 43%, 2 – 39%, 1 – 11%9.
Следует учитывать, что многие местные препараты, назначаемые специалистом дополнительно – слезозаменители, кератопротекторы — также могут содержать БАХ в качестве консерванта, что увеличивает токсическую нагрузку.
Бесконсервантные формы
В исследованиях прослеживается зависимость между частотой ССГ и наличием консерванта в используемых пациентом препаратах. Например, по данным мультицентрового кросс-секционального эпидемиологического исследования в 4 странах Европы с участием 9658 пациентов с глаукомой переход на бесконсервантную форму препарата позволяет уменьшить нежелательную симптоматику10:

На сегодняшний день существуют препараты выпускаемые в бесконсервантной форме — одноразовые тюбик-капельницы (монодозы), или многодозовые флаконы со специальной системой защиты от контаминации (особая мембрана или клапан). Однако выпуск препарата в форме монодоз увеличивает его стоимость, а перечень антиглаукомных препаратов в многодозовых флаконах без консерванта пока ограничен.
Альтернативные консерванты
Помимо бесконсервантных форм, у современному специалисту доступен целый ряд альтернативных консервантов, позволяющих уменьшить негативное влияние на глазную поверхность даже при частых закапываниях.
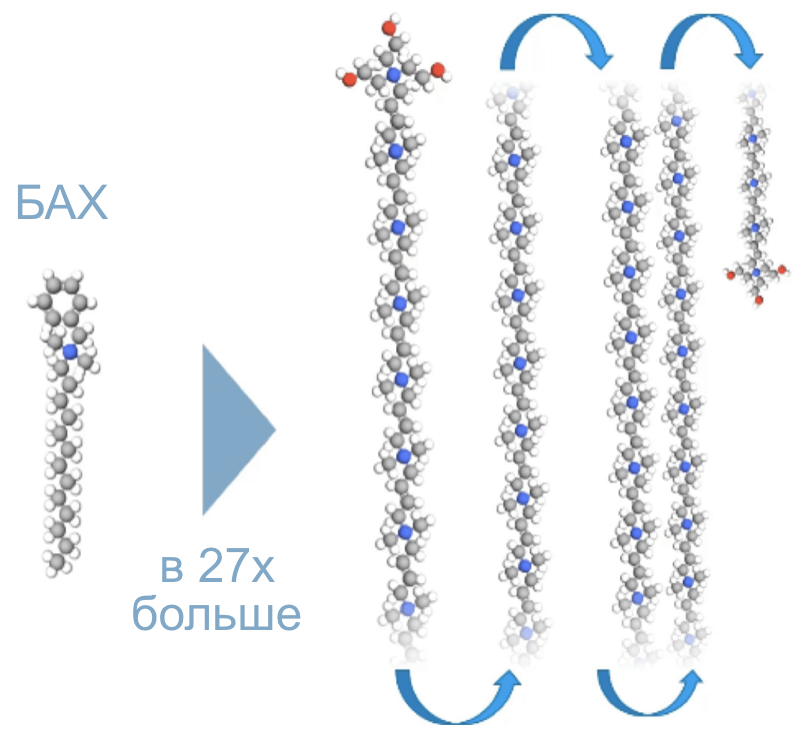
Поликватерниум (Поликвад) – консервант, широко используемый в растворах для контактных линз, в слезозаменителях и в препаратах для лечения глаукомы. По своей структуре поликватерниум представляет полимерное соединение четвертичного аммония. Размер молекулы примерно в двадцать семь раз больше молекулы БАХ.
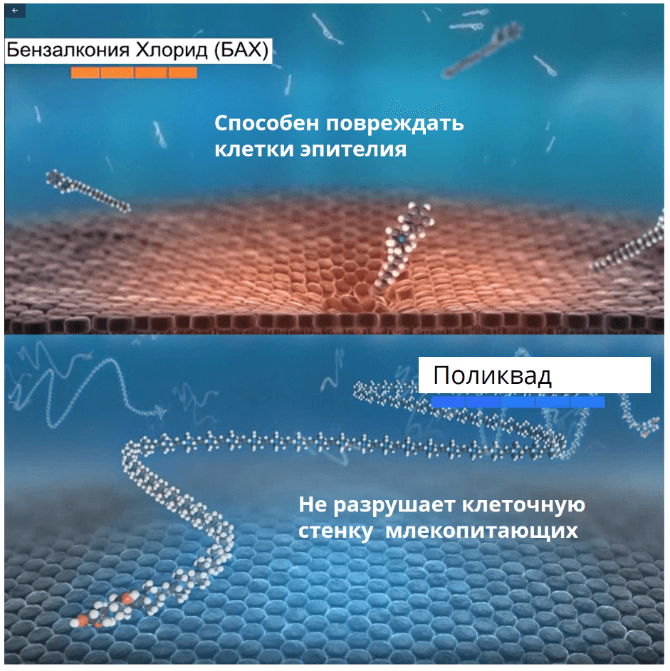
Макромолекула поликватерниума не оказывает токсического действия на клетки млекопитающих. Кроме того, молекула не обладает детергентными свойствами и не разрушает липидный слой, что это сводит к минимуму нежелательные эффекты на глазную поверхность6.
Целый ряд клинических исследований подтвердил безопасность применения офтальмологических растворов с поликвадом для тканей глазной поверхности6,13,14,15
Еще одна группа консервантов, активно использующаяся в препаратах для лечения глаукомы и ССГ — окислительные консерванты, распадающиеся при контакте со слезой.
Перборат натрия, является консервантом окислительного типа, который изменяет синтез белка в бактериальных клетках через окислительные механизмы. При попадании в глаза присутствующие в слезе энзимы (каталаза) разлагают консервант с образованием кислорода и воды6.
Стабилизированный Оксихлорокомплекс (СОК) состоит из хлорита, хлората натрия и диоксида хлора, распадается под действием света6.
Исследование Manlong et al. Позволило сравнить действие различных консервантов, используемых в слезозаменителях, на клетки эпителия роговицы человека.
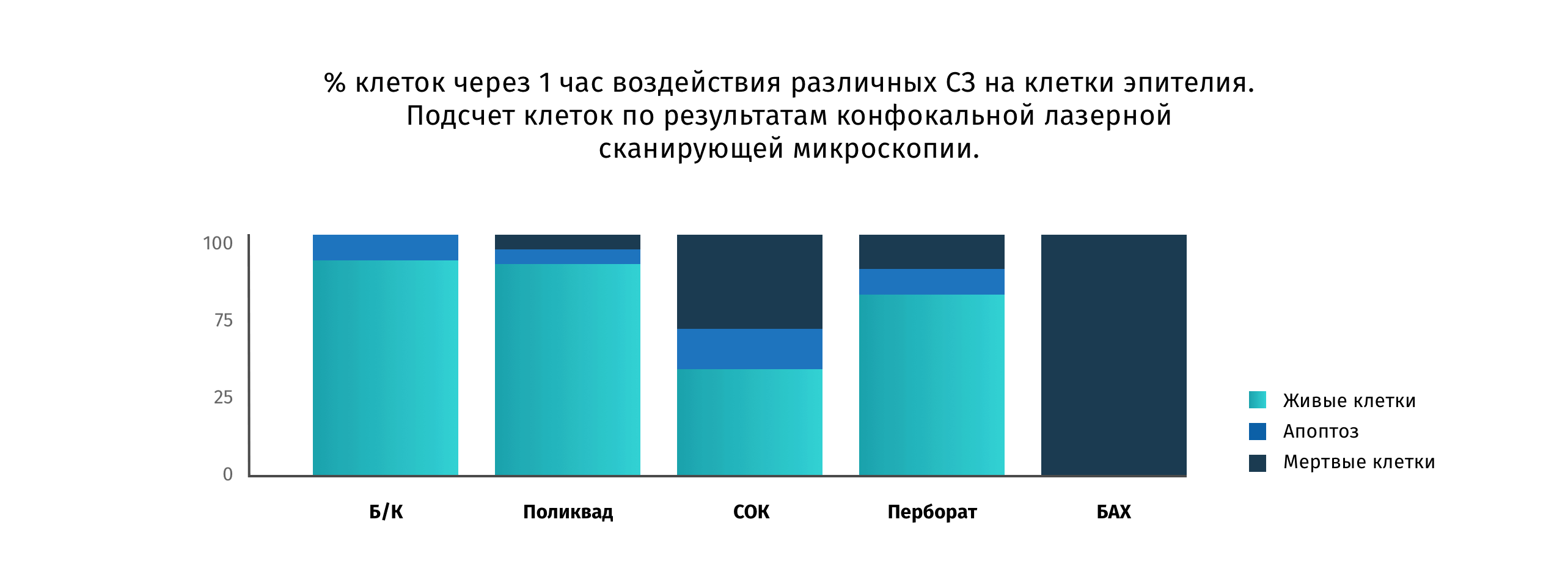
После воздействия различных слезозаменителей на монослой эпителиальных клеток жизнеспособность оценивалась с помощью конфокальной микроскопии. Альтернативные консерванты и бесконсервантные формы продемонстрировали клинически значимую разницу в сравнении с БАХ11.
Влияние ССГ на прогрессирование глаукомы
Проблема нежелательных явлений в терапии глаукомы волнует многих специалистов, и не только с точки зрения ССГ. Исследование Philippe Denis выявило связь между наличием симптомов ССГ, связанных с использованием антиглаукомных препаратов, и течением глаукомы. Данные исследования показывают, что присутствие нежелательных симптомов увеличивает риск прогрессирования глаукомы в 3,3 раза!12
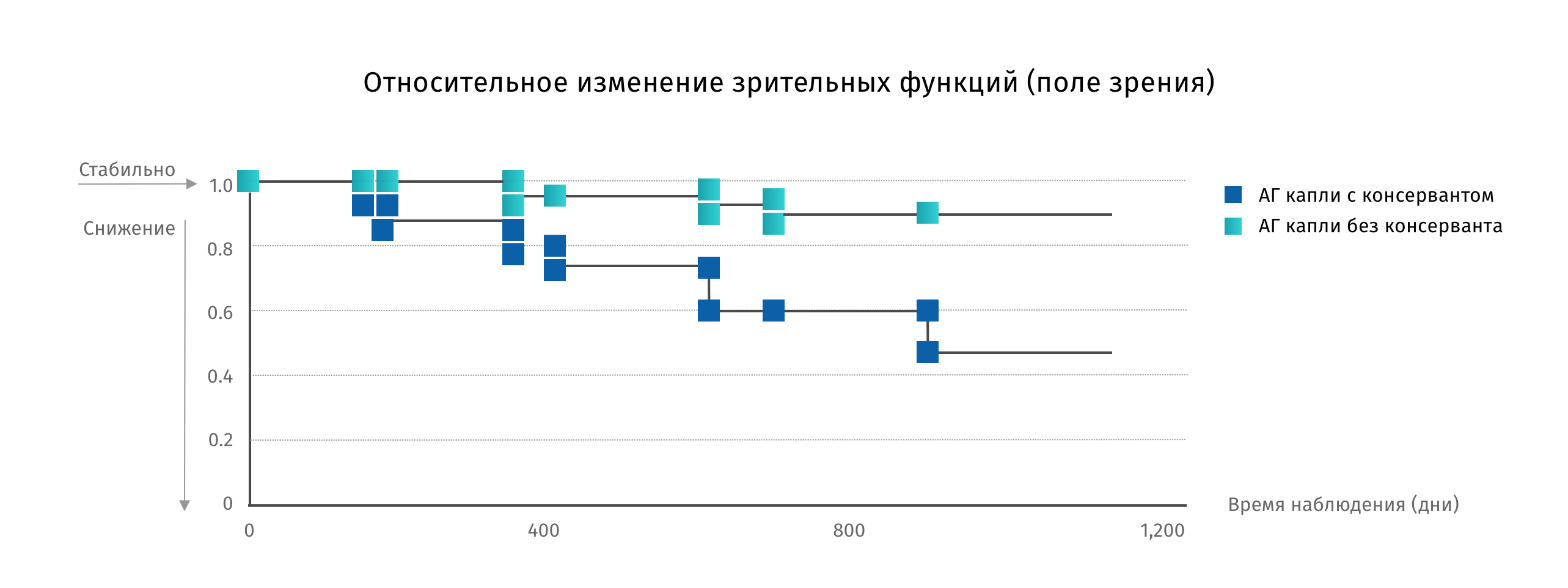
Причина достаточно проста – дискомфорт, связанный с нежелательными явлениями, снижает комплаентность пациентов. А нарушение режима ведет к прогрессированию атрофии зрительного нерва и необратимому снижению зрительных функций. Нежелательные явления, связанные с местным применением антиглаукомных препаратов, могут оказать неблагоприятное воздействие на соблюдение рекомендаций пациентом12.
Ведение пациентов с ССГ в практике глаукомного приема
Ведение пациентов с глаукомой в случае выявления ССГ имеет некоторые особенности: требуется корректировка схемы применения антиглаукомных препаратов с целью уменьшения токсической нагрузки.

Минимизмация кратности закапывания (использование комбинированных препаратов, пролонгированных форм)

Переход с БАХ на альтернативные консерванты с минимальной токсичностью или бесконсервантные формы

В случае выраженной симптоматики ССГ и повреждения глазной поверхности можно рассматривать также возможности лазерного и хирургического лечения2.
Выбор слезозаменителей для пациентов с глаукомой
Для защиты глазной поверхности, а также для уменьшения симптоматики у данных пациентов применяют слезозаменители. Однако если слезозаменитель в качестве консерванта также содержит БАХ – итоги такого лечения могут быть сомнительны. Токсичность БАХ зависит от дозировки – вероятность ее увеличивается с каждым закапыванием препарата. Это важно учитывать при назначении дополнительных препаратов для местного применения.
Сегодня все больше слезозаменителей выпускается с альтернативными консервантами, обладающими минимальной токсичностью в отношении слезной пленки и эпителия глазной поверхности. Среди них – поликвад, оксид, пурит, окупур6.
Также все более популярными становятся препараты без консерванта – монодозы и препараты в особых мультидозных флаконах-контейнерах.
Ключевыми факторами при выборе слезозамещающей терапии у пациентов с глаукомой являются2:

Безопасный консервант или его отсутствие. Бесконсервантные формы выпускаются в форме монодоз или в специальных мультидозных флаконах.
Альтернативные консерванты, например, поликвад, не оказывают токчического действия на глазную поверхность и не нарушают стабильность слезной пленки6.

Длительность действия. Вязкие, гелеобразные препараты имеют более продолжительное действие, пример — препараты на основе карбомера.
Препараты с трансформационным эффектом при закапывании имеют низкую вязкость, а на поверхности глаза вязкость увеличивается, обеспечивая более длительную защиту — таким действием обладают препараты на основе гидроксипропилгуара.
Источник
Авторы
- Сафонова Т.Н., к.м.н., ведущий научный сотрудник отделения патологии слезного аппарата;
- Федоров А.А., к.м.н., ведущий научный сотрудник, заведующий лабораторией фундаментальных исследований в офтальмологии;
- Забегайло А.О., к.м.н., научный сотрудник отделения патологии слезного аппарата;
- Егорова Г.Б., д.м.н., ведущий научный сотрудник отдела рефракционных нарушений;
- Митичкина Т.С., к.м.н., старший научный сотрудник отдела рефракционных нарушений.
ФГБНУ «НИИ глазных болезней»
В настоящее время глаукома, основным фактором патогенеза которой является хроническая оптическая нейропатия, занимает лидирующее положение среди заболеваний, приводящих к слепоте, уступая только катаракте. Отмечается неуклонный рост заболеваемости глаукомой. Прогноз на 2020 г. составляет 80 млн человек среди общей популяции.
Традиционная терапия глаукомы, чаще всего ассоциированной с повышением внутриглазного давления, направлена на достижение уровня его индивидуальной нормы пациента, что создает условия для сохранения зрительных функций как основной цели лечения. В качестве гипотензивной терапии, назначаемой на продолжительный срок, используют аналоги простагландинов, -блокаторы, ингибиторы карбоангидразы. Длительное применение лекарственных средств, как правило, содержащих в своем составе консерванты, приводит к патологическим изменениям глазной поверхности: конъюнктивы, роговицы, а также трабекулярного аппарата, что является одним из факторов развития синдрома «сухого глаза» (ССГ) [1, 2].
Выраженность субъективных симптомов, необходимость частых инстилляций большого числа препаратов является одной из возможных причин отказа от лечения пациентов с глаукомой. В настоящее время установлено, что 60% больных глаукомой имеют признаки ССГ различной степени выраженности [3]. Следует отметить, что даже на первом году использования пациентами с глаукомой гипотензивных препаратов могут развиться ранние признаки ССГ, которые в последующем претерпевают значительные изменения и напрямую зависят от длительности применения и количества препаратов [4].
Наличие ССГ следует учитывать при оценке функциональных показателей больных с глаукомой, в частности — состояния полей зрения [5]. Известно, что на результаты исследования могут повлиять различные факторы: ширина зрачка, ошибки при определении рефракции, физиологический статус пациента, прием им лекарственных средств и т. д. При наличии у больного признаков ССГ возможны ошибки в определении остроты зрения из-за истончения прекорнеальной слезной пленки и изменения интерфейса между воздушной средой и поверхностью глаза, а также оценки площади псевдоскотомы при периметрии. Инстилляции слезозаменителей за 15 минут до проведения обследования позволяют уменьшить процент ложноположительных и ложноотрицательных ответов, что повышает достоверность исследования [6].
Длительное применение гипотензивных средств, особенно содержащих консерванты, нередко приводит к воспалению конъюнктивы, которое проявляется гиперемией, развитием субконъюнктивального фиброза, апоптозом эпителия, а также к дестабилизации прекорнеальной слезной пленки и структурным изменениям поверхности роговицы [7]. Патогенез повреждения глазной поверхности у пациентов с глаукомой многокомпонентен. В первую очередь — это токсическое воздействие консервантов на эпителий конъюнктивы и роговицы, который клинически реализуется снижением продукции слезы (что следует рассматривать как вторичный процесс) и уменьшением плотности бокаловидных клеток [8].
Отмечен и нейротоксический эффект гипотензивных препаратов. Механизм воздействия на нервные волокна роговицы заключается в разрушении мембранных структур нервных клеток [9]. Снижение чувствительности роговицы является дополнительным фактором, способствующим уменьшению частоты миганий и тока слезной жидкости [10]. Установлено также, что гипотензивные средства оказывают непосредственное, прямое детергентное воздействие на липидный слой прекорнеальной слезной пленки, дестабилизируя ее и повышая вапоризацию слезной жидкости [11].
Усиление испарения слезы, наряду с гиперосмолярностью, является одним из центральных звеньев в развитии ССГ. Контролирование процесса испарения помогает нормализовать осмолярность и минимизировать структурные изменения глазной поверхности. Поэтому актуальной является разработка лечения и профилактики развития вторичного синдрома «сухого глаза» у пациентов с первичной открытоугольной глаукомой, что и стало целью настоящего исследования.
Материалы и методы
Проведено обследование 50 пациентов (100 глаз): 20 мужчин, 30 женщин в возрасте от 46 до 85 лет с первичной глаукомой. Средний возраст больных составил 65,5±9,6 года. Продолжительность заболевания глаукомой от 1,5 до 17 лет. Пациенты использовали аналоги простагландинов (латанопрост, тафлупрост, травопрост), -адреноблокаторы (бетоксолол, тимолол), ингибиторы карбонангидразы (бринзоламид, дорзоламид), альфа -адреномиметик (бримонидин) в виде монотерапии или комбинации двух и трех лекарственных средств.
Для выявления признаков ССГ и последующего мониторинга проводили клинический осмотр и функциональные пробы: тест Ширмера и пробу Норна для определения общего объема слезопродукции и стабильности прекорнеального слезного слоя соответственно. Функциональное состояние мейбомиевых желез определяли по наличию липидов в мазке-отпечатке интермаргинального пространства век на миллипоровом фильтре после окрашивания в парах осмия (патент РФ № 2373832). Оценочная балльная шкала функционального состояния мейбомиевых желез основывалась на интенсивности и площади прокрашивания липидного слоя на миллипоровом фильтре.
Степень поражения эпителия роговицы и конъюнктивы устанавливали на основании тестов с витальными красителями (лиссаминовый зеленый и флюоресцеин) и импрессионно-цитологического исследования. Осмолярометрию проводили на приборе TearLab («Tearlab Corp», США). Изменение состояния липидного слоя слезной пленки оценивали методом тиаскопии. Анализировали цифровое изображение интерференционной картины липидного слоя с помощью специально разработанной компьютерной программы «Lacrima». Конфокальная микроскопия позволяла выявить нарушение в структуре эпителиального слоя роговицы и оценить состояние нервов стромального и суббазального нервных сплетений. Исследование осуществляли на конфокальном микроскопе «Confoscan-4» фирмы «Nidek» (Япония). Срок наблюдения составил 3 года.
Результаты и обсуждение
В результате проведенного комплексного клинико-функционального и инструментального обследования 50 больных с двухсторонней первичной глаукомой (100 глаз) признаки ССГ были выявлены в 70,6% (76 глаз). Из них в 23,6% случаев (18 глаз) имела место дисфункция мейбомиевых желез (ДМЖ). При анализе спектра субъективных жалоб были выделены наиболее распространенные: на чувство жжения в 89%, рези — в 71%, инородного тела — в 56%, болезненные ощущения при инстилляциях — в 43%. Средние значения общего объема слезопродукции по данным теста Ширмера составили 20,7±0,8 мм. Сопоставление этих показателей со средним возрастом исследуемой группы больных (65,5±9,6 года) позволяло сделать вывод о наличии гиперсекреции как начального проявления ССГ.
Показатели пробы Норна в группе в среднем соответствовали 9,7±0,1 с, что также указывало на начальные функциональные нарушения. Обращал на себя внимание тот факт, что ни в одном случае не было зафиксировано повышение уровня осмолярности (средние показатели составили 290,2±13,1 мОсм/л). Полученные нами результаты не совпали с имеющимися в литературе данными о гиперосмолярности слезы у пациентов с ССГ, ассоциированным с глаукомой [12]. Основные изменения касались, в первую очередь, нарушения состояния липидного слоя слезной пленки, которые четко коррелировали со стажем основного заболевания и количеством используемых гипотензивных препаратов.
Примененный метод компьютерной обработки интерференционной картины липидного слоя с помощью программы «Lacrima» позволил оценить его толщину и характер распределения липидов на поверхности водного слоя. Метод обеспечил возможность определения относительной площади (%) исследуемой зоны с определенной толщиной липидного слоя слезной пленки. Компьютерный анализ интерференционной картины слезной пленки показал распространение липидов по вертикали, отсутствие цветов высокого порядка. Липидный слой был неравномерно истончен с сохранением его нормальной толщины лишь на незначительных по площади участках (рис. 1).
Следует отметить, что процесс истончения липидной составляющей слезной пленки был более выражен у пациентов с наличием ДМЖ как отягощающего фактора, способствующего ускоренной эвапоризации слезной жидкости с поверхности глаза. Таким образом, были подтверждены данные о «размывающем» действии гипотензивных препаратов на липидную составляющую слезной пленки и создании предпосылок для токсического воздействия на эпителий конъюнктивы и роговицы. Это положение было подтверждено импрессионно-цитологическим исследованием конъюнктивы. Установлено значительное снижение числа бокаловидных клеток (от единичных до полного отсутствия в поле зрения), а также выраженные дистрофические изменения эпителия конъюнктивы (рис. 2).

Рис. 1. Интерференционная картина липидного слоя слезной пленки пациентки со стажем глаукомы 10 лет, постоянным использованием 2 гипотензивных средств на протяжении 5 лет и наличием ДМЖ. Сохранность нормальной толщины липидного слоя на 2-3% исследуемой площади

Рис. 2. Импрессионно-цитологическое исследование пациентки со стажем заболевания 1 год на фоне гипотензивной монотерапии
Доказательной базой цитотоксического эффекта на роговицу служили данные конфокальной микроскопии, которые демонстрировали наличие десквамированного переднего эпителия роговицы (рис. 3А), отечность, извитость и прерывистость хода нервов суббазального сплетения (рис. 3Б). Степень выраженности указанных изменений также коррелировала с длительностью заболевания и количеством используемых препаратов.


Рис. 3. Данные конфокальной биомикроскопии пациентки с 10-летним стажем глаукомы и наличием ДМЖ:
А — передний эпителий роговицы; Б — суббазальное сплетение
При разработке схемы лечения ССГ, ассоциированного с первичной глаукомой, были учтены полученные при обследовании результаты. С целью коррекции выявленных нарушений липидного слоя слезной пленки использовали инстилляции систейн-баланса — капель-любрикантов, формирующих защитную пленку на глазной поверхности. Капли применяли по следующей схеме: через 5-10 мин. после закапывания антиглаукомных препаратов и дополнительно от 2 до 4 раз в день в зависимости от индивидуальных ощущений пациента.
Выбор препарата был основан на особенностях состава препарата систейн-баланс, который включал в себя минеральные масла, анионы фосфолипидов и оригинальную систему Lipi Tech, способную восстанавливать и стабилизировать липидный слой слезной пленки. Дополнительно назначали репаративные средства: корнерегель, систейн-гель или витА-Пос на ночь для стимулирования регенераторных процессов в переднем эпителии роговицы. По данным нашего клинического наблюдения, эти препараты следует применять длительно, ориентируясь на результаты конфокальной микроскопии роговицы.
В процессе проведения исследования в 5 случаях (5 глаз, 6,5%) при отсутствии компенсации внутриглазного давления на проводимой терапии возникла необходимость смены режима инстилляций антиглаукомных средств. Через неделю после замены препаратов было проведено обследование этой группы пациентов, которое не выявило изменений функциональных показателей по данным теста Ширмера.
У всех пациентов установлено значительное увеличение показателей осмолярности — в среднем до 330,0±11,2 мОсм/л, которые до изменения медикаментозного режима не превышали 290,2 мОсм/л. На этом фоне была проанализирована интерференционная картина липидного слоя слезной пленки с помощью программы Lacrima. Зафиксировано увеличение зоны неопределенности (n/d) и наиболее тонких липидных слоев (0,07-0,13 мкм) слезной пленки наряду с уменьшением зоны с большей толщиной (0,17-0,5 мкм) (рис. 4А). Эти изменения липидного слоя слезной пленки отразились на результатах пробы Норна, средние показатели которой составили 7,3±0,2 с.
Рис. 4. Динамика интерференционной картины липидного слоя слезной пленки на фоне повышения показателей осмолярности: А — при повышении показателей осмолярности; Б — на фоне лечения
Полученные данные стали основанием для дополнения терапии назначением препарата оптив (трехкратно в день), стабилизирующего осмолярность эпителиальных клеток. Увеличения времени разрыва слезной пленки и понижения показателей осмолярности до референтных значений достигали за 3-4 недели терапии. На фоне проводимой терапии отмечали изменение интерференционной картины липидного слоя: увеличение зоны с большей толщиной липидов (рис. 4Б).
Рис. 5. Спектр и динамика субъективных жалоб

Рис. 6. Состояние липидного слоя в мазке-отпечатке межреберного пространства верхнего века: А — до лечения; Б — после курса терапии. Окраска осмием. Ув. 10
Предложенная схема медикаментозного сопровождения пациентов с первичной глаукомой в значительной степени снизила количество и степень проявления субъективных жалоб, динамика которых представлена на рис. 5.
За период 3-летнего наблюдения неоднократно проводили контроль функционального состояния слезных желез по данным теста Ширмера. В табл. 1 представлена динамика функциональных показателей до лечения и при выходе из исследования.
Отягощающим фактором дестабилизации слезной пленки считали наличие дисфункции мейбомиевых желез (18 глаз), усиливающее испарение слезы. Полученный в предыдущих исследованиях положительный результат по купированию воспалительного процесса на веках при дисфункции мейбомиевых желез и дополнительное увлажнение глазной поверхности при использовании очковой оправы «Блефастим» в комбинации с препаратом рестасис позволили применить этот метод в настоящей работе [13]. Препарат рестасис наносили на внутренние вкладыши оправы. При нагревании оправы происходило испарение препарата, за счет чего создавался эффект «паровой бани». Это способствовало направленной и ускоренной доставке его к поверхности глаза и век. Двойное действие процедуры позволяло устранить закупорку протоков мейбомиевых желез и увеличить секрецию липидов, восстанавливая и стабилизируя тем самым слезную пленку.
Касторовое масло, входящее в состав рестасиса, оседало на коже век, дополнительно увлажняя и питая ее. При проведении процедуры в качестве увлажняющего средства рекомендовали применять препараты, не содержащие консервантов (систейн — монодозы, визмед, визин «Чистая слеза» монодозы, офтолик БК, хило комод). Контролем эффективности лечения были данные тиаскопии и исследование функционального состояния мейбомиевых желез. Интерференционная картина липидного слоя после курса физиотерапии демонстрировала появление цветов интерференции второго порядка, что свидетельствовало о восстановлении структуры липидной составляющей слезной пленки. Исследование отпечатков устьев мейбомиевых желез до и после лечения показало увеличение числа функционирующих желез и объема их секрета (рис. 6).
Таблица 1
Динамика функциональных показателей
| Функциональные показатели, средние значения | До лечения | После лечения | Достоверность, р |
| Тест Ширмера, мм | 20,7±0,8 | 21,5±0,9 | 0,01 |
| Проба Норна, с | 9,7±0,1 | 9,8±0,2 | 0,05 |
| Осмолярность, мОсм/л | 290,0±13,1 | 297,0±14,7 | 0,05 |
Заключение
Разработанная схема лечения ССГ при первичной глаукоме, включающая препараты направленного действия, позволила оптимизировать состояние глазной поверхности и обеспечить стабильность функциональных показателей в течение всего периода наблюдения.
Литература / References
- Baudoin C. Detrimental effect of preservatives in eyedrops: implication for the treatment of glaucoma. Acta Ophthamol 2008; 86(7):716-726. doi 101016/s0161 6420(99)90116 1.
- Pflugfelder S., Baudoin C. Chclinical measurment of ocular surface diseae in glaucoma patients. ClinOphthalmol2011; 5:1575-1583. doi 10.2147/opth.s24410.
- Leung E.W., Medeiros F.A., Weinreb R.N. Prevalence of ocular surface disease in glaucoma patients. J Glaucoma 2008; 17(5): 350-355. doi 10.1097/ijg.0b013e31815c5f4f.
- Ammar D.A., Nolcker R.S., Kahook M.Y. Effect of benzalkonium chloride-preseved, polyquad-preserved, and sofZia-preserved topical glaucoma medications on human ocular epithelial cells. Adv Ther 2010; 27(11):837-845. doi 10.1007/s12325-010-0070-1.
- Ruker F., Erb C. Influence of dry eye syndrome on glaucoma diagnostic procedures. Ophthalmologe 2012; 109(11):1082-1086. doi 10.1007/s00347-012-2640-x
- Kocabeyoglu S., Mocan M.C., Bozkurt B., Irkec M. Effect of artificial tears on automated visual field testing in patients with glaucoma and dry eye. Can J Ophthalmol 2013; 48(2):110-114. doi 10.1016/j.jcjo.2012.11.001.
- Baudoin C., Labbe A., Liang H., Pauly A., Brignole-Baudoin F. Preservatives in eyedrops: the good, the bad and the ugly. Prog Retin Eye Res 2010; 29(4):312-334. doi 10.1016/j.preteyeres.2010.03.001.
- Lemp M.A., Zimmerman L.E. Toxic endothelial degeneration in ocular surface disease treated with topical medications containing benzalkonium chloride. Am J Ophthalmol 1988; 105(6):670-673. doi 10.1016/0002-9394(88)90062-1
- Sarkar J., Chaudhary S., Namavari A., Ozturk O., Chang J.H., Yco L., Sonawane S., Khanolkar V., Hallak J., Jain S. Corneal neurotoxicity due to topical benzalkonium chloride. Invest Ophthalmol Vis Sci 2012; 53(4):1792-1802. doi 10.1167/iovs.11-8775.
- Benitez-Del Castillo J.M., Acosta M.C., Wassfi M.A. Relation between corneal innervation with confocal microscopy and corneal sensivity with noncontact esthesiometry in patients with dry eye. Invest Ophthalmol Vis Sci 2007; 48(1):173-181. doi 10.1167/ iovs.06-0127.
- Wilson W.S., Duncan A.J., Jay I.L. Effect of benzalkonium chloride on the stability of the precorneal tear film in rabbit and man. Br J Ophthalmol 1975; 59(11):667-669. doi 10.1136/bjo.59.11.667.
- Clouzeau C., Godefroy D., Riancho L., Rostene W., Baudouin C., Brignole-Badouin F. Hyperosmolarity potentiates toxic effects of benzalkonium chloride on conjunctival pithelial cells in vitro. Mol Vis 2012; 18:851-863.
- Safonova T.N., Zabegailo A.O., Fedorov A.A., Lukisheva O.V. New method for treatment of chronic blepharitis associated with dry eye syndrome. Vestn Oftalmol 2014; 130(1):73-78.
https://www.glaucomajournal.ru/jour/article/view/82
Источник

