С антиген сетчатки глаза
Важной иммунологической особенностью глаза является наличие в нем большого числа т. н. секвестрированных (забарьерных) увеитогенных аутоантигенов, изолированных ГОБ от иммунной системы и способных в определенных условиях, при нарушении ГОБ и доступа антигенов к лимфоидным органам и активации иммунных клеток, индуцировать иммунный ответ и внутриглазное иммунное воспаление.
К их числу относятся несколько антигенов увеальной ткани и сетчатки:
- S-антиген (арестин),
- интерфоторецепторый белок (IRBP),
- родопсин,
- рековерин,
- фосдуцин,
- антигены пигментного эпителия, увеальной ткани и хрусталика.
 Одним из ключевых белков участников процесса усиления сигнала в зрительной клетке является арестин. Он участвует в механизме деактивации сенсорного сигнала, однако, как оказалось, также он играет роль и в других процессах, протекающих в сетчатке. Еще в 70-е годы прошлого века было установлено, что введение кролику водорастворимой фракции, полученной из сетчатки, индуцирует аутоиммунный увеит. Фактор, вызывающий аутоиммунный увеит, был назван S-антиген. Позже было установлено, что S антиген и арестин это один и тот же белок. Дальнейшие исследования показали, что у многих животных, включая приматов, вызванный S-антигеном экспериментальный увеит по своим клиническим проявлениям и гистологически похож на некоторые формы увеита у людей. Известно, что в индукции этого заболевания ключевую роль играет иммунная Т-система. Это позволяет предположить, что S-антиген играет определенную патогенную роль в индукции увеита. При некоторых формах увеита наблюдался как гуморальный, так и клеточный ответ на S-антиген.
Одним из ключевых белков участников процесса усиления сигнала в зрительной клетке является арестин. Он участвует в механизме деактивации сенсорного сигнала, однако, как оказалось, также он играет роль и в других процессах, протекающих в сетчатке. Еще в 70-е годы прошлого века было установлено, что введение кролику водорастворимой фракции, полученной из сетчатки, индуцирует аутоиммунный увеит. Фактор, вызывающий аутоиммунный увеит, был назван S-антиген. Позже было установлено, что S антиген и арестин это один и тот же белок. Дальнейшие исследования показали, что у многих животных, включая приматов, вызванный S-антигеном экспериментальный увеит по своим клиническим проявлениям и гистологически похож на некоторые формы увеита у людей. Известно, что в индукции этого заболевания ключевую роль играет иммунная Т-система. Это позволяет предположить, что S-антиген играет определенную патогенную роль в индукции увеита. При некоторых формах увеита наблюдался как гуморальный, так и клеточный ответ на S-антиген.
В крови и слезной жидкости больных S-антитела обнаруживаются при различных формах увеита:
- двусторонний увеит,
- односторонний увеит,
- кератоувеит,
- переднекамерный увеит,
- промежуточный увеит,
- заднекамерный увеит,
- хориоретинит,
- панувеит
Методы исследования
- Клеточный ответ на S-антиген исследуется в реакции торможения миграции лейкоцитов (TMJ1) в периферической крови в присутствии 20 мг/мл S-антигена.
- S-антитела определяются в реакции пассивной гемагглютинации (РПГА). Первичное разведение слезной жидкости составляет 1:8, сыворотки крови -1:2.
- Для обнаружения S-антител, связанных в иммунный комплекс с S-антигеном в крови (S-ИКК), сыворотку обрабатывают ультразвуком.
- Т-субпопуляцию СД4 (хелпер/индуктор) и СД8 (супрессор/цитотоксин) определяют с помощью цитофлуориметра, используя моноклональные антитела ОКТ4 и ОКТ8.
Исследования доказали, что наибольший иммунный ответ на антиген наблюдался при увеитах, сопровождающихся дегенерацией сетчатки. Для кератоувеитов и переднекамерных увеитов наблюдается достаточно слабый ответ (наблюдался редко). В целом S антитела обнаруживаются в слезной жидкости значительно чаще (47%), чем в крови (14%). В 25% случаев в крови больных S-антитела находятся в виде циркулирующих иммунных комплексов, т.е. в латентной форме.
Реакция на S-антиген обычно значительно сильнее у пациентов с часто рецидивирующими и хроническими формами увеита. Существует три типа иммунограмм, которые типичны для заболеваний на различных стадиях:
Для редко рецидивирующих увеитов с благоприятным прогнозом титр антител в слезе обычно выше, чем 1:256, на начальной стадии заболевания и затем падает до среднего уровня (1:32-1:128).
В случае подстрой часто рецидивирующей формы относительно высокий титр антител (выше чем 1:256) наблюдался в течение достаточно длительного периода. Низкий титр антител в слезе (меньше 1:16) и сильная реакция в крови типичны для наиболее тяжелых форм с неблагоприятным исходом.
При длительной ремиссии уровень S-антител в слезе достигает 1:132-1:128 у 75% больных. S-антитела в крови отсутствуют или их уровень приближался к 1:16. Клеточный ответ не регистрируется или наблюдается средняя местная реакция и ослабление реакции в крови.
Положительная реакция на S-антиген при длительной ремиссии отсутствует. Увеличение титров S-антител в слезе и/или в сыворотке крови происходят за 1-2 недели до появления признаков рецидива увеита.
При обследовании больных с постувеальными нарушениями оказалось, что развитие вторичной хориоретинальной дистрофии, отслойка и отек сетчатки коррелируют с иммунным ответом на s-антиген (табл. 8.5). Отек и локальная отслойка сетчатки коррелировали с увеличением титровs-антител в слезе. s-антитела в сыворотке и клеточный ответ регистрировались не всегда, т.е. преобладал местный иммунный ответ. Напротив, общая дистрофия и отслойки сетчатки были связаны с падением титров s-антител в слезе и с увеличением титров в сыворотке и сильным клеточным ответом.
Клеточный ответ на S-антиген, накопление S-антител в слезе и сыворотке могут быть свидетельством дистрофии сетчатки при увеите, а также положительные реакции на s-антиген могут быть использованы как диагностический тест при помутнении хрусталика, стекловидного тела и роговицы, т.е. когда исследование глазного дна затруднено. Это согласуется с высокой тканеспецифичностью S-антигена.
При хроническом увеите, отеке сетчатки и ограниченной отслойке сетчатки преобладает местный иммунный ответ. По-видимому, это объясняется локальным выделением иммуноглобулинов и специфических антител в глазу. С другой стороны, для большинства тяжелых увеитов, хориоpeтинaльныx дистрофий и полной отслойки сетчатки характерны низкие титры или отсутствие S-антител в слезе и усиление как гуморального, так и клеточного ответов в крови. Это означает, что необходимо исследовать как местные, так и системные реакции, непременно включая тестирование слезы.
Средние титры S-антител в слезе — 1:32-1:128; при отсутствии S-антител в сыворотке (1:8) и слабый клеточный ответ, по-видимому, связаны с благоприятным прогнозом течения увеита, и это следует рассматривать как нормальную специфическую тканевую реакцию защитного свойства. Нормальный тип такой реакции сочетаемся также с нормальным уровнем иммунорегуляторной субпопуляции Т- лимфоцитов крови.
Усиление реакции крови, накопление S-антител в сыворотке (больше 1:16) отражает генерализацию аутоиммунного процесса — это указывает на развитие двустороннего рецидивирующего увеита и постувеальных осложнений.
Наиболее интересно отсутствие S-антител в слезах больных с наиболее тяжелыми симптомами увеоретинитов и хориоретинальных дистрофий. Предполагается, что дефицит антител при заболеваниях сетчатки можно считать парадоксальным состоянием, причиной которого является слабый местный иммунный ответ. Однако необходимо принять во внимание и некоторые другие возможные объяснения: образование специфических иммунных комплексов, антиидиотипические антитела и блокирующие факторы.
Иммунопатологическая важность как роста титров S-антител в слезе или сыворотке, так и дефицита S-антител слезе подтверждается существенным дисбалансом уровня лимфоцитов СД4 и СД8 в крови. Усиление реакций в слезе и сыворотке связано с низким уровнем Т-супрессоров (СД8). Слабый ответ на антиген, по-видимому, вызван дефицитом Т-хелперив (СД4) и увеличением уровня Т-супрессоров. Такое состояние можно определить как состояние общего Т-зависимого иммунодефицита и свидетельство cвязи тканеоспецифических реакций (включая и местные реакции; с дисбалансом иммунорегуляторов клеток крови.
Таким образом, наличие антител в слезе больных увеитом указывает на наличие сильной аутоиммунной компоненты заболевания. Лечение больных с дефицитом S-антител в слезе кортикостероидами, особенно в комбинации с цитостатиками, было, как правило, неэффективным.
В целом, как это следует из вышеизложенного, использование такого теста, как определение титра S-антител, оказалось очень эффективным как для определения характера увеита и прогноза течения заболевания, так и для определения метода лечения.
S-антитела при диагностике диабетической ретинопатии
Еще более интересными для перспективы использования выявления S-антител для диагностики и прогноза глазных патологий представляются результаты исследования больных диабетической ретинопатией. Для ранней диагностики ДР применяется как метод выявления антител, так и метод электроретинографии. При применении иммуноферментного анализа (ИФА) антитела — иммуноглобулины IgG и IgM — выявляются в крови и слезной жидкости с использованием античеловеческих антител, конъюгириванных с пероксидазой хрена.
Исследованы S-ат в сыворотке крови (СК) и слезной жидкости (СЖ) у больных инсулинзависимым сахарным диабетом (ИЗСД) без диабетической ретинопатии (без ДР) на разных стадиях диабетической ретинопатии
- ДР0 — субклиническая стадия; — явные клинические признаки заболевания еще отсутствуют, однако возможны некоторые изменения в электроретинограмме и ангиограмме.
- ДР1 — манифестная стадия, — начало заболевания, сопровождающееся появлением клинически выраженных изменений глазного дна.
- ДР2 — препролеферативная стадия; — тяжелое поражение сетчатки.
- ДР3 — пролиферативная стадия — тяжелое поражение сетчатки.
Приблизительно у половины пациентов с ИЗСД гуморальный иммунный ответ на S-аг как в крови, так и в слезе обнаруживается до развития клинически явных признаков ДР. Пик выявления s-ат ассоциируется с манифестацией ДР: на этой стадии (ДР1) s-ат обнаруживались в 100% проб в сыворотке крови (Р < 0,01 по сравнению с больными без признаков клинически явной ДР) и в 80% проб слезной жидкости.
В слезной жидкости минимальное число положительных результатов отмечается на препролиферативной стадии — ДР2, стадия пролиферации — ДРЗ характеризуется возвратным повышением частоты обнаружения S-ат. Надо полагать, что на доклинических стадиях отрицательные результаты свидетельствуют об отсутствии S-аутоиммунизации, тогда как при развитой ДР они могen быть следствием образования специфических иммуноциркулирующих комплексов (ЦИК) или антиидиотипических антител.
Таким образом, выявление S-антител оказывается удобным диагностическим методом именно на тех стадиях заболевания, когда клинические признаки отсутствуют.
Дифференцированный анализ частоты выявления s-ат IgG и/или IgM класса показал, что в отсутствие каких-либо признаков ДР (клинических, функциональных, биохимических — группа «без ДР») оба класса антител выявлялись примерно с одинаковой частотой. При развитии ДР, начиная с манифестной стадии (ДР1) — в сыворотке крови, а в слезе — раньше (ДР0), S-IgМ обнаруживались в обеих пробах примерно на 30% чаще, чем S-IgG, в СЖ в период манифестации — на 56% чаще. Возможно, что явное доминирование S-ат IgМ-класса, особенно в слезе при развитой ДР связано с образованием патологических иммунных комплексов, в состав которых, как известно, чаще входят S-антитела.
Функциональная стадия (ДРО) характеризовалась селективным накоплением только S-IgG, что, возможно, указывало на стабилизацию процесса. На манифестной стадии вновь преобладают антитела класса IgМ. Аналогичная тенденция была отмечена и при исследовании слезной жидкости, причем, доминирование селективной продукции S-IgМ-ат проявлялось раньше, чем в сыворотке крови (уже на функциональной стадии ДР-ДРО).
Одновременное накопление S-ат обоих классов было обнаружено и при исследования внутриглазных жидкостей, полученных во время операций по поводу отслойки сетчатки у больных с ДР3. В стекловидном геле — в 100% и в субретинальной жидкости (СРЖ) — в 87,5% проб выявлялись S-IgG. S-IgМ были обнаружены у половины пациентов в СРЖ и в 13% случаев в стекловидном теле.
Неблагоприятная роль аутоиммунизации S-антигеном была подтверждена и при исследовании пациентов с различными исходами лазеркоагуляции (ЛК). Использование метода обнаружения S-антител оказалось удобным и для прогноза результатов оперативного лечения ДР методом лазеркоагуляции (ЛК).
Анализ показал, что неизменные показатели S-ат наблюдались при благоприятном течении послеоперационного периода; в случае дальнейшего прогрессирования ДРЗ после ЛК сетчатки S-ат обоих классов как в крови, так и в слезе наблюдались значительно чаще, причем, наиболее значимым показателем явилось одновременное накопление S-IgG и S-IgМ антител.
Таким образом, обнаружение s-антител различного класса оказалось удобным прогностическим признаком как при ранней диагностике диабетической ретинопатии, так и при прогнозе результата лечения.
Иммуноферментный метод
Иммуноферментный метод и набор реагентов для определения антител к S-антигену сетчатки глаза в сыворотке крови человека. Используется для:
- ранней диагностики вовлечения в патологический процесс сетчатки глаза;
- диагностики поражений сетчатки у больных с помутнениями оптических сред глаза, когда офтальмоскопия глазного дна невозможна или затруднена (катаракта, бельма, помутнение стекловидного тела);
- диагностики и прогнозирования течения аутоиммунных увеитов;
- прогнозирования развития и прогрессирования диабетической ретинопатии;
- прогнозирования осложнении и быстрого прогрессирования близорукости.
В обоих случаях критерием обнаружения IgG или IgM служит разность оптической плотности сыворотки крови нормальных доноров и исследуемой сыворотки при исследовании их методом иммуноферментного анализа. Если эта разность превышает 0,2, то присутствие IgG или IgМ считалось установленным.
Этот метод позволяет объективно предсказать переход монолатерального увеита в билатеральный.
При исследовании больных диабетической ретинопатией установлено, что обнаружение в крови больных иммуноглобулинов обоих типов обычно коррелирует с резким обострением патологического процесса и таким образом является дополнительным диагностическим критерием наряду с ангиографией и офтальмоскопией.
В ряде случаев один из иммуноглобулинов обнаруживается в крови больных диабетической ретинопатией (ДР) на самой ранней стадии заболевания. Установлено, что обнаружение одного из иммуноглобулинов IgG или IgМ в крови больных диабетом без видимой глазной патологии свидетельствует о скором появлении признаков заболевания ДР. Использование метода позволяет выявить группу риска глазных осложнений среди больных диабетом, что позволяет как проводить профилактику, так и своевременно начать лечение.
Источник

Описание
Одним
из ключевых белков участников процесса усиления сигнала в зрительной клетке
является арестин. Подробно его свойства и роль в механизме деактивации
сенсорного сигнала описаны в первых главах настоящей книги. Однако, как оказалось,
арестин участвует и в других процессах, протекающих в сетчатке. Еще в 70-е годы
прошлого века было установлено, что введение кролику водорастворимой фракции,
полученной из сетчатки, индуцирует аутоиммунный увеит. Фактор, вызывающий
аутоиммунный увеит, был назван S-антиген. Позже было установлено, что S антиген
и арестин это один и тот же белок. Дальнейшие исследования показали, что у
многих животных, включая приматов, вызванный S-антигеном экспериментальный
увеит по своим клиническим проявлениям и гистологически похож на некоторые
формы увеита у людей. Известно, что в индукции этого заболевания ключевую роль
играет иммунная Т-система. Это позволяет предположить, что S-антиген играет определенную
патогенную роль в индукции увеита. При некоторых формах увеита наблюдался как
гуморальный, так и клеточный ответ на S-антиген.
Совместно
с МНИИ глазных болезней им. Гельмгольца мы попытались системно подойти к
исследованию корреляции между общими и местными иммунными реакциями и
различными проявлениями увеита. Искали корреляцию между содержанием S-антител в
крови и слезной жидкости у пациентов с клинической формой увеита. В ходе
многолетнего исследования был собран большой клинический материал, который
позволяет предложить исследование слезной жидкости пациента на наличие
S-антител и S-антиге- на как перспективную форму диагностики.
В
ходе исследования было обследовано 630 пациентов (средний возраст 29,5 лет):
197 мужчин (31%), 257 женщин (41%), 176 подростков (28%). Обследовались пациенты
со следующими заболеваниями: двусторонние увеиты (298), односторонние увеиты
(332). 928 глаз было обследовано на кератоувеиты (27), переднекамерные увеиты
(83), промежуточные увеиты (331), заднекамерные увеиты (78), хориоретиниты
(140), панувеиты (287). 450 пациентов обследовались в течение длительного времени
(от 6 мес. до 8 лет). В качестве контрольной группы обследовалось 68 здоровых
мужчин в возрасте от 10 до 60 лет (средний возраст — 28 лет). Клеточный ответ
на S-антиген исследовался в реакции торможения миграции лейкоцитов (TMJ1) в
периферической крови в присутствии 20 мг/мл S-антигена. Учитывалось как
ингибирование (индекс миграции ИМ меньше 0,8), так и стимулирование (ИМ больше
1,2) реакции.
S-антитела
определялись в реакции пассивной гемагглютинации (РПГА). Первичное разведение
слезной жидкости составляло 1 : 8, сыворотки крови -1:2.
Для
обнаружения S-антител, связанных в иммунный комплекс с S-антигеном в крови
(S-ИКК), сыворотку обрабатывали ультразвуком.
Т-субпопуляцию
СД4 (хелпер/индуктор) и СД8 (супрессор/цитотоксин) определяли с помощью
цитофлуориметра, используя моноклональные антитела ОКТ4 и ОКТ8.
Обследование
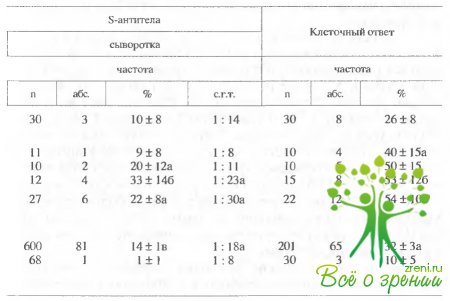
показало, что наибольший иммунный ответ на антиген наблюдался при увеитах,
сопровождавшихся дегенерацией сетчатки.
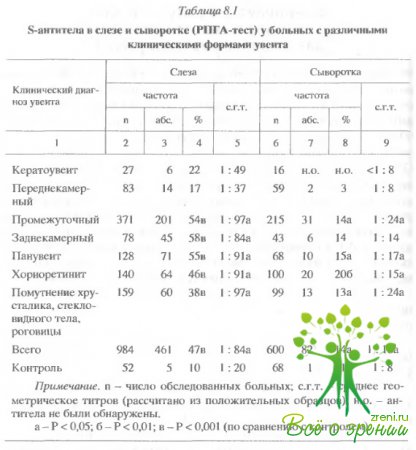
Для кератоувеитов и переднекамерных
увеитов наблюдался достаточно слабый ответ (наблюдался редко) (табл. 8.1 и
8.2). В целом S антитела обнаруживались в слезной жидкости значительно чаще
(47%), чем в крови (14%). В 25% случаев в крови больных S-антитела находились в
виде циркулирующих иммунных комплексов, т.е. в латентной форме.

Обследование
показало, что реакция на S-антиген обычно значительно сильнее у пациентов с
часто рецидивирующими и хроническими формами увеита. Наблюдение в динамике
выявило три типа иммунограмм, которые типичны для заболеваний на различных
стадиях (табл. 8.3).
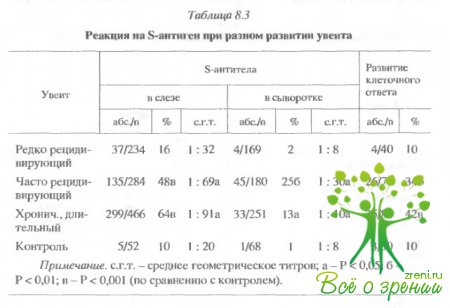
Для
редко рецидивирующих увеитов с благоприятным прогнозом титр антител в слезе был
обычно выше, чем 1 : 256, на начальной стадии заболевания и затем падал до
среднего уровня (1 : 32-1 : 128).
В
случае подстрой часто рецидивирующей формы относительно высокий гипрантител (выше
чем 1 : 256) наблюдался в течение достаточно длительного периода. Низкий титр
антител в слезе (меньше 1 : 16) и сильная реакция в крови были типичны для
наиболее тяжелых форм с неблагоприятным исходом.
При
длительной ремиссии уровень S-антител
в слезе достигал 1 : 132-1 : 128 у 75% больных. S-антитела в крови отсутствовали или
их уровень приближался к 1 : 16. Клеточный ответ не регистрировался или
наблюдалась стимуляция I МЛ, т.е. средняя местная реакция и ослабление реакции
в крови.
Положительная
реакция на s-антиген
при длительной ремиссии отсутствовала. Увеличение титров s-антигел в слезе и/или в сыворотке
крови и ингибирование I МЛ происходили за 1-2 недели до появления признаков
рецидива увеита.
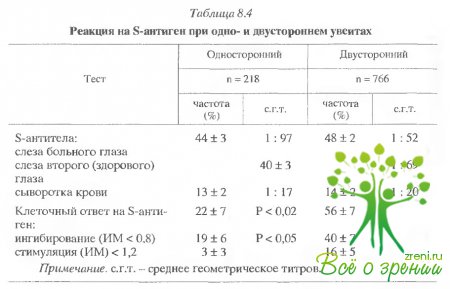
Частота
определения s-антител
в слезе и их уровень были одинаковы при одно- и двусторонних увеитах, однако
клеточный ответ и результаты определения ИКК были типичны для двустороннего
увеоретинита (табл. 8.4).
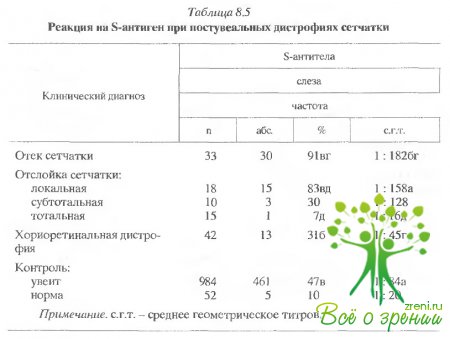
При
обследовании больных с постувеальными нарушениями оказалось, что развитие
вторичной хориоретинальной дистрофии, отслойка и отек сетчатки коррелируют с
иммунным ответом на s-антиген
(табл. 8.5). Отек и локальная отслойка сетчатки коррелировали с увеличением титровs-антител
в слезе. s-антитела
в сыворотке и клеточный ответ регистрировались не всегда, т.е. преобладал
местный иммунный ответ. Напротив, общая дистрофия и отслойки сетчатки были
связаны с падением титров s-антител в слезе и с увеличением титров в сыворотке
и сильным клеточным ответом.
Клеточный
ответ на s-антиген (ингибирование ТМЛ), накопление s-антител в слезе и сыворотке
могли бы быть свидетельством дистрофии сетчатки при увейте, как это и было
продемонстрировано в настоящем исследовании при сравнении больных с тяжелыми
формами увеитов и здоровых людей. Положительные реакции на s-антигек также могли бы быть
использованы как диагностический тест при помутнении хрусталика, стекловидного
тела и роговицы, т.е. когда исследование глазного дна затруднено. Это
согласуется с высокой тканеспецифичностью s-антигена. Было высказано предположение,
что только s-антиген человека может быть использован для диагностики
заболеваний, однако наши данные свидетельствуют о возможности применения для
этих целей s-антигена
из сетчатки быка, что существенно облегчает задачу.
Нами
впервые показано, что при хроническом увейте, отеке сетчатки и ограниченной отслойке
сетчатки преобладает местный иммунный ответ. По-видимому, это объясняется
локальным выделением иммуноглобулинов и специфических антител в глазу. С другой
стопоны, для большинства тяжелых увеитов, хорио-peтинaльныx дистрофий и полной
отслойки сетчатки характерны низкие титры или отсутствие s-антител в слезе и усиление как
гуморального, так и клеточного ответов в крови. Это означает, что необходимо
исследовать как местные, так и системные реакции, непременно включая
тестирование слезы.
Средние
титры S-антител
в слезе (1 : 32-1 : 128; при отсутствии S-антител в сыворотке (1 : 8) и
слабый клеточный ответ (стимуляция ТМЛ), по-видимому, связаны с благоприятным
прогнозом течения увеита, и это следует рассматривать как нормальную
специфическую тканевую реакцию защитного свойства. Нормальный тип такой реакции
сочетаемся также с нормальным уровнем иммунорегуляторной субпопулящ.и Т-
лимфоцитов крови.
Усиление
реакций ь крови, т.е. ингибирпвание ТМЛ, накопление s-антител в сыворотке
(больше 1 : 16), циркуляция 8-ИКК отражают генерализацию аутоиммунного
процесса. Все это указывает на развитие двустороннего рецидивирующего увеита и
постувеальных осложнений.
Наиболее
интересно отсутствие S-антител
в слезах больных с наиболее тяжелыми симптомами увсоретинитов и хориоретинальных
дистрофий. Мы предполагаем, что дефицит антител при заболеваниях сетчатки можно
считать парадоксальным состоянием, причиной которого является слабый местный
иммунный ответ. Однако необходимо принять во внимание и некоторые другие
возможные объяснения: образование специфических иммунных комплексов, антиидиотипические
антитела и блокирующие факторы.
Иммунопатологическая
важность как роста титров s-антител
в слезе или сыворотке, так и дефицита s-антител
слезе подтверждается существенным дисбалансом уровня лимфоцитов СД4 и СД8 в
крови. Усиление реакций в слезе и сыворотке связано с низким уровнем
Т-супрессоров (СД8). Слабый ответ на антиген, по-видимому, вызван дефицитом
Т-хелперив (СД4) и увеличением уровня Т-супрессоров. Такое состояние можно
определить как состояние общего Т-зависимого иммунодефицита и свидетельство
«вязи тканеотецифических реакций (включая и местные реакции; с дисбалансом
иммунорегуляторов клеток крови
Таким
образом, наличие антител в слезе больных увеитом указывало на наличие сильной
аутоиммунной компоненты заболевания. В этом случае применение
иммунодепрессантов оказывается очень эффективным.
Действительно,
лечение больных с дефицитом s-антител
в слезе кортике/стероидами, особенно в комбинации с цитостатиками, было, как
правило, неэффективным. Эти наблюдения позволяют понять, почему малоэффективна
иммунодепрессивная терапия увеитов.
В
целом, как это следует из вышеизложенного, использование такого теста, как
определение титра S-антител,
оказалось очень эффективным как для определения характера увеита и прогноза
течения заболевания, так и для определения метода лечения.
Еще
более интересными для перспективы использования выявления 8-антител для диагностики
и прогноза глазных патологий представляются результаты исследования больных
диабетической ретинопатией Для ранней диагностики ДР применялся как метод
выявления антител, так и метод электроретинографии. В данном разделе
представлены результаты, полученные при применении иммуно-ферментного анализа
(ИФА). В этом случае антитела – иммуноглобулины IgG иIgM–
выявлялись в крови и слезной жидкости с использованием античеловеческих
антител, конъюгириванных с пероксидазой хрена.
Исследованыs-антителa (S-ат) в сыворотке крови (СК) и слезной
жидкости (СЖ) у больных инсулинзависимым сахарным диабетом (ИЗСД) без диабетической
ретинопатии (без ДР) на разных стадиях диабетической ретинопатии (ДРО —
субклиническая стадия; ДР1 — манифестная стадия, ДР2 — предрофилеративная
стадия; Др3 — прелиферативная стадия). Для субклинической стадии характерно то,
что явные клинические признаки заболевания еще отсутствуют, однако возможны
некоторые изменения в электроретинограмме и ангиограмме. Манифестная стадия —
начало заболевания, сопровождающееся появлением клинически выраженных изменений
глазного дна; предпролиферативная и пролиферативная стадии сопровождаются
тяжелым поражением сетчатки. Результаты исследования представлены на рис. 8.1.
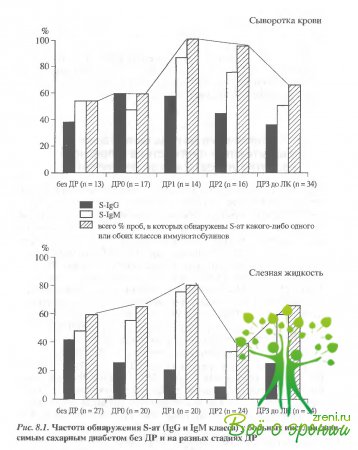
Анализ
полученных данных показал, что приблизительно у половины пациентов с ИЗСД гуморальный
иммунный ответ на S-АГ
как в крови, так и в слезе обнаруживался до развития клинически явных признаков
ДР. Пик выявления s-ат
ассоциировался с манифестацией ДР: на этой стадии (ДР1) s-ат обнаруживались в 100% проб в
сыворотке крови (Р < 0,01 по сравнению с больными без признаков клинически
явной ДР) и в 80% проб слезной жидкости. При развитии ДР8-ат обнаруживались в
делом реже, чем в период манифестации. Причем, частота их выявления в СК
снижалась постепенно, приближаясь на пролиферативной стадии (ДРЗ) к исходным
показателям (у больных без ДР). В слезной жидкости минимальное число положительных
результатов отмечалось на предпролиферативной стадии — ДР2, стадия пролиферации
— ДРЗ характеризовалась возвратным повышением частоты обнаружения s-ат. Надо полагать, что на
доклинических стадиях отрицательные результаты свидетельствовали об отсутствии s-аутоиммунизации, тогда как при
развитой ДР они могли быть следствием образования специфических иммуноциркулирующих
комплексов (ЦИК) или антиидиотипических антител.
Таким
образом, выявление s-антител
оказывается удобным диагностическим методом именно на тех стадиях заболевания,
когда клинические признаки отсутствуют.
Дифференцированный
анализ частоты выявления s-атIgGи/или IgMкласса показал, что в отсутствие каких-либо признаков ДР (клинических,
функциональных, биохимических — группа «без ДР») оба класса антител
выявлялись примерно с одинаковой частотой. При развитии ДР, начиная с
манифестной стадии (ДР1) — в сыворотке крови, а в слезе — раньше (ДРО), S-IgМ обнаруживались в обеих пробах
примерно на 30% чаще, чем S-IgG, в СЖ в период манифестации — на
56% чаще. Возможно, что явное доминирование s-ат IgМ-класса, особенно в слезе при
развитой ДР связано с образованием патологических иммунных комплексов, в состав
которых- как известно, чаще входят С-антитела.
При
оценке патогенетического значения каждого из двух классов s-ат был проведен
анализ их сочетанного или селективного накопления в разных группах больных
(рис. 8.2). У пациентов «без признаков ДР» в сыворотке крови
отмечался селективный синтез только S-IgM-ат (15%), что, вероятно, отражало
первичность аутоиммунного ответа на S-АГ.
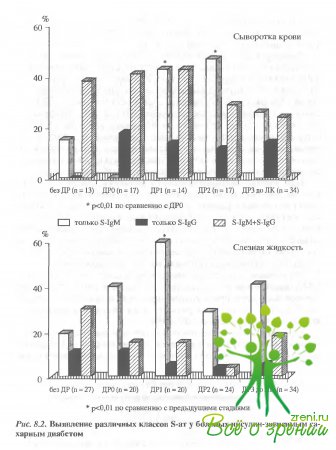
Функциональная стадия (ДРО) характеризовалась селективным накоплением только S-IgG, что, возможно, указывало на
стабилизацию процесса.
На
манифестной стадии вновь преобладают антитела класса IgМ. Аналогичная тенденция была
отмечена и при исследовании слезной жидкости, причем, доминирование селективной
продукции S-IgМ-ат проявлялось раньше, чем в
сыворотке крови (уже на функциональной стадии ДР-ДРО).
Одновременное
накопление s-ат обоих классов было обнаружено и при исследования внутриглазных
жидкостей (ВПК), полученных во время операций по поводу отслойки сетчатки у
больных с ДРЗ (табл. 8.6). В стекловидном геле — в 100% и в субретинальной
жидкости (СРЖ) — в 87,5% проб выявлялись S-IgG. S-IgМ были обнаружены у половины
пациентов в СРЖ и в 13% случаев в стеклосидном теле. Следует отметить, что и в
СРЖ и в СТ.Т. выявлялись достоверно чаше (100%), чем в пробах СЖ (24%; Р <
0,01) и СК (35%; I < 0,01); тогда как IgМ в СРЖ — примерно с той же
частотой, а в СТ.Т. реже, чем в СК и СЖ.

Неблагоприятная
роль аутоиммунизации S-антигеном
была подтверждена и при исследовании пациентов с различными исходами
лазеркоагуляции (ЛК)
Использование
метода обнаружения s-антител
оказалось удобным и для прогноза результатов оперативного лечения ДР методом
лазеркоагуляции (ЛК).
Анализ
показал, что неизменные показатели S-ат
наблюдались при благоприятном течении послеоперационного периода; в случае дальнейшего
прогрессирования ДРЗ после ЛК сетчатки s-ат обоих классов как в крови, так
и е слезе наблюдались значительно чаще, причем, наиболее значимым показа гелем
явилось одновременное накопление S-IgG иS-IgМ антител. Эти данные
согласовались
и с результатами индивидуального анализа. Так, из 14 пациентов, обследованных в
динамике до и после ЛК, у 8 человек с успешным исходом лечения существенных
сдвигов в характере местного и/или системного иммунного ответа на S-АГ после ЛК не отмечалось. У 6
пациентов с осложнениями после ЛК наблюдалось двукратное усиление синтеза S-ат обоих классов как в СК. гак и в
СЖ
Таким
образом, обнаружение s-антител
различного класса оказалось удобным прогностическим признаком как при ранней
диагностике диабетической ретинопатии, так и при прогнозе результата лечения.
Опираясь
на изложенные выше результаты, нами был разработан метод и набор реагентов для
определения антител к S-антигену
сетчатки глаза в сыворотке крови человека методом иммуноферментного анализа
для:
- ранней
диагностики вовлечения в патологический процесс сетчатки глаза; - диагностики
поражений сетчатки у больных с помутнениями оптических сред глаза, когда
офтальмоскопия глазного дна невозможна или затруднена (катаракта, бельма,
помутнение стекловидного тела); - диагностики
и прогнозирования течения аутоиммунных увеитов; - прогнозирования
развития и прогрессирования диабетической ретинопатии; - прогнозирования
осложнении и быстрого прогрессирования близорукости.
Метод
и набор прошли все необходимые технические и медицинские испытания и рекомендован
к широкому применению МЗ РФ.
В
обоих случаях критерием обнаружения иммуноглобулиноз в (IgG) или иммуноглобулинов М (IgM) служила разность оптической
плотности сыворотки крови нормальных доноров и исследуемой сыворотки при исследовании
их методом иммуноферментного анализа. Если эта разность превышала 0,2, то
присутствие IgGили IgМ
считалось установленным.
Испытание
набора показало, что наиболее интересные и значимые для широкого применения
результаты получены при исследовании больных монолатеральными увеитами и
диабетической ретинопатией. При исследовании более 130 больных было
установлено, что обнаружение в крови больных одновременно обоих
иммуноглобулинов свидетельствовало о скором вовлечении в патологический процесс
второго глаза. Так, при обследовании 130 больных монолатеральным увеитом у 34 в
крови были обнаружены одновременно IgG и IgM. У 32 больных в течение полугода
при офтальмоскопии было отмечено начало воспаления на втором глазу.
Разработанный
нами метод позволяет объективно предсказать переход монолатерального увеита в
билатеральный.
При
исследовании больных диабетической ретинопатией было установлено, что обнаружение
в крови больных иммуноглобулинов обоих типов обычно коррелировало с резким
обострением патологического процесса и таким образом явилось дополнительным
диагностическим критерием наряду с ангиографией и офтальмоскопией.
В
ряде случаев один из иммуноглобулинов обнаруживался в крови больных
диабетической ретинопатией (ДР) на самой ранней стадии заболевания. Мы установили,
что обнаружение одного из иммуноглобулинов IgG или IgМ в крови больных диабетом без
видимой глазной патологии свидетельствовало о скором появлении признаков
заболевания ДР. Так, нами было обследовано 140 больных инсулин-зависимым
сахарным диабетом в течение 3 лет. У 34 в крови были обнаружены IgG или IgM. Пои последующем наблюдении у 32
больных были от мечены признаки ДР при офтальмоскопии или ангиографии.
Таким
образом, обнаружение антител к s-антигену
в крови больных диабетом оказалось объективным прогностическим критерием
скорого наступления глазной патологии. Использование метода позволяет выявить
группу риска глазных осложнений среди больных диабетом, что позволяет как
проводить профилактику, так и своевременно начать лечение.
Источник


