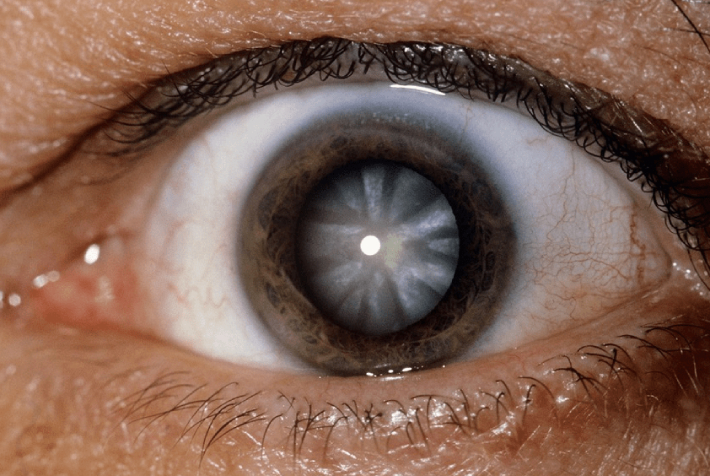
Разработка алгоритма лечения начальной стадии псевдоэксфолиативной глаукомы
Статья посвящена особенностям медикаментозного лечения псевдоэксфолиативной глаукомы
DOI: 10.21689/2311-7729-2016-16-4-220-223
Последние десятилетия характеризовались увеличением интереса исследователей к проблеме ПЭГ, рассматриваемой как разновидность глаукомного процесса, развивающегося на фоне псевдоэксфолиативного синдрома (ПЭС). Последний определяется как распространенная патология экстрацеллюлярного матрикса, характеризующаяся избыточной продукцией и накоплением патологического внеклеточного материала в различных интра- и экcтраокулярных тканях [1]. Подобный интерес связан с появлением принципиально новых данных, касающихся не только хорошо известных каждому клиницисту особенностей течения заболевания, но и вопросов этиопатогенеза, ранней диагностики и попыток обоснования патогенетически ориентированных методов лечения ПЭГ.
Целью настоящей работы является обобщение результатов исследований в области изучения возможностей местной гипотензивной терапии ПЭГ.
Актуальность проблемы ПЭГ в нашей стране обусловлена не только клиническими особенностями, но и высокими эпидемиологическими показателями, характеризующими заболевание. В проспективном популяционном исследовании изучена распространенность ПЭС в Центральном регионе России. Синдром установлен у 15,1% населения старше 50 лет (174 человека из 1154 обследованных). Встречаемость глаукомы среди пациентов с ПЭС составила 14,4%, что в 15 раз превысило общепопуляционный показатель, подтвердив тезис о роли ПЭС как одного из основных доказанных факторов риска развития глаукомы [2].
Эпидемиологии ПЭГ посвящено значительное число исследований, показывающих, что частота заболевания среди глаукомных больных заметно варьирует в различных регионах. Значительная распространенность патологии характерна для Северной Европы (до 60–66% в отдельных скандинавских странах) [3]. Работы, посвященные эпидемиологии ПЭГ в нашей стране, немногочисленны. По данным Д.С. Кроля, частота псевдоэксфолиативного процесса среди пациентов с первичной открытоугольной глаукомой (ПОУГ) в Куйбышевской (ныне Самарской) области составила 47% [4]. В многоцентровом исследовании по изучению распространенности ПЭГ в Центральном регионе России (включившем около 800 пациентов из 6 областей) доля ПЭГ составила 64,6% от общего числа больных открытоугольной глаукомой, причем в отдельных регионах достигала 75–80%. Эти результаты сопоставимы с эпидемиологическими показателями в наиболее «неблагоприятных» с точки зрения псевдоэксфолиативного процесса странах [5].
Наряду с широко известными фактами, относящимися преимущественно к особенностям клинической картины данной патологии (более тяжелое течение, резистентность к терапии, прогрессирующая деградация зрительных функций и т. п.), в последние годы получены новые сведения, в т. ч. фундаментального характера, отражающие специфичность ПЭГ. Это касается генетических аспектов патологии (от рутинных клинико-генеалогических и популяционно-семейных до современных цито- и молекулярно-генетических исследований), биохимических особенностей (связанных преимущественно с достоверными различиями концентрации во влаге передней камеры и плазме крови некоторых веществ, участвующих в патогенезе глаукомы: маркеров оксидативного стресса, факторов роста и пр.), патоморфологической специфичности (характер изменений трабекулярной сети в сравнении с таковым при ПОУГ) [6–11].
Особенности клинического течения ПЭГ, определяющие стратегию медикаментозной терапии, хорошо изучены. Отличительными чертами данного вида глаукомы являются более высокие значения среднего уровня ВГД, его пиковых величин в течение дня и степень выраженности суточных колебаний офтальмотонуса (p<0,001) [12, 13], а также асимметричный характер процесса [14].
В большом количестве публикаций отмечается, что ПЭГ в сравнении с ПОУГ хуже поддается медикаментозной терапии, несмотря на то, что в начале лечения степень снижения ВГД при ПЭГ нередко оказывается более выраженной [15]. Монотерапия часто оказывается несостоятельной и требует дополнительных гипотензивных препаратов. Переход к лазерному или хирургическому лечению у таких пациентов происходит чаще, чем при ПОУГ [16].
Возможности бета-блокаторов в терапии заболевания в настоящее время признаются весьма ограниченными. Спустя 3 года монотерапии бета-блокаторами только у 8% пациентов с ПЭГ в сравнении с 33% при простой глаукоме отмечена стабилизация патологического процесса [17]. Несмотря на более выраженное при ПЭГ снижение ВГД (в процентном отношении) относительно исходного при стартовой терапии тимололом 0,5%, уровень суточных колебаний и максимальные пиковые подъемы офтальмотонуса у таких больных сохраняют большую выраженность, чем у пациентов с ПОУГ [18].
Специфичной для ПЭГ некоторые авторы считают клиническую эффективность пилокарпина, который не только улучшает отток внутриглазной жидкости, но и, иммобилизуя зрачок, препятствует высвобождению псевдоэксфолиативного материала и экзогенного пигмента, играющих существенную роль в патогенезе заболевания [1]. Однако побочные эффекты холиномиметиков, а также сам механизм образования псевдоэксфолиативного материала (в т. ч. эндотелиальными клетками трабекулярной сети), не позволяют всерьез рассчитывать на подобную тактику лечения.
Наилучший результат при ПЭГ, связанный с нормализацией офтальмотонуса, минимизацией суточных колебаний, высокой 24-часовой эффективностью характерен для АП [19]. К сожалению, количество исследований, посвященных сравнительной эффективности представителей данной группы препаратов при ПЭГ, особенно на длительных сроках наблюдения, остается немногочисленным.
В работе A. Konstas et al. изучались эффективность и безопасность латанопроста и травопроста у лиц с ПЭГ с исходным уровнем Po >24 мм рт. ст.. Спустя 8 нед. наблюдения средние значения офтальмотонуса снизились с 25,1±2,5 до 17,8±2,1 мм рт. ст. при использовании латанопроста (р=0,001) и с 25,1±2,5 до 17,3±2,2 мм рт. ст. при использовании травопроста (р=0,001). Уровень ВГД на протяжении суток был сопоставим в обеих группах, за исключением 18.00 ч, когда травопрост показывал более значимый гипотензивный эффект (16,7±2,6 против 17,9±2,5 мм рт. ст., р<0,001). При этом для последнего была характерна выраженная гиперемия конъюнктивы у большего числа пациентов (р=0,03) [20]. В другом исследовании показаны преимущества гипотензивной терапии биматопростом в сравнении с латанопростом у пациентов с ПЭГ (снижение ВГД на 35% от исходного уровня против 31%, p<0,001). Впрочем, количество побочных эффектов при использовании биматопроста также было выше (p=0,0003) [21]. Использование бесконсервантного АП тафлупроста на сроках наблюдения 3 мес. позволило достичь снижения ВГД на 32,2% от исходного (р<0,001). При этом у 92,6% больных ПЭГ удалось уменьшить офтальмотонус более чем на 20%, у 48,1 и 22,2% пациентов – более чем на 30 и 40% соответственно. Крайне небольшое число больных в исследовании (3,7%) отмечали дискомфорт и негативные явления при использовании тафлупроста в сравнении с другими АП [22].
Следует отметить появление работ, свидетельствующих, что использование АП помимо гипотензивного эффекта может воздействовать на ключевые звенья патогенеза ПЭС/ПЭГ на уровне снижения продукции и накопления патологического псевдоэксфолиативного материала. Известно, что повышение концентрации TGF-b1, а также дисбаланс матричной металлопротеиназы (MMP) и ее тканевого ингибитора (TIMP) играют ключевую роль в избыточной продукции и накоплении псевдоэксфолиаций с развитием клинической картины ПЭС/ПЭГ. Показано, что длительная терапия латанопростом при ПЭГ приводит к снижению уровня TGF-b1 и MMP-2 во влаге передней камеры [23].
Наконец, учитывая характер прогрессирования глаукомной оптиконейропатии, важным представляется стратегия нейропротекторной терапии ПЭГ. В настоящее время показано опосредованное и прямое нейропротекторное действие, подтвержденное в эксперименте in vitro и in vivo, для 2-х представителей группы АП: тафлупроста и латанопроста, заключающееся в предотвращении апоптоза ганглиозных клеток сетчатки, повышении их выживаемости и сохранности толщины внутренних слоев сетчатки [24, 25]. Также в эксперименте отмечено нормализующее влияние АП на некоторые параметры эндотелиальной дисфункции (в частности, снижение негативных эффектов эндотелина-1 в виде улучшения показателей глазного кровотока и уменьшения вазоконстрикции). Наилучшие показатели и наиболее пролонгированный эффект отмечены при использовании тафлупроста [26].
Еще один немаловажный момент, который необходимо учитывать при выборе препарата для медикаментозной терапии ПЭГ, связан с качеством жизни данной категории пациентов. ПЭС сопровождается изменением функциональных показателей суммарной слезопродукции и стабильности прероговичной слезной пленки и может рассматриваться как фактор риска развития ССГ [27]. Очевидно, что мерой профилактики ССГ на фоне необходимости длительной медикаментозной терапии ПЭГ может стать выбор бесконсервантных форм гипотензивных препаратов, примером которых может служить 0,0015% раствор тафлупроста [28].
Однако монотерапия АП при ПЭГ не всегда способна обеспечить требуемый результат, что обусловливает необходимость усиления гипотензивного режима для предотвращения прогрессирования глаукомной оптиконейропатии. В последнее десятилетие роль ФК в лечении ПЭГ значительно возросла. В 2-месячном проспективном перекрестном исследовании сравнивалась эффективность ФК дорзоламид/тимолол и латанопроста [29]. Пиковое снижение ВГД приходилось на 10.00 ч в обеих группах. Использование ФК позволило снизить офтальмотонус в указанном временном интервале на 42,8% от исходного, в то время как монотерапия латанопростом – на 40,2% (р=0,21). Следует отметить, что ингибитор карбоангидразы дорзоламид в дополнение к снижению ВГД существенно улучшает важные показатели глазного кровотока [30], что может иметь большое значение в лечении данной разновидности глаукомы.
В ряде исследований дана оценка эффективности применения при ПЭГ ФК АП (латанопроста 0,005%, травопроста 0,004%, биматопроста 0,03%, тафлупроста 0,0015%) и 0,5% раствора тимолола [31–33]. Эти ФК характеризуются значимым снижением ВГД, удобным однократным использованием в течение суток, позволяющим также уменьшить системные побочные эффекты бета-блокатора в сравнении с его двукратным применением и минимизировать воздействие консерванта на глазную поверхность. Определенными конкурентными преимуществами в этой связи обладает бесконсервантная ФК тафлупрост/тимолол, выпускаемая в монодозах [34].
Ряд опубликованных работ позволяет сравнить гипотензивный эффект перечисленных комбинаций в лечении ПЭГ. В 3-месячном перекрестном исследовании показано более значимое снижение ВГД при использовании ФК травопрост/тимолол (на 34,4% от исходного уровня) по сравнению с комбинацией латанопрост/тимолол (на 31,2%) (р<0,001) [31]. В 3-месячном проспективном многоцентровом перекрестном исследовании применение ФК биматопрост/тимолол, назначаемой в вечерние часы, позволило добиться снижения ВГД на 35,3% от исходного, в то время как использование инстилляций утром – на 33,8% (p=0,005) [33].
Гипотензивный эффект бесконсервантной ФК тафлупрост/тимолол (назначаемой утром) в лечении ПЭГ оценивали по результатам 6-месячного проспективного двойного слепого параллельного многоцентрового исследования. Уровень снижения ВГД от исходных значений оказался весьма высок, составив в различные временные интервалы от 8,6 до 10,3 мм рт. ст. (от 31,8 до 36,7%), среднесуточный уровень офтальмотонуса уменьшился на 34,1% (p<0,001) [35].
Результатов крупномасштабных клинических исследований по изучению эффективности комбинаций 3-х и более гипотензивных препаратов в лечении ПЭГ в настоящее время не опубликовано. Для медикаментозной терапии перспективными могут оказаться направления по разработке препаратов, способных эффективно устранять дисбаланс в концентрации различных метаболитов, участвующих в патогенезе ПЭГ: многочисленных факторов роста и их ингибиторов, вазоактивных субстанций (особенно гомоцистеина). Делаются первые шаги по изучению веществ, способных влиять на организацию соединительной ткани трабекулы, вызывая увеличение ее пропускной способности (в частности, латрункулина В, вызывающего временную дезинтеграцию актинового цитоскелета) [36]. Возможно появление препаратов, способных ингибировать избыточную продукцию и накопление патологического внеклеточного псевдоэксфолиативного материала.
Заключение
Накопленные в течение последнего десятилетия данные, касающиеся генетических, морфологических, иммунологических и клинических особенностей ПЭГ, позволяют рассматривать заболевание не просто как разновидность открытоугольной глаукомы, а как особую форму глаукомного процесса, требующую помимо стандартных технологий разработки качественно новых, специфичных подходов к ранней диагностике, медикаментозной и хирургической коррекции. Особенности местного гипотензивного лечения ПЭГ заключаются в необходимости значительного снижения ВГД, минимизации суточных колебаний (стартовая терапия АП, а при необходимости – ФК), профилактики развития ССГ (с использованием бесконсервантных антиглаукомных стредств). Желательным является наличие у назначаемых препаратов дополнительных «негипотензивных» свойств (влияние на регионарную гемодинамику, нормализация уровня отдельных метаболитов в трабекулярной сети и влаге передней камеры, нейропротекторные механизмы), получивших подтверждение с позиций доказательной медицины.
Источник
При исследовании стабилизации глаукомной оптической нейропатии: в сравнительном исследовании латанопроста и ФК бринзоламид/тимолола к концу срока наблюдения (10 мес.) индекс MD улучшился в группе ФК бринзоламид/тимолол на l,2±0,37dB (р=0,003), при этом MD в группе латанопроста ухудшился на с -6,03±2,08dB до -6,8±1,87dB, но это изменение было недостоверным (р=0,057); в сравнительном исследовании латанопроста и ФК латанопрост/тимолола к концу 24 мес. наблюдения индекс MD улучшился в обеих группах, однако более существенно в группе ФК латанопрост/тимолола до -4,08±0,70dB (р=0,005) и -4,82±0,69dB (р=0,000), соответственно. При этом в сравнительном исследовании латанопроста и ФК бринзоламид/тимолола к концу срока наблюдения фокальные потери ГКС (FLV) в группе латанопроста возросли на 0,219±0,241% (р=0,04). Если в результате исследований, выполненных при диагностике начальной ПЭГ, выявлено снижение скорости кровотока в крупных ретрабульбарных сосудах, рекомендовано назначать ФК бринзоламид/тимолол, в результате применения которой мы получили улучшение артериального глазного кровотока, который к концу срока наблюдения был выше в группе ФК бринзоламид/тимолола по сравнению с латанопростом в глазной артерии (9,42±1,25 и 6,37±0,58, соответственно, р=0,044) и латеральной задней короткой цилиарной артерии (14,26±0,53 и 10,96±1,02, р=0,011).
В том случае, когда медикаментозная терапия недостаточно эффективна, целесообразно выполнение селективной лазерной трабекулопластики. Под нашим наблюдением находились 64 больных с ПЭГ (64 глаза) и 63 больных ПОУГ (63 глаза) которым был применен метод лазерного воздействия на трабекулу -селективная лазерная трабекулопластика, предложенная MXatina в 1995 г. Сутью метода, как известно, является избирательное действие энергии лазера на пигмент трабекулярной зоны. CЛT была выполнена по стандартной методике на лазере Laserex «Solo» как у больных с ПЭГ, в том числе и с впервые установленным диагнозом, так и у больных с ПОУГ. Динамическое наблюдение за больными осуществлялось в сроки 1 сутки, 1 неделя, 1 мес, 6 мес, 1 год, 2 года, 3 года и 4 года. Проведенное нами исследование показало, безопастность СЛТ: легкая инъекция в первые сутки после СЛТ встречалась у 29,7% больных ПЭГ и у 24,3% при ПОУГ. Более выраженное воспаление со смешанной инъекцией, ограничением реакции зрачка на свет и единичными преципитатами наблюдалось в 11% при ПЭГ и 10% при ПОУГ. Все признаки воспаления были купированы в последующие 1-2 дня. Анализ динамики ВГД после СЛТ показал достоверное его снижение на всех этапах, за исключением периода в три года, по сравнению с исходным у больных ПЭГ, в то время, как у пациентов ПОУГ достоверное снижение офтальмотонуса происходило только в первые полгода после операции. В ходе наблюдения мы обнаружили в группе ПЭГослабление гипотензивного режима (1,69±0,11 до1,45±0,09, р=0,05), в отличие от группы ПОУГ, где количество капель к концу периода наблюдения достоверно не поменялось. По нашим данным, необходимость в повторных СЛТ возникала с равной частотой в обеих группах больных глаукомой, чаще всего в период между первым и вторым годом наблюдения, реже — между вторым и третьим годом. Через три года необходимости в СЛТ не возникло ни в одном случае при ПЭГ, в то время как при ПОУГ СЛТ выполнялась в 6% случаев. Ни один из пациентов не нуждался в хирургическом лечении ни на одном этапе наблюдения. Однако анализ выживаемости методом Каплана-Мейера показал, что СЛТ в целом менее эффективна при ПЭГ, чем при ПОУГ. При этом нам удалось стабилизировать глаукомную оптическую нейропатию в обеих группах: MD в группе ПЭГсоставил -5,19±0,72dB и -5,03±0,97 dB, (р=0,104), в группе ПОУГ -5,73±0,56dB и -5,6±1,01 dB (р=0,365).
Принимая во внимание часто встречающуюся катаракту в глазах с ПЭГ и необходимость проведения факоэмульсификации в таких глазах, мы изучили ее влияние. Примечательно, что раннее подобные исследования не проводились. Учитывая ряд возможных осложнений подобной операции, связанных с дистрофическими изменениями переднего отрезка глаза, ранняя хирургия катаракты вызывает некоторые опасения. Однако в результате исследования 18 пациентов (28 глаз), получавших гипотензивную терапию по поводу ПЭГ и подвергшихся ФЭК с имплантацией ИОЛ и 16 больных (25 глаз), лечение которых ограничивалось назначением местных гипотензивных препаратов в виде инстилляций без ФЭК, мы выявили, что к концу 2 лет наблюдения после проведения ФЭК в основной группе ВГД было ниже, чем в группе сравнения: 18,1±0,16 мм рт ст. и 19,0±0,28 мм рт ст., (р=0,007), а также суточные флуктуации 2,6±0,11 мм рт ст. и 3,4±0,37 мм рт ст., (р=0,035). К концу срока наблюдения 5 лет эти показатели достоверно не отличались. При этом, для поддержания офтальмотонуса в группе после ФЭК требовалось меньшее количество капель, что сохранялось до конца периода наблюдения 1,46±0,1 и 1,04±0,03 (р=0,000), в то время, как в группе сравнения количество капель возросло с 1±0,00 до 1,4±0,09 (р=0,001). Примечательно, что стабилизацию глаукомной оптической нейропатии мы получили в обеих группах, однако MD к концу периода наблюдения в группе после проведения ФЭК был достоверно выше, чем в группе сравнения 0,92± 0,22dB и -0,66±0,43dB (р=0,001) при исходно более худших значниях светочувствительности сетчатки в основной группе (-5,12±0,25dB и -4,41±0,lldB, р=0,014).
В литературе имеются данные о том, что у пациентов с ПЭГ чаще развивается вторичная катаракта, однако они очень немногочисленны. В нашем исследовании частота развития вторичной катаракты при ПЭГ встречалась в 35%, тогда, как при ПОУГ в 15%. При этом развивалась она в 80% случаев при ПЭГ в срок 24 мес. после проведения ФЭК.
Источник