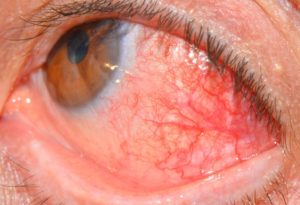
Покрытие роговицы по кунту
Онищенко А.Л., Набиева Н.Н.
Ожоги глаз являются тяжелым повреждением органа зрения и представляют серьезную медицинскую и социальную проблему. В настоящее время частота ожогов от общего числа глазных травм составляет от 6,1 до 38,4% [5]. Соответственно актуальна задача возвращения зрения больным с рубцовыми исходами тяжелых ожогов глаз, при которых требуются неоднократные реконструктивные пластические и оптические операции.
Лечение трофических язв роговицы представляет большую сложность. В патогенезе этих язв играют роль иммунный конфликт, глубокая деструкция роговицы, дефицит ростковых эпителиальных клеток лимба. Несмотря на широкий спектр современных лекарственных препаратов, консервативная терапия часто бывает недостаточно эффективной. Это заставляет офтальмологов прибегать к оперативному лечению. Используются хирургические методы офтальмопластики, основанные на применении ауто- или аллогенных тканей.
Чаще применяют конъюнктивопластику в различных модификациях. Конъюнктивопластика по Кунту состоит в том, что раневая поверхность пересаженного лоскута должна плотно соприкасаться с язвой роговицы, лишенной эпителия и боуменовой оболочки [5]. При недостаточности или некрозе слизистой оболочки в качестве аутопластического материала может быть использована теноновая оболочка аутотенонопластика [2]. При применении данных методов для закрытия обширных дефектов роговицы может происходить уменьшение глубины конъюнктивальных сводов и смещение лоскута за счет выраженной тракции. При обширных дефектах слизистой глаза может быть использована конъюнктива здорового глаза или слизистая полости рта. Часто возникают трудности с формированием лоскутов слизистой оболочки и недостаточностью их размеров, что склоняет хирургов к использованию других биологических материалов.
Методика биологического покрытия или лечебной поверхностной кератопластики используется при тяжелых, неподдающихся лечению патологических процессах роговицы при ожогах, длительно незаживающих эрозиях и язвах, рецидивирующих кератитах, рванных лоскутных ранах роговицы. Для биологических покрытий используются кадаверная роговица, аллопланты. В качестве пластического материала для укрепления постожоговых бельм используются трансплантаты из твердой мозговой оболочки, склеры, аутохрящ ушной раковины [5]. К лечебному покрытию можно отнести и амнионопластику [4].
Поиски, направленные на коррекцию лимбально-клеточной недостаточности, привели к разработке операций, целью которых является замещение недостающих лимбальных клеток новым источником таких же клеток. В зависимости от источника эти операции делятся на аутолимбальную трансплантацию с парного глаза при монолатеральном поражении и аллолимбальную трансплантацию с глазного яблока родственников или кадаверных доноров при билатеральном поражении [3, 6].
Цель разработка и клиническая апробация хирургического лечения трофической язвы постожогового бельма роговицы, заключающегося в использовании волокон наружных прямых мышц глазного яблока в качестве аутопластического материала.
Материал и методы
Для хирургического лечения ожоговой болезни глаз с угрозой перфорации (или перфорацией) роговицы нами предложено использование мышечного аутотрансплантата на «ножке» для реваскуляризации переднего сегмента глазного яблока, улучшения трофики и закрытия дефекта роговицы.
Сущность способа хирургического лечения трофической язвы роговицы на фоне постожогового бельма заключается в следующем1. (СНОСКА!!! Онищенко А.Л., Набиева Н.Н. Способ хирургического лечения трофической язвы постожогового бельма роговицы. Заявка на изобретение № 2009145611, приоритет от 8.12.2009 г.) Выполняется ретробульбарная анестезия, акинезия, инфильтрационная анестезия. В зависимости от преимущественной локализации дефекта роговицы (язвы, области истончения бельма роговицы) выделяется одна из наружных прямых мышц глазного яблока — верхняя, внутренняя, нижняя или наружная прямые мышцы. Например, при локализации дефекта мутной роговицы во внутренних прилимбальных отделах делается разрез конъюнктивы в 7 мм от лимба над областью сухожилия внутренней прямой мышцы, выделяется мышца. Сухожилие и «брюшко» мышцы «тупо» расщепляется на две порции — верхнюю 1/3 и нижние 2/3 ширины мышцы — от места фиксации к склере и кзади длиной до 10-12 мм. Верхняя 1/3 порция мышцы пересекается в 10 мм от места прикрепления к склере и дистальная часть ее подшивается узловыми швами к сохранной части роговицы, «перекрывая» истонченную (или язвенную) поверхность мутной роговицы. При этом сохраняется анатомическая связь данного лоскута мышцы в области фиксации сухожилия ее к склере. Дополнительно в этой же области выделяется лоскут теноновой оболочки размером 10×10 мм на «питающей» ножке («ножка» необходима для лучшей мобилизации и васкуляризациии лоскута для эпикератопластики), подшивается узловыми швами по всей окружности лимба, предварительно удалив эпителий роговицы. Рана конъюнктивы ушивается узловыми швами. Операция заканчивается временной блефарорафией на 2/3 длины век. В послеоперационном периоде продолжаются инстилляции глазных капель — антибактериальных, кератопластических препаратов. Через 1 мес. швы с век снимаются. Формируется хорошее эпителизированное покрытие, укрепляется истонченное бельмо роговицы, имеется врастание сосудов по ходу швов из лоскута мышцы и теноновой оболочки в ткани роговицы и рубцово-измененную конъюнктиву глазного яблока. Эффективность способа доказана в клинической практике.
Больной Б., 36 лет, перенес термохимический ожог роговицы и конъюнктивы III- IV степени обоих глаз 12 лет назад с исходом в лейкому роговиц обоих глаз IV степени, вторичную глаукому, осложненную катаракту. В последующие годы были проведены оперативные вмешательства послойная кератопластика, экстракапсулярная экстракция катаракты, антиглаукоматозные операции — глубокая склерэктомия обоих глаз с использованием дренажей, неоднократное лечение по поводу болезни трансплантата обоих глаз. Было выполнено оптическое кератопротезирование правого глаза (кератопротез модели Федорова-Зуева). Через 2 года произошла «протрузия» кератопротеза, проведена кератопластика правого глаза. В октябре 2009 г. больной поступил в офтальмологическое отделение с наличием глубокой «чистой» язвы, локализующейся прилимбально на 2-3 ч, диаметром 5 мм на фоне тотальной лейкомы и рубцово-измененной конъюнктивы правого глазного яблока (Vis светоощущение), тотальной лейкомы левого глаза (Vis=0). Учитывая угрозу перфорации роговицы, отсутствие положительной динамики при терапевтическом лечении, отсутствие кадаверной роговицы и высокий риск отторжения трансплантата (из-за многочисленных пластических операций) больному выполнена операция по предложенному способу — эпикератопластика лоскутом теноновой оболочки «на ножке» с использованием порции внутренней прямой мышцы для реваскуляризации роговицы, временная блефарорафия правого глаза. В послеоперационном периоде проводилась комплексная консервативная терапия по общепринятой методике, через 1 мес. сняты швы с век.
Результаты и обсуждение
После операции имеется приживление лоскута теноновой оболочки, активация репаративных процессов, устранение дальнейшего разрушения и перфорации роговицы. Формирование плотной рубцовой ткани у больного является хорошей основой для укрепления бельма с целью планирования повторного оптического кератопротезирования через 10-12 мес.
Общеизвестные методы закрытия дефектов роговицы кадаверной роговицей или другими аллогенными тканями часто приводят к отторжению и некрозу трансплантата вследствие нарушения микроциркуляции собственной поврежденной ткани, а также развития механизмов иммунологического конфликта, что неизбежно при тяжелых ожогах глаз. Кроме того, в настоящее время имеются существенные «пробелы» в нормативно-правовой базе РФ при осуществлении трансплантации органов и тканей, и соответственно офтальмологи испытывают трудности с обеспечением донорского материала.
Известно, что волокна наружных прямых мышц глазного яблока используются в реваскуляризирующих операциях при заболеваниях сетчатки и зрительного нерва в офтальмологии. Результаты исследований ряда авторов свидетельствуют о благоприятном влиянии мышечного аутотрансплантата на окружающие ткани [1].
Заключение
Предложенный способ хирургического лечения трофической язвы роговицы постожогового бельма, включающий эпикератопластику сосудисто-нервным стеблем теноновой оболочки и реваскуляризацию в виде пересадки порции внутренней прямой мышцы к области истончения (или перфорации) роговицы, способствует формированию рубца в зоне повреждения роговицы за счет усиления микроциркуляции и стимуляции репаративных процессов в собственной ткани роговицы, а также дает дополнительные возможности офтальмохирургу при выборе аутопластического материала при лечении особо тяжелых ожогов глаз и их осложнений.
Источник
Конъюнктивальное покрытие раны роговицы: методика
Предложено несколько способов закрытия раны в роговице конъюнктивальным лоскутом. Наиболее удобны:
1) частичное покрытие роговицы лоскутом-передником, если рана находится вблизи от лимба, и
2) полное покрытие всей роговицы при локализации раны в центральной ее части.
И в том, и в другом случае производится капельная, ретробульбарная и субконъюнктивальная анестезия, а также акинезия век.
Частичное покрытие роговицы конъюнктивальным лоскутом-передником производится следующим образом. Конъюнктива надрезается у лимба в той его полуокружности, которая соответствует локализации раны, и отсепаровывается до области экватора тонким слоем, без избытка субконъюнктивальной ткани. Накладываются два провизорных шелковых шва, отступя на 2 мм от края лоскута (по одному матрацному шву на двух иглах с каждой стороны). Концы нитей выводятся через неотсепарованную часть конъюнктивы по обе стороны от лимба.
Заготовив лоскут-передник, иссекают ткани, выпавшие в рану роговицы, после чего осторожно натягивают лоскут конъюнктивы на роговицу и завязывают швы, фиксирующие лоскут в этом положении. Если после этого лоскут кажется чрезмерно натянутым и край его резко анемизирован, рекомендуется сделать сразу же «освобождающий» разрез в лоскуте параллельно краю его и отступя от края на 7—8 мм.
Бинокулярная повязка, постельный режим и пенициллинотерапия производятся по общим правилам послеоперационного режима и лечения при проникающих ранениях глаза. Эвакуация в лежачем положении возможна через 2—3 дня (самолетом).
Швы снимаются через 8—10 дней, если они до этого сами не прорезаются. Наложение швов на двух иглах по типу матрацных и проведение их не слишком близко от края лоскута предупреждает раннее их прорезывание. После снятия швов лоскут отходит на свое место.
Если конъюнктивальное покрытие производится при наличии в роговице проникающей раны с большим дефектом ткани, мы рекомендуем выкраивать лоскут конъюнктивы более толстым, т. е. вместе с субконъюнктивальной тканью.
Конъюнктивальное покрытие всей роговицы, отличается от частичного тем, что разрез конъюнктивы делается по всей окружности лимба. Она отсепаровывается до экватора и после хирургической обработки раны в роговице натягивается на роговицу с двух сторон, полностью покрывает ее и удерживается здесь матрацными швами в течение 8—10 дней. Швы на края отсепарованной конъюнктивы накладываются в направлении, перпендикулярном длиннику раны в роговице. Благодаря этому натягиваемая швами конъюнктива несколько сближает края роговичной раны.
Наши наблюдения и эксперименты показали, что полного смыкания краев раны под конъюнктивальным лоскутом все же не получается.
Конъюнктивальное покрытие раны в склере должно производиться таким образом, чтобы швы на конъюнктиву накладывались не в области склеральной раны, а несколько в стороне от нее (А. Г. Кроль и др.) Конъюнктива отсепаровывается по обе стороны от раны в склере. С одной стороны выкраивается лоскут конъюнктивы в виде буквы П. Экономно отсекаются ткани, выпавшие в рану склеры.
Края раны прижигаются гальванокаутером или же производится электрокоагуляция склеры вокруг раны с целью профилактики отслойки сетчатки, если рана расположена за областью цилиарного тела. После этого П-образный лоскут конъюнктивы натягивается на склеральную рану, сближая ее края. Край лоскута подводится под конъюнктиву с другой стороны раны и фиксируется здесь матрацными швами.
— Также рекомендуем «Тектоническая пересадка роговицы и склеры: методика»
Оглавление темы «Хирургия ранений глаза»:
- Иссечение тканей глаза при их выпадении после травмы. Рекомендации
- Хирургическое закрытие проникающих ран глаза. Наложение роговичных и склеральных швов
- Зашивание раны в склере. Рекомендации
- Конъюнктивальное покрытие раны роговицы: методика
- Тектоническая пересадка роговицы и склеры: методика
- История развития методов закрытия проникающих ран роговицы и склеры
- Экспериментальные исследования в области закрытия проникающих ран роговицы и склеры
- Исходы закрытия проникающих ран роговицы и склеры. Клинические наблюдения
- Выбор метода закрытия проникающих ран роговицы и склеры. Показания
- Сквозные ранения глазного яблока. Особенности
Источник
in stromal keratitis
Sudalin A., Batmanov Yu.
This article reveals current information on treatment algorithm in patients with infectious keratitis and contaminated cornea trauma. Authors reported different methods of wool patching and infection control.
Повреждения и заболевания роговицы занимают одно из ведущих мест среди причин слепоты и слабовидения [10]. В таких экстренных ситуациях, как проникающие ранения глаза с дефицитом ткани роговицы, ожоги глазного яблока, язвы роговицы, осложненные десцеметоцеле и перфорации ее при инфекционных, трофических, аллергических и др. кератитах, необходимо ургентное хирургическое вмешательство на роговой оболочке.
Основной целью лечебной кератопластики (ЛКП) является сохранение глазного яблока путём удаления патологического участка роговицы и замещения её дефекта. С целью устранения дефектов роговицы применяют различные материалы: роговица, склера, амнион, альбуминовая плёнка, аллоплант, твёрдая мозговая оболочка, конъюнктива и др.
В 1975 году [33] впервые были использованы при десцеметоцеле мягкие контактные линзы, как подготовительный этап к последующей операции. Однако в дальнейшем появились сообщения об осложнениях инфекционного характера при данной методике (17%).
Впервые [37] в 1968 г. и [24] в 1969 г начали использовать адгезивные вещества (цианокрилаты) для лечения десцеметоцеле и перфораций роговицы. Прогрессирующее расплавление ткани роговицы при этом приостанавливалось вне зависимости от этиологии. Среди возможных осложнений отмечались: токсический иридоциклит, некроз окружающего участка роговицы и инфекционные осложнения.
Отдельным направлением в лечении язв роговицы являлась разработка различных материалов для биопокрытия, одним из которых стал амнион [2]. Клетки амниона способны вырабатывать вещества, угнетающие или тормозящие иммунитет. Считается, что это связано с ферментом альфа–фетопротеином.
При ЛКП в виде биопокрытия применяется также аллоплант. Э. Р. Мулдашев с соавт. (1987) отмечают возможность при более широком обеспечении офтальмохирургов трансплантатами достижения стойкого клинического эффекта ввиду замещения собственной тканью роговицы, а не чужеродной тканью [6].
Единого мнения относительно результатов данного варианта ЛКП пока нет. Определение эффективности ЛКП связано с трудностями дооперационного анализа таких критериев, как помутнение, воспаление, васкуляризация, чувствительность роговицы, определение функций слезы, внутриглазного давления, качества трансплантационного материала, тактики в до– и послеоперационном лечении и так далее. Важна также техника операции и то, что оценка клинического материала должна быть основана на анализе множества операций, производимых не одним, а разными хирургами.
Исследования, проведенные за последние 10–15 лет в Великобритании, показали, что на фоне значительных успехов трансплантации различных органов отдаленные результаты пересадки роговицы остаются прежними и часто заканчиваются развитием обширных синехий, вторичной глаукомы, увеита и помутнением трансплантата.
Лечение заболеваний роговой оболочки методом кератопластики связано с именами Fuchs (1901), Elschnig (1930), Franceschetti (1950) и др. Выдающийся вклад в разработку проблемы пересадки роговицы и внедрения этой операции в клиническую практику внес В.П.Филатов (1934–37) [24,25,26,27].
Лечебная или реконструктивная кератопластика (по Barraquer, 1961) представляет собой пересадку роговичного трансплантата различного размера, формы, толщины, и локализации при заболеваниях роговицы, резистентных к другим методам лечения и приводящих к распаду ее ткани [19].
Впоследствии советскими учеными–офтальмологами было разработано множество различных модификаций операции кератопластики (по Горгиладзе) [3]. В 1983 году [9] был предложен метод биологического покрытия – лечебная поверхностная послойная кератопластика или эпикератопластика, часто выполнявшаяся со склеральным ободком, без удаления при этом поврежденных подлежащих слоев роговицы. Гундорова Р.А. с соавт. (1983) [4] производили лечебную сквозную, послойную, грибовидную и аутокератопластику при офтальмогерпесе, инфекционных язвах и дистрофии роговицы. В 1989 году [7] была предложена операция стромопластики, обладавшая преимуществами как послойной, так и сквозной кератопластики. Данный метод интерламеллярной пересадки роговицы удобен ввиду своей технической простоты, физиологичности и надежности.
В.Г. Абрамов, Н.А. Маркичева (1983) изучали эффективность лечебной кератопластики донорским материалом, консервированным в меде. Они считают, что использование мелитированной роговицы целесообразно, в первую очередь, в ургентной офтальмохирургии [1].
По данным литературы, характер приживления кератотрансплантата в 70–80% случаев находится в прямой зависимости от показателей иммунитета и их послеоперационной динамики. Доказанным является факт ассоциации помутнения роговичного трансплантата с выявлением у пациента сенсибилизации к роговой оболочке.[20] Практическое применение сквозного кератопротезирования ограничено также в связи с возможностью таких тяжелых осложнений в позднем послеоперационном периоде, как асептический некроз (до 21% случаев) и отторжение кератопротеза (10%) [17]. По данным разных авторов, частота прозрачного приживления трансплантатов после повторной кератопластики составляет от 33 до 74,6% случаев [6].
Среди неблагоприятных факторов, оказывающих влияние на прозрачность трансплантата, помимо иммунодисбаланса и активности кератита, авторы указывают на интенсивную васкуляризацию роговицы, глаукому, послеоперационные передние синехии, потерю стекловидного тела, афакию и повторную кератопластику.
В настоящее время наряду с лечебной кератопластикой используется метод конъюнктивальной пластики роговицы (КПР). Аутоконъюнктивальная пластика роговицы является операцией выбора при показаниях к экстренной кератопластике, когда отсутствует донорский материал.
Впервые аутоконъюнктивальная пластика роговицы была предложена в 1847 году, в дальнейшем (1877) Krebs (1887), Кунтом (1883) и Мейером (1892). Независимо от них, Кунт в 1889 году разработал собственные способы конъюнктивального покрытия роговицы и определил показания к их применению [30, 31].
Конъюнктивальная пластика роговицы, разработанная Кунтом, состоит в том, что раневая поверхность пересаженного конъюнктивального лоскута должна плотно соприкасаться с язвой роговицы, лишенной в области дефекта эпителия и боуменовой оболочки. При этом длина и ширина лоскута зависят от места расположения дефекта на роговице и его величины [31].
В первой половине ХХ века КПР была одним из основных методов хирургической обработки проникающих ранений глазного яблока. Сторонниками её были Терсон (1908), Дюверже и Вельтер (1926), Вильяр (1928), Авербах М.И. и Юзефова Ф.И. (1944), Кроль А.Г. (1949) и др. Несколько позже, в 1940–50-х гг. среди офтальмологов появились противоречивые мнения об эффективности КПР и необходимости ревизии существующих методов хирургической обработки (ХО) при нарушениях целостности роговицы. Левкоевой Э.Ф. (1947–1951), а в дальнейшем Масловой И.П. были доказаны преимущества шовной методики хирургической обработки проникающих ранений и язв роговицы перед КПР [8, 9, 12].
Оппоненты конъюнктивальной пластики апеллировали к следующим аргументам и выводам, явившимся следствием наблюдений за ходом выздоровления пациентов, прооперированных по этим методикам:
1. Недостаточная адаптация краёв ран при проникающих ранениях роговицы, что приводит к неправильному их срастанию, синехио– и швартообразованию.
2. Невозможность визуального контроля за раневым процессом.
3. Отсутствие у конъюнктивального лоскута механико–асептического и кератопластического свойства.
4. Возможна ранняя дислокация лоскута с обнажением зияющей раны.
Основным аргументом сторонников КПР был, главным образом, один из этапов шовной методики операции ХО на роговице, связанный с давлением на раненый глаз, что увеличивало возможность большего выпадения внутриглазного содержимого (Филатов В.П., 1934). Кроме того, неудовлетворённость авторов обусловливалась инфильтрацией и отёком краёв раны, а также возможностью их некротизирования (Логинов Г.Г., Юзефова Ф.И., 1949) [11].
В отдельных источниках отечественных авторов, посвященных КПР, данный метод характеризуется при нетравматических патологиях роговицы, в случае десцеметоцеле, как «радикальный», если сочетать его с каутеризацией. По мнению В.П. Филатова (1934), в случае отсутствия дислокации лоскута операция по Кунту дает наибольшие гарантии успеха [18].
По мнению Insler M.S. , Pechous B. , Larsson S. , КПР является простой и эффективной операцией в случае неэффективного медикаментозного лечения заболевания роговицы. Она способна быстро снять боль и явления воспаления, а при необходимости – лоскут может быть легко смещен с целью повторной операции для улучшения зрительных функций [28].
Troft R.A. (1977) предложил использовать трансплантацию конъюнктивы с парного глаза на область лимба, как альтернативу послойной кератопластике при рецидивирующих эрозиях, постожоговой васкуляризации и рубцовых изменениях поверхностных слоев роговицы [36]. Эффективность данной методики подтверждают сообщения Herman W.K. , Dougman D.J. , Lindstrom R.L.(1983) [29].
Клиническими особенностями трансплантации конъюнктивы в модификации Troft R.A. являются:
1. Быстрая эпителизация стромы роговицы. В настоящее время доказано, что эпителизация роговицы может происходить путем миграции и трансформации конъюнктивального эпителия из зоны палисад Vogt области лимба. Весь цикл миграции и трансформации при этом длится 5–6 недель.
2. Надежная адгезия эпителия к строме, без тенденции к рецидивирующим эрозиям, постепенная регрессия васкуляризации роговицы с увеличением её прозрачности.
3. Поверхность роговицы становится гладкой, что позволяет корригировать остроту зрения очками или контактными линзами.
Но, с другой стороны, в литературе [34, 35] отмечаются следующие многочисленные осложнения КПР:
1. Дефекты лоскута, которые, по мнению некоторых авторов, необходимо ушивать в обязательном порядке, так как они могут увеличиваться в размерах и привести к ретракции лоскута.
2. Подлоскутные геморрагии из каутеризированных сосудов при перитомии, являющиеся предпосылкой для присоединения вторичной инфекции и удлиняющие восстановительный период.
3. Транзиторный послеоперационный птоз, связанный с погрешностями в технике операции и с опущением верхнего свода вследствие тракций теноновой капсулы, выкроенной вместе с лоскутом.
4. Паралимбальные эпителиальные кисты, возникающие из–за неполной деэпителизации роговицы и напоминающие фильтрационную подушечку.
5. Эрозии лоскута, вызванные подлежащей язвой роговицы.
6. Васкуляризация и помутнение подлежащей роговицы. То есть оптические функции роговицы при данной методике лечения зачастую приносятся в жертву надёжности её заживления.
Учеными [5,14] была введена в систему экстренной хирургии дефектов роговицы новая модификация конъюнктивальной пластики – аутоконъюнктивальная пластика роговицы с жесткой фиксацией лоскута узловыми швами край в край на одной ножке в ложе–канале, без ушивания дефекта эпибульбарной конъюнктивы.
Трансплантация аутоконъюнктивы представляется исследователям данного метода лечения [5, 14], как многофункциональное воздействие на патологический процесс в роговице. Лоскут защищает патологически изменённую роговицу от конъюнктивальных секретов и других экзогенных раздражителей, в том числе мигательных движений. Это имеет большое значение, учитывая, что все изъязвления роговицы сопровождаются её отеком и снижением её резистентности к инфекции. Кроме того, патологические процессы роговицы, как правило, сопровождаются роговичным синдромом, при котором состав слезы отличается от нормального. Лоскут же благодаря изоляции патологического участка вызывает нормализацию состава слезной жидкости, что благоприятно отражается на течении процесса. Такой же эффект достигается хирургами при наложении биопокрытия донорской кадаверной роговицы на пораженную роговицу пациента.
Дополнительными аргументами в пользу КПР являются такие факторы, как отсутствие материала для ургентной пластики роговицы, недостаточная функциональная результативность ургентной кератопластики роговицы и статистически доказанная неудовлетворительность результатов повторных пересадок роговицы.
Выводы
Несмотря на использование самых различных хирургических методик, проблема дифференциального лечения глубоких стромальных кератитов различной этиологии до настоящего времени не решена.
Литература
1. Абрамов В.Г., Маркичева Н.А. Лечебная послойная кератопластика мелитированным материалом //Офтальмол. журн. – 1983. – Т. 258, №2. – С. 81 – 83
2. Батманов Ю.Е., Егорова К.С., Колесникова Л.Н. Применение свежего амниона в лечении заболеваний роговицы // Вестн. офтальмол. – 1990 – т.106, №5 – с. 17–19.
3. Горгиладзе Т.У. Классификация бельм и показания к кератопластике // Офтальмол. журн. – 1983 –т 258, №2. – с. 71–75.
4. Гундорова Р.А. , Поволочко Л.И., Ржечицкая О.В. с соавт. Лечебная кератопластика при различных патологических состояниях роговицы // Офтальмол. журн. – 1983 –т 258, №2. – с. 75 – 77.
5. Гундорова Р.А., Оганесян О.Г., Макаров П.В., Илуридзе С.Л., Аутоконъюнктивальная пластика роговицы – операция выбора для герметизации инфекционных дефектов роговицы // Теоретические и клинические исследования как основа медикаментозного и хирургического лечения травм органа зрения: Материалы науч. – практ. конф. – М., 2000. – С. 45.
6. Комах Ю.А., Мороз З.И., Борзенок С..А. Современное состояние проблемы повторной пересадки роговицы (Обзор литературы) //Офтальмохирургия. – 1997. – №1. – С. 19–27.
7. Краснов М.М., Каспаров А.А., Мамикоян В.Р., Филоненко И.В. Первый опыт полной стромопластики // Вестник офтальмол. – 1989. – Т. 105, №3. – С. 19 – 24.
8. Левкоева Э.Ф. Регенерация наружных оболочек глаза при ранении, её значение в клинике и прогнозе перфоративного повреждения. // Вестн. офтальмол. – 1946. – Т. ХХV, №3. – С. 25 – 31.
9. Левкоева Э.Ф. Раневой процесс в глазу. – М.: АМН., 1951. – 125 с.
10. Либман Е.С., Мелкумянц Т.А. Состояние инвалидности по зрению в СССР, меры по её профилактике и снижению //Актуальные вопросы социальной офтальмологии: Сборник науч. трудов. – М., – 1988. – С. 105.
11. Логинов Г.Г. Сравнительная оценка лечения свежих ран глазного яблока способом Кунта и наложением швов. // Вестн. офтальмол. – 1945. – Т. ХХIV, №3. – С. 21 – 28.
12. Маслова И.П. Сравнительное клинико–анатомическое изучение различных методов первичной хирургической обработки глазных ран: Дисс. … канд. мед. наук. – М., 1953. – 284 с.
13. Мулдашев Э.Р., Муслимов С., Саликов., // Аллопланты для офтальмохирургии – Уфа. – 1987. – С. 30.
14. Оганесян О.Г., Гундорова Р.А., Майчук Ю.Ф., Макаров П.В., Хорошилова – Маслова И.П. Илатовская Л.В. Новая модификация аутоконъюнктивальной пластики в неотложной хирургии роговицы. //Вестн. офтальмол. – 2002. – №1 – С. 18 – 22.
15. Пучковская Н.А. Лечебная кератопластика и возможности стимуляции регенеративной способности роговой оболочки // Офтальмол. журн. – 1983. – №2. – С. 69–71.
16. Сафонова Т.Н., Ермаков Н.В. Лечение прободных язв роговицы при синдроме Шёгрена // Тез. докл. VII Съезда офтальмологов России. – М., 2000. – Т.2. – С. 42–43.
17. Федоров С.В., Мороз З.И., Зуев В.К. Кератопротезирование – М. 1982.
18. Филатов В.П. //Руководство глазной хирургии. – М. – Л. –1934, Т. II – С. 574 – 597.
19. Barraquer J. Total Penetrating Keratoplasty //Proc. R. Soc. Med. – 1961. – Vol. 54, №4. – P. 1116–1118.
20. Boruchoff S.A., Refojo M.F., Slansky H.H. et al. Clinical applications of adhesives in corneal surgery //Trans. Am. Ac. Ophthal. Otolaryng. – 169. – Vol. 73, №4. – P. 499–505.
21. Brown B.C., Nesburn A.B., Nauhiem J.S. et al. The use of conjunctival flaps in the treatment of herpes keratouveitis //Cornea – 1992. – Vol. 11, №1. – Р. 44–46.
22. Elschnig A. Keratoplasty //Arch Ophthalmol. – 1930. – Vol. 4, – P. 165–173.
23. Filatov V.P. Remarks concerning the amelioration of leucomas and corneal transplantation //Amer. J.Ophtalmol. – 1937. – Vol. 20, №6. – P. 1283.
26. Franceschetti A., Doret M. Keratoplastie a chaud // Ophthalmologica – 1950. – Vol. 120, №1. – P. 11 –15.
27. Fuchs E. Zur Keratoplastik //Z. Augenheilkd. – 1901. – Vol. 5, P. 1–5.
28. Insler M.S., Pechous B. Conjunctival flaps revisited // Ophthalmic Surg. – 1987. – Vol. 18, №5. – P. 455–458.
29. Herman W.K., Dougman D.J., Lindstrom R.L. Conjunctival autograft transplantation for unilateral ocular surface diseases. // Ophthlmol. – 1986. – Vol. 90, №9. – Р. 1121–1126.
30. Kuhnt H. Uver die Verwerbarkeit der Bindehant in der praktischen operativen //Augenheilkunde, Wiesbaden – 1898. – P. 149.
31. Kuhnt H. // Elschnigs Operatioslehre – 1905. – Bd. 1, P. 560.
32. Larsson S. Treatment of perforated corneal ulcer byautoplastic scleral transplantation.
//Br. J. Ophthalmol. – 1948. – Vol. 32, №1. – Р. 54–57.
33. Leibowitz H. M., Berrospi A.R. Initial Treatement of descemetocele with hydrophilic contactlenses // Ann. Ophthalmol. – 1975. – Vol. 7, 6. – P. 1161 – 1166.
34. Paton D., Milauskas A.T. Indication, surgical technique, and thin conjunctival flap on the cornea: а review of 122 consecutive cases //Int. Ophthalmol. Clin. – 1970. – Vol. 10, №2. – Р. 329–345.
35. Rosenfeld S.I., Alfonso E.C., Gollamudi S. Recurrent herpes simplex infection in a conjunctival flap //Amer. J. Ophthalmol. – 1993. – Vol. 116, №2. – Р. 242–244.
36. Throft R.A. Indication for conjunctival transplantation. //Ophthlmol. – 1982. – Vol. 89, №4. – Р. 335–339.
37. Webster R.G., Refojo M.F., Slansky H.H. et al. The use of adhesive for the closure of corneal perforation //Arch. Ophthalmol. – 1968. – Vol. 80, №6. – P. 705 – 709/
Источник