Назальная ступенька при глаукоме
Исследование поля зрения
Поле зрения – это область пространства, воспринимаемая глазом при неподвижном взоре. Периметрия – метод исследования поля зрения с использованием движущихся (кинетическая периметрия) или неподвижных стимулов (статическая периметрия).
Кинетическая периметрия
Основной ее целью является исследование периферических границ поля зрения, при этом до некоторой степени возможно также выявление крупных участков полной или частичной утраты светочувствительности (абсолютных и относительных скотом), в частности – определение границ слепого пятна. Исследование проводится последовательно в нескольких, чаще – в 8 меридианах, путем плавного перемещения тестового объекта по поверхности периметра от периферии к центру до момента, когда его замечает испытуемый (или от центра к периферии до момента, когда его перестает видеть испытуемый, что, однако, считается менее точным).
В настоящее время у больных глаукомой кинетическая периметрия имеет ограниченное значение, обеспечивая преимущественно контроль состояния границ поля зрения. Для установления диагноза и мониторинга пациентов в развитой и далекозашедшей стадиях ПОУГ этого достаточно. При подозрении на глаукому и при начальной стадии заболевания метод не имеет диагностической ценности и существенно уступает статической периметрии, которая является более информативной.
Статическая периметрия
Метод количественной статической периметрии заключается в определении световой чувствительности в различных участках поля зрения с помощью неподвижных объектов переменной яркости. Исследование проводится с помощью компьютеризированных приборов, обеспечивающих выполнение исследования в полуавтоматическом режиме; такой модификации метода было дано название компьютерной или статической автоматической периметрии (САП).
При глаукоме в качестве стандартных используют скрининговые и пороговые программы для исследования центральной области поля зрения (аналогичные 30–2 или 24–2 на периметре Humphrey либо программе 32 или G1 на периметре Octopus).
Оценка результатов
Схемы с нанесенными числами демонстрируют количественные показатели светочувствительности и их отклонения от возрастной нормы: чем меньше вероятность отклонения, тем интенсивнее штриховка соответствующего символа. Наряду со схемами распечатки содержат также ряд суммарных показателей (индексов), дающих общую количественную характеристику состояния центрального поля зрения.
1. MD – mean deviation (среднее отклонение) – отражает среднее снижение светочувствительности.
2. PSD – pattern standard deviation (паттерн стандартного отклонения) / LV – loss variance (дисперсия потери светочувствительности) – характеризует выраженность локальных дефектов.
3. SF – short term fluctuation (краткосрочные флюктуации, только Humphrey) – говорит о стабильности (повторяемости) измерений светочувствительности в точках, которые проверялись дважды в ходе исследования. SF>7,0 дБ рассматривается как признак ненадежности полученных результатов.
4. CPSD – corrected PSD / CLV – corrected LV – скорректированные с учетом величины краткосрочных флюктуаций значения PSD / LV статической автоматической периметрии.
По мере прогрессирования глаукомы обнаруживаются характерные дефекты в области, расположенной в 10–20° от точки фиксации (так называемой зоне Бьеррума), в виде очаговых или дугообразных скотом, которые могут сливаться со слепым пятном. Несколько реже имеет место изолированное расширение слепого пятна либо мелкие скотомы в пределах 10° от точки фиксации. Может наблюдаться так называемая назальная ступенька, которая проявляется в виде скотомы в верхненосовых (реже – нижненосовых) отделах центрального поля зрения, строго ограниченной горизонтальным меридианом. Подобная горизонтальная граница нередко отмечается и у дугообразных скотом в зоне Бьеррума.
Стандартная автоматическая коротковолновая (синее-на-желтом) периметрия (САКП) – отличается от обычной периметрии только использованием желтой окраски фона и стимулов синего цвета, однако это позволяет выделить и изолированно оценить функцию так называемых синих колбочек, а также зрительных путей. САКП обеспечивает наиболее раннее выявление изменений поля зрения при глаукоме, но метод весьма чувствителен при патологии рефракции, помутнениях оптических сред глаза и поэтому имеет несколько меньшую специфичность.
Периметрия с удвоением частоты (frequencydoublingtechnology perimetry, FDT) основана на оптической иллюзии, заключающейся в том, что черно-белая решетка, изменяющая окраску черных полос на белую, а белых – на черную с определенной частотой, создает иллюзию наличия вдвое большего числа полос. Используются надпороговая и пороговая стратегии. Надпороговое исследование занимает всего 35 с, а пороговое – 3,5–4 мин. Скорость исследования, а также слабая зависимость от расфокусировки и размеров зрачка позволяют использовать метод и прибор для скрининговых исследований на глаукому. Показана высокая чувствительность и специфичность метода в диагностике глаукомы, хорошее соответствие получаемых результатов данным обычной статической периметрии.
Достаточно обоснованное суждение о характере изменений поля зрения обеспечивает сравнение не менее трех, а лучше 5–6 последовательных измерений, учитывая субъективность исследования, в том числе «эффект обучения». Для обеспечения возможности сравнения все исследования должны проводиться строго по одной и той же программе, желательно на одном и том же аппарате. Повторные исследования целесообразно проводить 2 раза в год, а при впервые выявленной глаукоме (или подборе терапии) рекомендуется проведение исследований в течение первых двух лет наблюдений через 2-3 мес.
6. МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ ГЛАУКОМЫ
Необходимое условие успешного лечения глаукомы – снижение офтальмотонуса и длительная стабилизация его на уровне целевого давления. ВГД может быть снижено медикаментозным, лазерным и хирургическим путем. В подавляющем большинстве случаев лечение начинают с местного применения гипотензивных лекарственных препаратов (табл. 12). Однако комплексная терапия глаукомы должна включать два направления:
— нормализация индивидуального ВГД;
— нейропротекторная терапия с улучшением глазного кровотока.
Кроме того, учитывая наличие у больных глаукомой, длительно получающих местную инстилляционную терапию, сопутствующего синдрома «сухого глаза», показано назначение слезозаместительной терапии.
Общие принципы выбора местной гипотензивной терапии
1. До лечения определяют предполагаемое давление цели с учетом всех факторов риска, имеющихся у данного конкретного больного.
2. При подборе препарата необходимо производить оценку влияния назначенного гипотензивного режима на каждый глаз пациента по отдельности.
3. Лечение начинают с монотерапии лекарственным средством (ЛС) первого выбора. При его неэффективности или плохой переносимости пациентом данное ЛС заменяют другим ЛС из другой фармакологической группы или переходят к комбинированной терапии.
4. При проведении комбинированной терапии не следует использовать более двух ЛС одновременно; предпочтительно применение ЛС в виде фиксированных комбинаций.
5. При проведении комбинированной терапии не следует использовать ЛС, относящиеся к одной и той же фармакологической группе (например, нельзя комбинировать два разных β-адреноблокатора или два разных простагландина).
6. Адекватность достигнутого гипотензивного эффекта регулярно проверяется исследованием состояния ДЗН и зрительных функций.
7. При оценке лекарственного воздействия необходимо учитывать следующее:
— тип влияния на гидродинамику глаза;
— степень возможного понижения уровня ВГД;
— наличие противопоказаний к применению;
— переносимость;
— необходимую частоту применения.
Два последних фактора могут значительно ухудшать качество жизни больных и в конечном итоге приводить к несоблюдению рекомендуемого режима лечения, что снижает эффективность проводимой терапии.
8. При выборе ЛС необходимо систематическое сравнение полученного тонометрического давления (Pt) с давлением цели. Уровень ВГД не должен быть выше давления цели.
9. Лечение осуществляется на протяжении всей жизни больного. При проведении медикаментозной терапии для исключения развития тахифилаксии целесообразно проводить плановую замену ЛС. С этой целью 2–3 раза в год на 1-2 мес. изменяют терапию, кроме терапии простагландинами и ингибиторами карбоангидразы. Замену следует проводить на ЛС, принадлежащее к другой фармакологической группе.
Таблица 12
Основные фармакологические группы гипотензивных препаратов
и механизм их действия
| Фармакологическая группа | МНН | Форма выпуска, упаковка |
| Улучшающие отток внутриглазной жидкости | ||
| Простагландины | травопрост 0,004% | глазные капли по 2,5 мл во флаконах-капельницах |
| латанопрост 0,005% | глазные капли по 2,5 мл во флаконах-капельницах | |
| М-холиномиметики | пилокарпина гидрохлорид 1%, 2%, 4%, 6% | глазные капли по 1,5 мл в тюбиках-капельницах или во флаконах по 5, 10 и 15 мл |
Снижающие продукцию внутриглазной жидкости | ||
| Неселективные β-адреноблокаторы | тимолола малеат 0,25%, 0,5% | глазные капли по 5–10 мл во флаконах-капельницах |
| Селективные β-адреноблокаторы | бетаксолол 0,25%, 0,5% | глазные капли по 5 мл во флаконах- капельницах |
| α- и β-адреноблокаторы | бутиламиногидроксипропоксифеноксиметил метилоксадиазол 1%; 2% | глазные капли по 1,5 мл в тюбиках- капельницах, по 5 мл во флаконах- капельницах |
| Ингибиторы карбоангидразы | ацетазоламид 250 мг | таблетки 250 мг |
| бринзоламид 1% | глазная суспензия по 5 мл во флаконах-капельницах | |
| дорзоламид 2% | глазные капли по 5–10 мл во флаконах-капельницах | |
| Улучшающие отток и снижающие продукцию внутриглазной жидкости | ||
| α2-селективный адреномиметик | бримонидин 0,15% | глазные капли по 5-10-15 мл во флаконах-капельницах |
Требования к оптимальному препарату для лечения глаукомы
1. Эффективное снижение уровня ВГД.
2. Поддержание уровня ВГД с небольшими колебаниями его значений в течение суток.
3. Сохранение гипотензивного действия в течение длительного времени (табл. 13).
4. Минимальные побочные реакции.
5. Удобный и простой режим дозирования.
Таблица 13
Основные характеристики фармакологических групп, применяемых
для гипотензивной терапии глаукомы
| Фармакологическая группа | Понижение уровня ВГД, % от базового | Начало действия | Макси- мальный эффект | Продол- житель- ность дей- ствия | Период вымыва- ния | Режим дози- рования |
| Простагландины | 25–33 | 2 ч | 8–12 ч | До 24 ч | 4–6 нед | 1 раз / сут |
| М-холиномиметики | 17–20 | 10–15 мин | 30–60 мин | 4–8 ч | 1–3 дня | 3–4 раза / сут |
| β-адреноблокаторы (неселективные) | 20–25 | 20 мин | 1–2 ч | 12–24 ч | 2–5 нед | 2 раза / сут |
| β-адреноблокаторы (селективные) | 20 | 30 мин | 1–2 ч | 12 ч | 2–5 нед | 2 раза / сут |
| α- и β-адреноблокаторы | 20 | 15–30 мин | 4–6 ч | 24 ч | Нет данных | 2–3 раза / сут |
| α2-адреномиметики | 20 | 30 мин | 2 ч | 8–12 ч | 1–3 нед | 3 раза / сут |
| Ингибиторы карбоангидразы (местные) | 20 | 15–20 мин | 2 ч | 12 ч | 1 нед | 2–3 раза / сут |
Комбинированные лекарственные средства
Для повышения эффективности медикаментозного лечения глаукомы и улучшения качества жизни больных был разработан ряд фиксированных комбинированных препаратов, содержащих вещества, которые, имея различный механизм гипотензивного действия, при комбинации обладают аддитивным эффектом.
Основные положения комбинированной терапии
В арсенале препаратов местной терапии выделяют комбинированные формы, в состав которых входят два гипотензивных препарата из разных групп. Обладая различными механизмами регуляции офтальмотонуса, они обеспечивают усиление гипотензивного действия друг друга и показаны пациентам, у которых отсутствует стойкая нормализация ВГД на монотерапии.
1. Применение местных гипотензивных препаратов возможно в комбинации друг с другом, а также в сочетании с лазерными и хирургическими методами лечения.
2. Лечение начинают с монотерапии ЛС первого выбора. При его неэффективности или плохой переносимости пациентом данное ЛС заменяют другим ЛС из другой фармакологической группы. Если же первое выбранное ЛС хорошо переносится пациентом и действует в целом эффективно, но все же недостаточно для достижения давления цели и уровень офтальмотонуса подлежит пересмотру, то переходят к комбинированной терапии.
Таблица 14
Комбинированные фиксированные формы, зарегистрированные в РФ
| Комбинируемые лекарственные средства | Режим дозирования | Гипотензивная эффективность, % | |
| Тимолол малеат 0,5% | пилокарпина гидрохлорид 2%, 4% | 1 кап 2 раза в сутки | 25-30 |
| Тимолол малеат 0,5% | пилокарпина гидрохлорид 4% | 1 кап 2 раза в сутки | 25-30 |
| Тимолол малеат 0,5% | латанопрост 0,005% | 1 кап 1 раз в сутки | 30-37* |
| Тимолол малеат 0,5% | травопрост 0,004% | 1 кап 1 раз в сутки | 30-38* |
| Тимолол малеат 0,5% | биматопрост 0,03% | 1 кап 1 раз в сутки | 33-39* |
| Тимолол малеат 0,5% | дорзоламид 2% | 1 кап 2 раза в сутки | 33-45* |
| Тимолол малеат 0,5% | бринзоламид 1% | 1 кап 2 раза в сутки | 28-35* |
| Бутиламиногидроксипропоксифеноксиметил метилоксадиазол 1% | клофелин 0,25% | 1 кап 2 раза в сутки | 20-25 |
| Бутиламиногидроксипропоксифеноксиметил метилоксадиазол 1% | пилокарпина гидрохлорид 1% | 1 кап 2 раза в сутки | 20-25 |
| Тимолол малеат 0,5% | бримонидин 0,2% | 1 кап 2 раза в сутки | 25-30 |
* по данным публикаций.
3. При проведении комбинированной терапии не следует использовать более двух ЛС одновременно; предпочтительно применение ЛС в виде фиксированных комбинаций.
4. При проведении комбинированной терапии не следует использовать ЛС, относящиеся к одной и той же фармакологической группе.
5. Эффект комбинированной гипотензивной терапии оценивается по степени снижения уровня ВГД.
Наиболее эффективно сочетание простагландинов с неселективными β-блокаторами, несколько уступает комбинация с ингибиторами карбоангидразы или α-агонистами.
В табл. 14 представлены наиболее часто применяемые комбинированные препараты и их ориентировочная гипотензивная эффективность.
Нейропротекторная терапия глаукоматозной оптической нейропатии
Нейропротекция подразумевает защиту сетчатки и волокон зрительного нерва от повреждающего действия различных факторов, в первую очередь от ишемии. Нейропротекторная терапия направлена на коррекцию метаболических нарушений, возникающих при глаукоме в головке зрительного нерва, улучшение местной микроциркуляции и трофики тканей, нормализацию реологических свойств крови.
В настоящее время принято выделять две группы нейропротекторных препаратов – прямого и непрямого действия.
Нейропротекторы прямого действия непосредственно защищают нейроны сетчатки и волокна зрительного нерва за счет блокирования прямых факторов повреждения клеток, вызывающих увеличение концентрации продуктов перекисного окисления липидов (ПОЛ) и свободных радикалов, ионов Са++.
Нейропротекторы непрямого действия, влияя на различные патофизиологические нарушения (снижение перфузионного давления, атеросклероз, изменение реологических свойств крови, ангиоспазм) и повышая устойчивость различных функциональных систем к снижению перфузионного давления в сосудах глаза и гипоксии, опосредованно оказывают защитное действие. Подобным эффектом обладают препараты, улучшающие микроциркуляцию, реологические свойства крови, снижающие уровень холестерина в крови, ноотропные средства.
Нейропротекторная терапия должна всегда проводиться при активном гипотензивном лечении (медикаментозном, лазерном или хирургическом), позволяющем достичь целевого давления.
Препараты прямого действия
Кортексин – комплекс пептидов, выделенных из коры головного мозга крупного рогатого скота и свиней. Кортексин обладает тропным действием в отношении коры головного мозга и регулирует процессы метаболизма нейромедиаторов и перекисного окисления липидов (ПОЛ) в коре головного мозга, зрительном нерве и нейронах сетчатки.
Ретиналамин – представляет собой комплекс пептидов, выделенных из сетчатки крупного рогатого скота. Относится к цитомединам, которые влияют на клеточный и гуморальный иммунитет, состояние системы гомеостаза, ПОЛ и другие защитные реакции организма независимо от того, из каких органов и тканей они были получены.
Пентагидроксиэтилнафтохинон (гистохром) — относится к препаратам, способным нейтрализовать ионы железа, которые накапливаются в зоне ишемии. В присутствии ионов железа и меди образуется один из активаторов ПОЛ – гидроксильный радикал (НО–) (реакции Габера–Вейса). Выполняя роль перехватчика свободных радикалов, гистохром улучшает энергетический обмен в тканях и реологические свойства крови на фоне ишемии.
Этилметилгидроксипиридин (мексидол) – относится к группе синтетических фенольных соединений, которые являются синергистами аскорбиновой кислоты и образуют буферную окислительно-восстановительную систему. Оказывает положительное влияние на процессы энергообразования в клетке, активизирует внутриклеточный синтез белка и нуклеиновых кислот. Активизируя ферментативные процессы цикла Кребса, препарат способствует утилизации глюкозы и увеличению образования АТФ. Мексидол улучшает кровоток в зоне ишемии, ограничивает зону ишемического повреждения и стимулирует репаративный процесс. Он стабилизирует мембраны клеток крови и способствует улучшению реологических свойств крови.
Метилэтилпиридинол (эмоксипин) – относится к аналогам витамина В6. Как и витамин В6, его аналоги оказывают антиоксидантное действие, являются эффективными ингибиторами гидроксильных радикалов, кальцийнезависимой фосфодиэстеразы, вследствие чего увеличивается концентрация цАМФ в тканях, что приводит к торможению гликолитических процессов. Они также уменьшают агрегацию тромбоцитов, обладают фибринолитической активностью, стабилизируют мембрану эритроцитов, оказывают положительное влияние на микроциркуляцию и оказывают воздействие на тонус сосудистой стенки.
Поделитесь с Вашими друзьями:
Источник

Описание
По данным, полученным в нашей лаборатории, физиологическая экскавация отсутствовала у 26% здоровых людей в возрасте старше 40 лет и была выражена в той или иной мере у 74% [Листопадова Н. А., 1979]. Все индивидуальные варианты физиологической экскавации могут быть классифицированы в зависимости от ее формы, размера и глубины, а также от характера височного края (пологий, крутой, подрытый). В 99% наблюдений экскавация имела правильную круглую или слегка овальную форму, а в 1% склеральный канал был резко скошен и клинически наблюдалась картина «косого» диска. В таких случаях экскавация имела неправильную форму: она расширялась в височную сторону и была узкой в носовой половине диска, при этом носовой край был крутым, а височный — пологим. Плоская физиологическая экскавация обычно имела небольшую величину, а глубокая экскавация могла достигать значительных размеров.
Описаны несколько клинических разновидностей глаукоматозной экскавации ДЗН [Нестеров А. П., Егоров Е. А., 1981; Reed R., Spaeth G., 1974]. Различают:
- темпоральную экскавацию;
- экскавацию с выемкой около верхнего или нижнего полюса;
- экскавацию с перекрытием;
- колбовидную экскавацию.
Первый тип характеризуется расширением физиологической экскавации во все стороны, но все же преимущественно в темпоральном направлении (рис. 31, а).
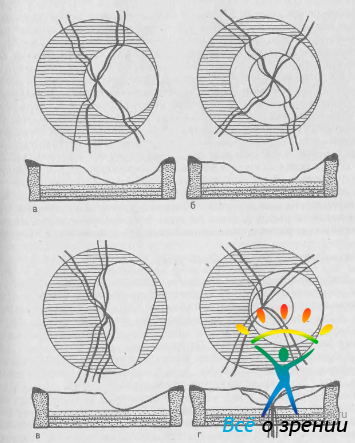
Рис. 31. Основные типы глаукоматозной экскавации ДЗН (схема). а — темпоральная; б — блюдцевидная; в — с выемкой; г — с перекрытием.
Края экскавации могут быть крутыми или пологими. В последнем случае углубление в диске иногда имеет два уровня, напоминая по форме блюдце (блюдцевидная экскавация, рис. 31, б). Темпоральная экскавация имеет правильную круглую или слегка овальную форму, в связи с чем ее трудно дифференцировать от физиологической экскавации.
Экскавация с выемкой (рис. 31, в) характеризуется «прорывом» зоны углубления к верхнему или нижнему полюсу (или к обоим полюсам). В таких случаях обнаруживают типичные для глаукомы изменения поля зрения в соответствующих сегментах.
По наблюдениям A. Tuulonen и P. J. Airaksinen [1991], в глазах с высоким уровнем ВГД экскавация зрительного нерва чаще развивается по первому типу, а у больных глаукомой с низким давлением — по второму типу. Экскавация с перекрытием (рис. 31, г) может быть обнаружена только с помощью стереоскопических методов. Сущность ее заключается в атрофии ткани в глубине ДЗН при сохранении целости внутренней пограничной мембраны. Ветви центральных сосудов сетчатки перекрывают зону экскавации. В дальнейшем мембрана и сосуды коллаптируют, т. е. смещаются на дно и боковые стенки экскавации [Spaeth G. et al., 1976].
Колбовидная экскавация характерна для далеко зашедшей и терминальной стадий глаукомы. Углубление в диске занимает всю или почти всю его поверхность и имеет крутые, подрытые края.
ДЗН у больных с глаукомой может характеризоваться не только прогрессирующей экскавацией, но и появлением глаукоматозного гало, связанного с атрофией хориоидеи в перипапиллярной области и атрофическими изменениями сетчатки вокруг диска, проявляющимися в исчезновении ее радиальной структуры и возникновении мелких линейных по форме кровоизлияний между нервными волокнами.
Любая классификация упрощает действительность, но вместе с тем облегчает диагностику и контроль за течением болезни. Описанная ниже классификация экскаваций ДЗН, как физиологических, так и глаукоматозных, разработана нами совместно с Н. А. Листопадовой на основе результатов детального стереоскопического изучения диска в 394 глазах у 264 человек.
Клинические разновидности экскавации можно объединить в два основных типа: симметричный и асимметричный. Симметричный тип (рис. 32)
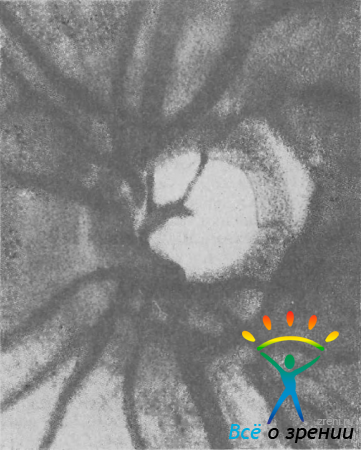
Рис. 32. Экскавация ДЗН правильной формы с крутым краем (отношение Э/Д равно 0,6).
характеризуется правильной округлой или слегка овальной формой; к нему можно отнести почти все случаи физиологической экскавации (исключая «косой» ДЗН), темпоральное расширение, экскавацию с перекрытием и колбовидную экскавацию. Асимметричный тип экскавации отличается выраженной асимметрией (рис. 33).
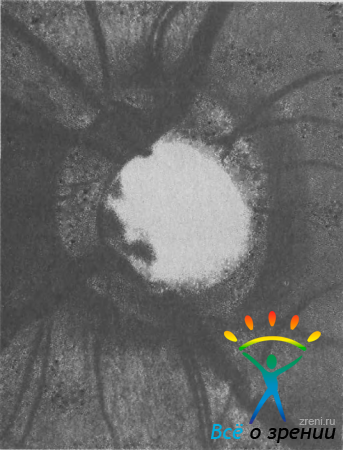
Рис. 33. Асимметричная, вытянутая в нижневисочном направлении экскавация ДЗН (отношение Э/Д равно 0,7).
При этом экскавация вытянута в одном направлении значительно больше, чем в других (экскавация с выемкой).
К. Iwata (1979) предложил симметричный тип экскавации обозначать буквой А, асимметричный — буквой В. Он выделил также третий тип, при котором экскавация имеет смешанный характер. Однако в клинической практике различить второй и третий типы не всегда возможно. Следует отметить, что по мере прогрессирования глаукоматозного процесса и расширения экскавации тип В может перейти в тип А. Своеобразную экскавацию, характерную для «косого» ДЗН (см. рис. 26), с крутым носовым краем и пологим, доходящим до края височным склоном, мы обозначили как тип С.
Кроме типа экскавации, в нашей классификации анализируются ее размеры, глубина и характер краевой зоны. По размеру экскавации все ДЗН разделены на шесть групп (от I до VI) в соответствии с величиной отношения максимального диаметра экскавации к диаметру ДЗН в том же меридиане (Э/Д). Принятое многими авторами определение отношения горизонтального (или вертикального) диаметра экскавации к диаметру ДЗН не всегда правильно, например при косовытянутой форме экскавации.
В группе I отношение Э/Д составляет от 0 до 0,3, в группе II — от 0,4 до 0,6. ДЗН с величиной отношения Э/Д более 0,6 относят к группе III при условии, что экскавация не достигает края ДЗН. Три следующие группы связаны с экскавацией краевого типа. Группа IV характеризуется ограниченным (до половины окружности) прорывом экскавации к краю ДЗН. В таких случаях всегда обнаруживают дефекты центрального или периферического поля зрения в секторе, соответствующем «прорыву» экскавации. В группу V включены краевые субтотальные экскавации. Ткань ДЗН сохраняется только на небольшом протяжении с носовой стороны. Тотальные экскавации с величиной отношения Э/Д 1,0 отнесены к группе VI.
Следует подчеркнуть, что упомянутые величины отношения Э/Д относятся к так называемой экскавации по конфигурации. При этом край экскавации определяют по изгибу сосудов, а при бинокулярном осмотре — по стереоскопическому эффекту. Для экскавации характерно также побледнение ткани. Диаметр зоны побледнения может совпадать с диаметром экскавации, но иногда значительно меньше. В настоящей классификации размер зоны побледнения не принимается во внимание.
Край экскавации может быть: пологим, крутым, подрытым. Обычно носовой и височный края экскавации отличаются друг от друга. Состояние носового края не имеет существенного значения в диагностике и определении прогноза заболевания. Он нередко бывает подрытым, даже в нормальных глазах. В связи с этим мы принимаем во внимание состояние только височного края.
Точное измерение глубины экскавации связано со значительными трудностями. По этому признаку мы сочли возможным разделить экскавации ориентировочно на мелкие, средней глубины и глубокие. В первом случае экскавация выглядит мелкой, во втором — глубокой, но не достигает решетчатой пластинки, в последнем случае на дне экскавации видны элементы решетчатой пластинки.
Таким образом, в классификации отражены следующие признаки: форма, или тип, экскавации (А, В, С), ее относительная величина (I—VI), характер височного края (пологий — 1, крутой —2, подрытый — 3) и глубина экскавации (мелкая, средняя, глубокая). Для сокращения записей в истории болезни можно использовать цифровые и буквенные обозначения. Например, если ДЗН имеет экскавацию правильной формы, глубокую, с крутым височным краем и величиной отношения Э/Д 0,6, то краткая запись будет иметь следующий вид: Э: А—I—(2) — глубокая.
По нашим данным, в здоровых глазах (201) экскавация ДЗН типа А выявлена в 99% случаев, типа С — в 1%, относительный размер экскавации I был отмечен в 50% наблюдений, II — в 47% и III — в 3%. В 70% случаев экскавация была мелкой (или отсутствовала совсем), в 30% — средней глубины или глубокой. Височный край в большинстве наблюдений был пологим. Крутой или подрытый край отмечен только в 16 глазах, или 27% от всех случаев экскавации средней глубины или глубокой. В 193 глаукоматозных глазах (неотобранный контингент) экскавация типа А наблюдалась в 63% случаев, типа В — в 36% и типа С — в 0,5% случаев. Размеры, глубина и характер края экскавации варьировали в зависимости от стадии болезни.
Следует отметить, что в начальной стадии глаукомы в большинстве случаев по состоянию ДЗН нельзя было установить правильный диагноз. В этом отношении большое значение имеет сравнение состояния ДЗН в двух глазах и динамическое наблюдение за ДЗН в течение продолжительного времени.
Глаукома приводит к постепенному поражению всех зрительных функций, но наиболее информативны изменения поля зрения. Их можно разделить на диффузные и фокальные. Диффузные изменения заключаются в общем снижении дифференциальной световой чувствительности всей или значительной части сетчатки. Однако наиболее характерны для глаукомы фокальные дефекты, вызванные поражением отдельных пучков нервных волокон. Аксоны ганглиозных клеток сетчатки в зрительном нерве группируются в отдельные пучки, каждый из которых выходит из глаза через отдельный канал в решетчатой пластинке склеры. Поражение одного или нескольких таких пучков приводит к образованию фокальных дефектов (скотом) в поле зрения.
При глаукоме наиболее уязвимы дуговые волокна, идущие к зрительному нерву от парацентральных отделов сетчатки (рис. 34).
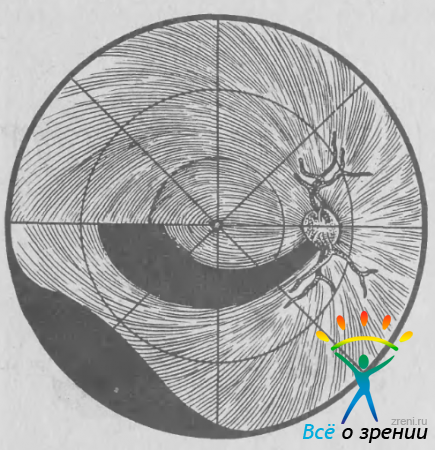
Рис. 34. Ход нервных волокон в сетчатке. Черные участки — волокна, поражение которых характерно для глаукомы.
Они начинаются от горизонтального шва сетчатки в ее височной половине, огибают макулярную зону и формируют группу пучков нервных волокон в верхне- и нижневисочных отделах ДЗН (см. рис. 21, 22). По форме дуговые волокна напоминают веер, широкая часть которого находится у горизонтального шва сетчатки, а узкая — у ДЗН. Непосредственно в ДЗН дуговые нервные волокна находятся в крайне стесненных условиях, будучи отодвинутыми к верхнему и нижнему полюсам ДЗН папилломакулярным пучком, занимающим более 1/3 всего объема головки зрительного нерва. Участок поля зрения, соответствующий дуговым волокнам сетчатки (10—20° от точки фиксации), получил название «зона Бьеррума». Поражение части этих волокон приводит к образованию скотомы, имеющей дугообразную форму. Если поражается весь дуговой пучок, то скотома приобретает форму кометы с широким хвостом, обрывающимся у горизонтального меридиана, и узким противоположным концом, сливающимся со слепым пятном (рис. 35, в).
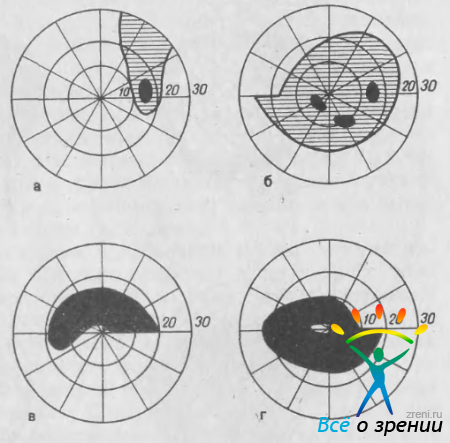
Рис. 35. Изменения центрального поля зрения при глаукоме. а — симптом обнажения слепого пятна; б — пара-центральные скотомы; в — дуговая скотома; г — кольцевая скотома.
Одновременное поражение верхнего и нижнего пучков приводит к образованию кольцевой скотомы (рис. 35, г).
Дугообразные скотомы при глаукоме впервые описаны A.Graefe (1856) и детально изучены J.Bjerrum (1880). В типичных случаях скотома Бьеррума связана с верхним или, реже, с нижним полюсом слепого пятна (либо с обоими полюсами). S.Drance (1969) отмечает, что скотома Бьеррума никогда не вырастает из слепого пятна, а соединяется с ним позднее. Однако она может образоваться не сразу, а в результате слияния мелких парацентральных скотом. Дугообразные скотомы могут быть относительными и абсолютными. В последнем случае область абсолютного выпадения поля зрения бывает окружена зоной относительного дефекта. Как уже отмечалось, дугообразные скотомы, распространяясь в носовую сторону, могут доходить до горизонтального меридиана, но никогда за него не проходят. В тех случаях, когда скотомы идут от верхнего и нижнего полюсов слепого пятна, они образуют одну кольцевую скотому, которая обычно бывает шире с верхней или, реже, с нижней стороны, образуя в носовой части центрального поля зрения своеобразную ступеньку (см. рис. 35, г). Дугообразная скотома, связанная со слепым пятном, может в дальнейшем слиться с периферическим дефектом поля зрения. Такое состояние называют «прорывом» слепого пятна на периферию.
Другая особенность изменений поля зрения при глаукоме связана с общей и локальной депрессией изоптер. Общая депрессия заключается в сужении как центральных, так и периферических изоптер. Локальная депрессия проявляется в обнажении слепого пятна, образовании назальной ступеньки и сужении периферических границ поля зрения с носовой стороны.
Обнажение слепого пятна — одно из ранних изменений поля зрения при глаукоме (рис. 35, а). Этот симптом был описан H.Roenne (1909). Он является следствием неравномерного сужения изоптер в парацентральной области. При исследовании центрального поля зрения малым объектом (1 /1000, 2/1000) обнаруживают дефект поля, идущий от периферии и включающий слепое пятно. Для глаукомы характерно слияние только у полюса (обычно у верхнего). Если повторить исследование с большим объектом, то дефект поля зрения, который носил относительный характер, не выявляется.
В верхне- или нижненосовой части поля зрения у некоторых больных обнаруживают характерный относительный дефект, имеющий вид ступеньки с ровной нижней границей, идущей по горизонтальному меридиану. Выступ может захватывать и периферические изоптеры (рис. 35, б). Этот дефект получил название «назальная ступенька» [Roenne Н., 1909]. Возникновение его связано с локальной депрессией изоптер в верхне- или нижненосовом сегменте.
Сужение границ поля зрения в глаукоматозном глазу сначала удается выявить только с помощью квантитативной периметрии, а значительно позднее — надпороговой периметрии. Следовательно, вначале наблюдается сужение изоптер и только позднее появляется полный дефект периферического поля зрения. Оно изменяется во всех направлениях, но не в одинаковой степени. Сужение поля зрения больше выражено в носовой половине, особенно часто в верхненосовом секторе (рис. 36, а).
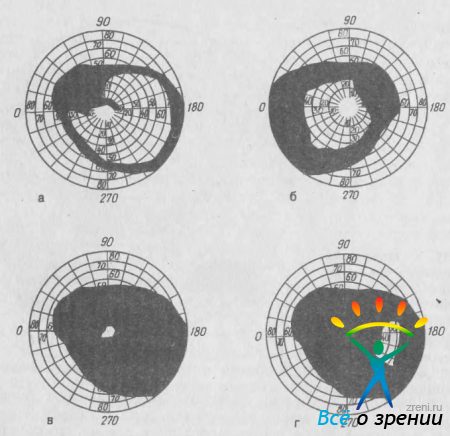
Рис. 36. Изменения периферического поля зрения при глаукоме. а — сужение поля зрения с носовой стороны, прорыв скотомы Бьеррума на периферию; б — концентрическое сужение; в — трубочное поле зрения; г — остаточный островок поля зрения.
В дальнейшем сужение поля зрения все больше приобретает концентрический характер (рис. 36, б). В поздних стадиях можно отметить два типа изменений поля зрения: у одних больных в течение некоторого времени сохраняется трубочное центральное зрение (рис. 36, в), у других островок зрения располагается эксцентрично в височной части поля зрения (рис. 36, г).
Один из ранних симптомов глаукомы — возникновение дефектов пространственной и временной контрастной чувствительности глаза. При исследовании пространственной контрастной чувствительности больному предъявляют полосчатые синусоидальные стимулы определенной частоты (количество полос в 1°) с постепенно увеличивающимся контрастом [Arden G., 1978]. Контрастная чувствительность при глаукоме страдает больше, чем острота зрения, а иногда и раньше, чем поле зрения. J. Ross и соавт. (1984) установили, что наибольшей чувствительностью обладает частота, равная 2,9 циклов на 1°, При глаукоме рано нарушается и временная пространственная чувствительность, измеряемая частотой стимулов в единицу времени. По наблюдениям Н. Н. Пивоварова и Л. А. Малановой (1976), при использовании аппарата с модулированной яркостью мелькающего объекта симптомы атрофии папилломакулярн

