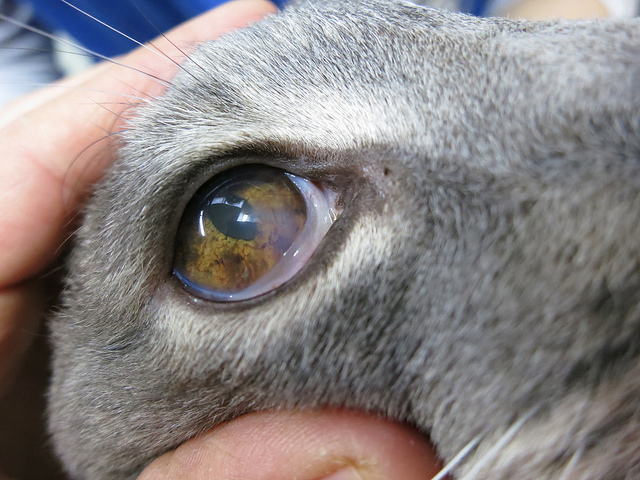
Мазок отпечаток с роговицы

Динамика морфологических изменений отдельных тканей и клеток после наступления смерти имеет значение для установления ее давности в комплексе с другими судебно-медицинскими и следственными данными.
Наиболее важным объектом для изучения этого процесса является роговица. Это обусловлено тем, что эпителиальные клетки поверхностного её слоя при гниении постоянно подвергаются десквамации с последующим их восстановлением (в течение до 10 дней). После наступления смерти происходит более интенсивно десквамация этих клеток. Кроме того, расположение роговицы создает удобства для её исследования на трупе. Она состоит из пяти слоев: поверхностного -неороговевающего эпителия, передней пограничной (боуменова) мембраны, собственного вещества или соединительнотканной стромы роговицы, задней пограничной мембраны (десцеметова) и эпителия задней поверхности роговицы. Толщина ее 0,8-0,9 мм в центре и 1,1 мм по периферии.
Поверхностный эпителиальный слой роговицы состоит из 5-6 слоев клеток многослойного неороговевающего эпителия (толщиной 50 микрон): плоских шиповатых и базальных. Последние цилиндрической формы образуют один слой на базальной мембране. Они обладают способностью заменять отмирающие и отпадающие с поверхности роговицы плоские эпителиальные клетки. Следующий слой — шиповатых, неправильной многоугольной формы с отростками, вдающимися между апикальными концами клеок базального слоя, их называют крылатыми. Они располагаются в 3—4 слоя. Верхние слои эпителия роговицы составляют плоские клетки 1-2 ряда. Они постепенно отмирают и десквамируются с поверхности. Это явление относят к физиологической регенерации. Цитологическим исследованием десквамации клеток поверхностного эпителия роговицы трупов установлена закономерность этого процесса, который находится в зависимости от времени наступления смерти.
На значительном фактическом экспериментальном (глазах обезьян е овец) и секционном материале (трупов лиц 18-55 лет, погибших от механической травмы и находившихся при температуре 16-18° окружающего воздуха) нами разработана следующая методика цитологического исследования десквамированных клеток поверхностного эпителия. Необходимо изготовить на обезжиренных предметных стеклах отпечатки с центральной части роговицы на участке 0,3-0,4 см в диаметре (предварительно веки разводятся пальцами или векорасширителями). После высыхания на воздухе их следует фиксировать в метиловом спирте или смеси Никифорова в течение 10 минут. Окрашивание их производится раствором краски Романовского-Гимза из расчета 30 капель но 10 мл дистиллированной воды в течение 30-40 минут, или раствором этой краски с дистиллированной водой в соотношении 1:2 в течение 5-7 минут, a 1:1 — 3,5 минут. Лучшие результаты окрашивания бывают, когда применяют меньшую концентрацию краски. Затем краска смывается водопроводной водой, мазок просушивается на воздухе и он готов для микроскопического исследования.
Цитологическая картина отпечатка роговицы
В первые 1-2 часа после наступления смерти в поле зрения обнаруживаются единичные (2-3) десквамированные плоские клетки поверхностного слоя эпителия роговицы, расположены, в основном раздельно. Они четко сохранят свою структуру — овальной, полигональной формы с четкими контурами. Их ядро фиолетового цвета с хорошо выраженными ровными контурами.
Через 3-4 часа — количество плоских полигональный клеток в отпечатке увеличивается до 3-5 в поле зрения. Местами они расположены по 2-3 клетки. Структура их выражена сравнительно хорошо.
К 5-7 часам в поле зрения обнаруживаются дс 6-15 клеток, расположенных преимущественно скоплениями. Среди полигональных клеток видно и немного крылатых клеток. Они с угловатыми очертаниями, розоватой цитоплазмой и фиолетовым ядром. У некоторых клеток ядра имеют более интенсивную окраску (начинающийся пикноз). Местами клетки сливаются и потому незаметны их контуры.
К 8-11 часам — в поле зрения 16-30 крылатых и полигональных клеток, преобладают крылатые, многие из них с темными ядрами и меньших размеров по сравнению с предыдущими сроками. Большая часть клеток слившиеся в виде пласта.
К 12-17 часам — клеток много, занимают почти всё поле зрения, границы их в большинстве случаев неразличимы, ядра преобладают пикнотичные. Цитоплазма в виде общей массы светлорозового цвета. В отдельных клетках ядра увеличены и более светлые (лизис).
К концу суток после смерти постепенно начинают преобладать клетки со светлыми и увеличенными ядрами, контуры их к этому сроку плохо выражены, большая часть их находятся в состоянии лизиса.
Они располагаются большими скоплениями, занимающими почти все поле зрения.
Через 2 суток все поле зрения покрыто слившимися клетками с бледными ядрами с неровными контурами и с мелкими вакуолями. Лизис ядер постепенно усиливается и к 3 суткам контуры их плохо различимы, к 4-5 суткам они представляются в виде «теней», а к 7 суткам они уже не видны.
Наблюдаемые изменения клеток роговицы более четко выражены при закрытых глазах трупа, вследствие мацерации от наличия жидкости под веками. При открытых глазах преобладает процесс подсыхания поверхности роговицы и поэтому в первую половину суток десквамация клеток несколько замедляется.
Установленная динамика морфологических изменений (количественных и качественных) клеток эпителия роговицы трупов лиц 18-55 лет, погибших от механической травмы и находившихся при температуре 16-18 С окружающего воздуха, в зависимости от времени, прошедшего с момента смерти до исследования трупа, может оказать помощь при определений давности наступления смерти с учетом и других судебно-медицинских и следственных данных. Метод отпечатков роговицы особенно важно применять при осмотре трупа на месте его обнаружения в первые сутки после наступления смерти.
Главный судебно-медицинский эксперт
В.О. Плаксин
Источник
Техника забора материала для бакпосева с глаз. Методы исследования глазных мазков
При заборе клинического материала от больного и при последующей работе с ним необходимо помнить о потенциальной опасности любых биологических материалов, полученных от инфекционных больных. Использование защитной спецодежды, как минимум, перчаток и халата, а в случае возможности возникновения аэрозолей — защитных очков или масок, является обязательным. Направляемый на исследование заразный материал должен быть соответствующим образом упакован для предотвращения заражения окружающих и контаминации самого материала посторонними биологическими агентами. На каждую пробу, направляемую в лабораторию, заполняется соответствующее направление.
При определении перечня необходимых лабораторных исследований учитывают необходимость этиологической расшифровки диагноза и установления ведущих патогенетических звеньев данного заболевания, а также предполагаемый дифференциальный диагноз.
Забор клинического материала следует производить до назначения антимикробных (антибактериальных или противовирусных) препаратов. Основное внимание необходимо обратить на получение материала из основного очага локализации предполагаемого возбудителя. Кратность проведения исследования зависит от метода исследования, сроков забора материала, особенностей заболевания и т. д. Количество клинического материала определяется выбором методов исследования и разумной достаточностью, поскольку недостаточное количество материала может определять ложноотрицательный результат.
При взятии материала приготавливают мазки для первичной бактериоскопии и производят высевы на сывороточный и тиогликолевый бульоны (2 пробирки). Мазки высушивают, стекло маркируют. Нативный материал (тампон с материалом в пробирке) и посевы доставляют в лабораторию для дальнейшего бактериологического исследования.
Методы исследования глазных мазков
Проведение традиционных бактериологических исследований при инфекционных поражениях глаз не отличается от аналогичных исследований при бактериальных инфекциях другой локализации.
Для диагностики вирусных инфекций наряду с традиционными иммунологическими исследованиями с целью обнаружения специфических антител чаще всего используют метод флюоресцирующих антител. Материалом для исследования являются соскобы конъюнктивы или эпителия роговицы.
Вирусный антиген обнаруживается в соскобах эпителия конъюнктивы и роговицы больного глаза при поверхностных и глубоких кератитах, при иридоциклитах. Специфическое свечение в ряде случаев может выявляться даже у реконвалесцентов, перенесших вирусную инфекцию с поражением глаз.
В повседневной практике применяют как прямой, так и непрямой метод флюоресцирующих антител. Непрямой метод не уступает прямому в частоте выявления вирусного антигена, однако при нем фоновое свечение и неспецифическая флюоресценция выражены сильнее, что затрудняет оценку результатов. Использование специфических антител позволяет проводить серотипирование возбудителя без выделения самого вируса.
Еще одним методом диагностики вирусных поражений органа зрения является традиционная реакция непрямой гемагглю-тинации. В качестве метода экспресс-диагностики она может быть использована, например, для диагностики герпетических поражений глаза, особенно на поздних этапах заболевания. Для анализа получают небольшое количество слезной жидкости, в которой определяют наличие антигена вируса герпеса. Для РНГА используют герпетический гамма-глобулиновый эритроцитарный диагностикум.
Метод выделения вируса может быть использован только при наличии специальной вирусологической лаборатории. Он дорогостоящ, занимает достаточно длительное время и требует высокой квалификации специалистов. В качестве исходного материала могут использоваться смывы с конъюнктивы, соскобы с конъюнктивы и роговицы, мазки-отпечатки и т. д.
Цитологический метод исследования глазных мазков. Исследование фиксированных и окрашенных соскобов конъюнктивы и роговицы может служить вспомогательным методом в диагностике вирусных поражений глаз. Одновременно отмечается усиление амитотического деления эпителиальных клеток и появление многоядерных клеток. При этом регулярно отмечаются базофилия их цитоплазмы, наличие внеклеточного детрита. Внутриядерные включения были описаны в роговичных соскобах кроликов, зараженных вирусом простого герпеса.
Определенные трудности связаны с диагностикой паразитарных заболеваний глаза. Так, при онхоцеркозе используют обнаружение микрофилярий в срезах кожи, в тканях и средах глаза, в моче и крови. Выявление паразитов в глазу позволяет установить диагноз и оценить тяжесть поражения органа зрения и при других паразитарных заболеваниях. Для диагностики ряда паразитарных инвазий применяют внутрикожные пробы (лоаоз и др.).
Серологические методы исследования глазных мазков позволяют выявить в сыворотке крови специфические антитела. Определенное диагностическое и прогностическое значение имеет изучение иммуноглобулинов в слезной жидкости.
В большинстве случаев диагностика инфекционных поражений органа зрения проводится в соответствии с рекомендациями, приведенными в указаниях и рекомендациях по диагностике той или иной конкретной инфекции с обязательными дополнительными исследованиями биологических материалов, полученных при проведении осмотра пораженного глаза.
— Также рекомендуем «Жалобы больных при заболеваниях глаз. Зрительные расстройства — нарушения зрения»
Оглавление темы «Заболевания глаз»:
- Преднизолон, дексаметазон в лечении эндокринной офтальмопатии
- Дипроспан, пульс-терапия эндокринной офтальмопатии
- Циклоспорин, плазмаферез при эндокринной офтальмопатии
- Гемосорбция при эндокринной офтальмопатии. Лечение псевдотумора
- Лечение гранулематоза Вегенера, химиотерапия опухолей орбиты глаза
- Клинические методы исследования глаз
- Техника забора материала для бакпосева с глаз. Методы исследования глазных мазков
- Жалобы больных при заболеваниях глаз. Зрительные расстройства — нарушения зрения
- Жалобы на боль в глазу. Причины глазных болей
- Жалобы на покраснение, появление отделяемого из глаз, светобоязнь, слезотечение
Источник
В настоящее время для определения этиологии конъюнктивитов и кератитов применяют следующие методы лабораторной диагностики:
- непосредственное определение возбудителя в соскобе (цитологический метод с окраской по Романовскому и по Граму, иммуноферментный, иммунофлюоресцентный, полимеразная цепная реакция — ПЦР);
- выделение хламидий и микоплазм в культуре клеток — культуральный метод, который считается эталонным;
- серологические тесты.
Результаты лабораторной диагностики зависят от тщательности выполнения процедуры забора патологических клеток конъюнктивы или роговицы. Применяют соскобы с конъюнктивы и мазки-отпечатки с конъюнктивы и роговицы.
Для забора соскобов необходимы следующие манипуляции: после эпибульбарной однократной анестезии с конъюнктивы верхнего и нижнего века с помощью одноразовых зондов-пробоотборников забирают клетки с патологически измененной конъюнктивы. Материал наносят на обычные предметные стекла, сушат в течение 8-10 мин на воздухе и фиксируют ацетоном, после чего предметные стекла с фиксированным материалом рекомендуется в течение 1 ч транспортировать в микробиологическую лабораторию.
Мазки-отпечатки берут с конъюнктивы нижнего века или роговицы, что позволяет повысить достоверность лабораторной диагностики. С помощью пинцета покровную пластинку прижимают к конъюнктиве век, глазного яблока или непосредственно к роговице после эпибульбарной анестезии любым анестетиком. Затем мазок-отпечаток сушат на воздухе в течение 5 мин и фиксируют метиловым спиртом. Транспортировку материала необходимо осуществлять в течение 1 ч после его забора.
Цитологический метод. Этот простой и доступный метод при острых или хронических конъюнктивитах дает много дополнительной информации для уточнения этиологии воспалительного процесса. При использовании специальных окрасок (по Граму и Романовскому) можно выявить хламидийные включения, разнообразную бактериальную флору, мицелий грибов, воспалительные клетки, измененные ядра и цитоплазму клеток конъюнктивы и роговицы. Диагностическая ценность данного метода зависит от внимательности исследователя.
Для бактериальных конъюнктивитов характерны обнаружение большого количества нейтрофилов, отсутствие изменений эпителиальных клеток. При вирусных конъюнктивитах обнаруживают дистрофические изменения эпителиальных клеток. В экссудате преобладают лимфоциты и макрофаги. При аллергических конъюнктивитах в экссудате преобладают эозинофилы и базофилы.
Прямая иммунофлюоресценция — достоверный и специфичный метод. Соскобы с конъюнктивы глаза окрашивают родоспецифическими моноклональными антителами хламидий, вируса простого герпеса типа 1 и 2, аденовируса. Данные антитела представляют собой моноклональные мышиные антитела, специфичные к определенному антигену. При люминесцентной микроскопии хламидий и вирусы выявляются либо в пораженных клетках в виде характерных цито-плазматических включений, окрашенных в зеленый цвет, либо внеклеточно в виде отдельных образований, окрашенных в ярко-зеленый цвет.
Культуральный метод является дорогостоящим и трудоемким. К отрицательным сторонам этого метода следует отнести длительность культивирования (48—52 ч). Однако возможность получения четких результатов даже при минимальном присутствии микрофлоры является важным преимуществом культурального метода.
Для идентификации и дифференциального титрования микоплазм используют специальный набор. Данная методика позволяет культивировать, а также идентифицировать микоплазмы. Идентификация и титрование микоплазм основаны на специфических свойствах мик-роорганизма, который гидролизует мочевину (Ureaplasma urealiticum) или аргинин (Ureaplasma hominis). При этом образуется ион аммония и происходит защелачивание среды. Вследствие этого изменяется цвет индикатора кислотности среды, что позволяет визуализировать реакцию. Титр микоплазм выражается в количестве единиц изменения цвета (ЕИЦ) на 1 мл пробы. Культивирование позволяет определить титры порядка 103/мл, которые уже считаются патогенными.
ПЦР позволяет непосредственно определить специфический участок последовательности ДНК для любого известного микроорганизма и вируса.
Серологические методы имеют второстепенное значение. Используют различные иммунные реакции, оценивается диагностический титр (1/64). Но даже при достоверно положительном титре для определенной инфекции в сыворотке крови невозможно установить локализацию патологического процесса и достоверно определить стадию заболевания.
В стадии разработки находится метод определения иммуноглобулинов различных классов в слезной жидкости. Обсуждается вопрос диагностической ценности этого метода и его помощи в постановке диагноза хламидийного поражения органа зрения. Чаще всего иммуноферментным методом определяют секреторные иммуноглобулины класса А и G. Считается, что появление в слезной жидкости иммуноглобулинов различных классов связано с несколькими причинами. Во-первых, это транссудация их из крови, во-вторых, активизация локального иммунитета непосредственно в органе зрения.
Проводят забор слезной жидкости с последующим проведением серологического анализа.
Методика забора слезной жидкости
Для забора слезной жидкости может быть использован пипеточный дозатор. Слезную жидкость собирают в стерильные пробирки Эпиндорфа. С помощью пластиковой насадки, которая имеет округлый край и закрепляется на пипеточном дозаторе, из нижнего конъюнктивального мешка собирают слезную жидкость. Предварительную эпибульбарную анестезию конъюнктивы и глазного яблока не проводят. Не рекомендуется использовать какие-либо химические вещества, стимулирующие слезоотделение. Пациентов просят смотреть кверху во время всей процедуры. Слезная жидкость собирается в течение 7—15 мин из нижнего конъюнктивального мешка обоих глаз, достаточно около 1 мл слезной жидкости. Биологический материал не позднее 2 ч после забора при комнатной температуре необходимо транспортировать в иммунологическую лабораторию.
Серологический анализ слезной жидкости включает определение чаще всего иммуноглобулинов класса А и G. Используют метод иммуноферментного анализа (ИФА), который обладает высокой специфичностью и чувствительностью. Чаще всего диагностический титр в таких тест-системах составляет 1/32. Соответственно результаты с титром менее 1/32 считаются отрицательными для определения антител к IgA и IgG.
Источник