Конфокальная микроскопия роговицы при глаукоме
В статье приведены результаты исследования морфологических изменений при глаукоме на фоне повышенного ВГД и при длительной гипотензивной терапии по результатам конфокальной микроскопии роговицы
Глаукома – это хроническое заболевание, одним из главных симптомов которого является повышение ВГД. Повышенный уровень ВГД при глаукоме является также важнейшим патогенетическим фактором развития глаукомной оптической нейропатии, что определяет необходимость лечебных мероприятий с целью достижения гипотензивного эффекта. Лечение пациентов, как правило, начинается с медикаментозной терапии [1].
Существует определенный диапазон значений ВГД, индивидуальный для каждого пациента, в пределах которого колебания ВГД не приводят к снижению зрительных функций [2, 3]. Для поддержания ВГД на безопасном для каждого конкретного пациента уровне требуется постоянное применение антиглаукомных гипотензивных препаратов на протяжении многих лет и в ряде случаев – в течение всей жизни.
Однако антиглаукомные препараты за небольшим исключением содержат в своем составе консерванты, причем наиболее часто используемым из них является бензалкония хлорид (БАХ). Это высокоэффективный консервант, который обладает способностью растворять стенки бактерий, благодаря чему в низких концентрациях (от 0,004 до 0,025%) широко используется в составе различных глазных капель. Однако действие БАХ является недостаточно специфичным. БАХ является катионным детергентом, поверхностно активным веществом (ПАВ), обладает способностью снижать поверхностное натяжение на границе водной и жировой фаз, что дает возможность четко разделенным фазам «проникать» друг в друга, т. е. растворяться. С липидами, белками, каротиноидами и другими нерастворимыми в воде веществами детергенты образуют смешанные мицеллы, способствуя тем самым переходу этих веществ в раствор. Данный механизм объясняет непосредственное разрушающее действие БАХ на липидный слой слезной пленки, вследствие чего нарушается ее структура, увеличивается испарение ее водной составляющей, снижается ее стабильность [5]. Дестабилизация слезной пленки ведет к нарушению смачиваемости глазной поверхности и снижению ее роли как фактора защиты от воздействия консерванта.
Консервант оказывает также прямое повреждающее воздействие на эпителий глазной поверхности, разрушая плазмолемму, вызывая гибель клеток и нарушение барьерных функций переднего эпителия. Все это лежит в основе нежелательных побочных эффектов при длительном применении глазных капель [4].
Непосредственное токсическое воздействие БАХ на клетки эпителиального слоя глазной поверхности связано с его способностью связываться с белками клеточных мембран.
В результате этого взаимодействия мембранные белки переходят в раствор в виде комплексов с детергентом, в состав которых также входят связанные с белками молекулы липидов. При разрушении липидных комплексов клеточных мембран повышается их проницаемость, образуются дефекты, нарушается ионное равновесие. Возникают отек клеток, повреждение внутриклеточных структур, что может вести к их гибели [1, 6].
Воздействие БАХ не ограничивается зоной поверхностного слоя эпителия – он в значительной степени накапливается во всех слоях роговично-конъюнктивального эпителия и строме роговицы, в меньшей степени – в радужной оболочке, хрусталике, сосудистой оболочке и сетчатке глаза. Присутствие БАХ определялось в данных структурах в течение 1 нед. после его применения [7, 8]. Необходимо отметить и раздражающий эффект данного консерванта. Нередко он может быть причиной воспалительных и иммуно-аллергических реакций [9].
Негативный эффект воздействия БАХ на эпителий конъюнктивы проявляется и в снижении плотности бокаловидных клеток. Нарушение дифференцировки клеток переднего эпителия может привести к их полному исчезновению, следствием чего является недостаточность муцинового слоя слезной пленки [10].
Разрушение слезной пленки в совокупности с цитотоксическим действием консерванта и нарушением структуры эпителиального слоя глазной поверхности обычно протекает по типу синдрома «сухого глаза». Побочные эффекты, связанные с длительным применением антиглаукомных препаратов, могут приводить к ухудшению их переносимости и потенциально снизить гипотензивный эффект лечения.
Регистрация изменений глазной поверхности, возникающих под воздействием консервантов антиглаукомных препаратов, важна и необходима для оценки степени морфологических нарушений, уточнения причин появления субъективного и зрительного дискомфорта, а также для оценки эффективности лечебных мероприятий. Контроль состояния глазной поверхности возможен с помощью метода конфокальной микроскопии. Данный метод прижизненной микроскопии роговицы обеспечивает визуализацию всех ее слоев и выявление характерных изменений при различных заболеваниях и воздействии различных неблагоприятных факторов [11–13]. Однако вариантов течения заболевания и медикаментозного режима при глаукоме достаточно много, кроме того, на результаты конфокальной микроскопии могут влиять возрастные изменения.
Для объективной оценки морфологических изменений под воздействием антиглаукомных препаратов на первом этапе исследований необходимо выявить исходное состояние всех слоев роговицы до назначения гипотензивной терапии.
Цель работы: с помощью метода конфокальной микроскопии оценить морфологические изменения роговицы до назначения гипотензивной терапии на фоне повышенного ВГД и при его компенсации на фоне длительного применения антиглаукомных препаратов.
Материал и методы
Было обследовано 42 (84 глаза) пациента с глаукомой, возраст больных – от 52 до 74 лет. Пациенты были разделены на 2 группы: 1-я включала 20 первичных больных (40 глаз), которые не использовали антиглаукомные препараты. 2-ю группу составили 22 пациента (44 глаза) с различным стажем (от 2 мес. до 17 лет) использования антиглаукомных препаратов, содержащих БАХ.
Исследование было выполнено на конфокальном микроскопе Confoscan-4 фирмы Nidek (Япония).
Результаты и обсуждение
На основе анализа результатов конфокальной микроскопии были выявлены характерные морфологические изменения в слоях роговицы при первичном обследовании пациентов с первичной открытоугольной глаукомой на фоне повышенного ВГД и после длительной гипотензивной терапии препаратами, содержащими БАХ. В регистрируемых изменениях роговицы прослеживается определенная закономерность. При обследовании пациентов с первично выявленной глаукомой (без медикаментозного режима) было выявлено, что основные изменения, определяемые при конфокальной микроскопии роговицы, локализуются в средних и задних слоях стромы (рис. 1).

Эпителий остается достаточно сохранным, в ряде случаев отмечали небольшую эпителиопатию. Практически неизменной оставалась и архитектоника субэпителиального нервного сплетения.
Изменения в передней строме – незначительные и непостоянные. Может наблюдаться умеренное снижение прозрачности межклеточного матрикса. Границы ядер кератоцитов остаются четкими, степень их рефлективности – в пределах нормы. Изменения стромы нарастают по направлению к ее средним слоям. В средних слоях регистрируются явные признаки отека: диффузное снижение прозрачности межклеточного матрикса, в результате чего границы клеточных структур становятся размытыми, нечеткими.
В задней строме, особенно в зоне, прилежащей к десцеметовой мембране, наблюдаются изменения в виде характерного свечения – проявление эффекта отражения света от слоя эндотелия. Согласно законам оптики, повышенный световой рефлекс от более оптически плотного слоя эндотелия проявляется светорассеиванием в предлежащих слоях стромы роговицы. Повышению уровня светорассеивания способствует отек межуточного вещества в средних и задних слоях стромы роговицы вследствие нарушения водного баланса.
Изменения со стороны эндотелия незначительны, плотность клеток соответствовала возрастной норме. Можно отметить умеренно выраженные явления поли- и плеоморфизма и полимегатизма. В 56% случаев были выявлены локальные изменения в виде расширенных межклеточных контактов, контурирование ядер эндотелиоцитов, нарушение рельефа клеточного слоя и неравномерного светового рефлекса с поверхности клеточных мембран.
Таким образом, при глаукоме на фоне повышенного ВГД основные изменения были отмечены в средних и задних слоях стромы роговицы.
В данной работе были обследованы пациенты с различной длительностью глаукомного процесса с целью оценки степени морфологических нарушений и их зависимости от стажа заболевания и использования антиглаукомных средств.
Обследование пациентов на фоне длительного медикаментозного режима при компенсированном ВГД выявило также определенную закономерность с максимальными изменениями морфологической картины эпителия и передних слоев стромы (рис. 2, выделено красным).

Морфологические нарушения со стороны эпителия роговицы выражены в различной степени в зависимости от длительности применения антиглаукомных препаратов. Нарушены структура, ход и взаиморасположение нервов субэпителиального нервного сплетения.
Максимальные изменения можно наблюдать в передних слоях стромы роговицы, видны явные нарушения структуры, уменьшается количество кератоцитов, происходит резкое снижение прозрачности вещества роговицы. Состояние же средней и задней стромы по сравнению с микроскопической картиной, получаемой при некомпенсированном ВГД и отсутствии медикаментозного режима, на фоне использования гипотензивной терапии улучшается. Уменьшается световой рефлекс от слоя эндотелия, что свидетельствует о снижении степени светорассеивания в предлежащих слоях стромы, а значит, об уменьшении степени отека. Это свидетельствует о том, что на фоне медикаментозного режима происходит стабилизация метаболических процессов в роговице. Эндотелий остается достаточно сохранным, по данным конфокальной микроскопии претерпевает незначительные изменения, т. е. выдерживает и высокое давление, и длительный медикаментозный режим.
Со стороны эпителия роговицы наблюдали нарастание явлений эпителиопатии по мере увеличения длительности заболевания и медикаментозного режима.
В данной работе были обследованы пациенты с различной длительностью глаукомного процесса с целью оценки степени морфологических нарушений и их зависимости от стажа заболевания и использования антиглаукомных средств.
В результате применения медикаментозного режима в течение 2-х мес. при глаукоме эпителий претерпевает незначительные изменения, структура поверхностного слоя в целом сохранена, границы клеток различимы, ядра достаточно четкие. Через 1 год появляются характерный отек эпителиоцитов и нарушение межклеточных контактов. Через 5 лет может быть выявлен другой вариант эпителиопатии – поверхностный слой эпителия представлен слоем полиморфных клеток, ядра которых не визуализируются. Их строение не является характерным для данного слоя, а больше соответствует морфологии клеток промежуточных слоев эпителия.
Через 15 лет эпителиопатия проявлялась увеличением размера ядер и повышенной десквамацией клеток. Через 17 лет медикаментозного режима эпителий приобретает черты кератинизирующего эпителия с уплотненной поверхностной плазмолеммой и пониженной прозрачностью. Более выраженными становятся клеточный полиморфизм, расширение межклеточных контактов (рис. 3).

Изменения в передней строме роговицы также прогрессировали по мере увеличения стажа заболевания с применением гипотензивных препаратов. После 2-месячного медикаментозного режима можно отметить умеренную степень дезорганизации структуры стромы, но границы ядер кератоцитов оставались достаточно четкими, не было выраженного снижения прозрачности межуточного вещества. Через 1 год имеют место снижение четкости микроскопической картины, прозрачности межклеточного вещества, изменение пространственной ориентации, четкости очертаний и формы ядер кератоцитов. В дальнейшем происходило нарастание изменений в виде «гомогенизации» и потери клеточности стромы, результатом чего являлись резкое снижение прозрачности, прогрессирующее снижение количества визуализируемых ядер кератоцитов (рис. 4).

Таким образом, результаты исследований свидетельствуют о том, что при повышении ВГД нарушается водный баланс стромы роговицы, возникают морфологические нарушения с признаками хронического отека преимущественно задних и средних слоев стромы.
Проникновение жидкости в строму роговицы ограничено 2 структурными элементами: передним и задним эпителием, специфические функции которых обеспечивают ее водный баланс.
В соответствии со своей функцией в качестве барьера передний эпителий роговицы отличается наличием плотных межклеточных контактов, относительно низкой ионной проводимостью через его апикальные клеточные мембраны и высоким сопротивлением парацеллюлярному транспорту.
Плотные контакты (tight junction) между эпителиальными клетками образуют барьер, значительно ограничивающий поступление воды из слезной пленки в строму. Водный баланс обеспечивается эпителиальным транспортом ионов натрия и хлора. В естественных условиях важность этого транспорта в поддержании нормальной толщины и прозрачности роговицы минимальна по сравнению с таковым роговичного эндотелия, этот ток жидкости имеет большее значение для обеспечения эпителиального гомеостаза.
Эндотелий представляет собой барьер для проникновения жидкости в роговицу, однако этот барьер неполный (избирательный) – жидкость проникает в строму через слой эндотелия по межклеточным пространствам. Концепция же строго определенного уровня гидратации роговицы, определяющего ее прозрачность, представляет баланс между объемом поступающей в роговицу влаги, в т. ч. и через слой эндотелия, и функцией активного метаболического насоса. Функция метаболического насоса (эндотелиальных помп) обеспечивает активный транспорт ионов. При нормальном функционировании эндотелиальных помп поддерживается постоянное динамическое равновесие между притоком жидкости в строму через эндотелиальный барьер и поступлением воды обратно в переднюю камеру по градиенту осмотического давления [14, 15].
Таким образом, основным механизмом поддержания водного баланса роговицы является перемещение ионов и жидкости из роговицы в переднюю камеру глаза, что обеспечивает отток жидкости из задних слоев стромы и направление ее движения из передних слоев роговицы к ее задним отделам. При некомпенсированном ВГД гидростатическое давление водянистой влаги может создать препятствие для осуществления нормального тока жидкости из роговицы в переднюю камеру через слой эндотелия и усилить ток жидкости через неполный эндотелиальный барьер в роговицу. Одним из факторов накопления жидкости в строме роговицы может быть нарушение функции метаболического насоса в результате давления на клетки эндотелия, что может нарушать их специфические функции.
С учетом направления тока жидкости в строме роговицы от ее передних слоев к задним отделам вполне объяснимым является появление признаков хронического отека в средних и задних слоях при нарушении специфической функции эндотелия, обеспечивающей активный транспорт жидкости из роговицы в переднюю камеру, и гидростатическом сопротивлении влаги передней камеры.
При компенсации ВГД на фоне инстилляций гипотензивных антиглаукомных препаратов работа метаболического насоса нормализуется, что приводит к уменьшению признаков стромального отека в задних и средних слоях. Однако параллельно нарастают патологические изменения в эпителии и передних слоях стромы роговицы, что, по-видимому, связано с токсическим действием консервантов, являющихся составляющей частью медикаментозных средств, используемых при глаукоме.
Заключение
Таким образом, результаты исследований подтверждают необходимость снижения риска возникновения морфологических нарушений в роговице при глаукоме. Наряду со снижением ВГД необходимо минимизировать неблагоприятное воздействие консервирующих агентов. Идеальным является вариант использования бесконсервантных препаратов (Тафлотан, Santen). Возможно применение препаратов с более «мягким» консервантом (пурит, распадается на ионы натрия, хлора, кислород и воду) (Альфаган, Allergan Inc.). Одним из вариантов снижения токсического действия консерванта является введение в состав препарата дополнительных увлажняющих агентов (поливиниловый спирт) (Люксфен®, Bausch & Lomb). Существует еще один путь смягчения действия консерванта – назначение слезозаменителей и/или кератопротекторов дополнительно к медикаментозному режиму пациентов.
Источник
В статье представлены результаты оценки морфологических изменений и уровня светорассеяния роговицы при глаукоме по данным конфокальной микроскопии. Показано, что величина интенсивности светорассеяния может быть использована в качестве дополнительного критерия для оценки морфологических изменений роговицы и эффективности использования медикаментозных средств. Выявлен благоприятный эффект использования слезозаменителя Стиллавит в комбинации с гипотензивными препаратами при глаукоме.
Введение
Роговая оболочка – это высокоорганизованная структура, выполняющая ряд важнейших функций для поддержания полноценной работы глаза как органа, и, вместе с тем, главная преломляющая среда в оптической системе глаза. Традиционно в роговице принято выделять пять слоев: передний эпителий роговицы, переднюю пограничную пластинку (боуменову мембрану), собственное вещество роговицы (строму), заднюю пограничную пластинку (десцеметову мембрану) и задний эпителий роговицы (эндотелий). 90% толщины всей роговой оболочки составляет ее собственное вещество, состоящее из коллагеновых волокон, организованных в стромальные пластины, кератоцитов и внеклеточного матрикса. Благодаря строгой упорядоченности расположения стромальных пластин, их одинаковому диаметру и расстоянию относительно друг друга, а также равномерному распределению внеклеточного матрикса между ними роговица имеет высокую степень прозрачности. Протеогликаны и гликопротеины, представляющие собой основу внеклеточного матрикса стромы роговицы, обеспечивают равномерное распределение ее водной составляющей.
Водный баланс роговицы поддерживается за счет барьерной функции переднего и заднего эпителия. Передний эпителий, являющийся плотным барьером благодаря межклеточным контактам — десмосомам, имеет низкую ионную проводимость и ограничивает поступление воды из прекорнеальной слезной пленки в переднюю строму. Задний эпителий представляет собой неполный барьер, т. е. избирательный, за счет различных типов межклеточных соединений (плотных и щелевидных). Баланс между объемом поступающей в роговицу влаги и ее возвратом обратно в переднюю камеру по градиенту осмотического давления обеспечивается функцией активного метаболического насоса (эндотелиальных помп) [1].
При глаукоме могут иметь место несколько факторов, вызывающих нарушение водного баланса роговицы. Гидростатическое давление водянистой влаги может усилить ток жидкости через неполный эндотелиальный барьер в роговицу, а также создать препятствие для осуществления нормального тока жидкости из роговицы в переднюю камеру через слой эндотелия. В результате избыточного давления на клетки эндотелиального слоя могут возникнуть структурные и функциональные нарушения эндотелиоцитов с дисфункцией метаболических помп, что приводит к набуханию стромы роговицы и возникновению ее отека [2, 3]. Является доказанным и факт снижения плотности, изменения формы клеток эндотелия на фоне глаукомного процесса [4, 5].
Как биологическая ткань роговица относится к слабо рассеивающим (прозрачным) тканям и описывается моделью малократного рассеивания упорядоченной среды с плотной упаковкой рассеивателей, содержащих поглощающие центры [6]. Оптические свойства роговицы определяются строгой ориентацией и упорядоченностью ее структур, расстояние
между которыми не превышает 200 нм (менее половины длины волны), что позволяет световым лучам проходить сквозь все слои роговой оболочки, не отклоняясь, и практически исключает их рассеивание. Степень светорассеяния роговицы в норме очень мала и составляет всего 1%.
Любые изменения морфологии роговичной ткани, в т. ч. нарушение водного баланса, снижают ее анизотропные оптические свойства и приводят к повышению эффекта светорассеяния и снижению прозрачности [6, 7].
При отеке роговицы расстояние между коллагеновыми волокнами увеличивается вследствие накопления воды в строме. Результатом хронического отека являются потеря протеогликанов и агрегация коллагеновых фибрилл. Данные нарушения приводят к появлению оптических неоднородностей, размер которых превосходит половину длины волны света, к дифракции света, увеличению светорассеяния [7].
Компенсация ВГД при глаукоме в большинстве случаев предполагает длительное использование медикаментозных средств, содержащих консерванты. Бензалконий хлорид (БХ), наиболее часто используемый из них, оказывает разрушающее действие на слезную пленку. Токсическое воздействие консерванта не ограничивается эпителиальным слоем глазной поверхности. БХ накапливается в строме роговицы, что может приводить к структурным изменениям при его длительном использовании [8, 9]. С целью защиты глазной поверхности от действия консерванта и снижения его токсического воздействия возможно использование средств слезозаместительной терапии [10–12].
Оценить состояние роговицы и, в определенной степени, возникающие морфологические нарушения в настоящее время возможно с помощью конфокальной микроскопии. Данный метод позволяет также определить уровень светорассеяния роговицы, который зависит от изменений оптической плотности и однородности ее различных слоев [13, 14]. Определение уровня интенсивности светорассеяния может служить дополнительным критерием для регистрации степени морфологических нарушений роговицы и оценки лечебного эффекта от назначаемых медикаментозных средств.
Цель работы: оценить морфологические изменения и уровень светорассеяния роговицы при глаукоме: а) при некомпенсированном ВГД без использования гипотензивных препаратов, б) при компенсированном ВГД на фоне длительного применения антиглаукомных препаратов, в) при использовании средств слезозаместительной терапии в комбинации с гипотензивными антиглаукомными препаратами.
Материал и методы
Всего было обследовано 66 пациентов (132 глаза), из них 46 (92 глаза) больных с глаукомой, возраст – от 40 до 80 лет. Работа была проведена в 2 этапа.
Первый этап работы заключался в обследовании 3 групп пациентов.
1-я группа пациентов была обследована для определения уровня светорассеяния в норме. Данная группа состояла из 20 пациентов (40 глаз) в возрасте от 40 до 70 лет, без признаков глаукомы и каких-либо заболеваний роговицы в анамнезе. 2-я группа включала 22 первичных больных (44 глаза) с некомпенсированным ВГД, у которых диагноз был установлен впервые, и пациенты не использовали антиглаукомные препараты. 3-ю группу обследуемых составили 24 пациента (48 глаз) с различным стажем (от 2 мес. до 17 лет) использования антиглаукомных препаратов, содержащих в качестве консерванта БХ. Обследование в данной группе проводили на фоне компенсированного ВГД.
На втором этапе были обследованы 24 пациента (48 глаз), которым в дополнение к медикаментозному режиму был назначен слезозаменитель Стиллавит (натрия гиалуронат 0,16%, хондроитина сульфат натрия 0,05%, D-пантенол 1%, консервант – тетраборат натрия 0,05%). Инстилляции данного слезозаменителя были рекомендованы за 3–5 мин до закапывания гипотензивных средств. Все пациенты применяли данную комбинацию не менее 3–6 мес. Выбор слезозаменителя был обусловлен его трехкомпонентным составом и комплексным воздействием на ткани глаза. Натрия гиалуронат восстанавливает смачиваемость эпителия роговицы и обеспечивает механическую защиту тканей глаза. D-пантенол (провитамин В5) превращается в живых клетках в пантотеновую кислоту, которая в составе коэнзима А участвует во многих клеточных реакциях, в результате чего ускоряется деление клеток, и эпителизация проходит в более ранние сроки. Хондроитина сульфат натрия снижает активность воспалительного процесса, стимулирует выработку собственных гликозаминогликанов роговицы, которые регулируют процесс заживления и предотвращают излишнее рубцевание и помутнение роговицы.
Конфокальная микроскопия была выполнена на микроскопе Confoscan-4 фирмы Nidek. Уровень интенсивности светорассеяния оценивали во всех слоях роговицы в режиме Z-сканирования на основе анализа денситометрической кривой. Регистрировали минимальные и максимальные значения интенсивности светорассеяния во всех слоях роговицы. Оценивали также величину диапазона между максимальным и минимальным уровнями светорассеяния как косвенный критерий оптической однородности исследуемой зоны роговичной ткани.
Статистическая обработка результатов проводилась с помощью пакета программ SPSS Statistica 17.0 с определением значимости различий по критерию Уилкоксона при связанных выборках и по критерию Манна – Уитни при несвязанных выборках.
Результаты и обсуждение
Исследования с помощью конфокальной микроскопии выявили определенные закономерности морфологических изменений в слоях роговицы при первичном обследовании пациентов на фоне повышенного ВГД и при длительном использовании гипотензивной терапии. Результаты подробно описаны в предыдущей публикации [15].
На первом этапе работы при обследовании пациентов с первично выявленной глаукомой (без медикаментозного режима) основные изменения, определяемые при конфокальной микроскопии, локализовались в средних и задних слоях стромы, что является результатом нарушения водного баланса роговицы. Наиболее характерными были признаки отека с диффузным снижением прозрачности межклеточного матрикса. В задней строме в зоне, прилежащей к десцеметовой мембране, наблюдали появление характерного свечения как следствие эффекта отражения света от слоя эндотелия.
На фоне длительного медикаментозного режима при компенсированном ВГД максимальные изменения морфологической картины были отмечены в слоях эпителия и передних отделах стромы роговицы. Эпителиопатия была выражена в различной степени. В передних отделах стромы наблюдали резкое снижение прозрачности вещества роговицы с тенденцией к уменьшению количества визуализированных ядер кератоцитов. Регистрируемые патологические изменения, по-видимому, связаны с токсическим действием консервантов, являющихся составляющей частью медикаментозных средств, используемых при глаукоме.
Таким образом, на основании результатов конфокальной микроскопии выявлены определенные закономерности морфологических изменений при глаукоме, что дает возможность предположить наличие характерных изменений интенсивности светорассеяния в различных слоях роговицы. Результаты исследования интенсивности светорассеяния при глаукоме на фоне повышенного ВГД и при условии его компенсации на фоне длительного медикаментозного режима (в сравнении с нормой) представлены в таблицах 1, 2.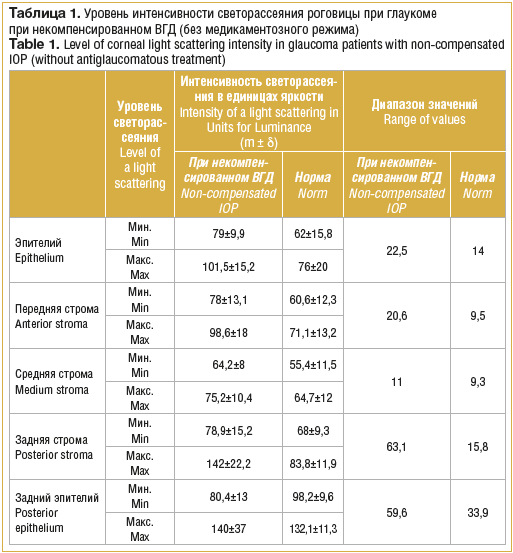
Полученные результаты свидетельствуют о повышении интенсивности светорассеяния при некомпенсированном ВГД во всех слоях роговицы (как минимальных, так и максимальных его значений) по сравнению с нормальными величинами (р<0,05). Незначительное снижение минимального уровня в слое заднего эпителия роговицы было статистически незначимым.
Наибольшие отклонения от нормы максимальной интенсивности светорассеяния наблюдали в задних слоях стромы роговицы, превышение составило 69,5%. Также значительно был превышен данный показатель в слое эпителия (33,5%) и передней строме (38,7%). Зарегистрировано также увеличение диапазона значений между максимальным и минимальным уровнем светорассеяния в задних слоях стромы в 4 раза, в эпителии – в 1,6 раза, в передней строме – в 2,2 раза.
Повышение интенсивности светорассеяния при прохождении света через слои роговицы при высоком ВГД обусловлено нарушением ее водного баланса, что приводит к хроническому отеку, нарушению оптической однородности среды. Причем по результатам конфокальной микроскопии изменения наиболее выражены в задних слоях стромы, что согласуется с полученными данными.
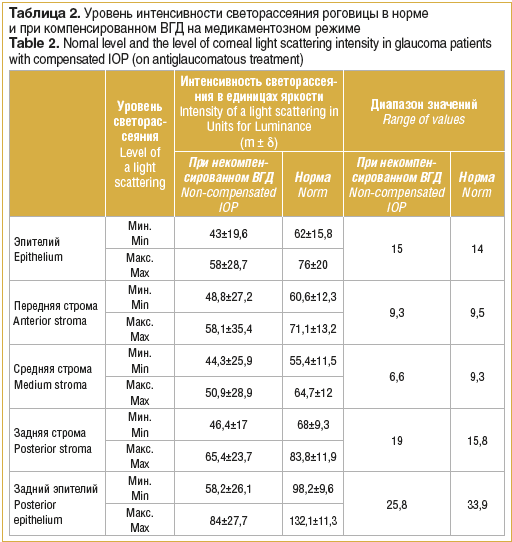
При компенсированном ВГД (на длительном медикаментозном режиме) выявлено некоторое снижение интенсивности светорассеяния по сравнению с нормальными величинами. В передних и средних слоях роговицы значения данного показателя сопоставимы, снижение составило от 19,5 до 21,2%. В слое эпителия минимальная интенсивность светорассеяния снизилась на 30,7%, максимальная – на 24%, в слоях задней стромы, соответственно, на 32% и 22%.
Наибольшие изменения зафиксированы в слое заднего эпителия роговицы. Снижение минимального уровня светорассеяния составило 61%, максимального уровня – 36,4% от нормы с уменьшением диапазона между данными показателями в 1,3 раза.
Зависимость интенсивности светорассеяния в различных слоях роговицы от компенсации ВГД при глаукоме продемонстрирована на рисунке 1.
Снижение интенсивности светорассеяния при компенсированном ВГД свидетельствует о восстановлении водного баланса роговицы. Более низкие показатели относительно нормальных величин могут быть следствием уменьшения количества и снижения контрастности ядер кератоцитов, визуализируемых при исследовании. Ядра кератоцитов обладают высокой рефлективностью, являются наиболее яркими наблюдаемыми объектами при конфокальной микроскопии и представляют собой основные центры светорассеяния. При определенной сопоставимости степени снижения интенсивности светорассеяния в слоях стромы все-таки наибольшая тенденция к снижению была отмечена в ее задних слоях, что являлось ожидаемым при компенсации ВГД. Достаточно значимое снижение светорассеяния в эпителиальном слое свидетельствует об увеличении его прозрачности и равномерности. Рассеяние света от слоя заднего эпителия роговицы резко снизилось, что может быть связано с уменьшением светорассеяния в предлежащих слоях стромы, которое, суммируясь, может приводить к увеличению светоотражения и светорассеяния в слое эндотелия.
На втором этапе данной работы при анализе результатов конфокальной микроскопии была выявлена положительная динамика при использовании слезозаменителя Стиллавит. В большинстве случаев удалось зафиксировать улучшение состояния поверхностных слоев эпителия роговицы. Рисунок 2 иллюстрирует один из вариантов эпителиопатии, в данном случае поверхностный слой эпителия представлен клетками, ядра которых не визуализируются, что свидетельствует об их недостаточной дифференцировке (рис. 2а). Через 6 мес. использования слезозаместительной терапии эпителиальный слой представлен достаточно дифференцированными клетками с четко контурируемыми ядрами (рис. 2б).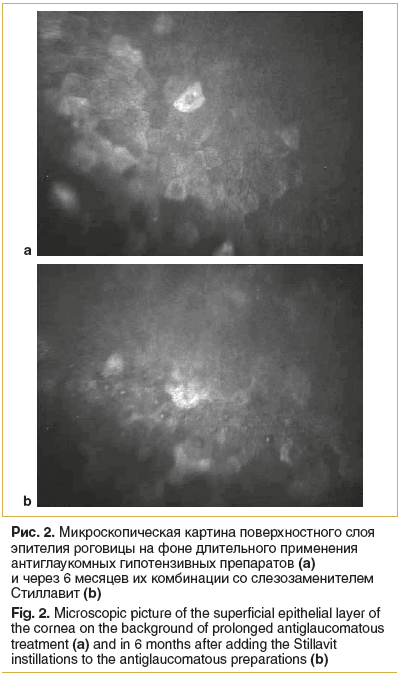
Улучшение состояния стромы роговицы не всегда было достаточно демонстративным, однако в ряде случаев можно было отметить повышение прозрачности межклеточного матрикса, яркости и контрастности ядер кератоцитов.
Оценка интенсивности светорассеяния показала статистически значимое снижение как максимального, так и минимального уровня интенсивности светорассеяния в эпителиальных слоях и строме роговицы. Изменения в слое эндотелия не были статистически достоверны (рис. 3). Наибольшее снижение максимальной интенсивности светорассеяния выявлено в слое эпителия (на 21%) и передней строме (на 23,2%) с уменьшением диапазона между максимальным и минимальным уровнем, соответственно, в 2 и 1,6 раза.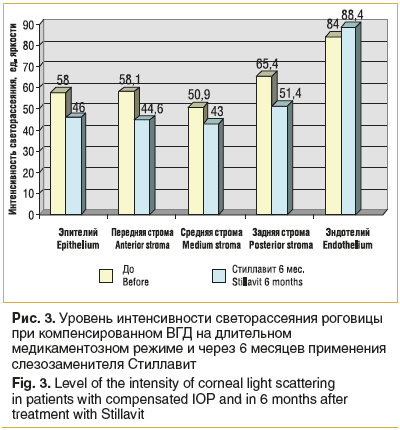
Полученный результат данного исследования демонстрирует восстановление структуры эпителиального слоя, повышение прозрачности и оптической однородности передних слоев стромы.
Заключение
Результаты проведенных исследований позволяют утверждать, что высокий уровень ВГД при глаукоме приводит к нарушению водного баланса роговицы с максимальным нарушением морфологии в средних и задних слоях стромы.
Компенсация ВГД способствует снижению хронического отека роговицы, что ведет к восстановлению ее структуры в задних слоях стромы. Однако длительное использование гипотензив?


