Клинические случаи по глаукоме
Резюме
В статье приведены клинические примеры назначения комбинированных антиглаукомных препаратов и обсуждение их эффективности у конкретных пациентов.
В статье приведены клинические примеры назначения комбинированных антиглаукомных препаратов и обсуждение их эффективности у конкретных пациентов.
Ключевые слова: глаукома, комбинированные антиглаукомные препараты, внутриглазное давление.
Abstract
Сlinical examples of the effects of a modern hypotensive treatment
Shevchenko M.V., Shugurova N.E., Lumpova T.N.
Samara State Medical University
Medical Center of specialty care «Tvoy doctor»
Clinical examples of combined antiglaucomatous drugs prescription and the discussion of their efficiency in the particular patients are discussed.
Key words: glaucoma, combined antiglaucomatous drugs, intraocular pressure
Несмотря на то, что за последние годы во многом пересмотрены взгляды на патогенез и клинику глаукомы, ведущее место в ее лечении по-прежнему отводится устранению повышенного внутриглазного давления (ВГД), которое расценивается как главный фактор риска развития глаукомной оптической нейропатии. Лечение глаукомы начинают, как правило, с назначения местных гипотензивных препаратов, которые применяются кратковременно или длительно, иногда на протяжении всей жизни больного [1, 3, 4, 6]. Систематическое применение средств, снижающих ВГД, используют также после лазерных вмешательств или гипотензивных операций. Так, по данным ряда авторов [3, 5], через 5–15 лет после различного вида антиглаукоматозных операций у 15–64% пациентов требуется применение гипотензивных препаратов. Таким образом, роль местной гипотензивной терапии в системе лечения глаукомы не уменьшается [2, 6].
В последние годы арсенал местных гипотензивных средств для лечения глаукомы постоянно пополняется. С момента появления гипотензивных препаратов фирмы Allergan – Ганфорта, Альфагана Р и Комбигана в Самарской области прошло 2 года. С появлением на рынке этих препаратов возможности медикаментозного лечения глаукомы существенно расширились, поскольку каждый из препаратов не имеет аналогов [7–10]. Накопленный опыт позволяет иллюстрировать определенные тезисы, характеризующие применение этих средств в практической работе, клиническими примерами.
Следует отметить принципиальные отличия контингента больных, которые обычно принимают участие в исследованиях по оценке препаратов в соответствии с критериями включения и исключения, и неотобранного контингента больных в реальной клинической практике, находящихся на диспансерном учете у окулиста: пациенты с запущенными стадиями глаукомного процесса, прооперированные по поводу глаукомы, со сложной сочетанной офтальмологической патологией, с рефрактерными формами глаукомы. Анализ клинических примеров из повседневной лечебной практики представляется нам интересным и значимым, поскольку именно практическое применение определяет место конкретного гипотензивного средства в лечении глаукомы.
Клинический пример 1. Перевод на Ганфорт с другой свободной комбинации препаратов дает дополнительное снижение ВГД.
Пациентка К., 65 лет. Диагноз: открытоугольная IIa глаукома, начальная катаракта ОD. Тотальная оперированная отслойка сетчатки, артифакия OS. Высокая осложненная миопия, ПЭС обоих глаз.
Vis OD: 0,02 M13,0D = 0,6. Vis OS: неправильная светопроекция.
Слепота левого глаза с 2009 г. вследствие дважды оперированной отслойки сетчатки. Тогда же с профилактической целью была выполнена лазеркоагуляция сетчатки правого глаза.
Диагноз глаукомы правого глаза установлен впервые в июне 2013 г.
Исходно ВГД OD (Po) составило 27 мм рт. ст.; OS – 9,0 мм рт. ст.
ЦТР: OD – 545 мкм; OS – 544 мкм.
Стадия глаукомы OD установлена на основании результатов кинетической и статической периметрии.
C учетом факторов риска (II стадия процесса, высокая миопия) артериальное давление (АД)) давление цели было определено на уровне 14,4 мм рт. ст.
При контроле ВГД OD через 2 нед. после назначения тимолола 2 р./сут ВГД понизилось до 20 мм рт. ст. (по Маклакову – 22 мм рт. ст).
К лечению в OD был добавлен латанопрост.
При уровне ВГД OD (Po) 18 мм рт. ст. комбинация тимолола и латанопроста была заменена на Ганфорт 1 р./день утром. Контроль ВГД через 1 нед. показал снижение ВГД до 15 мм рт. ст.
При динамическом наблюдении среднее ВГД за 5 измерений в течение 1 года составило 14,7 мм рт. ст., т. е. произошло уменьшение ВГД на 5,3 мм рт. ст. по сравнению с тимололом и на 2,3 мм рт. ст. по сравнению с комбинацией тимолол + латанопрост. Отрицательной динамики состояния поля зрения не было.
Клинический пример 2. Альфаган Р – эффективная терапия в начальной стадии глаукомы.
Пациентка М., 70 лет.
Диагноз: открытоугольная Iа глаукома, миопия слабой степени, миопический астигматизм обоих глаз.
Vis OD: 0,2 M 2,5 D Cyl — 1,5 D ax 95 = 0,9. Vis OS: 0,2 M 2,5 D Cyl — 0,5 D ax 90 = 0,8. ЦТР OU – 596 мкм.
Исходное ВГД OD (Po) – 24 мм рт. ст., OS – 25 мм рт. ст.
При определении целевого истинного ВГД с учетом возраста и диастолического АД в плечевой артерии (у пациентки гипотония) оно составило 12,9 мм рт. ст.
Сопутствующие заболевания: сердечно-сосудистая патология, пульс 55 уд./мин, что исключало применение бета-адреноблокаторов.
Учитывая невысокий исходный уровень ВГД и сопутствующие заболевания, была назначена монотерапия ингибиторами карбоангидразы (Азопт) – ВГД снизилось до 18–19 мм рт. ст., но имело место побочное действие ингибиторов карбоангидразы – ощущение горечи во рту.
Монотерапия бетаксололом была эффективна по своему гипотензивному действию (ВГД – 14 мм рт. ст.), но привела к дальнейшему снижению АД до 90/60 мм рт. ст., урежению пульса до 50 уд./мин.
Пациентке был назначен Альфаган Р 3 р./день. На этом фоне ВГД OS составило 12,5 мм рт. ст. Препарат хорошо переносился субъективно, пациентка отказалась от слезозаменителей, которые применяла раньше.
Данный клинический пример иллюстрирует эффективность Альфагана Р в начальной стадии глаукомы, а также сложность выбора гипотензивного препарата для монотерапии в ряде случаев в связи с их местными и общими побочными эффектами.
Клинический пример 3. Альфаган Р в качестве дополнительной терапии.
Пациент Т., 61 год.
Диагноз: ОД – подозрение на глаукому, OS – открытоугольная IIв глаукома, OU – ПЭС, начальная катаракта.
Vis OD: 1,0. Vis OS: 0,1 не корригирует.
В момент обращения ВГД ОД (Po) – 19,0; OS – 24,3 мм рт. ст.
ЦТР: ОД – 578 мкм, OS – 586 мкм.
Давление цели с учетом диастолического АД (80 мм рт. ст.) и возраста составило 13,9 мм рт. ст.
Предшествующий опыт гипотензивной терапии у этого пациента свидетельствовал о том, что он не переносит неселективные бета-адреноблокаторы (они вызывали депрессию, нарушение сердечного ритма), ингибиторы карбоангидразы (отмечал резь и другие неприятные ощущения в глазах).
На фоне латанопроста Po левого глаза снизилось до 20 мм рт. ст.
Единственным возможным добавлением был бримонидин. Помимо Ксалатана пациент стал закапывать Альфаган Р 3 р./день. Через 1 мес. Po OS составило 14 мм рт. ст. Эффективность данного сочетания гипотензивных средств обусловлена двойным воздействием на увеосклеральный отток, уменьшением продукции ВГЖ за счет бримонидина, усилением действия латанопроста со временем. Небольшая сонливость, которую отмечал пациент в первое время применения Альфагана Р, была преходящей.
Таким образом, комбинация бримонидина с аналогами простагландинов у данного пациента усилила гипотензивный эффект Ксалатана на 5 мм рт. ст.
Клинический пример 4. Нейропротекторное действие Альфагана Р.
Пациентка М., 41 год.
Женщина впервые обратилась с жалобами на чувство тяжести в обоих глазах. С декабря 2010 г. наблюдается с диагнозом «открытоугольная IIa глаукома обоих глаз». Наследственность не отягощена.
Глаукома выявлена в декабре 2010 г. при уровне Po OU 27 мм рт. ст. Преобладала симптоматика со стороны ДЗН, особенно в OS. Периметрический индекс MD находился в обоих глазах на верхней границе нормы.
Vis OU: 0,6 M 0,75 D = 1,0. ЦТР: OD – 555 мкм; OS – 560 мкм.
Был назначен латанопрост, на котором в течение 1 года ВГД держалось на уровне компенсации – 14–16 мм рт. ст.
С появлением нового препарата Альфаган Р, учитывая молодой возраст пациентки и нейропротекторные свойства бримонидина, лечащий врач заменил Ксалатан на Альфаган Р. Через 2 мес. ВГД OU поднялось до 24–28 мм рт. ст., что закономерно. Учитывая отсутствие компенсации ВГД при монотерапии Альфаганом Р в апреле 2012 г. вновь назначили Ксалатан, но повторное назначение препарата, как это часто бывает, не привело к достижению давления цели. Врач вновь добавил Альфаган Р. В апреле 2013 г., учитывая уровень ВГД 20 мм рт. ст. в OU, Ксалатан заменили на Ганфорт 1 р./день. Через 10 дней ВГД OU составило 12–13 мм рт. ст. на фоне режима инстилляции капель Ганфорт + Альфаган Р 3 р./день. При переходе с Ксалатана на Ганфорт у этой пациентки снижение ВГД составило 7 мм рт. ст. от исходного.
Таким образом, в общей сложности пациентка получала Альфаган в комбинированной или монотерапии в течение 1,5 года, практически с начала появления препарата на российском рынке.
В таблице 1 представлена динамика периметрических индексов за указанное время.
Несмотря на пограничные значения индекса MD исходно в обоих глазах, светочувствительность сетчатки в динамике увеличилась. Индекс PSD также не имел отрицательной динамики.
HRT ДЗН в динамике показала некоторые положительные изменения морфометрических характеристик.
В данном клиническом примере положительная динамика светочувствительности сетчатки и морфометрических характеристик ДЗН на фоне применения бримонидина в течение 1,5 года позволяет предположить связь положительной динамики с нейропротекторным действием бримонидина. Наблюдение будет продолжено.
Клинический пример 5. Комбинация Ганфорт + Альфаган Р – альтернатива хирургического лечения глаукомы
Пациентка Э., 66 лет, наблюдается с 2005 г. с диагнозом «открытоугольная оперированная IIа глаукома, артифакия, миопия средней степени обоих глаз». Отец ослеп от глаукомы.
Vis OD: 0,6 не корригирует. Vis OS: 0,6 M 1,0 D = 1,0.
Оба глаза неоднократно оперированы. Последовательно, в соответствии с принципом минимальной травматичности, был применен весь арсенал глаукомной хирургии: непроникающая хирургия, неоднократный нидлинг фильтрационной зоны с введением антиметаболитов, трабекулэктомия. Последние операции в 2009 и 2010 гг. – глубокая склерэктомия обоих глаз с имплантацией коллагеновых дренажей, после чего в течение 4-х лет ВГД держалось на уровне компенсации. Следует отметить, что каждое вмешательство у этой пациентки проходило сложно. После НСТ была отслойка сосудистой оболочки, нидлинг сопровождался токсической кератопатией, фильтрующие операции осложнились развитием двусторонней катаракты. Однако после хирургического лечения катаракты, несмотря на все сложности, удалось сохранить высокое зрение и II стадию процесса. Поэтому когда в июне 2012 г. появилась тенденция к повышению ВГД в левом, лучшем глазу, очередная операция представлялась крайне нежелательной.
Были назначены тимолола малеат, Азопт и Ксалатан, на фоне которых Ро левого глаза сохранялось на уровне 30 мм рт. ст. Ксалатан и 1 инстилляция тимолола были заменены на Ганфорт и добавлен Альфаган Р 3 р./день. На режиме Ганфорт утром, тимолол вечером, Альфаган Р 3 р./день и Азопт 2 р. ВГД OS снизилось через 3 нед. до 14,5 мм рт. ст.
В данном случае медикаментозная терапия с применением сочетания Ганфорт + Альфаган Р послужила оправданной альтернативой хирургического лечения.
Клинический пример 6. Комбиган в составе максимальной медикаментозной терапии у пациента с глаукомой нормального давления.
Пациент Г., 65 лет.
Диагноз: открытоугольная IIа глаукома низкого давления, факосклероз, миопия высокой степени OU.
Vis OD: 0,02 M 9,0 D = 0,5. Vis OS: 0,02 M 10,0 D = 0,6. ЦТР: OD – 515 мкм; OS – 504 мкм. У пациента тонкая роговица, примерная поправка на толщину роговицы составляет (+) 3 мм рт. ст. УЗБ: OU – 26,5 мм. ВГД (Ро): OD – 19 мм рт. ст., OS – 20 мм рт. ст.
В выявлении глаукомы у данного пациента преобладала симптоматика со стороны ДЗН – по данным ОСТ, снижение средней толщины слоя нервных волокон сетчатки до 74 мкм.
Факторами риска, определяющими давление цели, у данного пациента были артериальная гипотония (120/80 мм рт. ст.), высокая миопия, наследственность (мать и сестра ослепли в результате глаукомы), тонкая роговица.
Давление цели составило 13,8 мм рт. ст.
Режим гипотензивных капель был представлен Бетоптиком и Траватаном, что снизило Po до 15–16 мм рт. ст., (по Маклакову – 19–22 мм рт. ст.), давление цели не было достигнуто. С апреля 2013 г. в дополнение к Траватану рекомендован Комбиган вместо Бетоптика 2 р./день. Через 3 нед. Po роговично-компенсированное снизилось в OU до 13,5 и 14,0 мм рт. ст., что соответствовало давлению цели.
В результате Комбиган как дополнительный препарат к аналогу простагландинов позволил достичь низкого давления цели у пациента с нормотензивной глаукомой.
Клинический пример 7. Комбиган – препарат для максимальной медикаментозной терапии при сложной сочетанной патологии.
Глаукома часто сочетается с другой сложной патологией глаз, а пациенты, нуждающиеся в максимальной медикаментозной терапии, – это чаще всего пациенты, для которых хирургическое вмешательство по поводу глаукомы крайне нежелательно в связи с сопутствующей общесоматической патологией или особенно сложной офтальмологической ситуацией.
Пациент Г., 71 год, кроме глаукомы страдает тяжелым сахарным диабетом.
Диагноз: пролиферативная диабетическая ретинопатия, артифакия OU, тракционная отслойка сетчатки ОД; открытоугольная IIIс глаукома OS.
Vis OD: 0,02 не корригирует. Vis OS: 0,1 не корригирует.
Исходное ВГД практически единственного левого глаза составило 35 мм рт. ст. Проблема адекватного контроля ВГД осложнялась тонкой роговицей (468 мкм).
Правый глаз ослеп вследствие пролиферативной диабетической ретинопатии. В левом глазу кроме открытоугольной глаукомы III cтадии с высоким ВГД, артифакии имел место диабетический макулярный отек. Очевидно, что хирургическое вмешательство по поводу глаукомы в единственном видящем глазу с остротой зрения 0,1 и макулярным отеком крайне нежелательно.
Динамика ВГД OS на разных режимах гипотензивных средств было представлена следующим образом:
• Траватан – 1 р./день – Po OS 30 мм рт. ст.;
• Комбиган – 2 р./день + Траватан 1 р./день – Po OS 23 мм рт. ст.;
• Комбиган – 2 р./день, Траватан – 1 р./день, Азопт 2 р./день – Po OS 16 мм рт. ст.
В данном случае максимальная медикаментозная терапия с применением Комбигана позволила избежать оперативного вмешательства в единственном видящем глазу с ПДРП и макулярным отеком.
Так как лечение глаукомы – длительный, как правило, пожизненный процесс, выбор для конкретного больного медикаментозного средства, позволяющего достичь стойкой нормализации офтальмотонуса и создающего условия для длительного сохранения зрительных функций, представляет собой ответственную и часто непростую задачу для офтальмолога. Наши возможности решения этой задачи существенно возросли.
Литература
1. Глаукома. Национальное руководство / под ред. Е.А. Егорова. М.: ГЭОТАР-Медиа, 2013. 824 с.
2. Егоров Е.А., Астахов Ю.С., Ставицкая Т.В. Офтальмофармакология. М.: ГЭОТАР-Медиа, 2005. 464 с.
3. Еричев В.П. Современные принципы гипотензивной терапии глаукомы / Конф. «Глаукома: реальность и перспективы»: Сб. научн. статей. М., 2008. С. 220–223.
4. Нестеров А.П. Глаукома. М.: Медицина, 1995.
5. Нестеров А.П. Новые тенденции в консервативном лечении глаукомы // Вестник офтальмологии. 1995. № 4. С. 3–5.
6. Terminology and guidelines for glaucoma // European Glaucoma Society. 3–th ed. // Savona: Dogma, 2008. 184 p.
7. Aptel et al. // Eur. J. Ophthalmol. 2012. Vol. 22. Р. 5–18.
8. Bournias T.E., Lai J. // Ophthalmology. 2009. Vol. 116 (9). Р. 1719–1724.
9. Centofanti M., Oddone F., Gandolfi S., Hommer A. et al. // Am J Ophthalmol. 2010. Vol. 150. Р. 575–580.
10. Zimmerman T.J., Kooner K.S., Sharir M., Fechtner R.D. Textbook of ocular pharmacology. 1997.
Источник
В статье представлены результаты новой антиглаукомной операции непроникающего типа у больных вторичной глаукомой. Описано 2 клинических случая
Введение
Глаукома — это глазное заболевание с почти бессимптомным течением, при котором происходит повреждение зрительного нерва и сетчатки с характерным выпадением полей зрения, связанное, как правило, с повышенным внутриглазным давлением (ВГД), без лечения приводящее к слепоте. Во всем мире глаукома является одной из главных причин необратимой потери зрения [1].
По данным Всемирной организации здравоохранения (ВОЗ), количество глаукомных больных в мире колеблется от 60,5 млн до 105 млн человек, причем в ближайшие 10 лет оно увеличится еще на 10 млн. По литературным данным, в мире каждую минуту от глаукомы слепнет 1 человек, а каждые 10 мин — 1 ребенок. В настоящее время в России на официальном учете состоит 1 180 708 пациентов с глаукомой, что практически вдвое меньше предполагаемых расчетных показателей [2].
Особое место в группе глаукомы занимает вторичная глаукома.
Вторичная глаукома — заболевание, которое возникает при самых разнообразных патологических процессах в глазу, т. е. является осложнением или последствием других глазных болезней. Воспалительные заболевания глазного яблока, травмы, острое нарушение кровообращения в сосудах сетчатки, внутриглазная неоваскуляризация, некоторые стадии развития катаракты могут привести к повышению уровня ВГД. Причиной развития вторичной глаукомы чаще всего становится нарушение оттока внутриглазной жидкости (ВГЖ) [3].
Разграничение первичной и вторичной глаукомы условно, любое повышение уровня ВГД вторично. Частота вторичной глаукомы — 0,8–22% всех глазных заболеваний (1–2% всех стационарных больных). Нередко глаукома приводит к слепоте (частота составляет 28%). Отмечается высокая частота энуклеаций при вторичной глаукоме — 20–45%. Вторичная глаукома имеет те же стадии и степени компенсации, что и первичная глаукома, но есть и некоторые особенности: чаще всего это односторонний процесс; может протекать как открытоугольная, так и закрытоугольная (т. е. приступообразно); инвертированный тип кривой повышения уровня ВГД (вечерний подъем); очень быстро, часто в течение 1 года, понижаются зрительные функции; при своевременном лечении понижение зрительных функций обратимо [3].
Число лиц, заболевших сосудистой посттромботической глаукомой, с каждым годом увеличивается. Посттромботическая глаукома возникает как осложнение гипоксических заболеваний сетчатки, особенно часто — ишемической формы окклюзии центральной вены сетчатки (ЦВС). При этом образующиеся в зонах гипоксии сетчатки вазоформативные факторы путем диффузии поступают в стекловидное тело и через зрачок в переднюю камеру (ПК) глаза. Новообразованные сосуды возникают сначала у зрачкового края радужки, затем по ее передней поверхности распространяются на структуры угла передней камеры (УПК). В результате рубцового сокращения новообразованной фиброваскулярной ткани наступает частичная или полная облитерация УПК. Кроме рубеоза клиническая картина данной глаукомы представлена болевым синдромом, расширением сосудов эписклеры, отеком роговицы и внутриглазными кровоизлияниями (гифемой, гемофтальмом, геморрагиями в сетчатке) [4].
Посттромботическая глаукома развивается у больных через 2–3 мес. после перенесенного тромбоза ЦВС вследствие появления несостоятельных сосудов и соединительной ткани в углу ПК. В свою очередь данный патологический процесс препятствует нормальному оттоку ВГЖ и, как следствие, приводит к повышению уровня ВГД.
С целью нормализации офтальмотонуса при вторичной глаукоме (за исключением факоморфической и факотопической глаукомы) традиционно используют последовательно консервативный, лазерный и хирургический методы лечения.
В настоящее время разработка новых эффективных методик лазерного и хирургического лечения больных глаукомой продолжает сохранять свою актуальность. Среди лазерных методов в последнее время широкое распространение в офтальмологической практике получила лазерная циклокоагуляция (ЛЦК). Это объясняется высокой эффективностью, дозированностью, точностью воздействия и отсутствием необходимости вскрытия глазного яблока для проведения внутриглазных вмешательств.
В основу ЛЦК положен принцип воздействия на механизм образования влаги с целью снижения уровня ВГД, что достигается двумя путями: деструкцией (повреждением) цилиарного тела — циклокоагуляцией и склерозированием (тромбозом или выключением некоторых сосудов, идущих к цилиарному телу) — ангиофототермией. Данный вид лазерного лечения применяется даже при наличии резко суженных полей зрения. После лазерного воздействия острота зрения не меняется при отсутствии осложнений. Помимо положительных моментов у данной методики есть и отрицательные — после ЛЦК могут развиваться гифема, увеит, гипотония [5]. Из-за наличия осложнений лазерная хирургия не всегда может быть применима в лечении вторичной глаукомы.
Основными требованиями, предъявляемыми к хирургии глаукомы, являются стойкая нормализация офтальмотонуса, стабилизация зрительных функций при минималь-
ном риске осложнений. Этому требованию соответствуют операции непроникающего типа, которые проводятся без вскрытия ПК глаза.
Новый метод антиглаукомной операции — резекция склеры (патент на изобретение № 2587856) нами применяется в клинической практике с 2014 г. в лечении больных (60 человек) с первичной, не компенсированной на медикаментозном режиме, далеко зашедшей глаукомой. В представленной работе мы использовали этот метод в лечении больных вторичной посттромботической декомпенсированной глаукомой с явлениями неоваскуляризации переднего отрезка глазного яблока [6].
Предложенная нами техника хирургии далеко зашедших стадий глаукомы направлена на активизацию дополнительного, увеосклерального пути посредством улучшения проницаемости склеры как заключительного этапа оттока водянистой влаги из глазного яблока [7].
Техника данной операции заключается в следующем. После местной анестезии эпибульбарно 1% р-ром Инокаина и фиксации верхней прямой мышцы осуществляют разрез конъюнктивы и теноновой оболочки в верхнем отделе по лимбу длиной 7–10 мм, проводят их отсепаровку от склеры, осуществляют щадящий гемостаз. Затем, отступив 1–2 мм от лимба, в проекции ресничного тела и интрасклеральных коллекторных каналов между мышцами (внутренней и верхней прямой или верхней и наружной прямой) выполняют хирургическим лезвием резекцию (т. е. иссечение, удаление) склеры размером 7×5 мм на глубину 2/3–4/5 ее толщины. Операция завершается наложением 1–2 узловых швов на конъюнктиву и введением под конъюнктиву глазного яблока в нижнем отделе раствора антибиотика и кортикостероидного препарата [8, 9].
До и после операции у больных собирали анамнез (особое внимание уделялось медикаментозному режиму), выполняли визометрию, тонографию по Гранту, компьютерную периметрию Humphrey. Для оценки дренажной функции глаза, выраженной коэффициентом легкости оттока (КЛО), использовалась электронная тонография до и после операции.
Под нашим наблюдением находились 2 пациента с наиболее упорными случаями декомпенсации офтальмотонуса на фоне гипотензивного медикаментозного режима.
Клинический случай № 1
Пациентка Л., 59 лет, перенесла тромбоз ЦВС на правом глазу (OD) 5 лет назад. Спустя 5 мес. проведена панретинальная лазеркоагуляция сетчатки. Страдает вторичной глаукомой около 3 лет. Гипотензивный режим: тимолол 0,5% 2 р./сут, дорзоламид 2% 3 р./сут и латанопрост 0,005% на ночь.
Диагноз: OD — вторичная посттромботическая декомпенсированная IIIb глаукома. Оперированная лазером посттромботическая ретинопатия.
St. oculorum: OD — роговица прозрачная, ПК средней глубины, влага прозрачная. Радужка субатрофичная, зрачок круглый в центре, пигментная кайма отсутствует, рубеоз. Начальные явления факосклероза. Глазное дно: диск зрительного нерва (ДЗН) серый, границы четкие, экскавация диска (э/д)=1,0. По всему глазному дну множественные кровоизлияния, пигментированные лазеркоагуляты на периферии.
Больной была проведена операция на OD — непроникающая глубокая склерэктомия (резекция склеры). Результаты обследования до и после операции приведены в таблице 1.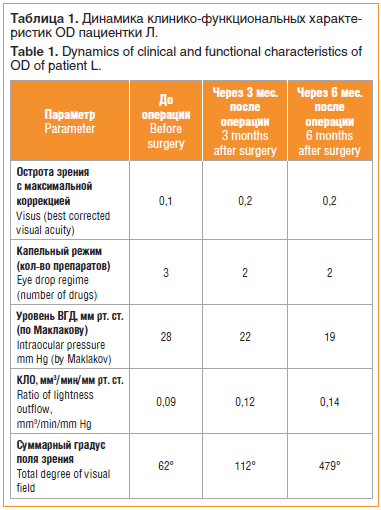
St. oculorum: OD спустя 6 мес. после операции: в верхненаружном и верхневнутреннем отделах глазного яблока просматриваются резецированные участки склеры 7×5 мм в 1 мм от лимба (рис. 1). Роговица прозрачная, ПК средней глубины, влага прозрачная. Радужка субатрофичная, зрачок круглый в центре, пигментная кайма отсутствует, рубеоз. Начальные явления факосклероза. Глазное дно: ДЗН серый, границы четкие, э/д=1,0. По всему глазному дну множественные кровоизлияния, пигментированные лазеркоагуляты на периферии.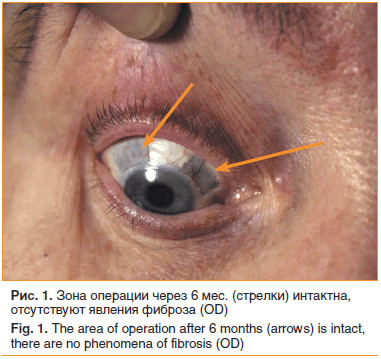
Через 6 мес. после хирургического лечения уровень ВГД уменьшился на 32%, КЛО увеличился на 36%, ППЗ расширились на 87% (рис. 2, 3).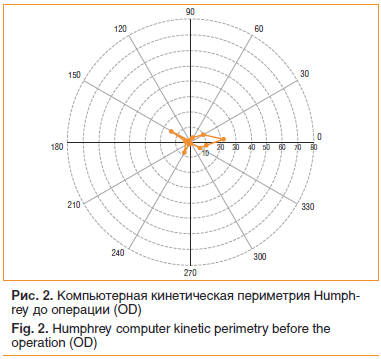

Клинический случай № 2
Больной П., 67 лет, вторичной глаукомой на левом глазу (OS) страдает с 2011 г. В 2010 г. перенес тромбоз ЦВС OS.
Исходные данные: Visus OS=0,02 нк, уровень ВГД (пальпаторно) ++. Медикаментозный режим — тимолол 0,5% 2 р./сут, латанопрост 0,005% на ночь (на большинство гипотензивных препаратов — аллергическая реакция).
Диагноз: OS — вторичная неоваскулярная IIIb глаукома. Оперированная лазером посттромботическая ретинопатия.
St. oculorum: OS — застойная инъекция. Роговица — небольшой отек эпителия. ПК средней глубины, влага прозрачная. Радужка субатрофичная, зрачок круглый в центре. Деструкция пигментной каймы, рубеоз радужки по зрачковому краю. Хрусталик с выраженными помутнениями в кортикальных слоях. Глазное дно: ДЗН — деколорирован, э/д=0,8, границы стушеваны, единичные кровоизлияния на ДЗН. Сосудистый пучок в центре. Вены полнокровные, извитые. По ходу верхневисочного и нижневисочного сосудистых пучков отмечаются множественные лазерные коагуляты.
В связи с наличием декомпенсации уровня ВГД на субмаксимальном медикаментозном режиме и с целью сохранения остаточных зрительных функций больному была проведена антиглаукомная операция — ЛЦК на OS. Результаты после операции приведены в таблице 2.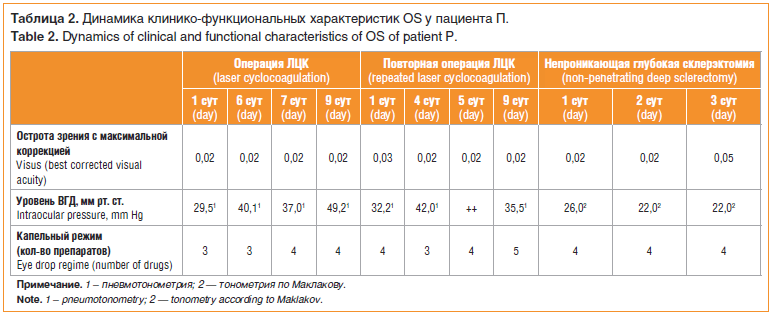
На 10-е сут после проведения ЛЦК компенсации ВГД не наступило. Проведена повторная ЛЦК на OS. Динамика уровня ВГД после повторной операции ЛЦК приведена в таблице 2.
С учетом стойкой декомпенсации, сохраняющейся в течение 2-х нед. даже после повторной ЛЦК и усиления гипотензивного режима (добавлен внутрь ацетазоламид 0,25 мг 1 р./сут на 2 дня), больному с целью активизации увеосклерального оттока ВГЖ была дополнительно проведена непроникающая глубокая склерэктомия — резекция склеры, после которой на 2-е сут удалось снизить уровень ВГД до 22 мм рт. ст. — на 45% от исходного (табл. 2).
Тонография не проводилась из-за отечности эпителия роговицы.
St. oculorum (спустя 6 мес. после операции): OS — застойная инъекция уменьшилась. Швы конъюнктивы чистые, края п/о раны адаптированы. В верхневнутреннем и верхненаружном отделах глазного яблока в 0,5 мм от лимба контурируются 2 резецированных участка склеры 7×5 мм (рис. 4). Роговица — небольшой отек эпителия. ПК средней глубины, влага прозрачная. Радужка субатрофичная, зрачок круглый в центре. Деструкция пигментной каймы, рубеоз радужки по зрачковому краю уменьшился. Хрусталик с выраженными помутнениями в кортикальных слоях. Глазное дно: ДЗН — деколорирован, э/д=0,8, границы стушеваны, единичные кровоизлияния на ДЗН. Сосудистый пучок в центре. Вены полнокровные, извитые. По ходу верхневисочных и нижневисочных сосудистых пучков отмечаются множественные лазерные коагуляты.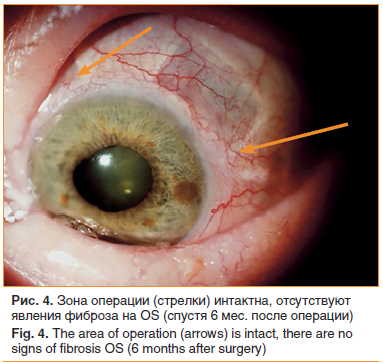
Выводы
Таким образом, с помощью резекции склеры достигаются:
стойкое усиление фильтрации ВГЖ на 25–50% от исходной за счет активизации увеосклерального оттока;
расширение ППЗ;
нормализация офтальмотонуса.
Непроникающая глубокая склерэктомия (резекция склеры) характеризуется меньшей травматичностью по сравнению с фистулизирующими антиглаукомными операциями за счет непроникающего характера хирургического воздействия.
Сведения об авторах: Румянцева Ольга Александровна — д.м.н., профессор. Корчуганова Елена Александровна — к.м.н., старший научный сотрудник. Казанцева Ангелина Юрьевна — аспирантка. ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Российская Федерация, г. Москва, ул. Островитянова, д. 1. Контактная информация: Казанцева Ангелина Юрьевна, e-mail: bronvis@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 22.11.2017.
About the authors: Olga A. Rumyantseva — MD, PhD, professor. Elena A. Korchuganova — PhD, senior research associate. Angelina Yu. Kazantseva — postgraduate student. Pirogov Russian National Research Medical University. 1, Ostrovityanova str., Moscow, 117997, Russian Federation. Contact information: Angelina Yu. Kazantseva, e-mail: bronvis@mail.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 22.11.2017.
Источник


