Глаутекс дренаж при глаукоме
Хакимов А.М., Даутова З.А., Митрофанова Н.В.
Глаукома — одно из наиболее распространенных заболеваний органа зрения. По данным ВОЗ, в среднем 3 % всего населения земного шара (около 70 млн. человек) страдают данной патологией.
Заболевание приводит к серьезным необратимым изменениям в глазу и значительной потере зрения, вплоть до слепоты. Методы диагностики и лечения глаукомы постоянно совершенствуются. Целью как консервативного, так и хирургического лечения глаукомы, является нормализация и стабилизация зрительных функций.
На рынке представлены различные препараты, действующие на подавление продукции водянистой влаги, увеличивающие увеосклеральный отток и т. д. Постоянно ведётся поиск новых методов хирургии, как наиболее радикального метода лечения данной патологии [1]. Хирургические методики претерпели значительные изменения и в настоящее время, преобладают операции непроникающего типа [2]. Техника операции была предложена И. Я. Барановым в 1986 г. [3], и позже акад. С. Н. Федоровым и В. И. Козловым (1989), которая получила название непроникающей глубокой склерэктомии (НГСЭ) [4]. Эта операция поэтапно воздействует на различные уровни ретенции (интрасклеральный, трабекулярный и блок шлеммова канала) оттока внутриглазной жидкости, что позволяет оперировать без вскрытия глазного яблока. Благодаря этому уменьшатся проблема послеоперационных осложнений, таких как формирование кистозной фильтрационной подушки, синдрома мелкой передней камеры, катаракты и др. В то же время операция обеспечивает хороший гипотензивный у 89,2 % больных.
Несмотря на эффективность данных операций, частота отдаленных послеоперационных осложнений, а именно дестабилизации глаукомного процесса, причиной которой служит избыточное рубцевание склерального лоскута, является достаточно высокой. В связи с этим, были предложены различные методики, позволяющие предупреждать рубцевание места операции и дозировать гипотензивный эффект. Для этой цели были разработаны и внедрены различные импланты, которые вводятся под склеральный лоскут: акриловые, полиуретановые, гидрогелевые, на основе никелида титана и др. Каждый из этих материалов имеет как достоинства, так и определенные недостатки. В связи с этим, актуальным остается поиск новых полимерных материалов для дренирования в хирургии глаукомы, сочетающих в себе высокую биосовместимость, эластичность, устойчивость и влагопроницаемость [5].
Наше внимание привлёк дренаж «Глаутекс», синтезированный из многокомпонентного материала на основе полигидроксиалканоатов различной природы. Отличительными чертами его являются биосовместимость с клеточными структурами человеческих тканей и контролируемые биорезорбируемые свойства, высокий уровень деформационно–прочностных характеристик, структура микропор пленки и возможности варьирования и контроля размеров дренажа в пределах сотых долей миллиметра.
Цель — оценка эффективности биодеградируемого дренажа «Глаутекс» при непроникающих гипотензивных операциях.
Материал и методы. В ходе исследования были проанализированы результаты НГСЭ с применением биодеградируемого дренажа «Глаутекс» у 25 пациентов (25 глаз) с открытоугольной глаукомой 2–3 стадии.
Операция НГСЭ с применением дренажа включала субсклеральное иссечение наружной стенки Шлеммова канала на первом этапе и лазерную гониопунктуру в зоне операции на втором. В ходе первого этапа рассекали конъюнктиву глазного яблока, отступая 6 мм от лимба, и отсепаровывали ее. Далее выкраивали поверхностный склеральный лоскут 4?4 мм основанием к лимбу с последующим удалением его наружной стенки в зоне хирургического доступа. Затем дренаж «Глаутекс» «надевали» на склеральный лоскут с помощью пинцета для завязывания швов. Склеральный лоскут подшивали к склере двумя узловыми швами. Окончательное расположение дренажа относительно склерального лоскута регулировали с помощью микроинструментов с гладкими браншами. Второй этап — лазерную гониопунктуру — выполняли точно в зоне хирургического вмешательства на 7–14 день после операции, что обосновывается сроками заживления конъюнктивальных и склеральных тканей.
Контрольную группу составили 25 пациента (25 глаз) с открытоугольной глаукомой 2–3 ст., которым была проведена стандартная НГСЭ с последующей лазерной гониопунктурой без применения дренажа.
Средний возраст исследуемых пациентов составил 68±7,5 лет.
Все больные проходили комплексное офтальмологическое обследование, включавшее в себя определение остроты зрения по таблицам Сивцева-Головина, оценку поля зрения на проекционном периметре, измерение внутриглазного давления тонометром Маклакова, биомикроскопию переднего отрезка глаза и глазного дна, гониоскопию, а также переднюю оптическую когерентную томографию (ОКТ) зоны операции и полученной интрасклеральной полости. Визометрия, биомикроскопия, гониоскопия и тонометрия выполнялись до операции и при каждой последующей явке. Границы поля зрения определяли перед операцией, при выписке и через 12 месяцев после хирургии. ОКТ интрасклеральной полости после операции проводили в сроки 1, 3, 6 и 12 месяцев с замером ее объема.
Среднее значение ВГД в исследуемой группе было 26±5,3 мм рт. ст. У 15 % пациентов в анамнезе ранее были проведены гипотензивные операции, такие как глубокая склерэктомия, непроникающая глубокая склерэктомия (без лазерной гониопунктуры) и синустрабекулэктомия.
Результаты исследования были обработаны с использованием непараметрических методов статистики (тест согласованных групп Вилкоксона, Uтест Манна–Уитни). При корреляционном анализе вычислялся коэффициент Спирмена. Все результаты описательной статистики представлены в виде M±?, где M — среднее значение, а ? — стандартное отклонение.
Результаты и обсуждение. В исследуемой группе во все сроки наблюдения отмечалось достоверное снижение внутриглазного давления.
В среднем значение ВГД в группе исследования равнялось 26±5,3 мм рт. ст. После лазерной трабекулопунктуры на 9 глазах (39 %) наблюдалось развитие цилиохориоидальной отслойки (ЦХО).
Двум пациентам была выполнена задняя трепанация склеры с выпусканием супрахориоидальной жидкости. В двух случаях отмечена блокада зоны трабекулопунктуры корнем радужки, что потребовало выполнения лазерного рассечения гониосинехий, лазерной иридотомии.
По данным ОКТ средний объем интрасклеральной полости в исследуемой группе составил 2,04±1,2 мм3, что в 2 раза больше чем при выполнении стандартной НГСЭ — 0,87±0,93 мм3.
Корреляционный анализ выявил среднюю прямую зависимость степени снижения ВГД и объема зоны фильтрации (коэффициент Спирмена равен 0,59, p
Выводы. НГСЭ с применением биодеградируемого дренажа «Глаутекс» является технически простой, безопасной и высокоэффективной операцией. Степень снижения ВГД после операции напрямую зависит от объема интрасклеральной полости.
Источник
Бикбов М.М., Бабушкин А.Э., Оренбуркина О.И., Хисматуллин Р.Р., Хуснитдинов И.И., Чайка О.В.
Согласно данным литературы, основным методом хирургического лечения глаукомы являются фистулизирующие операции. В настоящее время предложено большое количество способов хирургического лечения глаукомы, но справиться с вновь повышенным внутриглазным давлением в послеоперационном периоде не всегда удается.
Одной из причин снижения гипотензивного эффекта после операции является выраженная фибропластическая активность тканей глаза, приводящая к быстрому рубцеванию и облитерации созданных в ходе фильтрующих операций путей оттока водянистой влаги в различные сроки после вмешательства [Андреева Л. В., 2006]. По литературным данным рубцевание в зоне наружной и внутренней фистулы наблюдается у 20–30 % оперированных больных. Многообразие различных по форме и полимерным материалам дренажей, существующих и активно использующихся в офтальмологии, как в нашей стране, так и за рубежом, не всегда позволяет добиться сохранения стойкого гипотензивного эффекта. Причиной этого является развитие грубой соединительной ткани вокруг дренажа, непроницаемой для ВГЖ, что приводит к повышению ВГД в позднем послеоперационном периоде [Денисов И. О., 1986; Посаженников А. П., 1996; Измайлова С. Б., 2005,; Ayyala R. S. et al., 1998; Mermoud A. et al, 1999].
Вопрос о том, какие дренажи лучше и безопаснее для глаза — постоянные или биодеградируемые — по–прежнему, остается дискутабельным [Долгий С. С.].
Цель — провести анализ результатов применения нового биодеградируемого дренажа «Глаутекс» при проникающих антиглаукоматозных операциях (АГО).
Материал и методы. В исследование вошли 24 пациента (24 глаза), которым проводили проникающую АГО с дренажом «Глаутекс». Женщин было 14, мужчин — 10. Пациенты были разделены на две группы: 1 группа — 16 пациентов (16 глаз) с первичной открытоугольной глаукомой (ПОУГ), которым была произведена синустрабекулэктомия с применением дренажа «Глаутекс». 2 группа — 8 пациентов (8 глаз), ранее оперированных по поводу некомпенсированной глаукомы (одна и более АГО в анамнезе). Офтальмотонус (истинное внутриглазное давление) до операции на медикаментозном режиме варьировал от 29,0 до 60,0 мм рт. ст. и в среднем составил 33,4±0,8.
Помимо общепринятых офтальмологических исследований (визометрии, пневмотонометрии, переметрии, офтальмоскопии, биомикроскопии и т. п.) до и после операции, некоторым больным через 1 и 3 месяца после вмешательства проводилась ультразвуковая биомикроскопия (УБМ) с целью изучения сформированной фильтрационной подушки (ФП). Максимальный срок наблюдения за оперированными пациентами не превышал 3 месяцев.
Характеристика биодеградируемого дренажа «Глаутекс»:
— изготовлен из композиции на основе полимолочной кислоты (полилактида) и полиэтиленгликоля;
— представляет собой пористую биорезорбируемую пленку белого цвета с хорошим фильтрующим эффектом;
— имеет форму прямоугольной муфты (замкнутого кольца) 2,5? 5,5? 0,15 мм в сложенном виде с толщиной 80 мкм, диаметр пор 30– 50 мкм.;
— не разбухает, не оказывает избыточного давления на окружающие ткани;
— сроки полной резорбции — 4–5 мес.
Техника операции. Формировали традиционный конъюнктивальный лоскут и поверхностный склеральный лоскут (на 1/2–1/3 толщины склеры) в виде треугольника или трапеции. После чего, на склеральный лоскут надевали муфту дренажа и выполняли непосредственно трабекулэктомию с базальной иридэктомией. Затем склеральный лоскут с надетым на него дренажом укладывали на место, производили его репозицию и фиксировали с помощью 1 или 2 швов в области вершины.
Конъюнктивальный разрез ушивали непрерывным швом. Следует отметить, что одновременно с основной операцией для профилактики цилиохориоидальной отслойки (ЦХО) во всех случаях выполнялась двойная склерэктомия (в 2,5–3 мм от лимба и от границ склерального лоскута).
Результаты и обсуждение. В обеих группах после проведенной АГО с дренажом «Глаутекс» послеоперационный период протекал ареактивно. При проведении биомикроскопии дренаж визуализировался в виде прямоугольника. ФП после операции были разлитые, равномерные.
Блебитов не было ни в одном случае. Через 1–3 мес. ФП были бледного цвета, невысокие и без резких контуров.
В 1–й группе уровень истинного ВГД (Рo) снизился на 47 % и составил в среднем 11,1 мм рт. ст., во 2–й группе Рo снизился на 35 % и составил 13,5 мм рт. ст. Ни в одном случае мы не наблюдали выраженной гипотонии. Умеренная гипотония у 2–х больных (по 1 случаю в каждой группе) была купирована на 2–3 день медикаментозно назначением субконьюнктивальных иньекций кофеина 0,5 мл, атропина 0,1 % 0,3 мл и мезатона 1 % 0,2 мл. Острота зрения сохранилась на дооперационном уровне у 11 человек (78,6 %) первой группы и у 5 (62,5 %) — 2–й группы. У остальных пациентов отмечено улучшение остроты зрения по сравнению с дооперационными данными (в 35,7 % и 25 % случаях соответственно). У 1 больного 2–й группы она несколько ухудшилась в связи с прогрессированием помутнения хрусталика.
Таким образом, проведение антиглаукоматозных операций с использованием дренажа «Глаутекс» дает возможность получить стойкий гипотензивный эффект (в сроки наблюдения до 3–х месяцев), что позволяет снизить вероятность повторных оперативных вмешательств. Расположение дренажа вокруг склерального лоскута в виде «муфты» исключает возможность его дислокации и обеспечивает профилактику возникновения склеро–конъюнктивальных, склеро– склеральных сращений, а также спаек по краю склерального лоскута. Использование дренажа не усложняет ход операций, его установка не требует проведения сложных и трудоемких манипуляций.
Выводы. Предварительный анализ клинико-функциональных результатов показал, что использование биодеградируемого дренажа «Глаутекс» сохраняет гипотензивный эффект предложенных операций у пациентов с глаукомой, обеспечивая нормализацию ВГД в сроки до 3–х месяцев. Окончательные выводы можно будет сделать по мере увеличения клинического материала и срока наблюдения за пациентами.
Источник
Статья посвящена вопросам эффективности фистулизирующих операций с дренажом Глаутекс
В настоящее время активно разрабатываются и используются хирургические методы лечения глаукомы с применением дренажей, предотвращающие процесс избыточного рубцевания в послеоперационной зоне, что способствует более длительной и стабильной нормализации ВГД по сравнению с традиционными хирургическими вмешательствами [1–3]. Одним из основных требований к любому антиглаукомному дренажу является возможность выведения водянистой влаги из передней камеры без развития гипотонии. Другим критерием является длительность гипотензивного эффекта с минимальным побочным воздействием на окружающие ткани [4].
По данным литературы, эффективность дренажной хирургии глаукомы значительно варьирует – от 65 до 85% [5–8]. Основными недостатками при использовании дренажей в отдаленном послеоперационном периоде являются: облитерация просвета дренажа, формирование соединительнотканной капсулы вокруг наружного его конца, кистозное перерождение фильтрационной подушечки, девиация глазного яблока, регматогенные отслойки сетчатки, развитие эпителиально-эндотелиальной дистрофии роговицы, что приводит к необходимости удалять дренаж [9–15]. Вопрос о том, какие дренажи лучше и безопаснее для глаза – постоянные или биодеградируемые, – по-прежнему остается дискутабельным [16, 17].
В связи с этим актуальным является использование для дренирования в хирургии глаукомы новых полимерных материалов, сочетающих в себе высокую биосовместимость, эластичность, устойчивость и влагопроницаемость. Неоспоримым достоинством биодеградируемого материала является его способность к полному рассасыванию, что сводит к минимуму патологические реакции [18, 19]. Одной из патогенетически обоснованных является целенаправленная интраоперационная методика с использованием дренажа Глаутекс для стабильного функционирования созданных путей оттока.
Цель: оценить непосредственные и отдаленные результаты применения дренажа Глаутекс в хирургическом лечении различных видов глаукомы.
Материал и методы
Анализ результатов хирургического лечения пациентов с глаукомой проводился на базе II микрохирургического отделения ГБУ «Уфимский НИИ глазных болезней АН РБ» за 4 года (2012–2015 гг.). Всего прооперировано 243 пациента с рефрактерной глаукомой, из них 104 человека не посетили контрольные осмотры в течение срока наблюдения, в связи с чем исключены из исследования. Контрольный осмотр пациентов осуществлялся с 1 по 8 сут после операции, а также через 1, 3, 6, 12, 24 и 36 мес. Было обследовано 139 пациентов (148 глаз), в 9 случаях дренаж имплантирован на оба глаза. Клинические характеристики пациентов представлены в таблице 1.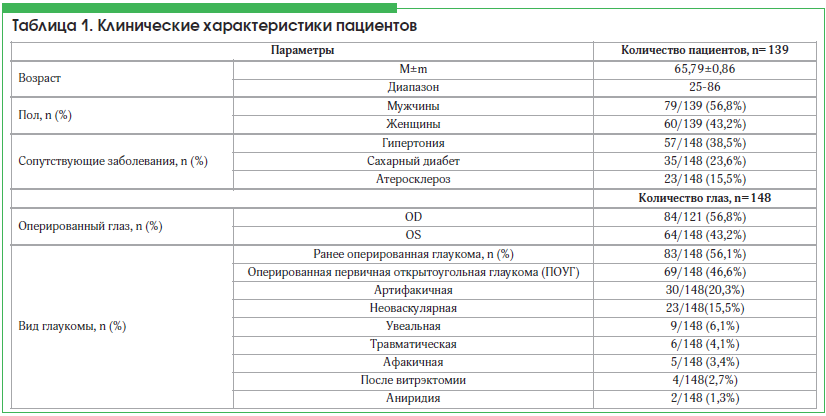
В анамнезе антиглаукомные операции выполнены в 56,1% случаев, преимущественно у пациентов с первичной открытоугольной (ПОУГ) и закрытоугольной глаукомой. Внутриглазное давление (ВГД) у всех пациентов, в т. ч. находящихся на максимальном медикаментозном режиме, превышало 32 мм рт. ст. и составляло в среднем 39,8±0,79 мм рт. ст., отмечались прогрессирование экскавации диска зрительного нерва (ДЗН) и сужение полей зрения.
Перед операцией всем пациентам провели офтальмологическое обследование, включавшее в себя определение остроты зрения по таблицам Сивцева – Головина, измерение ВГД бесконтактным пневмотонометром Topcon (Япония), биомикроскопию переднего отрезка глаза и глазного дна. Визометрия, биомикроскопия, тонометрия выполнялись до операции и при каждой последующей явке пациента на осмотр.
Техника синустрабекулэктомии с имплантацией дренажа Глаутекс была традиционной. Статистическую обработку полученных данных проводили с использованием лицензированного пакета программ Statistica 6.0. Числовые данные представлены в виде «среднее значение ± стандартная ошибка». Оценка достоверности различий между выделенными категориями объектов по какому-либо параметру проводилась при помощи методов непараметрической статистики внутри группы в динамике по критериям Вилкоксона и Фридмана. За вероятность статистически значимых различий принимались значения, начиная с p<0,05.
Результаты и обсуждение
Анализ показателей ВГД у пациентов после антиглаукомной операции с дренажом Глаутекс показал достоверное снижение изучаемого показателя на 70,3% по сравнению с исходными данными (χ2=390,4576, рФ=0,00000) (табл. 2).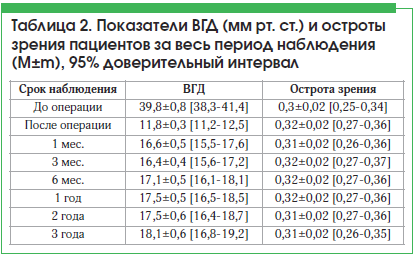
Абсолютный и относительный гипотензивный эффект составил соответственно 74,3% (110/148) и 83,1% (123/148) через 1 год после операции; 70,2% (104/148) и 79,7% (118/148) – спустя 2 года; 68,2% (101/148) и 76,3% (113/148) – после 3 лет наблюдения. При повышении ВГД были назначены гипотензивные препараты: бета-блокаторы, ингибиторы карбоангидразы, аналоги простагландина, а также их комбинации.
Отсутствие гипотензивного эффекта после антиглаукомной операции с дренажом Глаутекс при использовании гипотензивной терапии к концу наблюдаемого срока отмечено в 23,6% (35/148) случаев, из них в течение 1 мес. после операции – в 2% (3/148), через 3 мес. – в 6,1% (9/148), спустя 6 мес. – в 4,7% (7/148), 1 год – в 4,1% (6/148), 2 года – в 3,4% (5/148), 3 года – в 3,4% (5/148) случаев. Повторное хирургическое вмешательство с использованием других имплантатов выполнено в 10,8% (16/148) случаев, нидлинг – в 8,1% (12/148), при этом компенсация ВГД достигнута в 2% (3/148) случаев. Повторная синустрабекулэктомия с применением цитостатиков проведена в 6,1% (9/148) случаев. В 2,7% (4/148) случаев у пациентов с отсутствием зрительных функций и выраженным болевым синдромом выполнена криопексия. Лишь в 2% (3/148) случаев ВГД оставалось умеренно повышенным (до 28 мм рт. ст.) на фоне местной гипотензивной терапии. С учетом отсутствия ухудшения зрительных функций у этих пациентов повторное хирургическое вмешательство не проводилось.
Проведенный анализ в зависимости от вида глаукомы показал, что наибольшая эффективность антиглаукомной операции с дренажом Глаутекс установлена у пациентов с ПОУГ и артифакией (табл. 3). При неоваскулярной и увеальной глаукоме количество успешных исходов значительно меньше, чем при ПОУГ и артифакии. Кроме того, дренаж Глаутекс был неэффективен у пациентов с аниридией в 50% случаев (1/2), после витрэктомии – в 25% (1/4), после травмы – в 16,7% (1/6).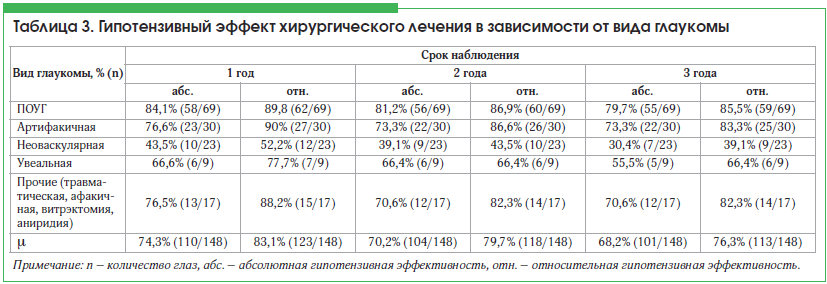
Динамика показателей остроты зрения представлена в таблице 2, отмечена статистическая достоверность анализируемых данных относительно дооперационных значений (χ2=36,48117, рФ=0,00001). После антиглаукомной операции с дренажом Глаутекс повышение остроты зрения отмечено в 9,5% (14/148) случаев. Снижение остроты зрения, связанное с прогрессированием катаракты, отмечено в 5,4% (8/148) случаев. Всем пациентам с осложненной катарактой выполнена факоэмульсификация с имплантацией ИОЛ, что позволило улучшить остроту зрения к 3-му мес. наблюдения. В сроки от 6 мес. до 3-х лет наблюдения отмечалось медленное снижение зрения на фоне прогрессирования глаукомной оптической нейропатии, пролиферативной диабетической ангиоретинопатии и возрастной макулярной дегенерации.
В раннем послеоперационном периоде гифема развилась в 10,8% (16/148) случаев, преимущественно у больных, ранее оперированных по поводу глаукомы, и со вторичной неоваскулярной формой. Воспалительных реакций не было ни в одном случае.
В сроки наблюдения до 1 мес. после антиглаукомной операции с дренажом Глаутекс отслойка сосудистой оболочки отмечена в 18,2% (27/148) случаев. Выпускание супрахориоидальной жидкости в нижневнутреннем или нижненаружном квадрантах глазного яблока выполнено в 12,8% (19/148) случаев. В 5,4% (8/148) случаев отслойка сосудистой оболочки при сохранной передней камере самостоятельно прилегла на фоне медикаментозного лечения.
При биомикроскопии переднего отрезка глаза дренаж просматривался в виде прямоугольника. Полное его рассасывание происходило к 5–6 мес. после операции, однако в 2,7% (4/148) случаев при быстром рубцевании и облитерации зоны оперативного вмешательства отмечалась его визуализация в сроки более 9 мес. после хирургического вмешательства (рис. 1а). Возможно, скорость биодеградации Глаутекса зависит от циркуляции внутриглазной жидкости вокруг дренажа.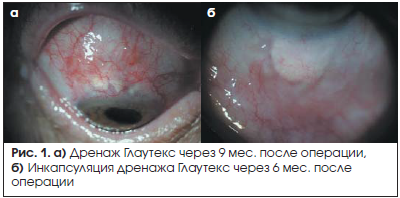
Инкапсуляция дренажа Глаутекс соединительной тканью отмечена в 3,4% (5/148) случаев. При биомикроскопии зона инкапсуляции дренажа определялась в виде приподнятого участка ткани без видимой фильтрации над ним (рис. 1б). При ревизии зоны инкапсуляции спустя 9 мес. после операции Глаутекс внутри капсулы определялся в виде бесформенной зернистой массы.
Вывод
Фистулизирующие операции с дренажом Глаутекс при рефрактерной глаукоме обеспечивают достаточно высокий гипотензивный эффект за счет предотвращения склеро-склерального и склеро-конъюнктивального избыточного послеоперационного рубцевания, обеспечивая нормализацию ВГД в 76,4% случаев при сроках наблюдения за пациентами до 3-х лет.
Гипотензивный эффект фистулизирующих операций с дренажом Глаутекс зависит от исходного вида глаукомы: при ПОУГ – 85,5%, артифакии – 83,3%, неоваскулярной глаукоме – 39,1%, увеальной глаукоме – 66,4% в сроки наблюдения до 3-х лет.
Источник


