Гистологическое исследование с сетчатки
Сетчатка – периферический рецептор зрительного анализатора, специализированная часть мозговой коры, вынесенная на периферию. Выстилает всю внутреннюю поверхность сосудистого тракта, состоит из двух отделов:
1) оптическая часть – задние 2/3 сетчатки, высокодифференцированная нервная ткань из 10-и слоев, заканчивающаяся у места перехода цилиарного тела в хориоидею
2) слепая часть – передняя 1/3 сетчатки, малодифференцированная нервная ткань из 2-х слоев, продолжается до зрачкового края, где образует краевую пигментную кайму.
Место выхода зрительного нерва – диск зрительного нерва, на расстоянии около четырех мм от диска зрительного нерва имеется углубление – желтое пятно.
Гистологически сетчатка – цепь трех нейронов: наружного – фоторецепторного, среднего – ассоциативного, внутреннего – ганглионарного, образующих 10 слоев сетчатки:
1) слой пигментного эпителия – клетки в виде шестигранных призм, расположенных в один ряд, тела клеток заполнены зернами пигмента – фусцина; плотно спаян с сетчаткой
2) слой палочек и колбочек – светочувствительный слой, наружные сегменты фоторецепторов (палочек и колбочек). Палочки – тонкие, цилиндрические, содержат пигмент родопсин, являются аппаратом сумеречного зрения, их количество в 20 раз выше количества колбочек. Колбочки – конусообразные, толще палочек, содержат пигмент йодопсин, являются аппаратом центрального и цветового зрения. В области желтого пятна находятся только колбочки.
3) наружная глиальная пограничная мембрана – полоса межклеточный сцеплений
4) наружный зернистый (ядерный) слой – образован ядрами фоторецепторов
5) наружный сетчатый слой – содержит синапсы, обеспечивающие связь первого и второго нейронов
6) внутренний зернистый (ядерный) слой – тела и ядра вторых биполярных нейронов, имеющих два отростка – один для связи с фотосенсорными клетками, второй – для образования синапса с дендритами оптико-ганглионарных клеток. Биполяры контактируют с несколькими палочковыми клетками и только с одной из колбочковых клеток.
7) внутренний сетчатый слой – синапсы биполярных и оптико-ганглионарных нейронов.
8) ганглионарный слой – оптико-ганглионарные нейроны, имеют крупное ядро, сильно ветвящиеся дендриты и один аксон – цилиндр.
9) слой нервных волокон – аксоны оптико-ганглионарных нейронов, формирующих зрительный нерв
10) внутренняя глиальная пограничная мембрана – покрывает поверхность сетчатки изнутри, основная мембрана, основаниями отросткой нейроглиальных клеток Мюллера.
Мюллеровские клетки – высокоспециализированные гигантские клетки, проходящие через все слои сетчатки. Выполняют опорную и изолирующую функцию, осуществляют активный транспорт метаболитов на разных уровнях сетчатки, участвуют в генерации биоэлектрических токов, разделяют рецептивные поверхности нейронов.
Ядерные и ганглионарные слои соответствуют телам нейронов, сетчатые – их контактам.
В области центральной ямки (желтого пятна) сетчатка состоит только из колбочконесущих клеток, что обеспечивает высокое центральное зрение.
Фиксация сетчатки: оптическая часть сетчатки крепко соединена с подлежащими тканями в двух местах: 1) у зубчатого края 2) вокруг зрительного нерва. На остальном протяжении сетчатка прилежит к сосудистой оболочке, удерживаясь на своем месте давлением стекловидного тела и достаточно плотной связью между палочками, колбочками и отростками клеток пигментного эпителия.
Функция сетчатки: преобразование светового раздражения в нервное возбуждение и первичная обработка сигнала.
Методы исследования сетчатки:
1) офтальмоскопия
2) офтальмохромоскопия (исследование с помощью офтальмоскопа со светофильтрами, позволяющее увидеть самые начальные изменения на глазном дне)
3) биомикроскопия с фундус-линзой
4) флюоресцентная ангиография сетчатки
5) эхоофтальмоскопия
Источник
Описание

Автор: В. В. Страхов, Л. А. Деев, В. В. Алексеев, А. В. Ярцев, Н. В. Корчагин, А. И. Малахова, В. В. Молчанов
ГОУ ВПО Ярославская государственная медицинская академия; ГОУ ВПО Смоленская государственная медицинская академия; ОГУЗ Смоленская областная клиническая больница; ОГУЗ Смоленский областной институт патологии
Посредством спектральной ОКТ и гистологического исследования проведен сравнительный анализ структуры слоев сетчатки у пациентов с ПОУГ и в группе контроля, состоящей из здоровых лиц. Установлено очевидное совпадение гистологической и ретинотомографической картин повреждения сетчатки при первичной глаукоме, что позволяет рассматривать ОКТ как адекватный прижизненный метод исследования слоев сетчатки при глаукоме, в том числе в ранних стадиях заболевания. Выявлены дистрофические изменения всех слоев сетчатки при первичной глаукоме. Непосредственной причиной дистрофических изменений наружных и средних слоев сетчатки является снижение объемного кровотока, в основе которого лежит склероз и гиалиноз сосудов увеального тракта.
Вопросы патогенеза первичной открытоугольной глаукомы (ПОУГ) широко дискутируются в мировой научной литературе, что свидетельствует о неослабевающем интересе ученых и клиницистов к этой проблеме. Повреждение диска зрительного нерва (ДЗН) и развитие специфической нейрооп-тикопатии долгое время рассматривали как единственную причину зрительных расстройств при глаукоме. Однако появились данные, свидетельствующие о вовлечении сетчатки в патологический процесс, причем, по-видимому, вследствие нарушения метаболизма в самой сетчатке.
Цель исследования — сравнительная характеристика структурного состояния сетчатки глаза по данным оптической когерентной томографии (ОКТ) и гистологических исследований микросрезов сетчатки в норме и при ПОУГ.
Обследована группа пациентов с ПОУГ в количестве 76 человек (138 глаз), средний возраст 63,37 ± 2,1 года. Средний уровень ВГД (Р0) 19,68 ± 0,98 мм рт. ст., рефракция — от —3,0 дптр до +3,0 дптр. Из 138 глаз — 64 глаза с начальной глаукомой, 41 глаз с развитой глаукомой, 19 глаз с далеко зашедшей глаукомой и 14 глаз с терминальной болящей глаукомой. Все пациенты не имели макулодистрофии и другой тяжелой сопутствующей патологии.
В контрольную группу вошли 22 человека (40 глаз), средний возраст 60,50 ± 0,91 года. Средний уровень ВГД (Р0 составил 14,5 ± 0,68 мм рт. ст. Все обследованные контрольной группы также не имели макулодистрофии и тяжелой сопутствующей патологии.
Обследования предусматривали проведение спектральной ОКТ у пациентов с ПОУГ I—111 стадии, а также гистологическое исследование сетчатки энуклеированных глаз пациентов с терминальной глаукомой.
Спектральную ОКТ выполняли на аппарате Cirrus HD-OCT 4000 (Германия) с анализом протоколов Macular Thickness Map. Использовали ламинарный дизайн, т. е. исследование микро-сканов сетчатки по слоям. Оценивали объем и среднюю толщину макулярной зоны (MZ), толщину комплекса пигментного эпителия (ПЭ) и мембраны Бруха (RPE), толщину комплекса RPE до зоны сочленения наружных и внутренних сегментов фоторецепторов (IS/OS), толщину наружного (ONL) и внутреннего (1NL) ядерных слоев, слоя ганглиозных клеток (GCL) и слоя нервных волокон макулярной зоны (NFL). Мы использовали цифровые значения объема и средней толщины MZ из протоколов исследования, а толщину остальных слоев сетчатки измеряли в зонах, отступая на 1,5 мм вправо и влево от фовеолярного минимума по горизонтальному меридиану, затем вычисляли среднеарифметическое значение толщины.
У 14 пациентов с абсолютной глаукомой была выполнена энуклеация пораженного глаза с последующим гистологическим исследованием. Материал помещали в 40% раствор формалина на 3 дня. Затем выполняли ряд поперечных микросрезов сетчатки глаз: в области зубчатой линии, в области экватора и через центральную зону сетчатки глаза. Срезы фиксировали и окрашивали гематоксилином и эозином, что позволяет получить общее представление о состоянии исследуемых тканей.
КТ-исследование сетчатки. С помощью спектральной ОКТ были выявлены значительные структурные изменения сетчатки у пациентов с глаукомой (см. таблицу).
Мы обратили внимание на уменьшение как объема, так и толщины MZ по мере прогрессирования заболевания. Объем MZ в начальной стадии составил 9,9 ± 0,23 мм3, а средняя толщина — 276,2 ± 2,99 мкм. В группе пациентов с развитой глаукомой мы отметили сокращение средней толщины макулы и некоторое снижение ее объема (до 9,49 ± 0,32 мм3). Хотя уменьшение объема не вышло на уровень статистической значимости (р < 0,06), тем не менее оно отражало общую тенденцию развития процесса. В далеко зашедшей стадии отмечали дальнейшее уменьшение как средней толщины, так и объема MZ (249,37 ± 13,39 мкм и 8,66 ± 0,85 мм3 соответственно), что было меньше, чем в группе больных со II стадией заболевания (достоверность различия средних р = 0,06), и статистически значимо (р < 0,05) отличалось от начальной глаукомы.
Уменьшение толщины и объема MZ — это хорошо известный факт, отмеченный уже при использовании классической методики ОКТ (Stratus). Большинство исследователей такое уменьшение объема и толщины макулы объясняли исключительно сокращением толщины NFL и GCL [2, 7]. Действительно, NFL и GCL макулы претерпевают изменения при ПОУГ. В I стадии глаукомы толщина NFL составляла 23,61 ± 3,59 мкм, толщина GCL — 101,17 ± 0,7 мкм. В развитой стадии глаукомы они уменьшились на 8% (21,9 ± 2,62 и 97,85 ± 9,91 мкм соответственно), в далеко зашедшей стадии — на 26% (17,36 ± 3,99 мкм) и на 29% (75,14 ± 11,3 мкм) соответственно по сравнению с начальной глаукомой.
Различия в толщине GCL были статистически значимы (р < 0,05) между всеми группами пациентов. Различия в толщине NFL оказались статистически значимыми (р 0,05). Это объясняет известный факт большей диагностической значимости исследования слоя нервных волокон в перипапиллярной зоне, чем в макулярной.
Вместе с тем уменьшение объема MZ нельзя связывать только с истончением NFL и GCL. Страдают все слои сетчатки, начиная с ПЭ и заканчивая слоем нервных волокон. Так, INL сетчатки при ПОУГ оказался истонченным. По нашим данным, в начальной стадии ПОУГ его толщина составила 52 ± 3,25 мкм. В развитой стадии глаукомы она уменьшилась на 11% (46,65 ± 5,49 мкм), а в далеко зашедшей стадии средняя толщина INL составила 42,29 ± 5,72 мкм, что на 19% меньше, чем при начальной глаукоме.
Обращает на себя внимание однонаправленное уменьшение толщины как GCL, так и INL, причем вклад обоих этих слоев в уменьшение средней толщины MZ при прогрессировании ПОУГ практически одинаков. При измерении толщины ONL мы обнаружили, что в I стадии ПОУГ она составила 91,89 ± 4,81 мкм, во II — 87,4 ± 6,4 мкм (на 5% меньше, чем в I стадии) и в III — 86,43 ± 7,34 мкм (что на 6% меньше по сравнению с I стадией ПОУГ). Различия в толщине INL и ONL как между группами контроля и больных глаукомой, так и между группами больных с начальной, развитой и далеко зашедшей глаукомой были статистически значимы (р < 0,05).
Обнаружены истончение наружных слоев сетчатки в группе пациентов с глаукомой и отчетливая негативная динамика толщины комплекса наружных слоев от ПЭ до сочленения IS/OS (RPE + IS/ OS) по мере прогрессирования глаукомы. При начальной ПОУГ данный показатель составил 61,88 ± 1,14 мкм, что отличается от контрольной группы на 7,0 мкм (р < 0,05).
Во II и III стадиях заболевания он изменяется в меньшей степени по отношению к предыдущей стадии заболевания, но различия между группой контроля и группами с I, II и III стадиями ПОУГ были статистически значимы (р < 0,05), причем оказалось, что истончение комплекса RPE + IS/OS главным образом происходит за счет уменьшения толщины ПЭ, измеряемой нами от мембраны Вирхофа до мембраны Бруха.
Так, при начальной глаукоме она составила 36,59 ± 1,99 мкм (на 13% меньше, чем в норме), при развитой глаукоме — 35,06 ± 2,92 мкм (на 17% меньше, чем в норме) и при далеко зашедшей глаукоме — 33,17 ± 3,11 мкм (на 22% меньше, чем в норме). Средние значения в группах достоверно различались (р < 0,05). Таким образом, установлено, что уменьшение толщины комплекса мембрана Бруха + ПЭ + наружные сегменты фоторецепторов связано в основном с истончением ПЭ.
Необходимо подчеркнуть, что при использовании технологии спектральной ОКТ наиболее наглядно структурные изменения наружных слоев сетчатки видны при оценке асимметрии ОКТ-томограмм идентичных участков сетчатки парных глаз. В качестве иллюстрации (рис. 1) ниже приводятся спектральные ОКТ-томограммы пациентки А., страдающей ПОУГ III стадии OD и I стадии OS с нормальным уровнем ВГД.
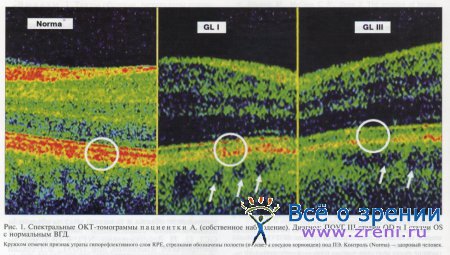
Сопоставлены идентичные участки оптических срезов сетчатки, проходящие горизонтально через фовеолярный минимум. На рисунке показаны зоны, соответствующие наружным секторам макулярной зоны, причем срезы выровнены по уровню наружной пограничной мембраны (ELM). На представленных томограммах несомненно истончение слоя ПЭ на худшем глазу.
Более того, изменения ПЭ при первичной глаукоме по данным спектральной ОКТ можно описывать не только количественно, но и качественно. Признаком, отражающим качественные изменения интервала RPE, является постепенное по мере прогрессирования заболевания истончение гипорефлективного слоя RPE вплоть до его исчезновения. При этом последняя и предпоследняя гиперрефлективные полосы наружных слоев (ВМ и VM) сливаются в одну линию (см. рис. 1). С патоморфологической точки зрения данный признак может отражать уменьшение высоты клеток ПЭ у пациентов с первичной глаукомой.
Визуально оценивая пространство под ПЭ, мы обнаружили, что в норме (см. рис. 1) оно выглядит однородным и программно картируется зеленым цветом. Это свидетельствует о том, что ПЭ у здоровых людей хорошо экранирует свет, поэтому структуры, находящиеся под ним, визуализируются очень слабо.
При первичной глаукоме в пространство под ПЭ на зеленом фоне появляются темные полости в виде замкнутых кругов (см. рис. 1). Мы считаем, что этими полостями являются просветы сосудов хориоидеи, которые становятся видимыми при снижении экранирующей способности ПЭ, что особенно четко проявляется в развитой стадии глаукомы. Данное утверждение хорошо соотносится с анатомо-гистологическими представлениями о зоне заднего отрезка глаукомного глаза.
Гистологическое исследование сетчатки.
При сравнении данных гистологического исследования наружных слоев сетчатки у лиц с глаукомой и группы контроля выявлены существенные отличия (рис. 2—6).
В норме слой ПЭ выглядит однородным, практически одинаковой толщины на всем протяжении (см. рис. 2). Дегенеративные участки в данном слое отсутствуют. Ядра клеток ПЭ расположены в один ряд плотно друг к другу. Цвет пигментного листка темно-коричневый, местами переходящий в черный. Под мембраной Бруха видны сосуды хориоидеи разного калибра. Перегородки между стенками сосудов содержат большое количество меланина, поэтому визуализируются как черные.
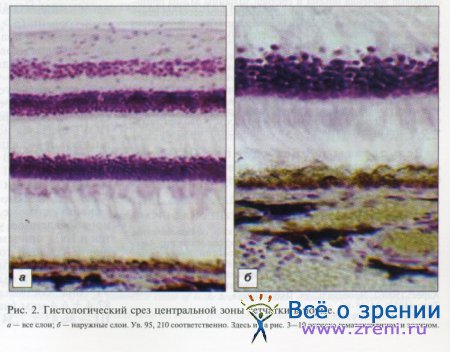
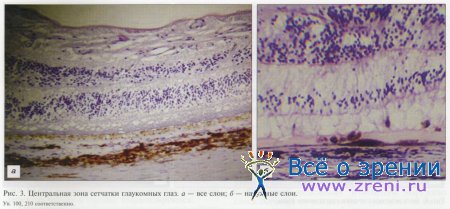
При ПОУГ обнаружено нарушение архитектоники пигментного слоя. Дистрофия и даже атрофия отдельных его участков встречается в центральной зоне сетчатки (см. рис. 3). Дегенеративные участки в ПЭ — от точечных до более протяженных (около 1,0—3,0 мм). Бросается в глаза существенное снижение плотности ПЭ сетчатки. Он бледнеет, его окраска вместо темно-коричневой, как в норме, становится бежевой и даже близкой к желтой. Мы обнаружили разрушение и уплощение отдельных клеток ПЭ, его дезинтеграцию. Количество «здоровых» клеток уменьшается, а патологически измененные клетки становятся безъядерными, и на их месте образуются мелкие полости, сформированные остатками клеточных стенок.
Отмечено уменьшение толщины некоторых участков пигментного листка центральной зоны сетчатки вплоть до едва заметной тонкой линии, местами переходящей в полноценный слой. Можно предположить, что по этой причине нарушается связь между нейросенсорной частью и ПЭ сетчатки. Становится понятно, почему у лиц с ПОУГ отмечают функциональные нарушения, характерные для повреждения ПЭ, например нарушение темновой адаптации.
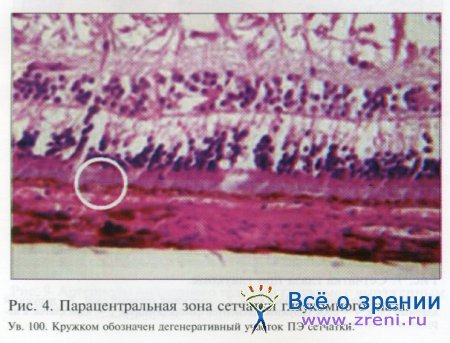
В парацентральной области сетчатки дегенеративные участки ПЭ на фоне ПОУГ не такие протяженные, как в центре, но границы их более четкие (см. рис. 4). Видно явное истончение слоя ПЭ на значительном протяжении. В этих же зонах исчезают ядра пигментных эпителиоцитов либо отмечается их разреженность. В парацентральной зоне сетчатки мы наблюдали такое явление, как миграция пигментных эпителиоцитов в нейросенсорный слой (см. рис. 5). Мигрируют как отдельные клетки, так и небольшие скопления, при этом под мигрирующими клетками видны точечные дефекты в слое ПЭ сетчатки.
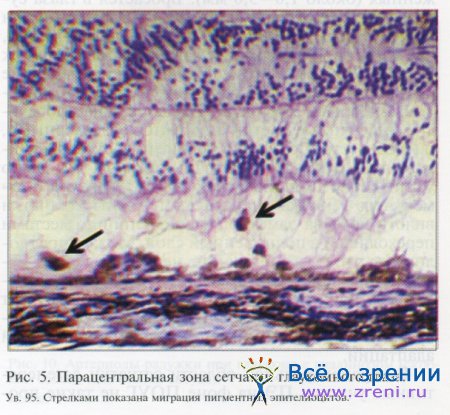
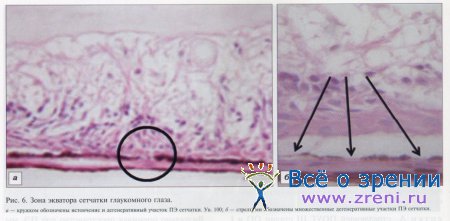
В зоне экватора сетчатки при ПОУГ обнаружены дегенеративные участки в ПЭ сетчатки (см. рис. 6) от единичных до множественных. Границы дефектов четкие и хорошо визуализируются.
При оценке структуры наружных слоев сетчатки мы выявили также признаки дегенерации фоторецепторов. Если в норме многочисленные ядра палочек и колбочек были расположены компактно и формировали широкий слой (см. рис. 2, а), то в глазах с терминальной глаукомой наружный ядерный слой оказался меньшей толщины, ядра клеток располагались более свободно за счет распространенной гибели клеток (на рис. 7, 3). Поражение фоторецепторов неизбежно сопровождается атрофией наружных сегментов клеток и их аксонов.
Гибель указанных микроструктур гистологически проявилась в виде очаговой атрофии с формированием микрокист как в наружном сетчатом слое (на рис. 7, 2), так и в слое наружных сегментов фоторецепторов (на рис. 7, 4), причем эти изменения оказались значительно более выраженными в наружном сетчатом слое, сформированном нервными отростками биполярных клеток и фоторецепторов. Возможно, это связано с различной толщиной аксонов и наружных сегментов фоторецепторов.
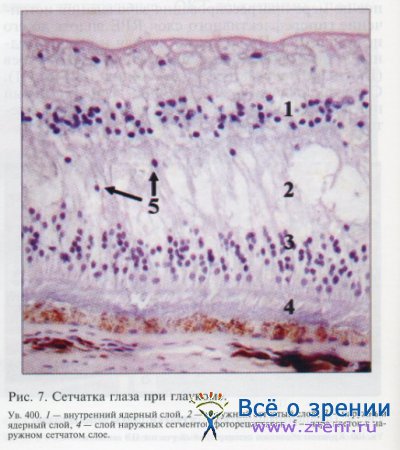
Известно, что наружные сегменты палочек и колбочек в несколько раз крупнее и расположены более плотно, нежели аксоны фоторецепторов, поэтому пропорциональная атрофия указанных структур нагляднее проявляется именно в наружном сетчатом слое сетчатки.
Кроме того, в наружном сетчатом слое при глаукоме мы обнаружили клеточные ядра (на рис. 7, 5). Вероятнее всего, это ядра биполярных клеток сетчатки. Миграция клеток может быть связана с потерей нервными клетками опоры в виде сети нервных отростков и их смещением в зону меньшей плотности, зону атрофии. Перемещение единичных ядер биполярных клеток сопровождалось дезорганизацией внутреннего ядерного слоя сетчатки (на рис. 7, 1). Вместе с тем для указанного слоя оказалось характерным и снижение плотности расположения ядер, что может свидетельствовать о дегенерации биполярных клеток.
Патогенез описанных изменений наружных слоев сетчатки от пигментного эпителия до биполярных клеток трудно объяснить непосредственным повреждающим влиянием повышенного ВГД. Мы считаем, что в основе данного дистрофического процесса лежит редукция внутриглазной гемодинамики. Уменьшение объемного глазного кровотока при глаукоме было подтверждено ранее, в том числе нашими исследованиями с применением метода офтальмоплетизмографии.
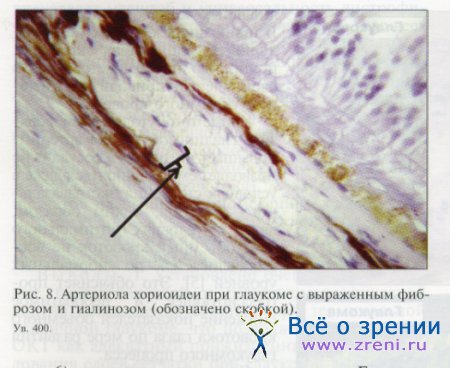
Представляла интерес попытка обнаружить морфологический субстрат патологических гемо-динамических сдвигов при глаукоме. В норме в глазах пожилых людей стенки артериол хороидеи выглядят умеренно утолщенными в соответствии с инволюционными атеросклеротическими изменениями. При глаукоме сосуды хороидеи характеризуются весьма существенным утолщением стенки, намного превышающим инволюционное за счет выраженного фиброза и гиалиноза (рис. 8). Просвет сосудов оказался существенно сужен вплоть до полной окклюзии в некоторых случаях.
Точно такие же изменения мы обнаружили в артериолах цилиарного тела (рис. 9) и радужной оболочки (рис. 10). Таким образом, выраженные структурные изменения сосудов охватывали все анатомические отделы сосудистой оболочки глаза.
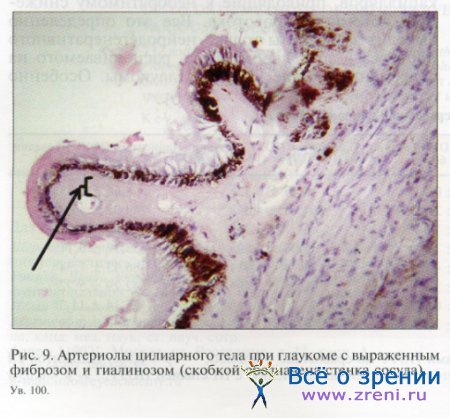
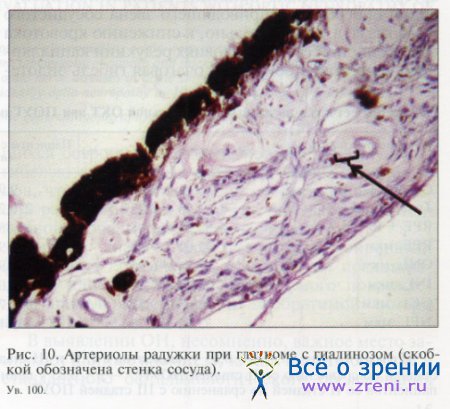
Очевидно, что подобное уменьшение просвета артериол неизбежно приводит к снижению пропускной способности приводящего звена сосудистого ложа глаза, а, следовательно, к снижению кровотока в капиллярной сети. В условиях редукции капиллярного кровотока происходит очаговая гибель эндотелиальных клеток и перицитов. В таких поврежденных (ацеллюлярных) капиллярах кровоток полностью прекращается, что в свою очередь приводит к снижению объемного кровотока.
Кроме того, утолщенная в связи с гиалинозом стенка артериол повышает ригидность сосуда и не позволяет ему расширяться даже в условиях снижения экстравазаль-ного давления. Таким образом, даже в условиях оптимального ВГД объемный кровоток не восстанавливается до нормальных уровней. Это объясняет прогрессирующее и необратимое снижение показателей объемного кровотока глаза по мере развития глаукомного процесса.
Сравнительный анализ мик-росканов спектральной ОКТ сетчатки живых глаукомных глаз и микросрезов сетчатки в энук-леированных глазах указывает на адекватность ОКТ-исследования тонких структур сетчатки, поскольку ретинотомографическая картина распределения когерентного света в слоях сетчатки при глаукоме практически совпадает с гистологической картиной структурных нарушений (рис. 11).
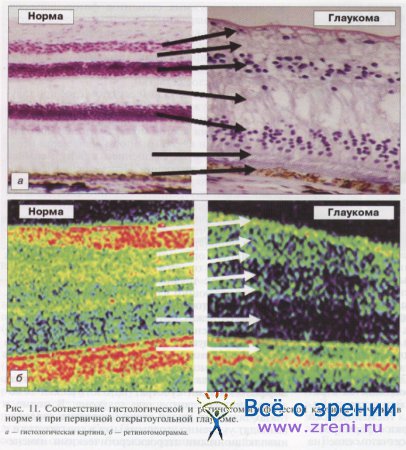

Более того, гистологические изменения в сетчатке прямо указывают на природу этих структурных нарушений, а именно на дистрофический процесс, охватывающий все слои сетчатки, отражая тем самым важную, если не важнейшую, проблему первичной глаукомы. Найден и морфологический субстрат дистрофии — фиброзное и гиалинозное перерождение стенки внутриглазных сосудов и редукция капилляров, приводящие к необратимому снижению объемного кровотока. Все это определенно выходит за пределы только нейродегенеративного процесса в зрительном нерве, расцениваемого на современном этапе как суть глаукомы.
Особенно впечатляет масштаб и универсальность дистрофических процессов не только в сетчатке, но и во всех внутренних оболочках глазного яблока при глаукоме, их однонаправленная динамика по мере про-грессирования заболевания. В свете указанных особенностей исключительное значение решетчатой пластины в патогенезе глаукомы представляется несколько преувеличенным. Вместе с тем и дистрофия внутренних оболочек глазного яблока, включая ДЗН (с гемодинамическими корнями снижения объемного кровотока), и деформация решетчатой пластинки (с биомеханическими корнями) могут и должны рассматриваться как единый процесс, если признать их вторичность, по крайней мере по отношению к повышенному ВГД.
1. Установлено очевидное совпадение гистологической и ретинотомографической картин повреждения сетчатки при терминальной первичной глаукоме, что позволяет рассматривать ОКТ как адекватный прижизненный метод исследования слоев сетчатки при глаукоме, в том числе в ранних стадиях заболевания.
2. С помощью гистологических методов и спектральной ОКТ выявлены дистрофические изменения всех слоев сетчатки при первичной глаукоме.
3. Непосредственной причиной дистрофических изменений наружных и средних слоев сетчатки является снижение объемного кровотока, в основе которого лежат склероз и гиалиноз сосудов увеального тракта.
—
Статья из журнала: Вестник Офтальмологии | Том 128. №2 2011
Источник


