Генетические исследования по глаукоме
Статья посвящена возможностям генетического исследования при первичной открытоугольной глаукоме
Особенностью течения ПОУГ является практически бессимптомное начало заболевания. В связи с этим важное значение имеют новые методы диагностики, в т. ч. молекулярно-генетические и параклинические методы обследования.
Данное положение определяет вопрос о необходимости поиска и исследования новейших действенных методов ранней диагностики глаукомы и введения их в практику [1].
Данные многочисленных исследований говорят о том, что значительная доля заболевания ПОУГ генетически обусловлена (от 21 до 50%), а риск развития данного заболевания у потомков больных глаукомой в 10 раз больше, нежели среднепопуляционный [2, 3]. В последние годы ведется активное изучение ПОУГ-генов и генов, вовлеченных в развитие глаукомы. К настоящему времени найдено около 25 генов, вызывающих заболевание или связанных с ним (табл. 1) [4, 5].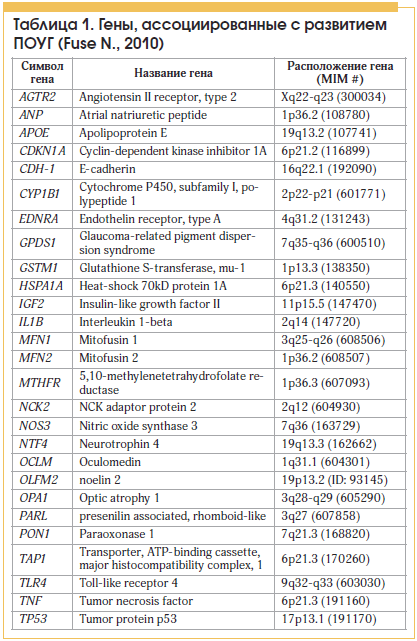
С 3 генами, такими как myocilin (MYOC), optineurin (OPTN) и WD repeat domain 36 (WDR36), связано не менее 10% всех случаев ПОУГ [5–13].
Глаукома, связанная с мутациями в генах OPTN (10р14-р15) и MYOC (Iq24.3-q25.2), принадлежит к группе моногенных болезней и наследуется по аутосомно-доминантному типу. Носители мутаций в этих генах рискуют заболеть ПОУГ в течение жизни с вероятностью от 60 до 100% [2]. Проведенные S. Monemi et al. исследования подтверждают, что сочетание мутаций в гетерозиготном состоянии в двух генах СYP1B1 и MYOC приводит к возникновению глаукомы с более злокачественным течением и ранним манифестированием [7].
При изменении последовательности аминокислот в результате мутации в гене MYOC миоцилин откладывается в зоне трабекулы и создает механическое препятствие для циркуляции внутриглазной жидкости. Мутантные формы миоцилина, в норме являющегося секреторным белком, не секретируются из клеток и уменьшают выделение нормальных форм миоцилина в том случае, когда обе формы коэкспрессируют в клетке. В мировой базе среди описанных мутаций миоцилина основную массу занимают миссенс- (83%) и нонсенс-мутации (6,4%). Около 6% составляют малые делеции, вставки и их комбинации. Основная масса полиморфизмов (а это несколько сотен) проанализирована в базе myocilin.com/variants.php. Наиболее тяжелые клинические проявления отмечаются в случае обрыва цепи миоцилина (rs139804296, rs74315329, rs143413116, rs74315337), а также в случае изменения структуры считываемого белка [14]. Известными являются мутации Gly252Arg (замещение глицина с аргинином в кодоне 252), Q368 мутация, iNOS, микросателлиты (ССТТТ)14, Туr347Туr в экзоне 3 и Arg76Lys в экзоне 1 [15].
Белок оптиневрин (ген OPTN) является частью белкового комплекса, регулирующего транспорт и экзоцитоз, и играет определенную роль в механизме апоптоза, выступая в качестве компонента опосредованного TNF-α сигнального пути. Среди его полиморфизмов известны Thr34Thr, Glul63Glu и 553-5С [16].
J.W. Cheng et al. провели метаанализ 32 опубликованных исследований связи между ПОУГ и R46X, R76K, Y347Y, T353I и Q368X полиморфизмов гена myocilin. Два полиморфизма Q368X и T353I были связаны с высоким риском глаукомы, при этом мутация Q368X характерна для европейской популяции, а мутация T353I – для азиатской [17].
В работе V. Mendoza-Renoso et al. проанализированы мутации гена миоцилина у 205 больных ПОУГ и 209 здоровых пациентов в Перу. Выявлены одиночные миссенс-мутации Gly326Ser и Trp286Arg у больных ПОУГ. Полиморфизмы Thr325Thr и Tyr347Tyr и Met476Arg выявлены и в группе контроля [18].
В.В. Рахманов у больных ПОУГ в Санкт-Петербурге идентифицировал мутацию Q368X в гене миоцилина, частота встречаемости которой составила 1,8%, что сравнимо с частотой ее встречаемости у больных ПОУГ в других популяциях за рубежом. Также было выявлено, что мутация Е50К в 4-м экзоне гена ОPTN, обнаруженная в США и Англии, не характерна для больных ПОУГ в Санкт-Петербурге, а аллель А полиморфизма М98К (с. 603 Т>А) гена оптиневрин может рассматриваться в качестве генетического фактора риска заболевания. Для других исследуемых полиморфизмов в генах миоцилина (Т285Т, Т325Т, Y347Y, K398R) и оптиневрина (L41L) ассоциации с глаукомой выявлено не было. Также проведено исследование мутации E50K (c. 458G>A) в гене OPTN, которая была обнаружена Т. Rezaie et al. в 2002 г. у 13,5% больных глаукомой, из которых 81,6% страдали глаукомой нормального давления. Автор не обнаружил этой мутации в российской популяции. Вариант L41L в гене OPTN был найден у 5 (2,9%) пробандов с ПОУГ [19, 20].
Проблеме исследования мутаций и полиморфизмов в генах миоцилина и цитохрома Р4501В1 у больных глаукомой в популяции Санкт-Петербурга посвящена работа А.Е. Мотущук [21]. Установлено, что полиморфизм L432V гена CYP1B1 у больных ПОУГ является нейтральным вариантом последовательности, не связанным с развитием заболевания.
В исследовании F. Lopez-Martinez et al. не выявлено ассоциаций с ПОУГ генетических вариантов MYOC (-1000C> G, -387C> T, -306G> А, -224T> С, -126T> С и -83G> А) в испанской популяции. Авторы также обнаружили у 3 (2,7%) пациентов с ПОУГ патогенные мутации в гене миоцилина. Две из этих мутаций (Gln368Stop и Ala445Val) были описаны ранее, в то время как третья (Tyr479His) была обнаружена впервые [22].
R. Rose et al. у 100 пациентов с ПОУГ из региона Каньякумари (Индия) выявили следующие мутации: Ser331Thr, Pro370Leu,Tyr347Tyr, Thr325Thr, Ser331Thrв в гене MYOC. Частота этих мутаций – 2%, что хорошо согласуется с другими сообщениями из Индии и иных стран [23].
S. Mookherjee et al. изучали связь полиморфных маркеров гена WDR36 с развитием ПОУГ у пациентов из Восточной Индии. Были отобраны 10 одиночных нуклеотидных полиморфизмов (rs1971050, rs1993465, rs13153937, rs10038177, rs11241095, rs10043631, rs10038058, rs10491424, rs17553936 и rs13186912), охватывающих практически весь ген WDR36. Исследовали 323 пациента с ПОУГ и 303 индивидуума из группы контроля. Установлена связь между данными полиморфизмами и ПОУГ с высоким ВГД [24].
L.Y. Jia et al. исследовали полиморфизмы генов myocilin (MYOC), optineurin (OPTN), WDR36 и аполипопротеина Е (АpoЕ) у 176 пациентов с ПОУГ и 200 человек из группы контроля из северной китайской популяции. Выявлены полиморфные локусы, ассоциированные с ПОУГ: MYOC IVS2 + 35A> G, OPTN Met98Lys, OPTN IVS5 + 38 т> G, OPTN IVS8-53T> С, WDR36 IVS5 + 30С> Т и АРОЕ -491A> T [25].
Y. Ikeda et al. проанализировали одиночные нуклеотидные полиморфизмы, которые позиционируются в качестве ПОУГ-ассоциированных у японского населения. Всего было исследовано 521 больной ПОУГ и 519 здоровых людей. В общей сложности было исследовано 154 полиморфизма из разных генов. Связанными с ПОУГ оказались следующие полиморфизмы: — rs11258194 в гене OPTN, 4 полиморфизма в гене WDR36 (rs1993465, rs13153937, rs6859041 и rs2034896), полиморфизм гена рецептора β2, ADRB2 (rs1042720) и 1 гена MTHFR (rs11559040) [11, 26].
А. Kumar et al. исследовали генетические полиморфизмы у пациентов с ПОУГ в популяции Индии. Частота генетических вариантов Pro193Leu, Glu229Lys, Arg368His и Met292Lys гена CYP1B1, Gln48His гена MYOC, Met98Lys гена OPTN в группе больных не отличалась от таковой в группе контроля [11].
Изучению вовлеченности генов системы детоксикации ксенобиотиков (CYP1B1, глутатион-S-трансфераза) в формирование ПОУГ посвящен ряд статей [2, 11, 27–30].
М. Űnal et al. исследовали генетические полиморфизмы глутатион S-трансферазы (GSTM1, GSTT1) у турецкого населения и выявили, что риск развития глаукомы значительно увеличивался у пациентов с комбинацией этих полиморфизмов [27].
W. Huang et al. провели метаанализ генетических полиморфизмов глутатион S-трансферазы при ПОУГ и получили следующие результаты. Авторы рассмотрели 11 исследований по GSTM1 (нулевой генотип) (1339 пациентов и 1412 лиц из группы контроля) и 7 исследований по GSTT1 (двойной генотип) (958 случаев, 1003 лица из группы контроля) и показали, что нулевой генотип GSTM1 повышает риск развития ПОУГ у азиатов, а генотип GSTM1 / GSTT1 связан с повышенным риском развития ПОУГ в европейской популяции [29].
Ряд исследований посвящен анализу ассоциаций генов системы апоптоза с развитием ПОУГ [5, 31, 32].
C.L. Daugherty et al. изучили роль полиморфизмов гена, кодирующего белок p53: rs1042522 (Arg72Pro), rs17878362 (16 п.н. Ins/Del) и rs1800371 (Pro47Ser), в подверженности к ПОУГ у пациентов в США. Проводилось исследование 191 пациента с ПОУГ и 167 пациентов группы контроля. Результаты исследования свидетельствуют о том, что генетический вариант rs1042522 связан с повышенным риском развития ПОУГ [31].
А.И. Белоусова обнаружила, что проапоптотические аллельные варианты генов p53(C72G), р21(С31А) и фактора некроза опухоли TNFa(G308A) оказывают значимое влияние на формирование ПОУГ, скорость прогрессирования и тяжесть течения заболевания в русской и бурятской этнических группах. Выявлено, что генетические полиморфизмы p53(C72G), р21(С31А) и TNFa(G308A) увеличивают риск развития ПОУГ среди лиц русской национальности в большей степени, чем у индивидуумов бурятской национальности [3].
Y. Guo et al. провели метаанализ нескольких баз данных для оценки ассоциаций между 2 полиморфизмами TP53 (в 4 экзоне в 3 интроне) и ПОУГ. По первому полиморфизму было рассмотрено 1930 пациентов и 1463 лица группы контроля из 9 независимых исследований, по второму полиморфизму – 858 пациентов с ПОУГ и 683 лица группы контроля в 4 исследованиях. Анализ показал значимую связь полиморфизма P53Arg72Pro с риском развития ПОУГ. В анализе подгрупп по этническому признаку (европейская и азиатская популяция) была обнаружена связь между этим полиморфизмом и риском ПОУГ в азиатской популяции (OR-1,36). В европейской популяции значимых ассоциаций выявлено не было. Сделан вывод о том, что полиморфизм P53Arg72Pro гена TP53 может влиять на индивидуальную восприимчивость к ПОУГ [32].
Одно из центральных звеньев в нарушении процессов апоптоза – факторы некроза опухолей и их рецепторы, имеющие широкий спектр биологического действия. В последнее время проведен ряд исследований по изучению ассоциаций полиморфизмов генов факторов некроза опухолей и их рецепторов с развитием ПОУГ в различных популяциях. Наибольший интерес исследователей вызывает полиморфизм 308G/A, расположенный в промоторной части гена TNFα [33, 34]. Исследованию вовлеченности в развитие ПОУГ генов фактора некроза опухолей посвящена работа Е.В. Тикуновой [35]. Автором выявлено, что фактором риска развития ПОУГ является аллель -308G TNFα (OR=1,78), а протективным фактором по данной патологии – генетический маркер -308АA TNFα (OR=0,01) и комбинации генетических вариантов: +1663АА TNFR2 с +250G Ltα (OR=0,34); -308AA TNFα с +250G Ltα (OR=0,09) и -308AA TNFα с +36А TNFR1 (OR=0,09). Генотипы -308GG TNFα, +250AA Ltα, +36GG TNFR1 и +36AG TNFR1 связаны с ранней манифестацией ПОУГ.
Важное патогенетическое значение при формировании ПОУГ имеют факторы роста. М.Ю. Кириленко (2014) выявлено, что генетические варианты сосудисто-эндотелиального (VEGF-A с.- 958C>T, rs 833061), инсулиноподобного (IGF-1 c.-1410T>C, rs 35767), трансформирующего (TGFβ-1 c.-1347T>C, rs 1800469), рецептора инсулиноподобного (IGFR-1 g.99181663C>T, rs 4965425) факторов роста и их комбинации ассоциированы с развитием и клиническим течением ПОУГ, а именно генетический вариант TIGFR-1 (OR=1,55) и комбинации аллелей С VEGF-A с Т IGFR-1 (ОR=3,17), С VEGF-A, Т IGF-1, Т TGFβ-1 (ОR=2,72), Т VEGF-A, Т IGF-1, С TGFβ-1 (ОR=2,13) являются факторами риска для ПОУГ [36].
Ряд публикаций посвящен исследованию ассоциаций между генами Toll-подобных рецепторов и развитием ПОУГ [4, 37, 38].
Е. Shibuya et al. выявили связь ряда полиморфизмов в гене TLR4 с риском развития НТГ в популяции Японии. Toll-подобный рецептор 4 (TLR4) принимает участие в запуске иммунного ответа и представляет собой трансмемб-ранный рецептор, который опосредует иммунные реакции на экзогенные и эндогенные лиганды и взаимодействует с белками теплового шока, которые вовлечены в патогенез нормотензивной глаукомы (НТГ). Было исследовано 250 пациентов с НТГ и 318 индивидуумов контрольной группы. Оценивали 8 одиночных нуклеотидных полиморфизмов в гене TLR4. Установлено, что минорные аллели 3 полиморфизмов (rs10759930, rs1927914 и rs7037117) значительно увеличивают риск НТГ. Было выявлено, что наличие 6 полиморфизмов -rs10759930, rs1927914, rs1927911, rs12377632, rs2149356 и rs7037117, rs7037117, расположенных в 3′-нетранслируемой области TLR4, увеличивает риск возникновения НТГ. Сделан вывод о том, что лиганды и/или цитокины, участвующие в сигнальной сети TLR4, могут быть факторами риска НТГ [4].
Y. Takano et al. в ходе многоцентрового исследования изучали связь полиморфизмов Toll-подобного рецептора (Toll-like receptor 4 (TLR4) gene) с ПОУГ, НТГ и псевдоэксфолиативной глаукомой у 760 пациентов в Японии. Аллельный вариант rs2149356 гена TLR4 чаще всего встречался при ПОУГ (р=0,015). Полиморфные варианты других локусов: rs10759930, rs1927914, rs1927911 и rs2149356 не были ассоциированы с ПОУГ (р=0,14) [37].
В работе W. Suh et al. не было выявлено статистически значимых различий в частотах гаплотипа гена TLR4 (рассматривались полиморфизмы rs10759930, rs1927914, rs1927911, rs12377632, rs2149356, rs11536889, rs7037117 и rs7045953) у 147 пациентов с НТГ и 380 здоровых индивидуумов в Южной Корее [38].
Значительное количество работ посвящено анализу вовлеченности в подверженность ПОУГ других генов-кандидатов (не представленных в таблице).
Ряд работ посвящен исследованию ассоциаций с ПОУГ рибосомальных генов. Ю.А. Кириленко и др. выявили, что патогенетически значимые показатели больных ПОУГ характеризуются различной по степени выраженности и направленности статистически значимой сопряженностью с функциональной активностью рибосомных генов [39].
Е.В. Кохтенко не выявила различий в частотах аллелей и генотипов генов, регулирующих транскрипцию рибосомальных генов (ТР53 (R72P), DNMT3B (C149T), POLR1B (S295L), TAF1B (A6S) у пациентов с ПОУГ и здоровых жителей Курской области. Анализ частот аллелей и полиморфизмов генов, регулирующих транскрипцию РГ, в группах больных глаукомой и здоровых людей не выявил ассоциации этих генов с предрасположенностью к ПОУГ [40].
Генетические исследования при эксфолиативной глаукоме, проведенные в Исландии и Швеции, выявили у 99% обследованных лиц 2 мутации в хромосоме 15 в гене lysyl ocedase-like LOXL1. Следует отметить, что эти мутации отсутствуют при других формах ПОУГ. Продукт гена LOXL1 является катализатором реакции, которая приводит к образованию зрелых волокон эластина [14].
N. Fuse et al. провели исследование лизил-оксидаза-подобного гена 1 (lysyl oxidase-like 1 (LOXL1) gene) в японской популяции у пациентов с эксфолиативной глаукомой и псевдоэксфолиативным синдромом. Изучались 3 одиночных нуклеотидных полиморфизма rs1048661, rs3825942, p.Arg141Leu; Gly153Asp и rs2165241. Два полиморфизма в экзоне 1 LOXL1, rs1048661 и rs3825942 были тесно связаны с ПЭС, включая и эксфолиативную глаукому [41].
К. Murakami et al. установили, что полиморфные варианты гена GLC1F могут быть связаны с развитием НТГ. Проводилось исследование 242 пациентов из Японии, в т. ч. 141 больного НТГ и 101 здорового индивидуума. Лица, несущие аллель 163 D7S1277i, имели статистически значимое увеличение риска развития НТГ в 2,47 раза (OR = 2,47) [42].
W. Liu et al. изучали связь 2 генов-кандидатов с формированием ПОУГ – аквапорина 1 (AQP1) и переносчика растворенных веществ SLC4A10. Среди 382 пациентов с ПОУГ и 363 индивидуумов контрольной группы ни один из 11 одиночных нуклеотидных полиморфизмов не показал статистически значимой связи с ПОУГ [43].
Таким образом, изучению генетических основ ПОУГ посвящено значительное количество работ. Однако следует отметить, что большинство исследований по выявлению генов предрасположенности к ПОУГ проведены за рубежом [9, 41, 44]. Единичные работы, выполненные в России, фрагментарны и посвящены оценке вовлеченности лишь некоторых генов в формирование ПОУГ: миоцилина (MYOC), оптиневрина (OPTN), цитохрома Р450 (CYP1B1), факторов некроза опухолей и их рецепторов (TNFα, TNFβ, TNFR1, TNFR2), факторов роста (VEGF-А, IGF-1 и др.), рибосомальных белков [3, 14, 19–21, 36, 39, 45–47], что крайне недостаточно и диктует необходимость проведения дальнейших генетических исследований ПОУГ в различных популяциях в России.
Источник
- Журналы
- Вестник офтальмологии
# 5, 2014
- Генетические исследования при первичн…
Авторы:
- Е. В. Тикунова
ФГАОУ ВПО «Белгородский государственный национальный исследовательский университет» - М. И. Чурносов
ФГАОУ ВПО «Белгородский государственный национальный исследовательский университет»
Журнал:
Вестник офтальмологии. 2014;130(5): 96-99
Просмотрено:
80
Скачано:
25
Большое количество проведенных в последнее время во многих странах эпидемиологических исследований свидетельствует о том, что значительная доля случаев первичной открытоугольной глаукомы (ПОУГ) имеет наследственную природу [1, 2]. Так, исследование, проведенное в Австралии, выявило отягощенный по глаукоме семейный анамнез у 59,6% участников, из них у 64,8% глаукомой страдал кровный родственник первой степени [3]. По результатам другого проведенного исследования удалось установить, что братья и сестры больных глаукомой подвержены гораздо большему риску развития глаукомы (64,7%), чем дети этих больных (13,2%) или другие родственники (22,2%) [4].
В некоторых публикациях приводится мнение о том, что ПОУГ — это аутосомно-доминантное заболевание с неполной пенетрантностью, в других признается аутосомно-рецессивный тип наследования. Оба типа наследования считали правомерными Т.И. Ерошевский и соавт. [5]. Гипотезу о полигенном типе наследования, при котором становятся объяснимыми спорадические случае заболевания, выдвигал М. Armaly [6].
В настоящее время ПОУГ считается многофакторным заболеванием с пороговым эффектом и связана не только с мутациями в одном или нескольких генах, но и с влиянием внешних факторов [1].
В ходе молекулярно-генетических исследований установлены три причинных и несколько десятков генов-кандидатов, ассоциированных с развитием ПОУГ.
Первым из изученных генов, связанных с развитием ПОУГ, был ген, ответственный за синтез белка миоцилина.
В 1993 г. V. Sheffield и соавт. [7], используя короткие тандемные повторы (STRP) в качестве генетических маркеров, обнаружили их сцепление с юношеской глаукомой в семье с аутосомно-доминантным типом наследования заболевания и картировали локус на длинном плече первой хромосомы GLC1A (1q21-q31), ассоциированный с развитием данной патологии. В 1995 г. J. Morissette и соавт. [8] в ходе проведенных исследований сделали вывод о том, что ген GLC1A отвечает за развитие как юношеской глаукомы, так и ПОУГ. Подобные данные впоследствии были получены другими авторами [9, 10]. В 1997 г. Е. Stone и соавт. [11] идентифицировали ген TIGR (Trabecular meshwork induced qlucocorticoid responce). Он кодирует белок, синтез которого в структурах трабекулярного аппарата увеличивается при стимуляции глюкокортикостероидами. В том же году R. Kubota и соавт. [12] независимо от E. Stone обнаружили экспрессию гена в нормальной сетчатке человека и назвали его MYOC, а кодируемый им белок — миоцилином.
Таким образом, было установлено, что в локусе GLC1A (1q24.3-q25.2) находятся гены MYOC-TIGR, изменения в которых приводят к развитию ПОУГ. Было выявлено более 70 мутаций, локализованных в этом локусе у представителей различных этнических групп по всему миру, приводящих к развитию ПОУГ в 3-5% случаев [13-16]. Наиболее часто встречающейся мутацией является Q368X (1,65% больных ПОУГ во всем мире). Известно, что на долю этой мутации приходится около 40% всех мутаций, найденных в локусе GLC1A [13, 17-19].
Белок миоцилин синтезируется во многих тканях и органах организма, в том числе и во многих структурах глаза [20-24]. Функции этого протеина остаются до конца не изученными.
При наличии мутаций в гене MYOC запускается каскад изменений, происходящих как в области трабекулярной сети, так в области решетчатой пластинки. Повышенная экспрессия миоцилина в клетках трабекулярной сети приводит к уменьшению числа актиновых волокон в них и к нарушению функционирования актиномиозинового сократительного комплекса [25], кроме того, он блокирует функции ряда белков, которые принимают участие в оттоке водянистой влаги [26, 27]. Следствием этих процессов является увеличение сопротивления оттоку внутриглазной жидкости [28].
Кроме того, ген миоцилина экспрессируется в ГКС и астроцитах в области решетчатой пластинки. Мутации в гене MYOC приводят к неправильному укладыванию дефектного миоцилина и его внутриклеточному накоплению в эндоплазматической сети и в аппарате Гольджи [29-33], что в конечном итоге приводит к запуску процесса апоптоза [34].
Другим геном, изменения в котором могут также приводить к развитию ПОУГ, является оптиневрин. В 1998 г. M. Sarfarazi и соавт. [35] обнаружили участок хромосомы 10p14-p15, названный в 2002 г. GLC1E, в котором был локализован ген OPTIN, ответственный за синтез белка оптиневрина [36].
Оптиневрин синтезируется в сердце, головном мозге, плаценте, печени, скелетных мышцах, почках, поджелудочной железе, а также в структурах глаза: трабекулярном аппарате, сетчатке, беспигментной части цилиарного тела [20, 36, 37]. Оптиневрин не является мембранным протеином, продолжительность его жизни составляет приблизительно 8 ч, в клетке он представлен диффузно, но основная масса его ассоциируется с аппаратом Гольджи.
Взаимодействуя с различными клеточными кофакторами, такими как хантингтин, миозин VI и Rab-8, оптиневрин является частью белковой сети, регулирующей мембранный транспорт и клеточный морфогенез [38]. Также он участвует в регуляции апоптоза, выступая в качестве компонента опосредованного TNFα сигнального пути [39].
Мутации в гене OPTIN наблюдаются в 1% случаев ПОУГ. Наиболее часто встречающимися полиморфизмами являются E50K (13,5%) и M98K (13,6%) [36]. Проведенные в разных странах исследования показали более низкие показатели встречаемости данных полиморфизмов, характерных только для глаукомы псевдонормального давления [40, 41], но сочетание мутации Q368X в гене миоцилина с полиморфизмом M98K в гене оптиневрина влияет на уровень внутриглазного давления (ВГД) у пациентов с ПОУГ [42].
В начале 2005 г. появилось сообщение о картировании у больных с ПОУГ еще одного гена WDR 36, локализованного на длинном плече 5-й хромосомы (GLC1G, 5q22.1). Экспрессия гена наблюдается во многих органах и тканях (в сердце, печени, почках, поджелудочной железе, головном мозге, легких, мышцах, а также в тканях глаза: трабекулярной сети, радужке, цилиарном теле, хрусталике, склере, сетчатке и зрительном нерве) [43]. Известно, что ген WDR 36 вовлечен в активацию Т-клеток и регулируется в значительной степени координированно с интерлейкином-2.
Мутации в данном гене ответственны за развитие 4,0-6,9% случаев ПОУГ. В настоящее время идентифицированы четыре мутации в гене WDR 36 у больных с ПОУГ: D658G, N355S, A449T, R529Q. Данные мутации были выявлены при глаукомах как с повышенным, так и с нормальным ВГД [43, 44].
В настоящее время имеются данные о роли полиморфизмов в гене NO-синтазы (NOS3, nitric oxide synthase gene), в гене, кодирующем цитохром P450 (CYP1B1, cytochrome P450 family 1, subfamily B, polypeptide 1) в развитии ПОУГ [45-47].
Цитохром P450 относится к ферментам, которые играют важную роль в метаболизме разнообразных ксенобиотиков (компонентов пищи, лекарственных препаратов, ядов) и эндогенных субстратов (таких как стероиды, жирные кислоты, простагландины), а также в регуляции роста и дифференцировки тканей [48, 49]. Мутации гена CYP1B1 изменяют функции цитохрома P450, приводя к нарушению детоксикации данных субстратов, что оказывает токсическое воздействие на развитие структур глаза, а также приводят к нарушению роста и дифференцировки тканей глаза, особенно в области переднего сегмента глаза [20, 50]. Доказано, что сочетание мутаций в гене MYOC (Gly399Val) в гетерозиготном состоянии с мутацией Arg368His в гене CYP1B1 приводит к возникновению заболевания с более злокачественным течением и ранним манифестированием [51].
Исследованиями последних лет выявлено несколько полиморфизмов в гене OPA1, предрасполагающих к развитию ПОУГ как с нормальным, так и с повышенным давлением. OPA1 является геном, кодирующим белок мембраны митохондрий, необходимый для регуляции динамических процессов в митохондриальной сети зрительного нерва, нарушение которых приводит к апоптозу. Наиболее значимой является комбинации полиморфизмов T-аллеля IVS8+4C/T и C-аллеля IVS8+32T/C [52].
В последнее десятилетие внимание исследователей, занимающихся изучением патогенеза ПОУГ, привлекают процессы апоптоза. Известно, что механизм апоптоза регулируется целым рядом как апоптических, так и антиапоптических генов. Одним из генов, индуцирующих апоптоз, является ген p53. По данным ряда исследователей, полиморфизм Pro/Arg в кодоне 72 гена p53 связан с возникновением ПОУГ [53, 54].
В настоящее время центральное место в развитии и регуляции апоптоза занимают факторы некроза опухоли и их рецепторы, но работы по изучению влияния генов данных факторов немногочисленны.
По данным китайских исследователей, существует ассоциативная связь между полиморфизмом гена TNFα и ПОУГ. Так, генетический вариант -308А TNFα связан с ПОУГ в китайской популяции и может использоваться как генетический маркер для картографии болезни [55]. В ходе исследования, проведенного среди представителей турецкой популяции, получены данные о значительном различии в частоте встречаемости G/A и G/G генотипов TNFα в группе контроля и среди пациентов, страдающих ПОУГ. В то же время результаты исследований австрийских ученых опровергают наличие какой-либо связи между полиморфизмом -308G/A TNFα и ПОУГ [56].
Таким образом, проведенный анализ литературных источников позволяет заключить, что результаты, полученные разными исследователями при изучении генетической предрасположенности к ПОУГ, зачастую противоречивы. Кроме того, исследования, посвященные молекулярно-генетическим аспектам ПОУГ, в России немногочисленны. Поэтому, учитывая большую медико-социальную значимость данной патологии, необходимо продолжать изучение молекулярно-генетических маркеров ПОУГ не только для расшифровки этиопатогенетических факторов развития глаукомы, но и для совершенствования существующих и создания новых подходов в диагностике и терапии этого заболевания.
Список литературы:
- Нестеров А.П. Патогенез и проблемы патогенетического лечения глаукомы. Клиническая офтальмология. 2003; 2: 47-48.
- Vegini F., Figueiroa Filho N., Lenci R.F., Garcia Neto D., Susanna Junior R. Prevalence of open angle glaucoma in accompanying first degree relatives of patients with glaucoma. Clinics. 2008; 63 (3): 329-332.
- Green C.M., Kearas L.S., Wu J., Barbour J.M., Wilkinson R.M., Ring M., Craig J.E., Wong T.L., Hewitt A., Mackey D.A. How significant is a family history of glaucoma? Experience from the Glaucoma Inheritance Study in Tasmania. Clin. Exper. Ophthalmol. 2007; 35 (9): 793-799.
- Nguyen R.L., Raja S.C., Traboulsi E.I. Screening relatives of patients with familial chronic open angle glaucoma. Ophthalmology. 2000; 107 (7): 1294-1297.
- Eрошевский Т.И., Кроль Д.С., Лукова Н.Б. Первичная глаукома и наследственность. Вестник офтальмологии. 1967; 3: 7-11.
- Armaly M.F. The genetic determination of ocular pressure in the normal eye. Arch. Ophthalmol. 1967; 78 (2): 187-192.
- Sheffield V.C., Stone E.M., Alward W.L.M., Drack A.V., Johnson A.T., Streb L.M. Genetic linkage of familial open angle glaucoma to chromosome lq21-31. Nature Genet. 1993; 4: 47-50.
- Morissette J., Co’te’ G., Anctil G.L., Plante M., Amyot M., Heon E. A common gene for juvenile and adult-onset primary open-angle glaucomas confined on chromosome lq. Am. J. Hum. Genet. 1995; 56: 1431-1442.
- Adam M.F., Belmouden A., Binisti P., Brezin A.P., Valtot F., Bechetoille A., Dascote J.C., Copin B., Gomez L., Chaventre A. Recurrent mutations in a single exon encoding the evolutionarily conserved olfactomedin-homology domain of TIGR in familial open-angle glaucoma. Hum. Mol. Genet. 1997; 6 (12): 2091-2097.
- Rozsa F.W., Shimizu S., Lichter P.R., Johnson A.T., Othman M.I., Scott K., Downs C.A., Nquyen T.D., Polansky J., Richards J.E. GLC1A mutations point to regions of potential functional importance on the TIGR/MYOC protein. Mol. Vis. 1998; 4: 20.
- Stone E.M., Fingert J.H., Alward W.L.M., Nquyen T.D., Polansky J.R., Sunden S.L, Nishimura D., Clark A.F., Nystuen A., Nichols B.E. Identification of a gene that causes primary open-angle glaucoma. Science. 1997; 275: 668-670.
- Kubota R., Noda S., Wang Y., Minoshima S., Asakawa S., Kudoh J., Mashima Y., Oquchi Y., Shimizu N. A novel myosin-like protein (Myocilin) expressed in the connecting cilium of the photoreceptor: molecular cloning, tissue expression, and chromosomal mapping. Genomics. 1997; 41: 360-369.
- Fingert J.H., Héon E., Liebmann J.M., Yamamoto T., Craig J.E., Rait J., Kawase K., Hoh S.T., Buys Y.M., Dickinson J., Hockey R.R., Williams-Lyn D., Trope G., Kitazawa Y., Ritch R., Mackey D.A., Alward W.L., Sheffield V.C., Stone E.M. Analysis of myocilin mutations in 1703 glaucoma patients from five different populations. Hum. Mol. Genet. 1999; 8: 899-905.
- Gong G., Kosoko-Lasaki O., Haynatzki G.R., Wilson M.R. Genetic dissection of myocilin glaucoma. Hum. Mol. Genet. 2004; 13: 91-102.
- Sud A., Del Bono E.A., Haines J.L., Wiggs J.L. Fine mapping of the GLC1K juvenile primary open-angle glaucoma locus and exclusion of candidate genes. Mol. Vis. 2008; 14: 1319-1326.
- Wiggs J.L. Genetic etiologies of glaucoma. Arch. Ophthalmol. 2007; 125: 30-37.
- Angius A., Spinelli P., Ghilotti G., Casu G., Sole G., Loi A., Totaro A., Zelante L., Gasparini P., Orzalesi N., Pirastu M., Bonomi L. Myocilin Gln368STOP mutation and advanced age as risk factors for late-onset primary open-angle glaucoma. Arch. Ophthalmol. 2000; 118: 674-679.
- Faucher M., Anctil J.L., Rodrigue M.A., Duchesne A., Bergeron D., Blondeau P., Cote G., Dubois S., Bergeron J., Arseneault R., Morissette J., Raymond V. Founder TIGR/myocilin mutations for glaucoma in the Quebec population. Hum. Mol. Genet. 2002; 11: 2077-2090.
- Mataftsi A., Achache F., Heon E., Mermoud A., Cousin P., Metthez G., Schorderet D.F., Munier F.L. MYOC mutation frequency in primary open-angle glaucoma patients from Western Switzerland. Ophthalmic. Genet. 2001; 22: 225-231.
- Challa P. Glaucoma genetics. Int. Ophthalmol. Clin. 2008; 48 (4): 73-94.
- Hogewind B.F.T., Gaplovska-Kysela K., Theelen T., Cremers F.P.M., Yam G.H.E., Hoyng C.B., Mukhopadhyay A. Identification and functional characterization of a novel MYOC mutation in two primary open angle glaucoma families from The Netherlands. Mol. Vis. 2007; 13: 1793-1801.
- Karali A., Russell P., Stefani F.H., Tamm E.R. Localization of myocilin/trabecular meshwork-inducible glucocorticoid response protein in the human eye. Invest. Ophthalmol. Vis. Sci. 2000; 41: 729-740.
- O’Brien E.T., Ren X.O., Wang Y.H. Localization of myocilin to the Golgi apparatus in Schlemm’s canal cells. Invest. Ophthalmol. Vis. Sci. 2000; 41: 3842-3849.
- Swiderski R.E., Ross J.L., Fingert J.H., Clark A.F., Alward W.L., Stone E.M., Sheffield V.C. Localization of MYOC transcripts in human eye and optic nerve by in situ hybridization. Invest. Ophthalmol. Vis. Sci. 2000; 41: 3420-3428.
- Wentz-Hunter K., Shen X., Okazaki K., Tanihara H., Yue B.Y. Overexpression of myocilin in cultured human trabecular meshwork cells. Exp. Cell Res. 2004; 297: 39-48.
- O’Brien E.T., Kinch M., Harding T.W., Epstein D.L. A mechanism for trabecular meshwork cell retractions Ethacrynic acid initiates the dephosphorylation of focal adhesion proteins. Exp. Eye Res. 1997; 665: 471-483.
- Peters D.M., Herbert K., Biddick B., Peterson J.A. Myocilin binding to Hep II domain of fibronectin inhibits cell spreading and incorporation of paxillin into focal adhesions. Exp. Cell Res. 2005; 303: 218-228.
- Wilkinson C.H., van der Straaten D., Craig J.E., Coote M.A., McCartney P.J., Stankovich J., Stone E.M., Mackey D.A. Tonography demonstrates reduced facility of outflow of aqueous humor in myocilin mutation carriers. J. Glaucoma. 2003; 12: 237-242.
- Caballero M., Rowlette L.L.S., Borras T. Altered secretion of a TIGR/MYOC mutant lacking the olfactomedin domain. Biochim. Biophys. Acta. 2000; 3: 447-460.
- Caballero M., Borras T. Inefficient processing of an olfactomedin-deficient myocilin mutant: potential physiological relevance to glaucoma. Biochem. Biophys. Res. Commun. 2001; 282: 662-670.
- Liu Y., Vollrath D. Reversal of mutant myocilin non-secretion and cell killing: implications for glaucoma. Hum. Mol. Genet. 2004; 13: 1193-1204.
- Sohn S., Hur W., Joe M.K., Kim J.H., Lee Z.W., Ha K.S., Kee C. Expression of wild-type and truncated myocilins in trabecular meshwork cells: their subcellular localizations and cytotoxicities. Invest. Ophthalmol. Vis. Sci. 2002; 43: 3680-3685.
- Joe M.K., Sohn S., Hur W., Moon Y., Choi Y.R., Kee C. Accumulation of mutant myocilins in ER leads to ER stress and potencial cytotoxicity in human trabecular meshwork cells. Biochem. Biophys. Res. Commun. 2003; 312 (3): 592-600.
- Nakagawa T., Zhu H., Morishima N., Li E., Xu J., Yankner B.A., Yuan J. Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-beta. Nature. 2000; 403: 98-103.
- Sarfarazi M., Child A., Stoilova D., Brice G., Desai T., Trifan O.C., Poinoosawmy D., Crick R.P. Localization of the fourth locus (GLC1E) for adult-onset primary open-angle glaucoma to the 10pl5-pl4 region. Am. J. Hum. Genet. 1998; 62: 641-652.
- Rezaie T., Child A., Hitchings R., Brice G., Miller L., Coca-Prados M., Heon E., Krupin T., Ritch R., Kreutzer D., Crick R.P., Sarfarazi M. Adult-onset primary open-angle glaucoma caused by mutations in optineurin. Science. 2002; 295: 1077-1079.
- Yung-Chang Y., Jiann-Jou Y., Ming-Chih C., Shuan-Yow L. Absence of optineurin (OPTN) gene mutations in Taiwanese patients with juvenile-onset open-angle glaucoma. Mol. Vis. 2008; 14: 487-494.
- Hattula K., Peranen J. FIP-2, a coiled-coil protein, links Huntingtin to Rab8 and modulates cellular morphogenesis. Curr. Biol. 2000; 10: 1603-1606.
- Li Y., Kang J., Horwitz M.S. Interaction of an adenovirus E3 14.7-kilodalton protein with a novel tumor necrosis factor alpha-inducible cellular protein containing leucine zipper domains. Mol. Cell Biol. 1998; 18: 1601-1610.
- Alward W.L., Kwon Y.H., Kawase K., Craig J.E., Hayreh S.S., Johnson A.T., Khanna C.L., Yamamoto T., Mackey D.A., Roos B.R., Affatigato L.M., Sheffield V.C., Stone E.M. Evaluation of optineurin sequence variations in 1048 patients with open-angle glaucoma. Am. J. Ophthalmol. 2003; 136: 904-910.
- Aung T., Ebenezer N.D., Brice G., Child A.H., Prescott Q., Lehmann O.J., Hitchings R.A., Bhattacharya S.S. Prevalence of optineurin sequence variants in adult primary open angle glaucoma: implications for diagnostic testing. J. Med. Genet. 2003; 40.
- Melki R., Belmouden A., Akhayat O., Brézin A., Garchon H.J. The M98K variant of the OPTINEURIN (OPTN) gene modifies initial intraocular pressure in patients with primary open angle glaucoma. J. Med. Genet. 2003; 40: 842-844.
- Monemi S., Spaeth G., DaSilva A., Popinchalk S., Ilitchev E., Liebmann J., Ritch R., Heon E., Crick R.P., Child A., Sarfarazi M. Identification of a novel adult-onset primary open angle glaucoma (POAG) gene on 5q22.1. Hum. Mol. Genet. 2005; 14: 725-733.
- Weisschuh N., Wolf C., Wissinger B., Gramer E. Variations in the WDR36 gene in German patients with normal tension glaucoma. Mol. Vis. 2007; 13: 724-729.
- Kang J.H., Wiggs J.L., Rosner B.A., Hankinson S.E., Abdrabou W., Fan B.J., Haines J., Pasquale L.R. Endothelial nitric oxide synthase gene variants and primary open-angle glaucoma: interactions with sex and postmenopausal hormone use. Invest. Ophthalmol. Vis. Sci. 2010; 51 (2): 971-979.
- Kumar A., Basavaraj M.G., Gupta S.K., Qamar I., Ali A.M., Bajaj V., Ramesh T.K., Prakash D.R., Shetty J.S., Dorairaj S.K. Role of CYP1B1, MYOC, OPTN and OPTC genes in adult-onset primary open-angle glaucoma: predominance of CYP1B1 mutations in Indian patients. Mol. Vis. 2007; 13: 667-676.
- Mookherjee S., Acharya M., Banerjee D., Bhattacharjee A., Ray K. Molecular basis for involvement of CYP1B1 in MYOC upregulation and its potential implication in glaucoma pathogenesis. PLoS One. 2012; 7 (9): e45077.
- Stoilov I., Akarsu A., Sarfarazi M. Identification of three different truncating mutations in cytochrome P4501B1 (CYP1B1) as the principal cause of primary congenital glaucoma (buphthalmos) in families linked to the GLC3A locus on chromosome 2p21. Hum. Mol. Genet. 1997; 6: 641-647.
- Stoilov I., Jansson I., Sarfarazi M., Schenkman J.B. Roles of cytochrome p450 in development. Drug. Metabol. Drug. Interact. 2001; 18: 33-35.
- Vasiliou V., Gonzalez F.J. Role of CYP1B1 in glaucoma. Annu. Rev. Pharmacol. Toxicol. 2008; 48: 333-358.
- Vincent A.L., Billingsley G., Buys Y., Alex V., Levin A.V., Priston M., Trope G., Williams-Lyn D., Heon E. Digenic inheritance of early-onset glaucoma: CYP1B1, a potential modifier gene. Am. J. Hum. Genet. 2002; 70: 448-460.
- Mabuchi F., Tang S.A., Kashiwagi K., Yamagata Z., Iijima H., Tsukahara S. The OPA1 gene polymorphism is associated with normal tension and high tension glaucoma. Am. J. Ophthal. 2007; 143: 125-130.
- Lin H.J., Chen W.C., Tsai F.J., Tsai S.W. Distribution of p53 codon 72 polymorphism in primary open angle glaucoma. Br. J. Ophthalmol. 2002; 86: 767-770.
- Ressiniotis T., Griffit P.G. Primary open angle glaucoma is associated with a specific p53 gene haplotype. Ophthalmology. 2004; 3: 134-138.
- Lin H.J., Tsai F.J., Chen W.C., Shi Y.R., Hsu Y., Tsai S.W. Association of tumour necrosis factor alpha -308 gene polymorphism with primary open-angle glaucoma in Chinese. Eye (Lond). 2003; 17: 31-34.
- Mossbock G., Weger M., Moray M., Renner W., Haller-Schober E.M., Mattes D., Schmut O., Wegscheider B., EI-Shabrawi Y. TNFa promoter polymorphisms and primary open-angle glaucoma. Eye. 2005; 20: 1040-1043.
Источник

