Фиксированные комбинации лечения глаукомы
Статья посвящена эффективности максимальной гипотензивной терапии с применением фиксированных комбинаций при лечении первичной открытоугольной глаукомы
DOI: 10.21689/2311-7729-2016-16-4-181-184
Введение
ПОУГ остается одной из ведущих причин слабовидения и неизлечимой слепоты и в настоящее время является главным инвалидизирующим заболеванием глаз у взрослых [1, 2]. Традиционно большинство пациентов с ПОУГ получают местное гипотензивное лечение. Известно, что для достижения компенсации уровня ВГД, стабилизации процесса и сохранения зрительных функций нередко возникает необходимость использовать комбинации нескольких препаратов [3, 4]. В частности, максимальная медикаментозная терапия (ММТ) включает применение как минимум 3-х компонентов из разных классов, причем для этого наиболее целесообразно использовать фиксированные комбинации. Последние способствуют повышению эффективности и комплаентности лечения, уменьшению числа и степени выраженности осложнений и НЯ, в т. ч. из-за отсутствия эффекта вымывания, уменьшения воздействия консервантов и т. д. [5, 6].
ММТ может быть рекомендована больным, у которых не достигнута нормализация ВГД (с учетом давления цели) как альтернатива лазерному лечению или хирургическому вмешательству. Кроме того, она может быть полезной и у пациентов с прогрессирующим течением заболевания для максимального снижения офтальмотонуса, несмотря на его контролируемый среднестатистический уровень.
Появление на фармацевтическом рынке Российской Федерации новых оригинальных гипотензивных препаратов обусловливает необходимость собственной их оценки. В связи с этим наше внимание привлекли комбинации неселективного бета-адреноблокатора тимолола с альфа-2 высокоселективным адреномиметиком – бримонидином (препарат Комбиган) и простамидом – биматопростом (Ганфорт). Гипотензивное действие тимолола 0,5%, входящего в состав указанных препаратов, обеспечивается снижением продукции внутриглазной жидкости (ВГЖ) посредством блокады бета-адренорецепторов в цилиарном теле. Бримонидин тартрат 0,2% не только снижает продукцию ВГЖ, стимулируя альфа-2 адренорецепторы, но и увеличивает увеосклеральный отток. Биматопрост 0,03%, помимо увеличения последнего, повышает отток и через чувствительную к давлению трабекулярную сеть [7, 8].
Цель: изучение эффективности и переносимости применения одновременно 2-х фиксированных комбинаций оригинальных гипотензивных препаратов – 0,03% биматопроста / 0,5% тимолола и 0,2 % бримонидина / 0,5% тимолола у больных ПОУГ.
Материал и методы
ММТ в связи с отсутствием компенсации ВГД была назначена 31 больному (37 глаз) с развитой (13 глаз, 35,1%) и далеко зашедшей (24 глаза, 64,9%) стадиями ПОУГ (в т. ч. 7 пациентам с прогрессированием заболевания, которые по тем или иным причинам отказались от предложенной операции). По сути, все больные были потенциальными кандидатами на хирургическое лечение. Возраст пациентов – от 58 до 75 лет (в среднем – 65,9±6,5 года). Среди пациентов было 14 женщин (45,2%) и 17 мужчин (54,8%). Указанное местное лечение включало использование 2-х фиксированных комбинаций: 0,03% биматопроста / 0,5% тимолола и 0,2% бримонидина / 0,5% тимолола с кратностью инстилляций 1 р./сут утром и вечером соответственно. До назначенной ММТ пациенты получали как моно-, так и нефиксированную и фиксированную гипотензивную терапию. В частности, непосредственно до ММТ больные закапывали Ксалатан (6 глаз), Траватан (2), Глаупрост (2), Ксалаком (5), Дуотрав (2), Дорзопт + и Глаупрост (4), Ксалаком и Азаргу (2), Ксалаком и Косопт (2), Ксалаком и Дорзопт (1), Дорзопт + и Траватан (2), Дуотрав и Дорзопт (3), Траватан и Азаргу (3), Косопт и Глаупрост (1) Дорзопт и Глаупрост (2). Следует отметить, что никто из пациентов никогда раньше не применял (не назначали) препараты, содержащие биматопрост и/или бримонидин.
Средний уровень исходного офтальмотонуса на фоне указанной местной гипотензивной терапии составил 33,9±3,5 мм рт. ст. (с колебаниями офтальмотонуса на фоне указанной терапии от 30 до 40 мм рт. ст.). Эффективность назначенной терапии оценивали через 1 сут, и если достигалась нормализация ВГД, то через 1, 3 и 6 мес. У всех пациентов использовали стандартное офтальмологическое обследование, кроме того, у 12 больных применяли компьютерную периметрию (Autoperimetr Dicon LD 400 (США) по пороговой программе 30-2) и у 8 пациентов – конфокальную лазерную сканирующую офтальмоскопию с использованием HRT-III Heidelberg Engineering (Германия). Девять пациенток осуществляли более или менее регулярный самоконтроль АД с фиксацией его показателей в динамике лечения. Сроки диагностирования глаукомы у пациентов до назначения ММТ варьировали от 1 до 7,3 года и в среднем оказались равными 4,1±0,9 года. Псевдоэксфолиативный синдром имел место у 15 (48,4%) больных. Из сопутствующих общесоматических заболеваний все больные имели кардиоваскулярную патологию (ишемическую болезнь сердца, гипертоническую болезнь, преимущественно II стадии, но без инфаркта или инсульта в анамнезе), заболевания желудочно-кишечного тракта (гастрит, колит, холецистит, язву 12-перстной кишки вне обострения и т. п.), а 3 пациента – артрозы коленных суставов обменного характера.
Статистическую обработку данных проводили с помощью программы Statistica 6.1. Рассчитывали групповые показатели суммарной статистики – среднюю арифметическую величину (М) и ошибку средней (m). Различия считались статистически значимыми при р<0,05.
Результаты и обсуждение
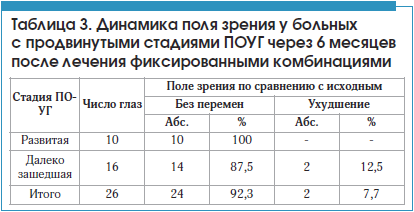
Через 1 сут на фоне инстилляций 2-х фиксированных комбинаций гипотензивных капель были обследованы все больные, через 1 мес. – 29 пациентов (35 глаз), через 3 мес. – 27 (32 глаза), через 6 мес. – 22 (26 глаз). Уровень среднего снижения офтальмотонуса через 1 сут после назначенной ММТ (табл. 1) составил 10,2 мм рт. ст., до 23,7±2,5 (35,3%), спустя 1 мес. (без учета не явившихся на обследование 2-х пациентов с ПОУГ на обоих глазах) – 10,4 мм рт. ст., до 23,5±2,1 (36,0%), через 3 мес. (без учета 2-х больных, у которых через 1,5 и 2,5 мес. была все же проведена операция в связи с рецидивом повышенного ВГД и прогрессированием глаукомной оптической нейропатии на фоне ММТ, а также 2-х пациентов, не присутствовавших на обследовании) – 9,3 мм рт. ст., до 24,6±2,3 (32,2%), через 6 мес. (без учета еще 3-х прооперированных глаз спустя 4–5 мес. после назначенной ММТ и 4-х не явившихся на обследование больных) – 8,4 мм рт. ст., до 25,5±2,4 (29,1%). При этом спустя 6 мес. в 19 глазах офтальмотонус находился в пределах среднестатистических значений, т. е. не превышал 26 мм рт. ст. (в т. ч. в 31,6% случаев был достигнут уровень целевого ВГД – ниже 21 мм рт. ст.). В остальных 7 случаях он был стабильно незначительно повышен в пределах 27–29 мм рт. ст. (табл. 2).


Таким образом, гипотензивная эффективность назначенной ММТ постепенно снижалась и к концу исследования составила 73,1%. При этом необходимо указать, что только в ранние сроки (до 3 мес.) после назначения ММТ в 51,4% случаев удалось добиться снижения офтальмотонуса до рекомендованного уровня соответственно стадии заболевания. Тем не менее зрительные функции подавляющего большинства (в 92,3% случаев) пациентов (за исключением прооперированных и выбывших из исследования) в течение всего срока наблюдения оставались достаточно стабильными (табл. 3), о чем свидетельствовали данные остроты и поля зрения, а также автоматизированной периметрии (табл. 4) на фоне среднестатистической нормы компенсации ВГД или даже слегка повышенного (до 27–29 мм рт. ст.) офтальмотонуса. Кроме того, не было отмечено достоверных отрицательных изменений морфометрических параметров состояния диска зрительного нерва (ДЗН) – в частности, соотношения площади экскавации к площади ДЗН, объема неврального пояска за указанный период лечения.

Что касается переносимости назначенной ММТ, комбинация Ганфорта и Комбигана удовлетворительно оценивалась больными и существенно не влияла на АД. Из побочных эффектов необходимо отметить небольшой кратковременный дискомфорт, жжение, изменение вкуса, на которые обратили внимание 12 больных (38,7%) после закапывания указанных капель. Сухость в глазах, появившаяся спустя примерно 1 мес. после инстилляций назначенных капель у 3-х больных (9,6%), как правило, сочеталась с таковой во рту и была купирована назначением дополнительной слезозаместительной терапии. У 1 пациентки (3,2%) через 5 мес. после указанной терапии был отмечен небольшой отек век, сопровождавшийся незначительным зудом и нерезко выраженными явлениями блефароконъюнктивита, который был купирован инстилляциями Опатанола и Индоколлира. Кроме того, из НЯ назначенного местного гипотензивного лечения следует указать на следы или незначительную (в 17 глазах, 45,9%), умеренную (в 8 глазах, 21,6%) и достаточно выраженную (в 1 случае (2,7%) – у больного ПОУГ, на фоне которой 1 год назад тот перенес тромбоз верхневисочной ветви ЦВС и был все же прооперирован в связи с декомпенсацией ВГД), в основном в глазах со светлой радужкой, невоспалительную конъюнктивальную реакцию. Последняя, на наш взгляд, возникла за счет сосудорасширяющего действия биматопроста в составе Ганфорта. Именно синдром «красного глаза», помимо достаточно высокой стоимости лечения, больше всего беспокоил больных на протяжении всего срока наблюдения. Это, однако, не послужило поводом для отказа пациентов от назначенного лечения (за исключением 5 больных, которые были прооперированы, и 2 пациентов с прогрессированием ГОН на фоне нормализованного или слегка повышенного офтальмотонуса, которые были направлены на селективную лазертрабекулопластику), поскольку ВГД у них все же нормализовалось, а зрительные функции оставались сохранными.
Вывод
ММТ с использованием одновременно 2-х оригинальных фиксированных комбинаций бримонидина/тимолола и биматопроста/тимолола у больных ПОУГ при отдаленных сроках наблюдения (до 6 мес.) обеспечила гипотензивную и функциональную эффективность 73,1%. Отмечено постепенное уменьшение со временем показателя среднего снижения офтальмотонуса: с 35,3% через 1 сут после назначения ММТ до 29,1% спустя 6 мес., что, возможно, было связано с развитием привыкания к тимололу и/или бримонидину. Достаточно серьезным побочным эффектом данной ММТ, на наш взгляд, явилась конъюнктивальная реакция, обусловленная, главным образом, влиянием биматопроста, которая в той или иной степени имела место у большинства больных и вызывала их беспокойство.
Источник
Авторы:
П.А. Бездетко
Статья в формате PDF
Глаукома представляет собой группу заболеваний органа зрения, характеризующуюся постоянным или периодическим повышением внутриглазного давления (ВГД), с последующим развитием типичных дефектов поля зрения, снижением остроты зрения и атрофией зрительного нерва (рис.). На вопросы редакции, посвященные современным подходам к лечению глаукомы, любезно согласился ответить заведующий кафедрой офтальмологии Харьковского национального медицинского университета, председатель Харьковского научного общества офтальмологов, член правления Украинского общества офтальмологов, член Европейского общества катарактальных и рефракционных хирургов (ERCRS) и Европейского общества ретинологов (Euroretina), доктор медицинских наук, профессор Павел Андреевич Бездетко.
 ? Павел Андреевич, расскажите, пожалуйста, об основных причинах развития глаукомы и о последствиях этого заболевания.
? Павел Андреевич, расскажите, пожалуйста, об основных причинах развития глаукомы и о последствиях этого заболевания.
– Первичная открытоугольная глаукома (ПОУГ) является крайне коварным заболеванием, которое зачастую заканчивается полной потерей зрения. Сегодня общее количество пациентов с глаукомой во всем мире составляет 60-100 млн. В структуре инвалидизации по причине нарушения зрительной функции на глаукому приходится до 15-20% случаев. Наиболее мощным фактором риска глаукомы является генетическая предрасположенность. Так, до 30% пациентов с ПОУГ имеют семейный анамнез по данной патологии. Заболевание в 6 раз чаще наследуется по материнской линии. Существуют также и другие предрасполагающие факторы, которые способствуют повреждению сетчатки и зрительного нерва: артериальная гипертензия / гипотензия, сахарный диабет, заболевания эндокринной системы. Остеохондроз шейного отдела позвоночника тоже является фактором, повышающим риск развития ПОУГ, поскольку обусловливает нарушение функции симпатических нервов и ухудшение кровотока в вертебро-базилярном бассейне. Принято считать, что ПОУГ имеет многофакторную этиологию, но именно генетический фактор является предопределяющим.
 ? Каковы патогенетические механизмы развития глаукомы?
? Каковы патогенетические механизмы развития глаукомы?
– Глаукома характеризуется патологической дегенерацией ганглиозных клеток сетчатки, структурными повреждениями в головке зрительного нерва. В результате гибели нейронов при глаукоме возникают дефект слоя нервных волокон сетчатки, истончение нейроретинального ободка с экскавацией диска зрительного нерва (ДЗН) и необратимой потерей его волокон. Дегенерация нейронов при глаукоме не ограничивается сетчаткой, изменяются также нейроны латерального коленчатого тела и зрительной коры. Патологические явления усугубляются изменениями окружающих тканей, что вызвано активацией глиальных клеток, прежде всего астроцитов. Они начинают вырабатывать различные патологические субстанции, например эндотелин, суживающий сосуды, а также матриксные металлопротеиназы, что приводит к исчезновению последнего и замещению его другим субстратом. Это явление получило название «ремоделирование тканей». Именно данный процесс лежит в основе изменений решетчатой мембраны склеры при глаукоме, а также в основе самой сути глаукомного поражения – формирования глаукомной экскавации ДЗН. Кроме того, активированные астроциты продуцируют синтаз оксида азота (NO) и тем самым секретируют NO, который легко диффундирует в окружающие ткани, включая аксоны. При одновременном усилении образования кислорода в аксонах создаются условия для синтеза достаточно агрессивной молекулы – пероксинитрита, который проникает через аксоны вглубь сетчатки, провоцируя гибель ганглиозных клеток сетчатки. А распространение пероксинитрита по направлению к мозгу приводит к потере клеток в наружных коленчатых телах.
Глаукомное поражение является следствием умеренной, но рецидивирующей реперфузии (восстановление кровообращения после его снижения в результате колебаний офтальмотонуса), что ассоциируется с усилением окислительного стресса и повышением уровня свободных радикалов, в частности супероксида. Наиболее ранние патологические изменения при глаукоме проявляются структурным повреждением митохондрий и гибелью клеток.
? Наблюдается ли рост заболеваемости глаукомой среди населения Украины?
– Основной массив статистических данных по глаукоме связан с высокой частотой инвалидизации по причине нарушения зрительной функции. В Украине доля инвалидизаций, обусловленных глаукомой, составляет около 20%. Существует также официальная статистика заболеваемости глаукомой в Украине, согласно которой за период с 2000-го по 2010 год количество случаев этой патологии во взрослой популяции возросло с 351 до 599 на 100 тыс. человек. Таким образом, только за первое десятилетие XXI века заболеваемость глаукомой в нашей стране возросла на 41%.
? Расскажите, пожалуйста, о современных подходах к лечению и профилактике данной патологии.
– На сегодняшний день рекомендации профильных офтальмологических ассоциаций США и ЕС совпадают в большинстве основных аспектов. Национальные рекомендации по лечению глаукомы также соответствуют принятым в мире, поскольку в Украине используются такие же методы диагностики и прогностические маркеры заболевания. Безусловно, главная задача терапии глаукомы – сохранение функции зрения. Основным методом, позволяющим эту задачу выполнить, является контроль ВГД. Алгоритмы лечения ПОУГ включают целевое снижение ВГД. В зависимости от стадии заболевания необходимая степень снижения ВГД может составлять от 20 до 40%. Первоначально после диагностирования ПОУГ прибегают к медикаментозным методам лечения, позволяющим снизить ВГД. Если медикаментозная терапия оказывается не эффективной, то пациенту назначают лазерные методы лечения. Если и они не позволяют добиться необходимого снижения ВГД, то пациенту показано проведение хирургического лечения.
? Какими критериями следует руководствоваться практикующему врачу при выборе препарата для лечения глаукомы? Какое влияние оказывают особенности анамнеза пациента на этот выбор?
– К главным требованиям, предъявляемым медикаментозной терапии ПОУГ, относятся способность нормализовать ВГД и обеспечивать его стабильность, т. е. не допускать суточных колебаний данного показателя, поскольку именно это позволяет сохранить зрение пациента. Следовательно, основным критерием выбора средства является не только эффективность конкретного препарата, но и фактор приверженности пациента к назначенной терапии, особенно учитывая тот факт, что пациенты с ПОУГ должны получать продолжительное, зачастую пожизненное лечение. Естественно, препарат выбора также должен обладать хорошим профилем переносимости, не приводить к развитию серьезных местных и системных побочных эффектов. Учитывая фактор комплайенса, ключевое значение в терапии ПОУГ приобретает удобство схемы приема препарата. Назначение минимально возможного количества использований препарата в сутки (<2) позволяет достичь наиболее высокого уровня приверженности и таким образом защитить пациента от потери зрения в долгосрочной перспективе. Кроме того, препарат выбора, особенно если речь идет о топической терапии, должен препятствовать прогрессированию поражения зрительного нерва при глаукоме. Следовательно, в терапию первой линии при ПОУГ входят препараты, позволяющие эффективно и стабильно снижать ВГД при минимальной кратности приема в сутки, а также обладающие нейропротекторными свойствами. При назначении терапии очень важно также учитывать анамнез пациента, поскольку коморбидные состояния, например кардиоваскулярная патология, могут не только повышать риск развития глаукомы, но и становиться противопоказанием к назначению некоторых противоглаукомных препаратов.
? Разработка и применение фиксированных комбинаций позволяют значительно увеличить эффективность лечения различных системных заболеваний. Каковы преимущества использования фиксированных комбинаций у пациентов с глаукомой?
– Как уже было сказано, ключевую роль в терапии ПОУГ играет нормализация ВГД. При подозрении на наличие глаукомы у пациента либо на начальной стадии этого заболевания достаточным является применение лекарственных средств, которые позволяют снизить ВГД на 20-30%. Прогрессирующие стадии глаукомы требуют снижения ВГД уже около 40%. К сожалению, использование монотерапии препаратами группы ингибиторов карбоангидразы или бета-блокаторов не позволяет достичь снижения ВГД более чем на 30% и не будет эффективным у пациентов с более развитой стадией глаукомы. Комбинированное лечение с использованием разных лекарственных средств позволяет добиться необходимого гипотензивного эффекта, однако такой подход имеет существенные недостатки, поскольку приводит к повышению кратности использования препаратов до 3 и более раз в сутки, что крайне негативно сказывается на приверженности к лечению.
В условиях высокого темпа жизни пациенты склонны пропускать использование препарата, а это, в свою очередь, приводит к значительным колебаниям ВГД в течение суток и существенно повышает риск потери зрения. Именно в такой ситуации оптимальным решением является применение фиксированных комбинаций. Сочетание двух действующих веществ в одном флаконе позволяет снизить необходимое количество инстилляций в сутки до 1-2 раз, что значительно повышает приверженность к лечению.
Таким образом, применение фиксированных комбинаций обеспечивает более выраженное снижение ВГД по сравнению с монотерапией и способствует приверженности пациента к назначенной схеме лечения. Важно также отметить, что только в том случае, когда пациент четко придерживается схемы лечения, у врача есть возможность объективного контроля эффективности терапии.
? Какие компоненты фиксированных комбинаций наиболее широко применяются в настоящее время?
– До 60-70% офтальмологов начинают лечить глаукому с назначения бета-блокатора. Одним из наиболее широко используемых препаратов данной группы является тимолол, его начали применять в клинической практике еще с 60-х годов ХХ века. К преимуществам тимолола относятся высокая доступность для пациентов и эффективное снижение ВГД. Однако для тимолола характерны недостатки, связанные с воздействием на сердечно-сосудистую и дыхательную системы. Тем не менее тимолол чаще всего включают в фиксированные комбинации для лечения глаукомы.
Ингибитор карбоангидразы дорзоламид, напротив, является относительно новым средством, которое начали применять в терапии глаукомы только в конце 90-х годов прошлого века. Препарат обладает достаточно высокой эффективностью в снижении ВГД (до 25-30%) и блокирует выработку водянистой влаги. Кроме эффективного снижения ВГД, дорзоламид также оказывает положительное действие на кровоток в области зрительного нерва, проявляет выраженные антиоксидантные и противоотечные свойства. Благодаря перечисленным эффектам применение тимолола в комбинации с дорзоламидом позволяет достичь комплексного воздействия на патогенетические механизмы глаукомы и более эффективно снижать ВГД по сравнению с монотерапией тимололом.
Украинская фармацевтическая компания «Киевский витаминный завод» выпустила новый комбинированный препарат Дорзитим® (дорзоламид/тимолол). Препарат выпускается во флаконах для проведения инстилляций в конъюнктивальный мешок. Дорзитим® назначают по 1 капле 2 раза в сутки. Дозировка тимолола и дорзоламида в Дорзитиме составляет 5 и 20 мг/л соответственно. Препарат обладает преимуществами комбинированного использования тимолола и дорзоламида, включая эффективное снижение ВГД, нейропротекторный, антиоксидантный и противоотечный эффекты, а также позволяет достичь высокого комплайенса за счет удобной схемы применения.
! Важно отметить, что фиксированная комбинация бета-блокатора и ингибитора карбоангидразы Дорзитим® на сегодняшний день имеет наиболее мощную доказательную базу среди препаратов, применяющихся для снижения ВГД у пациентов с глаукомой. Многоцентровыми исследованиями было обосновано, что эта комбинация улучшает кровоток в области зрительного нерва, обладает выраженным антиоксидантным воздействием. Комбинированное использование дорзоламида и тимолола обеспечивает снижение ВГД на 37%, а также обладает дополнительным нейропротекторным эффектом, не увеличивая при этом системные эффекты тимолола. С точки зрения воздействия на различные патогенетические механизмы развития глаукомы (повышение ВГД, оксидативный стресс, нарушение трофики зрительного нерва) более выгодной фиксированной комбинации для лечения глаукомы в настоящее время не существует.
Подготовил Игорь Кравченко
Медична газета «Здоров’я України 21 сторіччя» № 8 (429), квітень 2018 р.
СТАТТІ ЗА ТЕМОЮ
02.04.2020
Пульмонологія та оториноларингологія
Гострий риносинусит у період вірусної загрози: нагадуємо підходи до діагностики та лікування
Гострий риносинусит (ГРС) – чи не найчастіша недуга, з якою люди або намагаються впоратися самотужки, або відвідують отоларинголога, сімейного лікаря. Звертаються по медичну допомогу задля отримання лікарняного, але ж і на професійну пораду сподіваються, щоб лікар допоміг якнайшвидше «повернутись у стрій»….
01.04.2020
Терапія та сімейна медицина
Медичні освітяни не лише навчають студентів, а й розширюють свої горизонти, компетентності, звіряють цінності завдяки Осінній школі з медичної освіти
Реформу системи охорони здоров’я було визначено головним урядовим пріоритетом, починаючи з 2016 року, а вже у 2017 році Верховна Рада України ухвалила закон про медичну реформу. Питання потреби в реформі медичної освіти та запровадження інноваційних підходів до розвитку кадрового потенціалу раніше вже піднімалося в кількох політичних дебатах, і після тривалого процесу, який передбачав консультації з ключовими стейкхолдерами, включаючи студентів, викладачів, адміністрації закладів вищої освіти (ЗВО), в липні 2018 року було оприлюднено проєкт «Стратегії розвитку медичної освіти в Україні до 2028 року» (доступний для ознайомлення на офіційному сайті Міністерства охорони здоров’я України – МОЗ). Отже, Україна здобула системне бачення розвитку медичної освіти….
Источник


