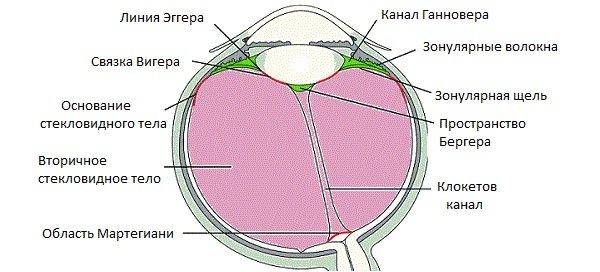
Деструкция очагов воспаления неоваскуляризации или новообразования сетчатки
Суточное наблюдение больного в 2-х местной палате
Суточное наблюдение больного в 2-х местной палате с дополнительным лечебным питанием
Суточное наблюдение больного в 1- местной палате
Суточное наблюдение больного в 1- местной палате с дополнительным лечебным питанием
Суточное наблюдение больного в палате категории «полулюкс»
Суточное наблюдение больного в палате категории «полулюкс» с дополнительным лечебным питанием
Суточное наблюдение больного в палате категории «люкс»
Суточное наблюдение больного в палате категории «люкс» с дополнительным лечебным питанием
Биопсия новообразования век, конъюнктивы или роговицы
Биопсия слезной железы с использованием радиоволнового метода
Биопсия слезного мешка
Биопсия новообразования радужки или цилиарного тела (новообразований)
Биопсия глазницы
Лазерная корепраксия, дисцизия задней капсулы хрусталика
Лазерная иридэктомия
Фокальная лазерная коагуляция глазного дна (Паравазальная коагуляция сетчатки)
Фокальная лазерная коагуляция глазного дна (Периферическая отграничительная коагуляция сетчатки)
Фокальная лазерная коагуляция глазного дна (Барраж макулярной области)
Панретинальная лазеркоагуляция сетчатки
Лазерная деструкция новообразований сетчатки, век, конъюнктивы, сосудистой оболочки глаза (Термотерапия внутриглазной опухоли)
Устранение дислокации слезной железы (дренирование слезной железы)
Интубация слезных протоков
Конъюнктиводакриостомия, конъюнктивориностомия
Удаление халязиона
Удаление контагиозного моллюска, вскрытие малых ретенционных кист век и конъюнктивы, ячменя, абсцесса века
Устранение энтропиона или эктропиона (операции по устранению выворота, заворота)
Коррекция блефароптоза (Миопластика леватора верхнего века)
Коррекция блефароптоза (Устранение птоза верхнего века путем резекции леватора)
Коррекция блефароптоза (Устранение птоза путем подвешивания век)
Коррекция блефарохалязиса
Блефарорафия
Удаление новообразования века
Удаление инородного тела века
Удаление новообразования века без пластики методом радиоволновой деструкции
Удаление новообразования века с пластикой методом радиоволновой деструкции
Свободная кожная пластика век и периокулярной области
Удлинение глазной мышцы по Стифенсону (1 мышца)
Удаление инородного тела конъюнктивы
Ушивание раны конъюнктивы
Снятие шва с конъюнктивы
Рассечение симблефарона
Пластика конъюнктивальной полости
Реконструкция конъюнктивальной полости при анофтальме
Аллопластическое коррекция анкилоблефарона
Устранение субтотального заращения конъюнктивной полости
Удаление птеригиума
Задняя послойная кератопластика (пересадка дисцеметовой оболочки)
Послойная кератопластика
Послойная кератопластика краевая
Кератопротезирование (укрепление бельма)
Удаление инородного тела роговицы (без проникновения в переднюю камеру глаза)
Удаление инородного тела роговицы с проникновением в переднюю камеру глаза
Ушивание раны роговицы
Снятие узлового шва с роговицы
Снятие кругового шва с роговицы после кератопластики
Парацентез, пункция передней камеры глаза
Промывание и пункция передней камеры глаза
Удаление инородного тела из переднего сегмента глаза
Иридопластика (местными тканями)
Трабекулоэктомия (синустрабекулоэктомия)
Декомпрессия зрительного нерва (жировая декомпрессия орбиты 1-го глаза)
Реваскуляция зрительного нерва с декомпрессией
Глубокая склерэктомия
Склеропластика (без стоимости трансплантатов) — 1 глаз
Склеропластика с использованием трансплантатов
Ушивание раны склеры
Удаление инородного тела из склеры
Реваскуляризация заднего сегмента глаза
Стимуляция васкулогенеза
Локальное эписклеральное пломбирование
Круговое эпиклеральное пломбирование
Деструкция очагов воспаления, неоваскуляризации или новообразование сетчатки, хориоидеи. Удаление опухоли радужки
Деструкция очагов воспаления, неоваскуляризации или новообразование сетчатки, хориоидеи (иридоциклэктомия)
Деструкция очагов воспаления, неоваскуляризации или новообразование сетчатки, хориоидеи — Иридоциклосклерэктомия
Эндовитреальное введение лекарственных препаратов, воздуха, силикона
Замещение стекловидного тела
Витреоэктомия
Витреошвартэктомия
Экстракция хрусталика (экстракапсулярная )
Удаление вывихнутого хрусталика
Факоэмульсификация ультразвуковая катаракты с имплантацией интраокулярной линзы и непроникающей склерэктомией
Факоэмульсификация с имплантацией интраокулярной линзы (без стоимости ИОЛ)
Факоэмульсификация (без стоимости ИОЛ)
Факоаспирация катаракты с имплантацией ИОЛ
Имплантация интраокулярной линзы
Репозиция с подшиванием интраокулярной линзы
Замена интраокулярной линзы
Удаление интраокулярной линзы
Рассечение спаек или задней капсулы хрусталика
Энуклеация глазного яблока
Энуклеация глазного яблока с пластикой опорно-двигательной культи глаза аллоплантом
Пластика глазницы с использованием аллопластического материала
Орбитотомия
Орбитотомия с удалением новообразования орбиты
Реконструкция глазницы (частичная)
Реконструкция глазницы контурная и височной области
Непроникающая глубокая склерэктомия
Удаление силиконового масла (или иного высокомолекулярного соединения) из витреальной полости
Удаление эпибульбарной опухоли методом радиоволновой деструкции
Удаление эпибульбарной опухоли с реконструкцией переднего отрезка глаза
Удаление эпибульбарной опухоли с реконструкцией переднего отрезка глаз
Микроинвазивная хирургия шлеммова канала
Источник
Тищенко О.Е.
1Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Пролиферативные заболевания сетчатки являются одной из причин слепоты и слабовидения во всем мире, самыми распространенными из которых являются пролиферативная диабетическая ретинопатия (ПДР) и экссудативная форма возрастной макулярной дегенерации (ВМД).
Для определения новых стратегических направлений в лечении офтальмологических заболеваний, связанных с развитием неоваскуляризции, необходимо иметь четкое представление о механизмах развития патологического ангиогенеза. Регуляция процессов формирования новообразованных сосудов, с точки зрения современных представлений, осуществляется благодаря наличию системы, связанных между собой, стимулирующих и ингибирующих факторов. Нарушение баланса в этой системе — между ангиогенными и антиангиогенными факторами приводит к развитию патологического ангиогенеза [37].
В настоящее время известно большое количество ангиогенных или, как их еще принято называть, — вазопролиферативных факторов, которые прямо или опосредованно влияют на ангиогенез. К ним относятся кислый и основной фактор роста фибробластов (aFGF, bFGF), инсулиноподобный фактор роста, фактор роста гепатоцитов (HGF), трансформирующий фактор роста b (TGF-b). Ключевым фактором ангиогенеза в норме и патологии, благодаря его биологическим свойствам, принято считать эндотелиальный сосудистый фактор роста (Vascular Endothelial Growth Factor-VEGF) [13].
VEGF принадлежит к семейству пептидных факторов. В настоящее время идентифицировано 8 его изоформ, отличающихся по количеству образующих аминокислот; наиболее распространенной из, которых, является изоформа VEGF-165.
Экспрессируется VEGF в хориоидее и сетчатке — перицитах и эндотелиоцитах, клетках пигментного эпителия и клетках Мюллера, ганглионарных клетках и глиальных [26].
Основным стимулом к повышению его экспрессии является гипоксия [36]. Кроме того, установлено, что усиливают продукцию VEGF некоторые противовоспалительные цитокины (IL-1 и IL-6) и ростовые факторы (Epidermal Growth Factor, Transforming Growth Factor).
Основные биологические эффекты VEGF проявляются при его взаимодействии с двумя основными видами рецепторов — VEGFR1 и VEGFR2, расположенных преимущественно на эндотелиоцитах и клетках Мюллера. Активация рецепторов VEGFR2 в процессах ангиогенеза играет ключевую роль, так как приводит к повышению сосудистой проницаемости [14].
За счет взаимодействия с рецепторами VEGF индуцирует комплекс механизмов формирования сосудов, который включает в себя пролиферацию эндотелиоцитов, их миграцию и индукцию синтеза металлопротеиназ — ферментов, необходимых для инвазии новообразованных сосудов в окружающие ткани [42].
В связи с тем, что VEGF играет роль одного из ведущих факторов в развитии патологической неоваскуляризации, целесообразно было предположить, что возможность ингибировать его действие — это возможность предотвратить развитие патологического ангиогенеза и, связанной с ним офтальмопатологии.
В настоящее время с этой целью используются несколько лекарственных препаратов — пегаптаниб (Макуджен) — селективный ингибитор VEGF-165, ранибизумаб (Луцентис) и бевацизумаб (Авастин) — блокаторы всех изоформ VEGF.
Пегаптаниб (Макуджен) по химической структуре представляет собой аптамер, связывающий изоформу VEGF-165. На основании проведения ряда клинических исследований пациентов с ВМД и субретинальной неоваскулярной мембраной (СНМ) субфовеолярной локализации было установлено, что данный препарат по эффективности не уступает ФДТ, при его применении наблюдается стабилизация и повышение зрительных функций [15].
Ранибизумаб (Луцентис) представляет собой Fab-фрагмент полноразмерного рекомбинантного моноклонального антитела ко всем изоформам VEGF. Эффективность данного препарата была доказана также при ВМД с СНМ всех типов с субфовеолярной локализацией [22].
Бевацизумаб (Авастин) — полноразмерное рекомбинантное моноклональное антитело ко всем изоформам VEGF.
Проведено большое количество научно-клинических исследований, посвященных его применению при ВМД со всеми типами хориоидальной неоваскуляризации с субфовеолярной локализацией [3, 35]. Обобщенные результаты свидетельствуют о том, что при его применении также наблюдается стабилизация (в 52,8-56% случаев) и повышение остроты зрения (в 30,4-43% случаев).
Положительный эффект, по результатам исследований ряда авторов, был получен и при применении бевацизумаба при ПДР. Наблюдался значительный и быстрый регресс новообразованных сосудов при его интравитреальном введении [2].
Высокая эффективность и относительно невысокая цена бевацизумаба, по сравнению с аналогичными препаратами (пегаптаниб, ранибизумаб) и ФДТ является основанием для проведения в настоящее время дальнейших широкомасштабных экспериментальных и клинических исследований, посвященных его применению в офтальмологии. В связи с тем, что в официальном перечне показаний для его применения отсутствуют офтальмологические заболевания (применяется «off-label») требуется проведение целого ряда дополнительных научно-исследовательских мероприятий.
Однако, несмотря на высокую эффективность, препараты, блокирующие сосудистый эндотелиальный фактор роста, особенно все его изоформы, продолжают вызывать некоторые опасения. Возможными осложнениями при применении бевацизумаба являются — артериальная гипертензия, острое (инфаркт миокарда, инсульт) и хроническое нарушение кровообращения (хроническая сердечная недостаточность, ишемия сосудов головного мозга), тромбоз глубоких вен [46]. В связи с этим при применении бевацизумаба авторы исключали из своих исследований пациентов с некомпенсированной артериальной гипертензией, инфарктом миокарда в анамнезе и нарушением функции сосудов головного мозга [3]. В результате проведения крупных клинических исследований (VISION, MARINA, ANCHOR, FOCUS) было уставлено, что при ВМД пегаптаниб (селективный блокатор VEGF-165) менее эффективен, чем ранибизумаб (блокирует все изоформы VEGF), но риск нежелательных осложнений при его применении значительно меньше. Сообщается об увеличении частоты сердечно-сосудистых нарушений, острых нарушений кровообращения головного мозга и кровотечений, по сравнению с группой плацебо, при применении ранибизумаба, однако, полученные различия не были статистически значимы.
Ряд авторов сообщает о некоторых других нежелательных эффектах данной группы препаратов. VEGF принимает участие в обеспечении жизнедеятельности хориокапилляров [24]; при интравитриальном введении бевацизумаба и, соответственно, снижении уровня его содержания наблюдались случаи атрофии хориокапилляриса у пациентов. Кроме этого VEGF в условиях ишемии сетчатки обладает нейропротективным действием [28]. Отсутствие этого эффекта в результате его блокады может привести к дальнейшему прогрессированию нейрональных повреждений [23].
В эксперименте при интравитреальном введении бевацизумаба, по результатам электронной микроскопии, было выявлено митохондриальное разрушение во внутреннем сегменте фоторецепторов и усиление апоптоза [18].
Накопленный клинический опыт свидетельствует о высокой эффективности анти-VEGF-препаратов в лечении заболеваний, сопровождающихся неоваскуляризацией и патологической проницаемостью сосудов. Однако, учитывая необходимость длительного лечения данной патологии, требуется проведение дополнительных экспериментальных и клинических исследований, которые позволят определить не только положительные, но ивозможные отрицательные побочные эффекты.
Поэтому изучение и разработка новых подходов в подавлении нежелательных патологических эффектов VEGF и одновременное сохранение нейропротективных и нейротрофических свойств может стать значимым прорывом в лечении данных заболеваний.
Большие надежды возлагаются на фактор пигментного эпителия (Pigment Epithelium-Derived Factor-PEDF), который является мощным эндогенным ингибитором ангиогенеза и обладает нейротрофическими и нейропротективными свойствами.
Впервые PEDF был обнаружен в культуральной среде человеческих клеток пигментного эпителия сетчатки, как белок с нейротрофической активностью. Было установлено, что PEDF является индуктором нейрональной дифференцировки клеток в культуре клеток ретинобластомы и авторы делают вывод о том, что PEDF играет важную роль в развитии и дифференцировке нервной ткани сетчатки [43].
В следующей работе установлено, что PEDF — белок с молекулярной массой 50 kDa и синтезируется в эмбриональных клетках ретинального пигментного эпителия. Ген PEDF в эмбриональных человеческих клетках является активным уже в 17 недель, что свидетельствует о вовлечении PEDF в развитие нервной ткани на ранних этапах [44].
Анализ последовательности ДНК показал, что молекула PEDF родственна серпиновому семейству сериновых протеаз [38].
Далее фактор пигментного эпителия был обнаружен в фоторецепторах и ретинальном пигментном эпителии, из которого он секретируется в интерфоторецепторный матрикс. PEDF локализуется во внутренних слоях сетчатки, хориоидее, цилиарном теле, в роговичном эпителии и эндотелии, в водянистой влаге, в высоких концентрациях содержится в стекловидном теле [5].
В связи с тем, что PEDF проявляет нейротрофическую активность в культуре опухолевых клеток (ретинобластома), возникло предположение, что это свойство должно проявляться и в отношении нейронов без патологии. В связи с этим было проведено исследование свойств рекомбинантного PEDF в культурах нормальных мозжечковых гранулярных клетках. Авторами было установлено, что PEDF значительно увеличивает клеточную жизнеспособность, не оказывая влияния на митотическую активность [41].
При более детальных исследованиях было установлено, что гибель клеток в культуре мозжечковых гранулярных клеток является естественным апоптозом, а PEDF является мощным ингибитором, как естественного, так и вызванного апоптоза [1].
Влияние PEDF не ограничивается только мозговыми нейронами. Было выявлено, что PEDF способствует дифференцировке и выживанию развивающихся спинных моторных нейронов [17]. В другой работе было установлено, что в органотипической культуре на модели моторной нейрональной дегенерации, в присутствии PEDF сохраняется морфологическая структура и общее количество нейронов [7].
PEDF обладает достаточно выраженными нейротрофическими свойствами, как при хроническом, так и при остром нейротоксическом повреждении; активно защищает мозжечковые гранулярные клетки при глутаматном токсическом повреждении [40], поддерживает клеточную жизнеспособность за счет уменьшения апоптоза, вызванного перекисью водорода, в культуре крысиных ретинальных нейронов [9].
При наследственной ретинальной дегенерации сетчатки у мышей, характеризующейся гибелью фоторецепторов, PEDF также проявил свойства ингибитора апоптоза, тем самым, увеличив выживаемость фоторецепторов [11].
Анализ активности PEDF на модели повреждения фоторецепторов, связанной с потерей пигментного эпителия (эмбриональная культура сетчатки лягушек без пигментного эпителия) показал, что PEDF при отсутствии пигментного эпителия поддерживает нормальное развитие фоторецепторов и экспрессию опсина [19].
При интравитреальном введении PEDF крысам с последующим воздействием повреждающих уровней освещенности, было установлено, что он обладает защитным действием на фоторецепторы от светового повреждения [10]. В культуре крысиных ретинальных ганглиозных клеток при глутаматном повреждении PEDF предохранял данные клетки от гибели [34].
При проведении клинических исследований было выявлено снижение уровня содержания PEDF в тканях глаза у пациентов с глаукомой [31] и миопией высокой степени, особенно с хориоретинальной дистрофией [29]. Авторы предполагают, что это может быть связано с гибелью при этой патологии ганглиозных клеток и клеток пигментного эпителия сетчатки, которые синтезируют PEDF.
В настоящее время PEDF представляет собой большой интерес для офтальмологов, не столько как фактор с нейротрофическими и нейропротективными свойствами, сколько, как один из главных эндогенных ингибиторов ангиогенеза [4]. Он обладает мощной антиангиогенной активностью, ингибирует миграцию и пролиферацию эндотелиальных клеток, которые играют основную роль в развитии патологической васкуляризации.
Выявлено, что PEDF поддерживает антиангиогенные свойства стекловидного тела и роговицы. В сетчатке физиологическое действие PEDF регулируется концентрацией кислорода: фактор пигментного эпителия создает условия для формирования сосудов, когда концентрация кислорода снижена, и ингибирует ангиогенез при высокой его концентрации [33].
На экспериментальной модели ишемической ретинопатии было установлено, что системное введение рекомбинантного PEDF предотвращает развитие ретинальной неоваскуляризации. В этой же работе было выявлено, что PEDF вызывает усиление апоптоза в культуре человеческих эндотелиальных клеток [39].
При интравитреальном введении рекомбинантного фактора пигментного эпителия мышам с экспериментальной моделью ретинальной неоваскуляризации, вызванной ишемией, было выявлено подавление роста патологических сосудов. В изолированной культуре эндотелиальных клеток увеличение концентрации PEDF приводило к ингибированию VEGF-вызванной миграции и пролиферации [12].
Интравитреальное введение мышам аденовирусного генетического вектора, содержащего ген фактора пигментного эпителия, выявило наличие регрессии вызванной неоваскуляризации, в ответ на повышенную экспрессию PEDF. Подавление патологического роста сосудов происходило за счет усиления апоптоза эндотелиальных клеток в пределах неоваскулярных повреждений [27].
Роль фактора пигментного эпителия была показана на модели хориоидальной неоваскуляризации in vitro. В работе пролиферация и миграция человеческих хориоидальных эндотелиальных клеток была вызвана сосудистым эндотелиальным фактором роста (VEGF). При воздействии различных доз PEDF на культуры происходило подавление VEGF-вызванной пролиферации и миграции хориоидальных эндотелиальных клеток [47].
На основании проведения клинических исследований было выявлено, что у пациентов с пролиферативной диабетической ретинопатией концентрация PEDF в водянистой влаге значительно ниже, чем у пациентов без данной патологии. Было установлено наличие корреляции между уровнем снижения PEDF и степенью тяжести пролиферативных изменений. Авторы выcказали предположение, что низкий уровень содержания фактора пигментного эпителия в водянистой влаге может являться прогностическим критерием прогрессирования диабетической ретинопатии [8].
При возрастной макулодистрофии было показано, что у пациентов с хориоидальной неоваскуляризацией уровень PEDF в стекловидном теле значительно снижен. Исходя из этого, авторы делают вывод о том, что снижение PEDF играет существенную роль в формировании и прогрессировании хориоидальной неоваскуляризации при возрастной макулодистрофии [16].
Недавно было обнаружено, что снижение PEDF в водянистой влаге находится в прямо пропорциональной зависимости от возраста, авторы считают, что данный факт может быть связан с увеличением с возрастом офтальмопатологии, особенно связанной с патологическим ангиогенезом [30].
В плазме крови у пациентов с диабетической ретинопатией было выявлено повышение уровня PEDF, при пролиферативной диабетической ретинопатии его уровень был выше. Авторы предполагают, что увеличение PEDF в плазме крови связано с микроваскулярными повреждениями и может прогнозировать вероятность прогрессирования [25].
Многочисленные экспериментальные и клинические исследования свидетельствуют о том, что при формировании патологической неоваскуляризации основная роль в нарушении баланса между ангиогенными и антиангиогенными факторами принадлежит сосудистому эндотелиальному фактору роста (VEGF) и фактору пигментного эпителия (PEDF) [20].
На экспериментальной модели хориоидальной неоваскуляризации для достижения терапевтического эффекта проводилось индуцированное снижение уровней VEGF или увеличение PEDF. В результате данной работы авторы получили подтверждение, что дисбаланс в системе VEGF — PEDF является основной причиной формирования хориоидальной неоваскуляризации, для поддержания физиологического ангиогенеза необходимо наличие баланса в этой системе [45].
На модели ретинальной неоваскуляризации, индуцированной ишемией, у крыс и мышей было проведено исследование по определению ретинального уровня сосудистого эндотелиального фактора роста и фактора пигментного эпителия. У животных с неоваскуляризацией было выявлено достоверное увеличение содержания VEGF, снижение PEDF и, соответственно, увеличение соотношения VEGF/PEDF. При прогрессировании патологического процесса ретинальной неоваскуляризации соотношение увеличивалось [21].
При возрастной макулодистрофии было выявлено значительное снижение уровня PEDF в сосудистой оболочке и, соответственно, нарушение баланса между VEGF и PEDF [6].
Дисбаланс между VEGF и PEDF был выявлен и в стекловидном теле у пациентов с диабетической ретинопатией: наблюдалось увеличение уровня VEGF и снижение уровня PEDF, причем эти нарушения были более выражены при пролиферативной диабетической ретинопатии [32].
Таким образом, анализ результатов экспериментальных и клинических исследований свидетельствует о том, что в основе развития патологического ангиогенеза лежат нарушения в системе баланса между сосудистым эндотелиальным фактором роста — VEGF и фактором пигментного эпителия — PEDF. Применение лекарственных препаратов — ингибиторов VEGF (Макуджен, Луцентис, Авастин), в настоящее время является одним из основных подходов в решении данной проблемы. Накопленный опыт свидетельствует о высокой эффективности анти-VEGF-препаратов в лечении офтальмологических заболеваний, сопровождающихся неоваскуляризацией и патологической проницаемостью сосудов. Однако, применение препаратов этой группы, в связи с вероятностью побочных явлений нейроваскулярного характера, обусловленных механизмом их действия, может быть только дифференцированным. Альтернативным способом восстановления баланса в системе может быть коррекция уровня PEDF. Результаты экспериментальных исследований свидетельствуют о том, что PEDF является достаточно сильным эндогенным ингибитором патологического роста сосудов при пролиферативной диабетической ретинопатии и экссудативной форме макулярной дегенерации, подавляя действия повышенной экспрессиии VEGF. Немногочисленные результаты исследований других авторов свидетельствуют о том, что PEDF обладает нейротрофическими и нейропротективными свойствами. При наличии таких уникальных свойств (физиологичность и комплексность) PEDF, вероятно, следует рассматривать, в качестве еще одного претендента на роль ингибитора патологической неоваскуляризации при ряде офтальмологических заболеваний.
Источник