Что такое рефрактерная глаукома
В статье представлено историческое развитие представлений о способах хирургического лечения рефрактерных форм глаукомы.
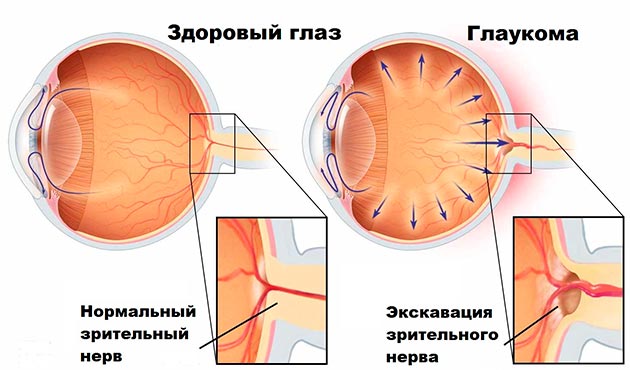
Понятие «рефрактерная глаукома»
В соответствии с современными представлениями, глаукома — это заболевание или группа заболеваний, сопровождающаяся поражением зрительного нерва (с формированием экскавации), характерными изменениями поля зрения, основным фактором риска которых является повышение внутриглазного давления (ВГД) выше толерантного уровня [1–5].
Глаукома является социально значимым заболеванием. Это связано с тем, что, наряду с ее высокой распространенностью, она приводит к высокому проценту инвалидизации пациентов [6, 7].
Значительную роль в росте показателей инвалидизации играет рефрактерная глаукома.
Под термином «рефрактерная глаукома» понимают такую форму заболевания, при которой отмечается тяжелое, упорное течение, осложненное устойчивостью, а часто и невосприимчивостью к стандартным способам лечения. К этой патологии относятся первичная ранее оперированная глаукома, которая требует проведения повторного хирургического вмешательства, врожденная, ювенильная, глаукома у лиц до 40 лет, а также вторичная глаукома (неоваскулярная, посттравматическая, увеальная и др.) [8–12].
Факторами риска рубцевания сформированных в ходе операции путей оттока внутриглазной жидкости (ВГЖ) являются: предшествующие хирургические вмешательства на глазном яблоке, ранее проведенные лазерные операции в области угла передней камеры, послеоперационные осложнения, исходно высокий уровень ВГД (свыше 40 мм рт. ст.), далеко зашедшая стадия глаукомы, псевдоэксфолиативный синдром, ранее длительно применяемая гипотензивная терапия с использованием нескольких препаратов одновременно [13].
Этиопатогенез рефрактерной глаукомы многообразен. Основой являются анатомические изменения в дренажной структуре глаза, что затрудняет или делает невозможным отток камерной влаги [14]. Причинами этого могут быть неоваскуляризация корня радужной оболочки, гониодисгенез II–III степени, выраженные гониосинехии, грубая дисперсия пигмента на структурах угла передней камеры, сращение корня радужки с передней стенкой шлеммова канала [8, 13, 15–19].
Как следствие, медикаментозное и лазерное лечение, несмотря на их широкие возможности, в случае данной формы заболевания оказываются неэффективными [13, 20].
Основным способом лечения этой патологии является оперативное вмешательство [21, 22]. Однако большую проблему представляет собой резистентность данной формы глаукомы к обычным методам хирургического воздействия. По некоторым данным, примерно у 10–25% больных в отдаленные сроки после хирургического вмешательства возникает блокада ранее созданных путей оттока ВГЖ рубцовой тканью [23–25].
На современном этапе выделяют три главных хирургических направления лечения больных с рефрактерными формами глаукомы:
Циклодеструктивные операции.
Операции, способствующие улучшению оттока ВГЖ с интраоперационным применением цитостатиков.
Операции с имплантацией искусственных дренажей, что обеспечивает направленный отток камерной влаги под конъюнктиву [26, 27].
Циклодеструктивные вмешательства
Данный вид операций направлен на снижение продукции ВГЖ. В случае рефрактерной глаукомы это вмешательство, как правило, является вторым этапом лечения, когда операции фистулизирующего типа, даже при повторном выполнении, не обеспечивают должной и стабильной нормализации уровня ВГД.
История циклодеструктивных операций начинается с H. Weve, предложившего в 1933 г. применение диатермии для селективной деструкции цилиарных отростков. Однако данный метод не получил широкого распространения, т. к. в большом числе случаев сопровождается фтизисом глазного яблока [14].
Предложенная позже циклокриодеструкция цилиарного тела основана на замораживании тканей, что вызывает дегидратацию клеток и механическое повреждение их мембран. Развивается ишемический некроз вследствие облитерации микрососудов в замороженной ткани.
В послеоперационном периоде возможны развитие выраженного болевого синдрома на первый день после операции, повышение уровня ВГД в момент вмешательства и в ранние сроки после операции, интенсивная воспалительная реакция, гифема, гипотония и фтизис глазного яблока.
В связи с этим на замену циклокриодеструкции разработана транссклеральная фотокоагуляция в проекции цилиарного тела [14, 28].
В настоящее время для ее проведения используются YAG-лазер, полупроводниковый диодный и ксеноновый лазеры. Механизм снижения ВГД при лазерном воздействии осуществляется за счет селективного воздействия на эпителий цилиарных отростков с их последующей атрофией.
Эффективность транссклеральной фотокоагуляции очень вариабельна. По некоторым данным, она составляет от 25 до 44% и снижается со временем после операции: в 1-й год эффективность высока и составляет 54%, во 2-й год снижается до 27,7% [14].
Также циклофотокоагуляция сопровождается развитием ряда осложнений. К их числу относятся болевой синдром, ожог конъюнктивы, транзиторный подъем уровня ВГД, гипотония и фтизис глазного яблока в отдаленные сроки наблюдения.
Среди осложнений, возможных при использовании диодного лазера, помимо вышеперечисленных наблюдаются гифема, гемофтальм, фибринозный увеит, стафилома склеры с перфорацией.
Разработанная позднее транссклеральная фотоциклодеструкция выполняется с применением аргонового лазера. Лазеркоагуляты наносятся на отростки цилиарного тела [14].
В настоящее время возможно также проведение эндоскопической циклофотодеструкции во время экстракции катаракты или витрэктомии. Эффективность данного метода составляет от 17 до 43%. Среди осложнений наблюдаются гемофтальм, гипотония, отслойка сосудистой оболочки.
Гипотензивный эффект от проведенных циклодеструктивных вмешательств является кратковременным (до 6 мес.). На сегодняшний день указанные методы хирургического воздействия используются нечасто, в основном у пациентов с рубцовыми изменениями роговицы и конъюнктивы, неоваскуляризацией радужки, с тяжелыми системными заболеваниями.
Наличие ряда серьезных послеоперационных осложнений и низкая эффективность существенно ограничивают широкое применение этих операций при лечении рефрактерной глаукомы.
Хирургия глаукомы с интраоперационным применением цитостатиков
С целью уменьшения рубцевания созданных в ходе оперативного вмешательства путей оттока ВГЖ в течение последних 20–30 лет активно применяются цитостатики в виде интраоперационных аппликаций.
Согласно клиническим наблюдениям, эффективность трабекулэктомии при рефрактерной глаукоме не превышает 20% в течение 1-го года после операции, в то время как проведение хирургического вмешательства в сочетании с интраоперационным применением цитостатика повышает данный показатель до 56% [14].
Применение цитостатических препаратов началось с 5-фторурацила. Данный препарат, согласно зарубежным источникам [29, 30], используется при лечении онкологических заболеваний, в т. ч. патологии органа зрения, однако при лечении глаукомы его применение не регламентируется официальными инструкциями. В России данный препарат не разрешен для применения в офтальмологии используется off-label. Действие 5-фторурацила основано на угнетении синтеза нуклеиновых кислот вследствие подавления тимидилатсинтетазы. Это способствует снижению деления эписклеральных фибробластов, тем самым уменьшая рубцевание в области фильтрационной подушки. Этот антиметаболит используют при антиглаукомных операциях в виде аппликаций. Губку пропитывают раствором препарата (25 или 50 мг/мл) и укладывают над или под склеральный лоскут. Длительность аппликации составляет 2–3 мин [31]. Эффективность применения 5-фторурацила варьирует в пределах 56–79% [13].
Вторым по частоте использования среди цитостатиков является митомицин, превосходящий 5-фторурацил по супрессивной активности в 100–300 раз [13]. Этот антиметаболит, согласно данным зарубежной литературы [32], применяется для лечения онкологических заболеваний переднего отрезка глаза в виде кратковременных аппликаций (3–5 мин) 0,02–0,04% раствора, для лечения глаукомы препарат не имеет зарегистрированных показаний и используется off-label. Митомицин ингибирует синтез нуклеиновых кислот вне зависимости от стадии клеточного цикла, что обусловливает более короткое время интраоперационной аппликации, по сравнению с 5-фторурацилом, для достижения оптимального эффекта.
F. Sayyad et al. провели сравнительный анализ эффективности трабекулэктомии с аппликацией митомицина под конъюнктивальный или склеральный лоскуты, а также с аппликацией препарата под оба лоскута. Было выявлено, что сочетанное применение цитостатика обеспечивает более эффективное снижение уровня ВГД. Успешность антиглаукомной хирургии с применением митомицина колеблется от 65,5 до 89% [13].
Несмотря на то, что интраоперационное использование антиметаболитов дает хороший гипотензивный эффект, их широкое применение затруднено из-за сходства биохимических и биологических свойств всех активно пролиферирующих клеток. Из этого следует, что препараты данного ряда оказывают токсическое действие на все делящиеся клетки, что сопряжено с развитием ряда серьезных осложнений. К ним относятся: избыточная фильтрация водянистой влаги в послеоперационном периоде (4,2–36,8%) с последующей гипотонией и симптоматической макулопатией; кератопатия (50–69%); развитие и прогрессирование катаракты (23–48%); формирование кистозных фильтрационных подушек (37–54%); геморрагическая цилиохориоидальная отслойка (5–9%); несостоятельность швов (36–38%). Отмечены также случаи помутнения интраокулярной линзы после использования митомицина во время операции, связанные с измененной рН водянистой влаги, что способствует отложению кристаллов кальция на линзе.
Кроме того, применение цитостатиков существенно повышает риск развития гифемы (21%), послеоперационной офтальмогипертензии (21%) и инфекционных осложнений [14].
Абсолютным противопоказанием для интраоперационных аппликаций цитостатиков является наличие значительных конъюнктивальных и роговичных дефектов. Рекомендуется также не применять антиметаболиты при значительном истончении конъюнктивы глазного яблока, а также при осевой близорукости [14].
Дренажная хирургия рефрактерной глаукомы
Операции этого типа способствуют нормализации уровня ВГД даже в условиях выраженной фибропластической активности тканей глаза благодаря применению дренажей, которые обеспечивают ток камерной влаги в субконъюнктивальное или в супрахориоидальное пространство. Кроме того, дренажные устройства препятствуют сращению поверхностного и глубокого листков склеры, поддерживая узкое пространство, обеспечивающее ток водянистой влаги в послеоперационном периоде [33–35].
Применение дренажей в хирургии глаукомы началось в 1912 г., когда впервые в качестве имплантата была использована шелковая нить. В последующем в качестве дренажных элементов использовались также радужка, капсула хрусталика, склера, мышечная ткань [36, 37].
Более длительное и стойкое снижение уровня ВГД при хирургии рефрактерной глаукомы достигается благодаря применению шунтов-трубочек. Этим обеспечивается пассивный ток камерной влаги.
Среди шунтов из гетерогенных материалов наибольшее распространение получили дренажи из силикона, благородных металлов, тефлона, лейкосапфира
и ванадиевой стали. В настоящее время широкое применение получил гидрогель на основе монолитного нерассасывающегося полиакриламида с содержанием воды 90% [38–40].
Впервые использование шунтов-трубочек было продемонстрировано в 1959 г. Дренаж представлял собой капиллярную трубочку, которая имплантировалась субконъюнктивально. Один из ее концов был обращен в переднюю камеру, другой конец выходил под конъюнктиву. В этом месте формировалась фильтрационная подушка. Недостатком было прекращение функционирования дренажа вследствие облитерации наружного просвета шунта.
С целью профилактики данного осложнения А.С.В. Molteno предложил модифицированную модель дренажа, в котором трубочка была соединена с акриловым диском диаметром 13 мм. Наличие диска обеспечивало стабильную площадь зоны фильтрации. Однако фиксация дренажа в области лимба обусловливала формирование гигантских подушек, наползавших на роговицу. В связи с этим в дальнейшем модель была усовершенствована, и эписклеральный диск фиксировался уже выше места прикрепления прямых глазодвигательных мышц, обеспечивая формирование зоны фильтрации в области экватора глазного яблока.
Сравнительный анализ результатов лечения при имплантации дренажа Molteno и при трабекулэктомии с аппликациями 5-фторурацила не выявил существенной разницы в гипотензивном эффекте, однако послеоперационные осложнения в обоих случаях существенно отличались. Так, например, у пациентов после трабекулэктомии с применением антиметаболического средства достаточно часто встречались цилиохориоидальная отслойка и наружная фильтрация водянистой влаги. Пациентам с имплантированным дренажом Molteno были необходимы дополнительные вмешательства для придания правильного положения сместившейся трубочке. Более серьезным недостатком дренажа Molteno явилась выраженная и длительная гипотония вследствие нерегулируемого оттока ВГЖ. Для профилактики данного осложнения была предложена двухэтапная имплантация дренажа: первоначально имплантируется диск, а через 5–6 нед. после его инкапсуляции — дренажная трубочка в переднюю камеру [41].
Активное развитие дренажной хирургии глаукомы привело к разработке и применению дренажей, снабженных клапаном, который поддерживает однонаправленный ток камерной влаги при достижении определенного уровня ВГД. Первым из таких устройств был клапан Krupin — Denver, который состоял из супрамидной внутрикамерной трубочки, соединявшейся с силиконовой субконъюнктивальной трубкой. Эффект обусловливался наличием мелких прорезей в дистальном конце трубки. Давление открытия было 11,0–14,0 мм рт. ст., закрытие клапана происходило при снижении ВГД на 1,0–3,0 мм рт. ст. Однако часто прорези зарастали фиброзной тканью, что приводило к развитию декомпенсации ВГД в отдаленном послеоперационном периоде.
В 1993 г. M. Ahmed разработал устройство, которое состояло из трубочки, соединяющейся с клапаном, находящимся в полипропиленовом корпусе-резервуаре. Работа дренажного устройства строилась на эффекте Venturi. Открытие происходило на 8 мм рт. ст. [39, 40]. Сравнительные результаты эффективности стандартной синустрабекулэктомии и имплантации клапана Ahmed показали, что снижение уровня ВГД было достигнуто в 83,6 и 88,1% случаев соответственно [33].
В настоящее время клапан Ahmed применяется для лечения врожденной и вторичной (травматической) форм глаукомы. В 57% случаев после имплантации клапана Ahmed отмечается стабилизация уровня ВГД при увеальной глаукоме [43].
По данным клинических наблюдений, нормализация уровня ВГД при оперативных вмешательствах с использованием дренажей варьирует в пределах 20–75%, что выше, чем в случае интраоперационного применения антиметаболитов [14, 44].
Согласно результатам сравнительных клинических исследований, антиглаукомные операции с имплантацией дренажа обеспечивают более существенное снижение уровня ВГД в раннем послеоперационном периоде в отличие от стандартных хирургических вмешательств [13, 45]. Однако в отдаленном периоде не выявлено статистически значимых различий между уровнем ВГД как при использовании дренажей, так и без них [45].
Несмотря на высокую эффективность антиглаукомных операций с использованием дренажных устройств, в раннем послеоперационном периоде возможно развитие ряда осложнений [14]. К ним относятся: гипотония с цилиохориоидальной отслойкой, супрахориоидальное кровоизлияние, гипотоническая макулопатия, кератопатия. Возможны также ограничение подвижности глазного яблока и диплопия. Кроме того, имплантируемые дренажи, являясь инородным телом, могут обусловливать развитие осложнений вследствие плохой биосовместимости имплантата и окружающих его тканей глаза [13, 46–50].
С учетом того, что при рефрактерной глаукоме приживление дренажей затруднено, последующие исследования в данной области должны быть ориентированы на повышение биосовместимости дренажных устройств, уменьшение риска развития фиброза в зоне операции и создание прогнозируемого тока камерной влаги. Усовершенствование дизайна имплантатов и их материалов будет способствовать повышению безопасности антиглаукомных операций с использованием дренажей [14].
Необходимо отметить, что хирургическому лечению рефрактерной глаукомы посвящено большое число научных публикаций, тем не менее их результаты трудно сопоставить между собой вследствие значительных различий хирургических методик, технических характеристик самих устройств, а также произвольно выбираемых авторами критериев оценки эффективности.
Заключение
Несмотря на имеющийся широкий выбор способов оперативного вмешательства при рефрактерной глаукоме, достижение стабильной эффективности при антиглаукомных операциях и сейчас остается актуальной проблемой. Все предложенные методики направлены на профилактику рубцевания созданных путей оттока ВГЖ, однако не решают данную проблему полностью [13].
Таким образом, на современном этапе не существует единого подхода к хирургическому лечению рефрактерных форм глаукомы. Наличие большого числа антиглаукомных операций и их модификаций лишний раз подчеркивает актуальность данной проблемы. Поиск и разработка антиглаукомной операции, обеспечивающей достижение оптимального и стабильного уровня ВГД, являются основными задачами хирургии рефрактерной глаукомы.
Сведения об авторах:
Жигальская Татьяна Александровна — аспирант кафедры офтальмологии, ORCID iD 0000-0003-3110-4112;
Кривошеина Ольга Ивановна — д.м.н., профессор, зав. кафедрой офтальмологии, ORCID iD 0000-0001-7509-5858.
ФГБОУ ВО СибГМУ Минздрава России. 634050, Россия,
г. Томск, Московский тракт, д. 2.
Контактная информация: Жигальская Татьяна Александровна, e-mail: 7atyana@gmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 18.09.2018.
About the authors:
Tatiana A. Zhigalskaya — graduate student of the Department of Ophthalmology, ORCID iD 0000-0003-3110-4112;
Olga I. Krivosheina — MD, PhD, Professor, Head of the Department of Ophthalmology, ORCID iD 0000-0001-7509-5858.
Siberian State Medical University. 2, Moscow tract, Tomsk, 634050, Russian Federation.
Contact information: Tatiana A. Zhigalskaya, e-mail: 7atyana@gmail.com. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 18.09.2018.
Источник