Брахитерапия глаза отслоение сетчатки
Метод лучевой терапии
Лучевую терапию применяют при лечении опухолей любой локализации. При опухолях глаза используют контактное облучение, называемое брахитерапией, а также наружное и внутритканевое облучение, называемые дистанционной рентгенотерапией и облучение узким электронным или протонным пучком соответственно. Наиболее распространены в офтальмологии наружное облучение и брахитерапия.
Брахитерапия внутриглазных опухолей
Долгое время использование наружного облучения внутриглазных опухолей было ограничено из-за опасения лучевого поражения ткани глаза. Локальное разрушение меланомы хориоидеи при помощи контактного облучения впервые было применено в 1930 г. Впоследствии было предложено использовать пластины радиоактивного кобальта, изогнутые в соответствии с наружной кривизной глаза. Некоторые исследователи использовали для разрушения внутриглазных меланом радиоактивный йод. Такая методика не была безупречной, так как после облучения возникали серьезные осложнения, что подвигло медиков на создание новых мощных, но более щадящих стронциевых и рутениевых глазных аппликаторов.
Особенности поглощения живыми тканями бета-излучения позволяют создать внутри патологически измененной ткани губительную для нее дозу облучения, которая практически не влияет на ткани здоровые. При помощи глазных аппликаторов (офтальмоаппликаторов) возможно создать поля, обеспечивающие достаточный эффект облучения опухолей сетчатки и хориоидеи, расположенных на любом участке глазного дна. Кроме того, облучение возможно и в непрозрачной среде, и даже при любом размере отслоившейся части сетчатки.
Так, при помощи стронциевых аппликаторов можно облучить новообразование толщиной до 4 мм, а при помощи рутениевых — до 6 мм. Тип аппликатора зависит от максимальных размеров опухоли. Так, существуют крупные аппликаторы до 22 мм, имеющие рабочую поверхность до 19 мм.
При лечении внутриглазных опухолей брахитерапию можно использовать и как самостоятельный метод, и в комбинации с фотодинамической терапией и лазеркоагуляцией. Поэтому очень важно при лучевой терапии использовать индивидуальный подход к каждому пациенту с внутриглазной опухолью. Нужно не только знать толщину и диаметр новообразования, но и точечную локализацию опухоли, размеры глаза, учитывать состояние склеры, лежащей непосредственно над опухолью, иметь в наличии аппликатор нужного размера, а также обеспечить визуальное наблюдение за его положением во время воздействия.
Мировая офтальмология накопила богатый опытиспользования брахитерапии при меланомах, что сделало данную процедуру альтернативой энуклеации. Однако использование аппликаторов сильно ограничено толщиной опухоли, и для того, чтобы повысить эффективность лечения, офтальмологи стали повышать дозы облучения, применяя более мощные источники. Но это привело к увеличению числа случаев лучевых осложнений.
Тем не менее, в последние годы возможности брахитерапии расширились эа счет интракорпорального облучения новообразований радионуклидами. Так, прием активированных таблеток при меланоме хориоидеи приводит к распространению радионуклида с кровотоком. При этом происходит его избирательное накопление в тканях опухоли. Кроме того, медики надеются, что длительный прием таких таблеток поможет им бороться с возможными метастазами меланомы.
Все большее значение приобретает брахитерапия и при ретинобластоме: в составе комбинированной терапии она позволяет сохранить пораженный орган зрения.
Залогом успешного лечения внутриглазных опухолей методом брахитерапии является правильный выбор дозы облучения. При ее расчете следует точно определить тип аппликатора, и только после этого планировать лечебные мероприятия. Так, суммарная доза облучения для меланомы хориоидеи обычно составляет 200-270 Гр при условии использования стронциевого аппликатора и 120-160 Гр при использовании рутениевого аппликатора.
При лечении ретинобластомы с учетом площади поражения тканей, толщины опухоли и возраста больного очаговая доза в центре опухоли должна колебаться от 40 до 80 Гр. Нужно помнить, что брахитерапия ретинобластомы дает хорошие результаты только в комплексе с химиотерапией, проводимой по нескольким протоколам.
Многолетние наблюдения за пациентами, которым была проведена брахитерапия по индивидуальному плану, свидетельствуют о максимальном терапевтическом эффекте при минимальных осложнениях. Однако оценивать результаты лечения задача не из легких, так как единого критерия подобной оценки просто не существует. Чтобы решить подобный вопрос, необходимы многолетние клинические испытания и наблюдения. Обычно их продолжительность составляет в среднем 7-8 лет.
Эффективность брахитерапии возможно оценить только спустя 6-8 месяцев после лечения. Именно в это время появляются явные признаки уменьшения опухоли, а вокруг нее формируется хориоретинальный рубец.
Тем не менее, время оценки эффективности лечения сильно зависят от первоначальной толщины опухоли, ее диаметра и размера. Мелкие опухоли диаметром 10 мм и толщиной до 1,5 мм регрессируют через 6 месяцев после приведения брахитерапии. Регресс крупных опухолей требует большего времени — от 12 до 18 месяцев. Результаты считаются положительными, если опухоль уменьшилась примерно на 50% от первоначального объема, и в течение 9-12 месяцев со дня лечения наблюдается стабильная клиническая картина.
Отграниченные гемангиомы хориоидеи (гамартомы) долгое время приводили к полной потере зрения в связи с осложнениями — вторичной глаукомой и полной отслойкой сетчатки. В результате врачи проводили энуклеацию глазного яблока. В наши дни благодаря брахитерапии стал возможным регресс гемангиомы в результате ее облучения при помощи аппликаторов. Что касается метастазов, то наиболее эффективной процедурой считается наружное облучение всего глаза.
Источник
Увеальная меланома (УМ) – наиболее частая внутриглазная злокачественная опухоль у взрослых.
На ее долю приходится 12–15% меланом всех локализаций и 90% всех внутриглазных новообразований. Заболеваемость УМ в России составляет 5–8 случаев, а в Москве достигает 13,3 случая на один миллион случаев в год. Пик заболеваемости приходится на возрастные группы 50–60 лет. Золотым стандартом органосохранного лечения УМ является брахитерапия.
Показана эффективность медицинской технологии. Полная резорбция УМ достигнута у 67,8% больных, частичное уменьшение размеров опухоли (на 50% и больше) и стабилизация процесса – у 24% пациентов. Рецидив опухоли и продолженный рост выявлены в 6% случаев. Частота отдаленного метастазирования составила 5,3%. Сроки наблюдения – от трех месяцев до 16 лет, медиана – 71,1 месяца. Полная резорбция ретинобластомы отмечена в 85% случаев при сроках наблюдения от девяти месяцев до шести с половиной лет. Локальный контроль при внутриглазной гемангиоме составил 95%.
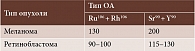
Оптимальные дозы на верхушке опухоли (Гр) в зависимости от типа используемого офтальмоаппликатора
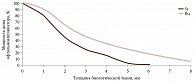
Падение мощности дозы офтальмоаппликатора в зависимости от толщины биологической ткани
Введение
Увеальная меланома (УМ) является наиболее частой внутриглазной злокачественной опухолью у взрослых. Она составляет 12–15% меланом всех локализаций и 90% всех внутриглазных новообразований. Заболеваемость УМ в России составляет 5–8 случаев, в Москве достигает 13,3 случая на один миллион случаев в год. Пик заболеваемости приходится на возрастные группы 50–60 лет. В абсолютном большинстве случаев опухоль поражает один глаз и растет в виде единичного узла. У пациентов, не получающих лечения, опухоль приводит к летальному исходу. На протяжении многих лет основным способом лечения УМ была энуклеация. Однако она не считается радикальной операцией. Пятилетняя выживаемость больных после удаления пораженного глаза составляет 50–70%. В настоящее время золотым стандартом органосохранного лечения УМ признано контактное облучение опухоли (брахитерапия).
Единственная злокачественная опухоль сетчатки – ретинобластома встречается в детском возрасте в одном случае на 12 000–15 000 новорожденных. На выбор тактики лечения влияют размер, локализация, характер роста и распространенность процесса. При опухолях групп А, В и C (согласно Международной классификации ретинобластомы ICRB) в схеме комбинированного лечения предусмотрена брахитерапия.
Гемангиомы сетчатки и хориоидеи – редкие врожденные доброкачественные новообразования, относящиеся к классу гамартом. Встречаются изолированные узловые и диффузные формы гемангиом. У больных, не получающих лечения, опухоль может приводить к развитию тотальной отслойки сетчатки, вторичной глаукомы. Брахитерапия с успехом применяется для лечения отграниченных гемангиом, особенно при периферической локализации новообразования.
Основными преимуществами брахитерапии являются сохранение глаза и зрительных функций у половины леченых больных, лучший прогноз для жизни. Так, пятилетняя выживаемость после брахитерапии УМ при сопоставимых стадиях заболевания составляет 90–95% [1–3].
Выбор типа офтальмоаппликатора (ОА) определяется толщиной новообразования и проникающей способностью бета-излучения, которая зависит от энергии распада радионуклида. ОА с изотопом Sr90 + Y90 применяют в случаях, когда толщина опухоли не превышает 3,5 мм. При большей толщине применяют ОА с изотопом Ru106 + Rh106. Главным условием успешного радикального лечения является набор необходимой дозы излучения на верхушке опухоли, то есть в точке, максимально удаленной от поверхности ОА. Оптимальные верхушечные дозы излучения при облучении ретинобластомы и УМ представлены в таблице. Целью облучения внутриглазной гемангиомы является облитерация патологических сосудов новообразования, большинство которых расположено у основания опухоли. Поэтому рассчитывается поверхностная доза излучения, то есть доза на склере глаза, которая должна составлять 600–700 Гр.
Эффективность лечения внутриглазных опухолей оценивается по следующим критериям: полная резорбция опухоли, частичная резорбция опухоли – уменьшение исходных размеров на 50% и более, отсутствие эффекта.
Показания и противопоказания
Показания:
- УМ, ретинобластома с проминенцией до 6 мм и диаметром до 15 мм;
- отграниченная гемангиома с проминенцией до 6 мм и диаметром до 15 мм.
Противопоказания к использованию медицинской технологии:
абсолютные:
- мультицентрический рост опухоли (при УМ);
- наличие отдаленных метастазов;
- врастание опухоли в диск зрительного нерва или прорастание за пределы склеры;
относительные:
- заболевания крови (лейкопения, агранулоцитоз, пойкилоцитоз, анемия различного генеза, гемофилия и др.);
- острые воспалительные заболевания глаза и его придаточного аппарата;
- гемофтальм, отслойка сетчатки, глаукома;
- тяжелая сопутствующая соматическая патология;
- беременность.
Материально-техническое обеспечение
- Стандартное оснащение офтальмологического кабинета.
- Стандартное оборудование офтальмологической операционной.
- Офтальмоаппликаторы с бета-активными радионуклидами по ТУ 9444–001–08624390–2006. Регистрационный номер медицинского изделия РЗН 2014/1750, изготовитель ФГУП «Государственный научный центр Российской Федерации „Физико-энергетический институт им. А.И. Лейпунского“».
Описание медицинской технологии
Дозиметрические характеристики офтальмоаппликаторов. Основной дозиметрической характеристикой ОА является дозное поле, создаваемое им в патологическом очаге и прилежащих отделах глаза. Конфигурация дозного поля любого бета-источника зависит от конструкции излучателя, формы и размеров его активной зоны, вида радионуклида и характера его распределения по объему (или поверхности) активной части.
По результатам экспериментальных и расчетных методик были получены дозные поля офтальмоаппликаторов и градиент падения поверхностной дозы в биологической ткани. Значения глубинных мощностей доз приведены в относительных единицах, причем за 100% принята величина дозы на поверхности ОА (рисунок). Все дозиметрические характеристики, необходимые для расчета, представлены в индивидуальном паспорте на каждый ОА.
Активный диаметр офтальмоаппликатора должен превышать границы опухоли на 1,5–2 мм со всех сторон. При локализации новообразования рядом с диском зрительного нерва используются офтальмоаппликаторы с вырезом для зрительного нерва.
Расчет поглощенной дозы. Распределение дозы на поверхности ОА относительно равномерное (±10%). Резкий спад дозы наблюдается по глубине, поэтому новообразование облучается неравномерно: участки, расположенные ближе к источнику, облучаются значительно интенсивнее, чем участки, отдаленные от излучающей поверхности аппликатора. Дозу следует рассчитывать таким образом, чтобы рекомендованная доза поглощалась на верхушке опухоли – в наиболее удаленной от ОА точке. При планировании брахитерапии внутриглазной опухоли выбирают тип ОА: Р (с изотопом Ru106 + Rh106) или С (с изотопом Sr90 + Y90), что определяется ее максимальной толщиной. При толщине новообразования до 3,5 мм выбирают ОА типа С, при толщине 3,5 мм – тип Р. Оптимальная верхушечная доза представлена в таблице.
Для облучения внутриглазной гемангиомы предпочтение следует отдавать офтальмоаппликаторам с изотопом Sr90 + Y90 , поскольку они создают максимальную поверхностную дозу излучения.
Методика операции
Фиксацию ОА к глазу выполняют в операционной. Подготовку к операции проводят по общепринятым правилам, необходим максимальный мидриаз. Под общим наркозом выполняют разрез конъюнктивы в квадранте локализации опухоли в 6 мм от лимба, слизистую оболочку отсепаровывают кзади. На две соседние прямые мышцы накладывают лигатуры. Для проведения транспупиллярной диафаноскопии обычно достаточно тракции за лигатуры или отведения брюшка мышцы, но при необходимости возможно временное пересечение прямой мышцы. С помощью транспупиллярной диафаноскопии маркируют тень границы опухоли. Для более четкого обзора центрального края опухоли при ее локализации в постэкваториальной зоне полезной может оказаться наружная кантотомия. Заранее выбранный ОА фиксируют к склере двумя швами, проведенными через его кольца. Необходимо следить, чтобы край ОА перекрывал намеченные границы опухоли на 1,5–2 мм. При необходимости аппликатор можно подвести под любую прямую мышцу глаза. После фиксации ОА к склере на конъюнктиву накладывают непрерывный шов. Время контакта ОА со склерой зависит от толщины опухоли и мощности аппликатора. После операции на сутки накладывают бинокулярную повязку, что значительно ограничивает движения глаза и снижает вероятность смещения ОА. Через сутки проводят ультразвуковой контроль положения ОА по отношению к облучаемой мишени. При необходимости осуществляют соответствующую коррекцию экспозиции облучения с целью достижения расчетной дозы на верхушке опухоли. Удаляют ОА под местной анестезией в операционной по истечении времени экспозиции.
На вторые-третьи сутки после начала облучения на глазном дне в области расположения ОА появляется отек сетчатки и ткани опухоли, который, постепенно нарастая, стушевывает рисунок глазного дна. Наряду с увеличением отека тканей могут появиться гемодинамические расстройства: локальные и дистантные кровоизлияния (на 5–7-й день), фрагментация ретинальных сосудов в зоне облучения (на второй-третьей неделе). Больного выписывают из стационара на 2–4-й день после удаления ОА. Острая лучевая реакция стихает через 4–8 недель, и наступает процесс резорбции опухоли, который длится от восьми до 24 месяцев.
Контрольные осмотры больных после брахитерапии проводят каждые 3–6 месяцев.
Возможные осложнения и способы их устранения
Парез прямой мышцы глаза возможен в случае, если ОА располагался под ней. После удаления ОА отмечают ограничение движения глаза в сторону действия такой мышцы. Субъективно это выражается в диплопии. Симптомы пареза прямой мышцы наблюдаются в течение двух-трех недель, затем они полностью проходят без специального лечения.
Повышение внутриглазного давления может иметь место при использовании ОА большого диаметра (22 мм). Реактивная гипертензия (до 35 мм рт. ст.) возникает на второй-третий день облучения и связана с гиперсекрецией водянистой влаги. После удаления ОА внутриглазное давление быстро нормализуется. Назначают Азопт, Диакарб, Лазикс.
Иридоциклит развивается крайне редко, когда глаз облучался большими дозами и передний край ОА располагался над цилиарным телом. Лучевой иридоциклит протекает с гипертензией, выраженным болевым синдромом и требует интенсивного лечения (мидриатики, глюкокортикостероиды, гипотензивные препараты, неспецифические противовоспалительные препараты, ингибиторы карбоангидразы, диуретики).
Кровоизлияния в сетчатку и ткань опухоли можно считать скорее проявлением лучевой реакции, чем осложнением. Рассасываются эти кровоизлияния на фоне медикаментозного лечения (Вобэнзим, Аскорутин, Дицинон) длительно и на исход лечения не влияют.
Эффективность медицинской технологии
Брахитерапия как самостоятельный метод лечения УМ использована более чем у 1600 больных в возрасте от 18 до 82 лет, 65% из которых составили женщины. Сроки наблюдения – от трех месяцев до 16 лет, медиана – 71,1 месяца. Полная резорбция УМ достигнута у 67,8% больных, частичное уменьшение размеров опухоли (на 50% и больше) и стабилизация процесса – у 24% пациентов. Рецидив опухоли и продолженный рост зафиксированы в 6% случаев. Лечение оказалось неэффективным у 35 (2,2%) больных. Частота отдаленного метастазирования составила 5,3% (в сроки от шести месяцев до девяти с половиной лет).
С 2008 по 2013 г. в комплексном лечении ретинобластомы брахитерапия была использована у 137 детей. Срок наблюдения составил от девяти месяцев до шести с половиной лет. Полная резорбция опухоли зарегистрирована в 85% случаев.
У 167 пациентов для лечения внутриглазных гемангиом использовали брахитерапию. Срок наблюдения составил от трех месяцев до девяти лет. Полная облитерация новообразования зафиксирована в 69% случаев, формирование рубца вокруг новообразования – у 26% больных. Таким образом, эффективность локального контроля составила 95%.
Источник


