В россии искусственную сетчатку
Впервые в России врачи смогли частично вернуть зрение слепому пациенту. Более двух десятилетий житель Челябинска находился в полной темноте. После того, как ему пересадили бионическую сетчатку глаза, он начал реагировать на свет и распознавать очертания предметов. Специалисты говорят, что после курса реабилитации мужчина сможет воспринимать окружающий мир почти так же, как и до болезни.
Первые робкие шаги Григория Александровича без трости для слепых. 25 лет он передвигался только с ее помощью. Из-за генетического заболевания мужчина почти совсем потерял зрение, но никогда не терял надежду.
«Я подал заявку — выбрали меня», — говорит Григорий Ульянов.
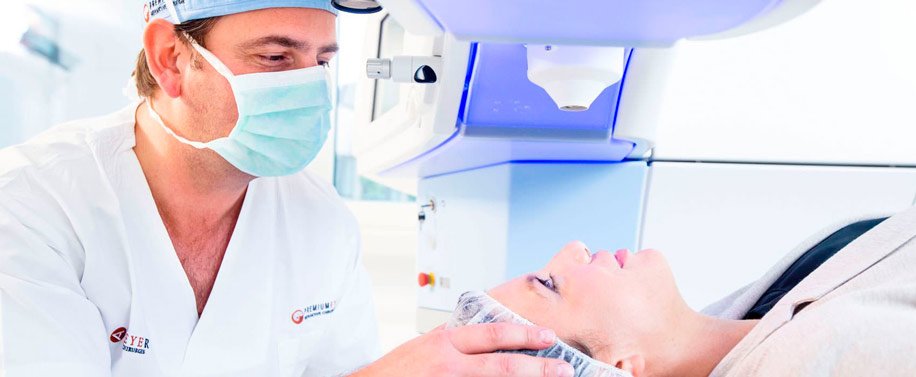
Он стал первым и пока единственным пациентом в России, которому удалось вернуть зрение при помощи электронной системы. Ее называют бионический глаз, хотя, конечно, глаз у пациента остался своим. Система состоит из вживленного датчика, выполняющего роль сетчатки, специальных очков и компьютера. Вмонтированная в очках камера получает изображение, оттуда сигнал идет в портативный компьютер, где переводится в электрические импульсы и отправляется на искусственную сетчатку.
«Ток по микрокабелю входит внутрь глаза, куда имплантирован электронный чип, который находится на поверхности сетчатки. Через этот чип происходит раздражение нервных окончаний зрительного нерва», — рассказывает директор Научно-исследовательского центра офтальмологии ФГБОУ ВО РНИМУ им. Н.И.Пирогова Христо Тахчиди.
Операция по имплантации сетчатки длилась более шести часов. Хирурги работали очень аккуратно, использовали даже специальные инструменты, чтобы не повредить миниатюрный имплантат.
«Через разрез в 5 мм этот имплант вводится в полость глаза. Обратите внимание, все пинцеты с силиконовыми наконечниками специальными, потому что, если вы сожмете кабель, то перекусите волокна», — рассказывает директор Научно-исследовательского центра офтальмологии ФГБОУ ВО РНИМУ им. Н.И.Пирогова Христо Тахчиди.
Сегодня — три недели после операции, Григорий Александрович уже различает предметы, но признается, что не может забыть момент, когда к нему вернулось зрение.
Григорий Александрович пока может только различать очертания предметов. Он видит все в черно-белом свете, а силуэты размыты, как на фотографии с низким качеством изображения. Но это уже не слепота. Со временем контуры предметов станут четкими, и пациент без труда будет ориентироваться в пространстве.
За 25 лет мозг пациента просто забыл, как видеть изображения. Но нервные связи постепенно восстанавливаются. Григорий Александрович быстро осваивает новый аппарат и как ребенок радуется своим пока еще маленьким успехам.
«Мы сегодня как раз говорили о лучших результатах, которых удалось добиться уже человечеству. Скажем, один из пациентов, который исходно был мастером спорта по стрельбе из лука, с пятиметрового расстояния попадает в десятку после того, как был совершенно слепым. Это результат прекрасный», — отметила министр здравоохранения РФ Вероника Скворцова.
В мире всего 30 пациентов с подобной электронной сетчаткой. Но опыт российских специалистов — один из самых успешных, восстановление происходит очень быстро. Не последнюю роль здесь играет настрой самого пациента. Григорий Александрович очень старается, потому что хочет опять пройтись по улицам любимого города, который долгое время был погружен для него в темноту.
Источник
В Федеральном научно-клиническом центре физико-химической медицины (ФНКЦ ФХМ) —подразделении Федерального медико-биологического агентства — научились выращивать сетчатку глаза из перепрограммированных клеток. Разработка позволит спасти от слепоты пациентов, теряющих зрение, например, из-за макуладистрофии. Первую трансплантацию в рамках клинических испытаний медики надеются провести уже в 2017 году. Необходимо лишь чтобы сделать это позволило законодательство.
«Перепрограммирование клеток — достаточно новое явление в науке, — рассказал Вадим Говорун, генеральный директор ФНКЦ ФХМ . — Открытие принадлежит профессору Университета Киото Синъе Яманаке».
Японский учёный обнаружил уникальную способность клеток человека той или иной ткани возвращаться в эмбриональное состояние при «выключении» определённых генов. Из таких недифференцированных (не определившихся со своими «обязанностями») стволовых клеток можно вырастить практически любую ткань. Например, из фибробластов (клеток соединительной ткани) кожи можно вырастить сетчатку глаза.
Такое преобразование позволит спасать от слепоты пациентов, теряющих зрение, например, из-за макулодистрофии — заболевания, являющегося одной из самых частых причин слепоты у людей старше 55 лет (и встречающееся у каждого второго жителя России старше 60 лет).
Исследователи Лаборатории клеточной биологии пояснили корреспондентам, что для перепрограммирования удобнее всего использовать именно кожу, потому что забор такой ткани практически не травмирует пациента. При этом клетки кожного покрова хорошо размножаются.
«Для каждого типа клеток есть специализированные стволовые клетки, то есть для восстановления клеток крови подходят только стволовые клетки крови, — рассказал Сергей Киселёв, заведующий Лабораторией биомедицинских технологий ФНКЦ ФХМ. — Универсальностью обладают лишь плюрипотентные стволовые клетки. Их можно получить или из эмбрионов, или из клеток кожи с помощью метода репрограммирования. Эти клетки пригодны для выращивания любого типа ткани».
Понятно, что из эмбриональных клеток (забираются из нежизнеспособных эмбрионов) получается только неродственный пациенту трансплантат. А это значит, что он может быть отторгнут организмом (либо человеку придётся всю оставшуюся жизнь принимать иммуносупрессивные препараты). Однако в организме человека есть ткани, на которые иммунная система «не обращает внимания». К ним относятся головной мозг и глаза. Для таких органов родственность тканей при трансплантации не очень важна. Хотя предполагается, что трансплантаты из родственных или перепрограммированных клеток будут приживаться лучше.
В США и Европе (в частности, в Великобритании) сейчас проходят клинические испытания по пересадке сетчатки глаза (операция впервые была проведена в 2014 году). В Японии они также велись, затем были временно приостановлены из-за изменений в законодательстве, но в 2017 году будут продолжены.
Применение перепрограммированных, то есть универсальных клеток, пригодных для большого количества реципиентов, упростит технологию и уменьшит стоимость операции, а значит, сделает её более массовой.
В ФНКЦ ФХМ такие технологии уже опробованы на кроликах. Однако клинические испытания пока невозможны: российские учёные ждут вступления в силу закона «О биомедицинских клеточных продуктах» (произойдёт 1 января 2017 года) и принятия по нему нормативных актов (срок пока неизвестен, потому что они не разработаны).
Как отмечают авторы материала в издании «Известия», в центре уже знают, кто станет первыми добровольцами для пересадки «искусственной» сетчатки глаза. Несколько лет назад к учёным обратилась за помощью семья с наследственной макулодистрофией. В отличие от возрастной макулодистрофии наследственная форма — это орфанное заболевание, то есть встречается крайне редко. Она обусловлена «поломкой» в генах. И если возрастная форма слепоты поддаётся некоторое время разным видам терапии, то лекарства от генетической макулодистрофи нет вообще. Между тем такие пациенты начинают слепнуть в 20–30 лет.
В семье, обратившейся в ФНКЦ ФХМ, носителями мутации являются дед по отцовской линии, отец и дети.
«Для детей этой семьи мы подготовили клетки сетчатки с отредактированным геномом, — рассказал Киселев. — Но, скорее всего, на первом этапе мы начнём испытания с неродственных клеток, потому что на это проще будет получить разрешение».
Центр физико-химической медицины планирует найти медицинских партнёров, с которыми уже в 2017 году сможет осуществить пациентам трансплантацию выращенной в лаборатории сетчатки.
Добавим, что эксперты ФНКЦ ФХМ похожим способом вырастили нейроны головного мозга и испытали их приживаемость на животных моделях. Трансплантация «исправленных» клеток вместе с процедурой редактирования генома поможет в лечении пациентов с болезнью Паркинсона. В мире такие клинические испытания также уже ведутся. В России они будут возможны при наличии интереса со стороны профильных учреждений — нейрохирургических и неврологических институтов — и тоже только после принятия закона.
Источник
В МФТИ на основе машинного обучения создают систему, которая будет сама отбирать и выращивать ткани для трансплантации сетчатки глаза. В ее основе самое простое применение искусственного интеллекта, имеющееся даже в смартфонах, — распознавание изображений. Нейросети определят, какие культуры стволовых клеток развиваются правильно и могут быть пригодны для операции. Такой подход поможет оптимизировать и существенно удешевить создание искусственных сетчаток в будущем. Пока целиком вырастить и пересадить пациенту искусственный орган не смогли нигде в мире — это очень долго и дорого.
Клеточный отбор
Сетчатка глаза выполняет простейшие математические операции со световыми сигналами. Результаты этой первичной обработки изображения отправляются в мозг. Нарушение регуляции выведения из глазного яблока излишней жидкости приводит к ее накоплению и повышению внутриглазного давления. Следствием становится глаукома — поражение сетчатки, в частности, потеря специальных клеток (ганглионаров). Создание искусственной сетчатки позволит заменить поврежденные участки. Другими методами вылечить эту патологию на сегодняшний момент невозможно. Поэтому во всем мире технологиям создания пригодного для пересадки в человеческий глаз материала уделяют огромное внимание.
Биоинформатики лаборатории геномной инженерии МФТИ совместно с партнерами из Гарварда разработали алгоритм и систему принятия решения о пригодности выращенной сетчатки и возможности ее трансплантации. Ученые также создают технологию получения искусственной сетчатки глаза из индуцированных стволовых плюрипатентных клеток (ИПСК). Их можно использовать как строительный материал для различных тканей человека.
В МФТИ вырастили десятки тысяч искусственных сетчаток и поэтапно изучили их развитие. Чтобы правильно обучить нейросеть, ученые накопили огромный массив данных о том, какие образцы развивались правильно, а какие нет.
— С помощью компьютерного зрения система сравнивает потенциальные сетчатки с предложенной качественной выборкой. Для этого мы используем генетически модифицированные ИПСК с флуоресцентным белком — определенным геном, который вводится в клеточную линию и активизируется, только когда сетчатка развивается правильно, — пояснил механизм работы системы руководитель лаборатории геномной инженерии МФТИ Павел Волчков. — Клетки светятся зеленым или красным цветом, когда превращаются в подходящие для выращивания сетчатки культуры, а мы фиксируем это излучение с помощью сканирующего микроскопа. Машина реагирует на подсвеченные образцы и делает снимки морфологической структуры в нескольких срезах.
На следующем этапе искусственный интеллект оценивает сетчатки уже без излучающего свет белка. Это важно, потому что пересадить человеку трансплантат с мутацией в генах нельзя. Поэтому искусственный интеллект обучили также анализировать обычные черно-белые изображения структуры будущих сетчаток, выращенных без генных изменений.
На пути к полной пересадке
Как пояснил Павел Волчков, создать из ИПСК структуру, подобную сетчатке глаза, впервые смогли в Японии. На настоящий момент Британия и США также переходят в фазу клинических испытаний такого трансплантата. Больным с серьезными нарушениями зрения пересаживают выращенные в лаборатории образцы, но это пока не сетчатка целиком, а ее фрагмент в виде заплатки. Российская разработка станет важным шагом на пути к пересадке более значительной части сетчатки, чего пока не делают нигде в мире.
Профессор Петр Баранов из Гарварда, с которым сотрудничает лаборатория геномной инженерии МФТИ, занимается еще одной важной задачей на пути к созданию искусственной части глаза. Он выращивает компонент сетчатки, участвующий в передаче сигнала в визуальный центр мозга. Его будут использовать для восстановления оптического нерва, например, при глаукоме. Это важнейшая работа, так как при нарушении функционирования нерва пересадка искусственной сетчатки не поможет человеку, потерявшему зрение.
Лекарственная терапия, в частности нейропротекторы, которые применяют в настоящее время при повреждениях сетчатки, способны лишь замедлить дегенеративные процессы. Однако они не могут полностью излечить и восстановить зрение, потерянное в результате таких заболеваний, как возрастная макулодистрофия, глаукома или диабетическая ретинопатия, сообщила «Известиям» ведущий научный сотрудник Инжинирингового центра микротехнологии и диагностики СПбГЭТУ «ЛЭТИ» Татьяна Зимина.
— Поэтому исследования в области применения стволовых клеток для замещения клеток сетчатки обещают появление первых эффективных средств для применения в клинической практике, — отметила она.
Директор НИЦ офтальмологии РНИМУ им. Н.И. Пирогова Христо Тахчиди уверен, что разработка российский ученых — важный шаг на пути к пока еще далекому будущему медицины.
— Эта важная и интересная работа, которая приближает нас к созданию искусственной сетчатки. Однако нужно понимать, что после отбора клеточных конструктов нужно их пересадить. Затем проследить, как организм человека реагирует на трансплантат, изучить возможные эффекты. А это вопрос будущего офтальмологии, — сказал эксперт.
В дальнейшем исследователи планируют объединить алгоритм по отбору качественных основ для будущих сетчаток с роботизированным решением, которое позволит оптимизировать и удешевить процесс их выращивания. Отбор и производство можно будет поставить на поток. Сейчас выращивание сетчатки — долгий и трудоемкий процесс, который занимает от 30 до 50 недель. Также он очень затратный: образцы делают в большом количестве — тысячами, чтобы из них отобрать всего несколько лучших. Затем уже из них ученые смогут отыскать один единственный пригодный для пересадки экземпляр.
Новая технология отбора клеточных линий позволит сократить стоимость траснплантата на порядок, а время изготовления — примерно вдвое. Сейчас этот процесс стоит около $100 тыс. и занимает до 50 недель. Однако, как отмечают ученые, речь пока идет только о лабораторных исследованиях.
Источник