Сухой глаз и глаукома
Может ли проактивное выявление ССГ влиять на прогрессирование глаукомы?

Голубев Сергей Юрьевич
К.м.н., врач-офтальмолог, филиал Военно-медицинской академии им С.М. Кирова, представитель TFOS* в России.

Бржеский Владимир Всеволодович
Д. м. н., завведующий кафедрой офтальмологии ФГБОУ ВО СПбГПМУ Минздрава Росии
*TFOS: Tear Film & Ocular Surface Society — Международное общество исследователей слезной пленки
Глаукома – группа заболеваний со схожими признаками, включающими поражение головки зрительного нерва и сужение поля зрения.
Причиной глаукомы чаще всего является повышенное внутриглазное давление. Исход глаукомы в отсутствие лечения – прогрессирующее сужение поля зрения и слепота.
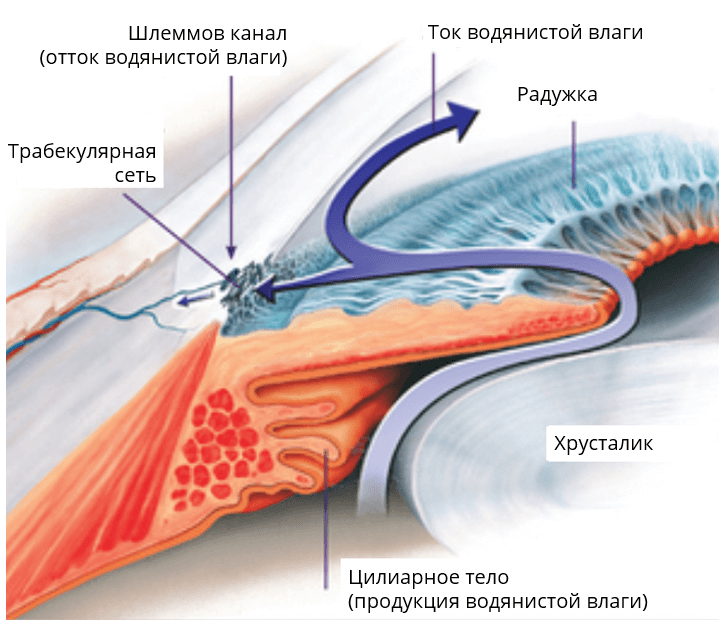
Лечение глаукомы основано на снижении внутриглазного давления для профилактики или задержки необратимых изменений зрительного нерва. Для этого в арсенале современного специалиста имеется несколько вариантов – медикаментозная терапия, лазерное или хирургическое вмешательство.
Методом первого выбора является использование местных антиглаукомных препаратов. На амбулаторном приеме задача специалиста в ведении этой группы пациентов – отслеживать эффективность назначенной терапии, соблюдение пациентом рекомендаций и динамику зрительных функций1.
Как проактивный подход к оценке состояния глазной поверхности может помочь улучшить качество жизни и способствовать сохранению зрительных функций пациентов с глаукомой?
Распространенность ССГ среди пациентов с глаукомой
И глаукома, и синдром сухого глаза (ССГ) – заболевания, чаще встречающиеся у «возрастных» пациентов. Однако если в исследованиях среди пациентов старше 50 лет частота ССГ варьирует от 3,9 до 34% , то по результатам многоцентрового эпидемиологического исследования, включившего более 20000 пациентов с глаукомой синдром сухого глаза был выявлен у 52.6%2,3.
В чем причина ССГ у пациентов с глаукомой?
Лечение глаукомы – постоянное использование антиглаукомных капель с кратностью закапывания от одного до нескольких раз в сутки, иногда – комбинации нескольких препаратов, на протяжении многих лет.
При этом и действующее вещество, и сопутствующие компоненты могут негативно влиять на слезную пленку и глазную поверхность4. В списке препаратов, способных индуцировать или ухудшать симптоматику ССГ, практически все группы антиглаукомных капель. При этом компонентом, наиболее тесно связанным с развитием ССГ, исследования называют консервант5.
В статье Hollo et al ССГ, сопутствующий глаукоме, определяется следующим образом:
дисбаланс гомеостаза глазной поверхности, вызванный токсическим эффектом длительного применения местных препаратов, что ведет к нарушению стабильности слезной пленки, повреждению эпителия и воспалению глазной поверхности4
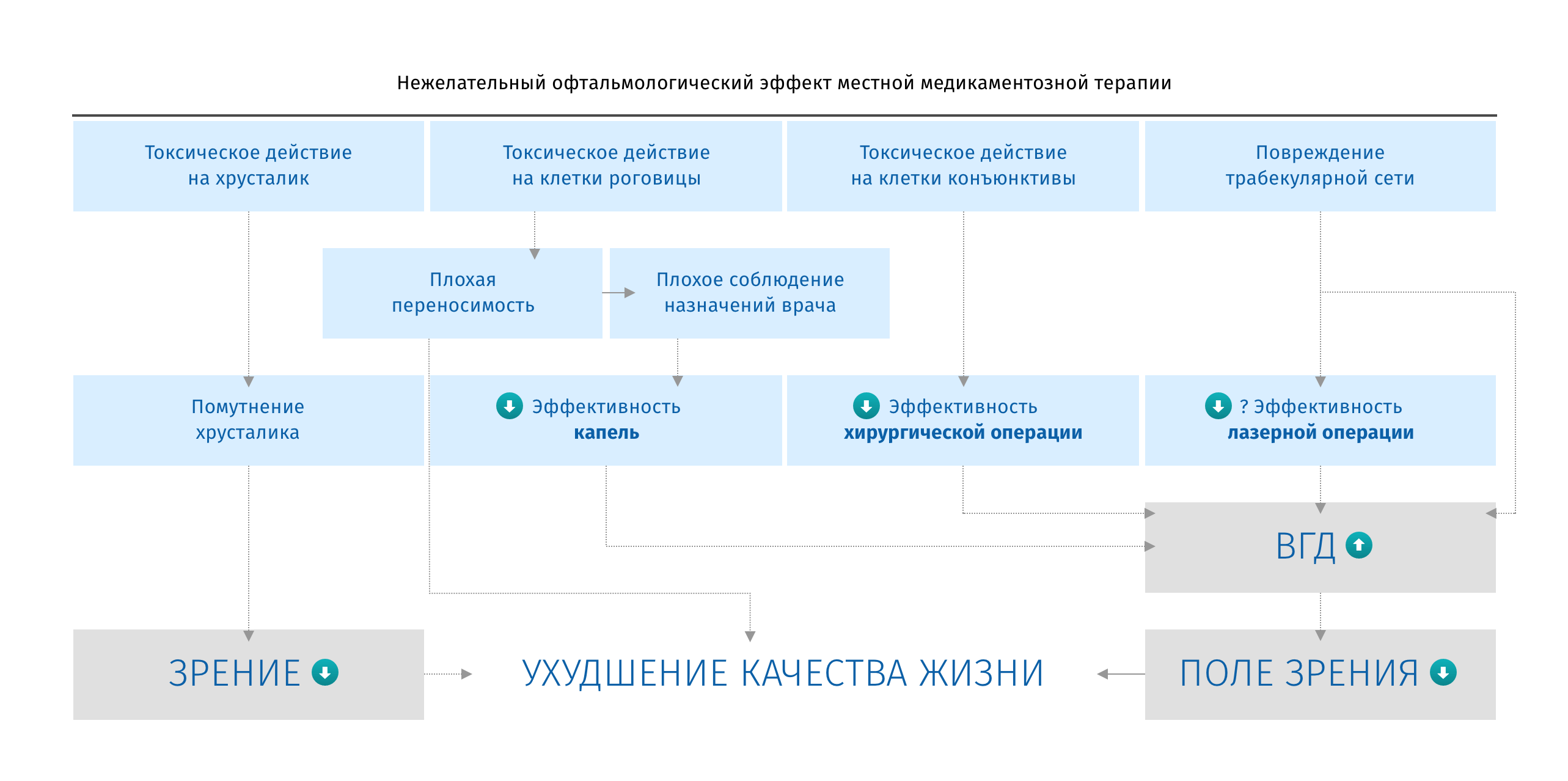
Нежелательные офтальмологические эффекты местной медикаментозной терапии глаукомы. Источник: Preservative-free Treatment in Glaucoma Is a Sensible and Realistic Aim for the Future. Marina Hopes, David Broadway. European Ophthalmic Review, 2010
Консерванты в глазных каплях: осторожно, БАХ!
Наличие консерванта в глазных каплях предотвращает микробную контаминацию содержимого флакона. Чаще всего в офтальмологических препаратах используется Бензалкония Хлорид (БАХ), который обладает высокой активностью в отношении большинства патогенных микроорганизмов в достаточно низкой концентрации, однако способен оказывать токсическое воздействие на клетки поверхности глаза, особенно при частом и длительном применении6.
Механизм негативного воздействия БАХ на ткани поверхности глаза связывают в непосредственным токсическим воздействием на клетки эпителия, а также с его детергентными свойствами,способствующими разрушению липидного слоя слезной пленки6.
Кроме того, ряд исследований связывает БАХ с токсическим действием на клетки трабекулярной сети и эпителия хрусталика7,8.
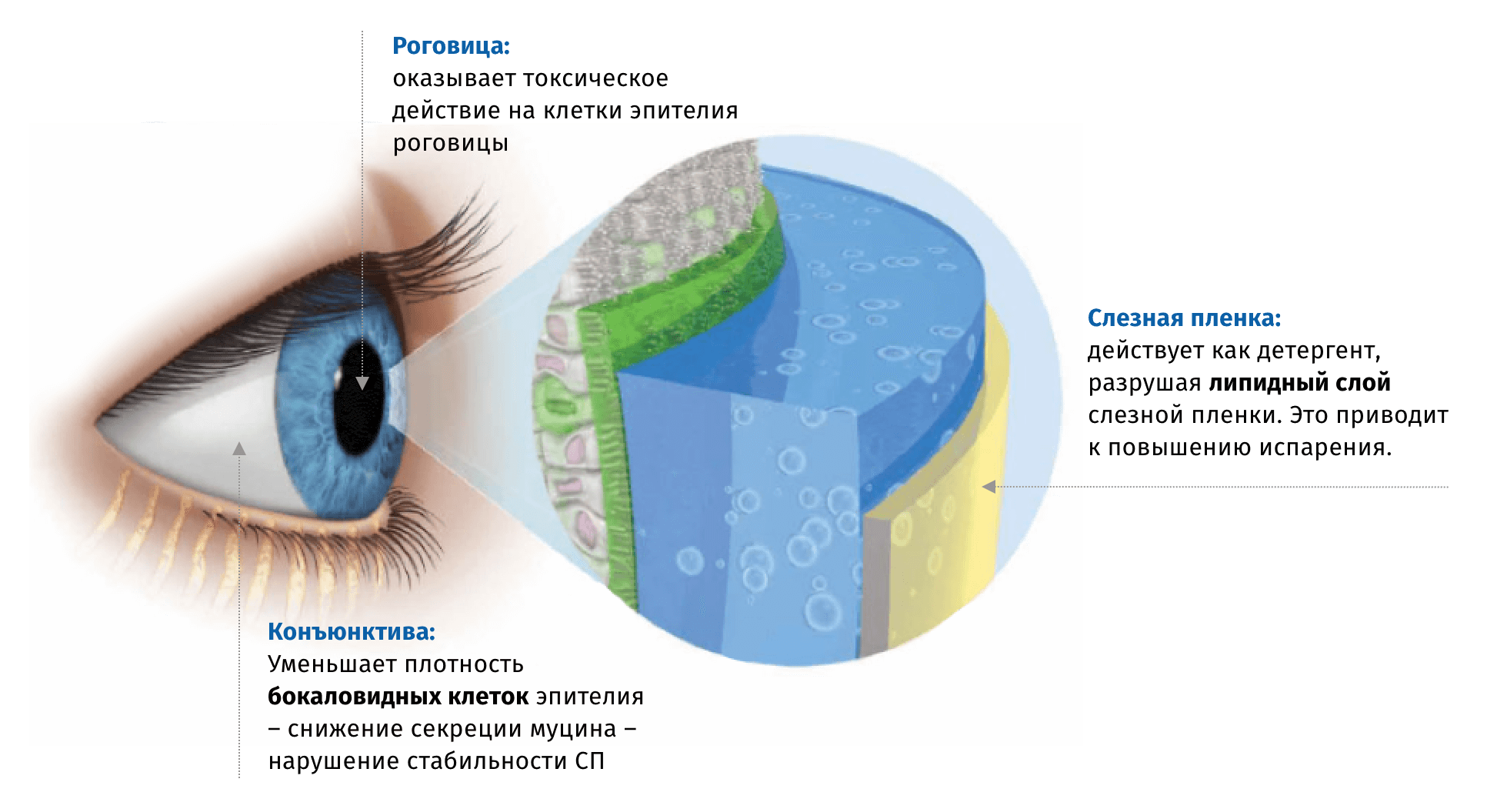
Выраженность негативного действия БАХ на ткани глаза зависит от кратности и продолжительности закапывания. Степень тяжести симптомов ССГ напрямую связана с количеством применяющихся местных препаратов. Исследование Rossi et al. показало зависимость частоты ССГ от количества применяемых препаратов: использование в схеме лечения 3х препаратов – 43%, 2 – 39%, 1 – 11%9.
Следует учитывать, что многие местные препараты, назначаемые специалистом дополнительно – слезозаменители, кератопротекторы — также могут содержать БАХ в качестве консерванта, что увеличивает токсическую нагрузку.
Бесконсервантные формы
В исследованиях прослеживается зависимость между частотой ССГ и наличием консерванта в используемых пациентом препаратах. Например, по данным мультицентрового кросс-секционального эпидемиологического исследования в 4 странах Европы с участием 9658 пациентов с глаукомой переход на бесконсервантную форму препарата позволяет уменьшить нежелательную симптоматику10:

На сегодняшний день существуют препараты выпускаемые в бесконсервантной форме — одноразовые тюбик-капельницы (монодозы), или многодозовые флаконы со специальной системой защиты от контаминации (особая мембрана или клапан). Однако выпуск препарата в форме монодоз увеличивает его стоимость, а перечень антиглаукомных препаратов в многодозовых флаконах без консерванта пока ограничен.
Альтернативные консерванты
Помимо бесконсервантных форм, у современному специалисту доступен целый ряд альтернативных консервантов, позволяющих уменьшить негативное влияние на глазную поверхность даже при частых закапываниях.
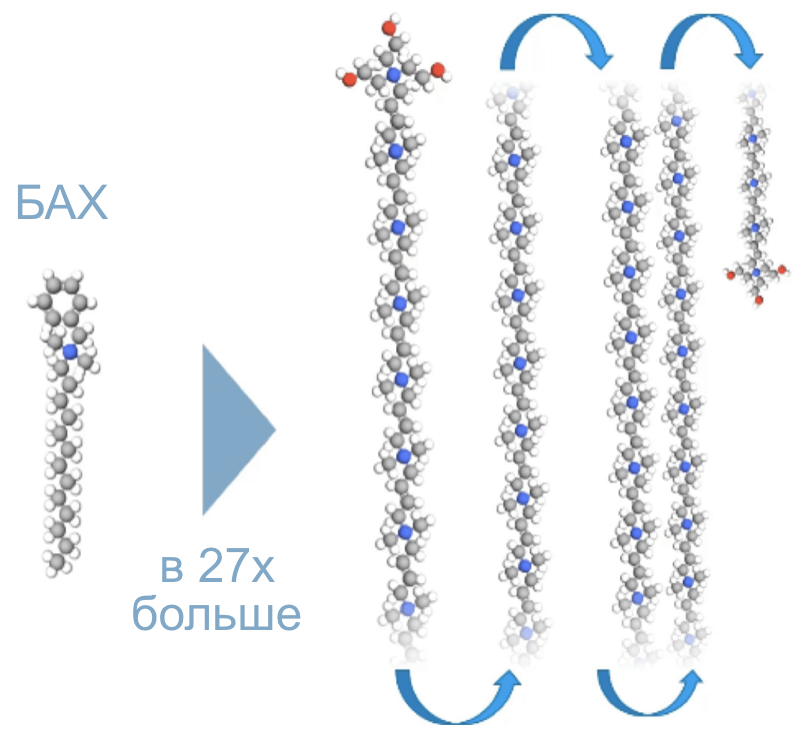
Поликватерниум (Поликвад) – консервант, широко используемый в растворах для контактных линз, в слезозаменителях и в препаратах для лечения глаукомы. По своей структуре поликватерниум представляет полимерное соединение четвертичного аммония. Размер молекулы примерно в двадцать семь раз больше молекулы БАХ.
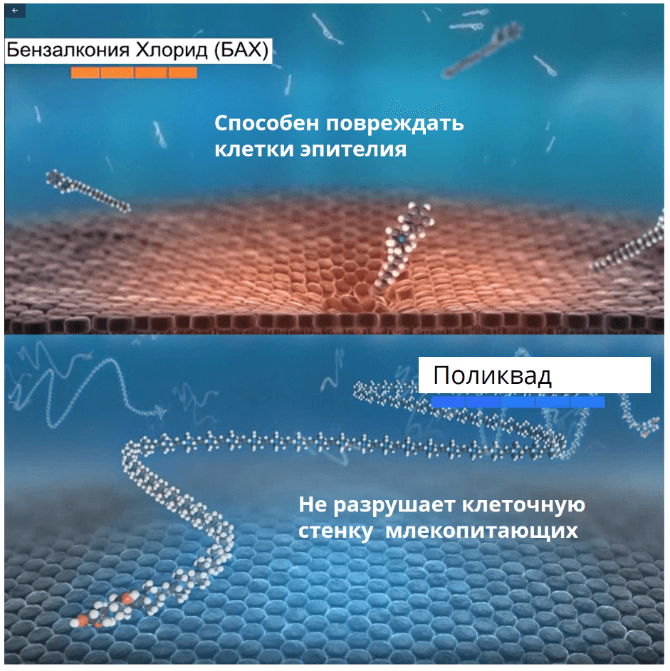
Макромолекула поликватерниума не оказывает токсического действия на клетки млекопитающих. Кроме того, молекула не обладает детергентными свойствами и не разрушает липидный слой, что это сводит к минимуму нежелательные эффекты на глазную поверхность6.
Целый ряд клинических исследований подтвердил безопасность применения офтальмологических растворов с поликвадом для тканей глазной поверхности6,13,14,15
Еще одна группа консервантов, активно использующаяся в препаратах для лечения глаукомы и ССГ — окислительные консерванты, распадающиеся при контакте со слезой.
Перборат натрия, является консервантом окислительного типа, который изменяет синтез белка в бактериальных клетках через окислительные механизмы. При попадании в глаза присутствующие в слезе энзимы (каталаза) разлагают консервант с образованием кислорода и воды6.
Стабилизированный Оксихлорокомплекс (СОК) состоит из хлорита, хлората натрия и диоксида хлора, распадается под действием света6.
Исследование Manlong et al. Позволило сравнить действие различных консервантов, используемых в слезозаменителях, на клетки эпителия роговицы человека.
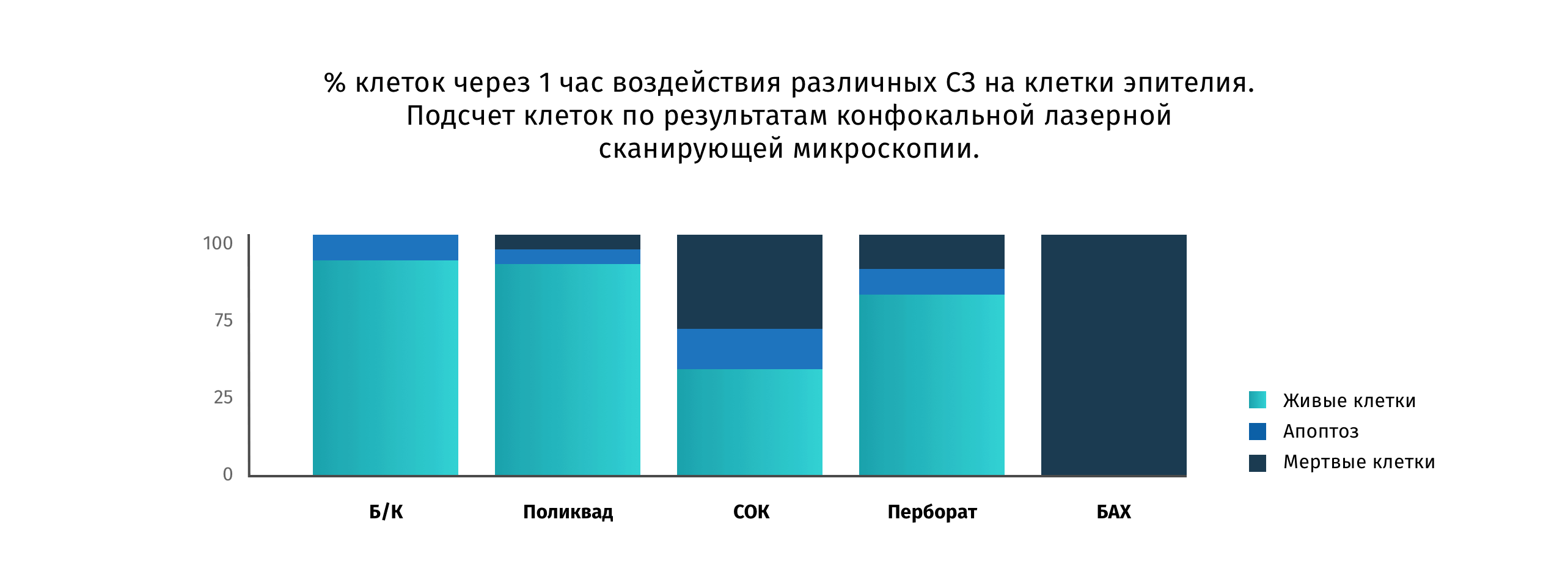
После воздействия различных слезозаменителей на монослой эпителиальных клеток жизнеспособность оценивалась с помощью конфокальной микроскопии. Альтернативные консерванты и бесконсервантные формы продемонстрировали клинически значимую разницу в сравнении с БАХ11.
Влияние ССГ на прогрессирование глаукомы
Проблема нежелательных явлений в терапии глаукомы волнует многих специалистов, и не только с точки зрения ССГ. Исследование Philippe Denis выявило связь между наличием симптомов ССГ, связанных с использованием антиглаукомных препаратов, и течением глаукомы. Данные исследования показывают, что присутствие нежелательных симптомов увеличивает риск прогрессирования глаукомы в 3,3 раза!12
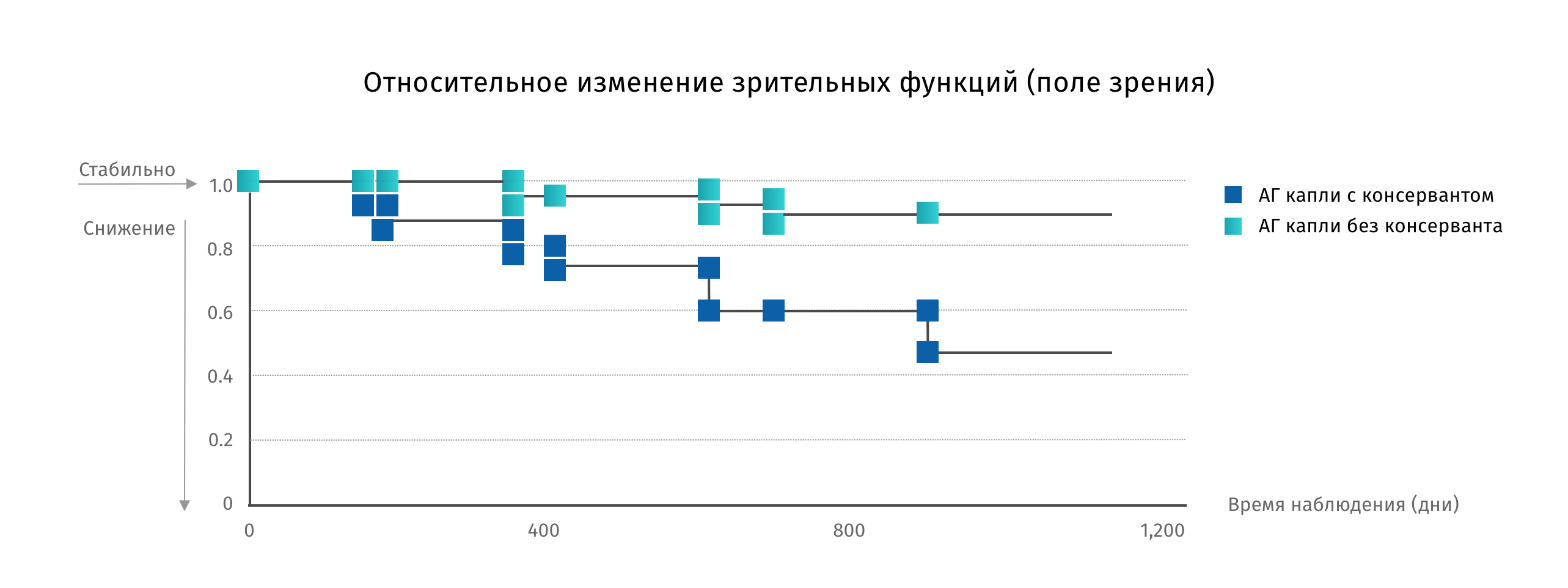
Причина достаточно проста – дискомфорт, связанный с нежелательными явлениями, снижает комплаентность пациентов. А нарушение режима ведет к прогрессированию атрофии зрительного нерва и необратимому снижению зрительных функций. Нежелательные явления, связанные с местным применением антиглаукомных препаратов, могут оказать неблагоприятное воздействие на соблюдение рекомендаций пациентом12.
Ведение пациентов с ССГ в практике глаукомного приема
Ведение пациентов с глаукомой в случае выявления ССГ имеет некоторые особенности: требуется корректировка схемы применения антиглаукомных препаратов с целью уменьшения токсической нагрузки.

Минимизмация кратности закапывания (использование комбинированных препаратов, пролонгированных форм)

Переход с БАХ на альтернативные консерванты с минимальной токсичностью или бесконсервантные формы

В случае выраженной симптоматики ССГ и повреждения глазной поверхности можно рассматривать также возможности лазерного и хирургического лечения2.
Выбор слезозаменителей для пациентов с глаукомой
Для защиты глазной поверхности, а также для уменьшения симптоматики у данных пациентов применяют слезозаменители. Однако если слезозаменитель в качестве консерванта также содержит БАХ – итоги такого лечения могут быть сомнительны. Токсичность БАХ зависит от дозировки – вероятность ее увеличивается с каждым закапыванием препарата. Это важно учитывать при назначении дополнительных препаратов для местного применения.
Сегодня все больше слезозаменителей выпускается с альтернативными консервантами, обладающими минимальной токсичностью в отношении слезной пленки и эпителия глазной поверхности. Среди них – поликвад, оксид, пурит, окупур6.
Также все более популярными становятся препараты без консерванта – монодозы и препараты в особых мультидозных флаконах-контейнерах.
Ключевыми факторами при выборе слезозамещающей терапии у пациентов с глаукомой являются2:

Безопасный консервант или его отсутствие. Бесконсервантные формы выпускаются в форме монодоз или в специальных мультидозных флаконах.
Альтернативные консерванты, например, поликвад, не оказывают токчического действия на глазную поверхность и не нарушают стабильность слезной пленки6.

Длительность действия. Вязкие, гелеобразные препараты имеют более продолжительное действие, пример — препараты на основе карбомера.
Препараты с трансформационным эффектом при закапывании имеют низкую вязкость, а на поверхности глаза вязкость увеличивается, обеспечивая более длительную защиту — таким действием обладают препараты на основе гидроксипропилгуара.
Источник
Антонов А.А.
ФГБУ «НИИГБ» РАМН, Москва
Синдром «сухого глаза» (ССГ) у больных глаукомой выявляется в 30-91% (Муратова Н.В., 2005), отягощая течение основного заболевания и создавая трудности при выборе оптимальной медикаментозной терапии. Развитие и значительное распространение ССГ, сопровождающего глаукомный процесс, обусловлено полиэтиологичностью роговичного ксероза. Среди основных факторов, способствующих ССГ при глаукоме, можно выделить: ассоциированное с возрастом снижение функции секреторных клеток, продуцирующих компоненты слезной пленки, а также уменьшение количества нервных окончаний, обеспечивающих рефлекторный мигательный акт; воздействие неблагоприятных факторов внешней среды (кондиционированный воздух, избыточное содержание вредных примесей); напряженный зрительный труд; наличие глазных хирургических вмешательств в анамнезе, в том числе рефракционных; побочное действие некоторых лекарственных средств; частые инстилляции анестетиков и гипотензивных препаратов, особенно бета-адреноблокаторов.
Значительная роль в повреждающем действии препаратов этой группы на нарушение формирования и сохранность слезной пленки отводится наличию в их составе консервантов, обеспечивающих стабильность лекарственного препарата, в частности, бензалкония хлорида. Предполагается, что вышеуказанное побочное действие адреноблокаторов с содержанием консерванта бензалкония гидрохлорида обусловлено: 1) повышенной испаряемостью слезной пленки за счет нарушения целостности ее липидного слоя; 2) непосредственным токсическим действием на секреторные и несекреторные эпителиоциты конъюнктивы, с развитием комбинированного водо- , липидо- , муцинодефицита и формированием альтеративных изменений эпителия; 3) индукцией выброса провоспалительных цитокинов слезной жидкости и развитием иммунного воспаления поверхности глаза (Янченко С.В., Еременко А.И., 2008).
Лица, страдающие глаукомой, – особенная категория больных, вынужденных в связи с наличием хронического заболевания в течение многих лет закапывать препараты, нормализующие внутриглазное давление. Длительная гипотензивная терапия при ее успешности обеспечивает стабилизацию глаукомного процесса и сохранность зрительных функций. Однако наличие сопутствующего ССГ создает определенные трудности в обеспечении зрительного акта и может значительно снизить качество жизни пациентов с глаукомой. Так, неустойчивость слезной пленки вызывает повышенную зрительную утомляемость, влияет на рефракционные свойства глаза, ограничивает трудоспособность больных и профессиональную пригодность, вынуждает применять большее число лекарственных средств (для лечения и глаукомы, и ССГ), вызывает дискомфорт при использовании индифферентных капель. В конечном итоге снижается комплаентность пациентов и эффективность предложенного офтальмологом лечения глаукомы.
Существуют три основных направления, позволяющих преодолеть возникающие проблемы, однако каждое из них сопряжено с рядом трудностей.
Первое – это разработка и активное внедрение в практику лекарственных средств со сниженным содержанием консервантов или вовсе не имеющих их в составе препарата. В этом случае фармацевтические компании сталкиваются с технологическими задачами, не имеющими простых решений. С одной стороны, необходимо обеспечить стабильность действующего вещества и асептичность вскрытого флакона в течение возможно более долгого времени, с другой – избежать наличия в препарате компонентов, потенциально оказывающих повреждающее или аллергизирующее воздействие на структуры глаза и слезную пленку.
Второе – расширение терапевтического режима за счет включения дополнительных инстилляций лекарственных средств, предназначенных для лечения ССГ, или препаратов, обладающих протекторными свойствами для защиты поверхности глаза от повреждающих агентов гипотензивных капель. В этом случае порой нелегко убедить пациента в необходимости применения еще 1-2 препаратов в дополнение к тем 2-3 видам капель, которые больной уже использует с целью гипотензивной терапии глаукомы.
И, наконец, третье – оптимизация консервативной терапии за счет комбинированных лекарственных форм, содержащих субстанции различного механизма действия в «одном флаконе» – фиксированные комбинации.
Наиболее часто и эффективно используемыми при ССГ, сопутствующем глаукоме, являются слезозаместительная терапия, обеспечивающая дополнительное увлажнение глаза при недостаточности собственных слезопродуцирующих структур, и гелевые препараты, способствующие сохранению компонентов слезы на поверхности глаза и обеспечивающие стабильность слезной пленки. Основными действующими веществами таких препаратов являются гиалуроновая кислота и повидон.
Повидон (поливинилпирролидон) представляет собой низкомолекулярный полимер с массой 12 600 ± 2 700 или 8 000 ± 2 000. Лекарственная форма используется в составе препаратов для увлажнения и защиты роговицы, а также средств с дезинтоксикационным действием для парентерального применения и энтеросорбентов. Дезинтоксикационное действие обусловлено способностью связывать токсины и быстро выводить их из организма. Повидон усиливает почечный кровоток, повышает клубочковую фильтрацию, увеличивает диурез. Уменьшение молекулярного веса полимера способствует усилению дезинтоксикационного действия.
При применении в качестве глазной лекарственной формы повидон обладает необходимой вязкостью и высокими адгезивными свойствами по отношению к роговице, за счет чего образует на ее поверхности равномерную, сохраняющуюся в течение длительного времени, слезную пленку, которая не смывается при моргании и не вызывает снижения остроты зрения.
В последнее время в терапии глаукомы приоритетные позиции занимают сложносоставные препараты, позволяющие сократить число необходимых инстилляций за счет комбинации в одном флаконе различных действующих веществ («fixed combination drug»). Фирма Bausch&Lomb для лечения глаукомы предлагает препарат арутимол, обладающий комбинированным действием. В его состав входит бета-адреноблокатор тимолола малеат 0,5%, обладающий выраженным гипотензивным действием, и повидон, обеспечивающий стабильность прекорнеальной слезной пленки. Несомненным преимуществом арутимола перед другими глазными каплями, содержащими тимолола малеат, является также крайне низкая концентрация консерванта бензалкония хлорида (0,03 мг) в сравнение со стандартным его содержанием (0,1 мг) в препаратах других производителей.
Показатели суммарной слезопродукции и времени разрыва слезной пленки у больных глаукомой
Эффективность фиксированной комбинации арутимола у больных глаукомой с сопутствующим ССГ подтверждена результатами исследования, проведенного у 58 пациентов (23 мужчин, 35 женщин, 94 глаза), средний возраст которых составил 69,9± 5,3 года. В исследование были включены больные первичной открытоугольной глаукомой I-III стадий с компенсированным внутриглазным давлением. Все пациенты использовали с гипотензивной целью только препараты тимолола малеата различных производителей 0,5% концентрации дважды в день (арутимол – в 55,3% случаев (52 глаза), тимололсодержащие капли иных торговых марок – в 44,7% случаев (42 глаза)), лекарственные средства других фармакологических групп не применяли. До начала исследования никому из больных не проводили исследования, направленные на выявление ССГ, слезозаместительную терапию не назначали.
При тщательном сборе анамнеза в 46% случаев выявляли жалобы на периодическое ощущение инородного тела, рези, жжения, дискомфорта, сухости глаза и затруднения при мигании, особенно в утренние часы.
Для функционального исследования суммарной слезопродукции применяли пробу Ширмера. Рабочий конец специальной полоски фильтровальной бумаги (5 мм) загибали под углом 45° и помещали за нижнее веко в латеральной трети глазной щели. Пациента просили закрыть глаза и через 5 мин полоски извлекали. От места перегиба измеряли длину их увлажненной части. В норме за 5 мин смачивается свыше 15 мм тестовой полоски.
Стабильность прероговичной слезной пленки оценивали с помощью пробы Норна. Пациента усаживали за щелевую лампу и орошали область лимба на 12 часах одной каплей 0,1-0,2% раствора флюоресцеина натрия. Затем при биомикроскопии с использованием кобальтового фильтра фиксировали время от последнего спокойного мигательного движения до образования в окрашенной слезной пленке первого разрыва. По данным В.В. Бржеского и Е.Е. Сомова (1998), у здоровых людей в возрасте 16-35 лет время разрыва СП составляет 21,1±2,0 с, а 60-80 лет – 11,6±1,9 с.
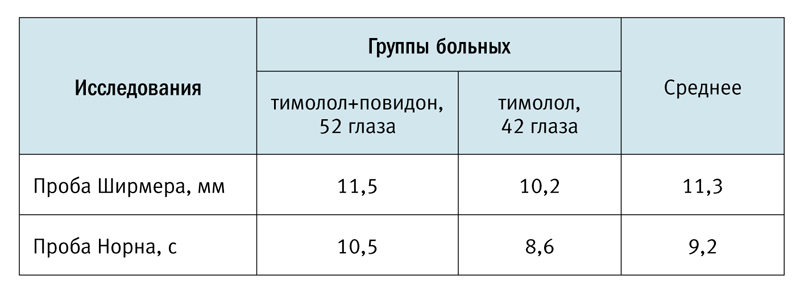
Среднее значение пробы Ширмера составило 11,3 мм, снижение суммарной слезопродукции выявлено в 63,8% случаев (59 глаз). В 36,2% случаев (35 глаз) смачивание тестовой полоски при проведении пробы Ширмера составило 15 мм и больше, что свидетельствовало об отсутствии нарушений слезопродукции.
Время разрыва слезной пленки при проведении пробы Норна в среднем составило 9,2 с, при этом в 30,9% случаев (29 глаз) этот показатель находился в пределах возрастной нормы (≥10 с). Результаты проведенных исследований в группах пациентов, применявших для снижения офтальмотонуса арутимол (тимолол+повидон) и тимолола малеат (тимолол) других торговых марок представлены в сводной таблице. Сравнительный анализ полученных показателей проб Ширмера и Норна показывает улучшение суммарной слезопродукции (на 12,7%) и увеличение времени разрыва слезной пленки (на 22,1%) при использовании фиксированной комбинации тимолола малеата и повидона (арутимол) (см. рис. 1).
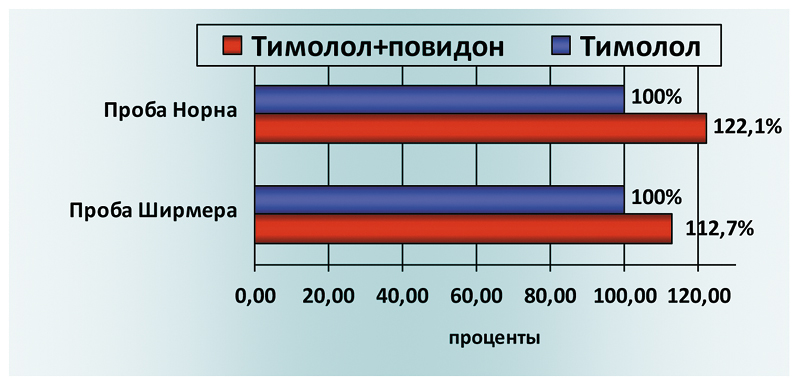
Рис. 1. Сравнительная характеристика фиксированной комбинации
тимолол+повидон и тимолола по результатам проб Ширмера и Норна
По результатам исследования установлено, что у больных глаукомой при длительном применении инстилляционных форм-блокаторов как препаратов местной гипотензивной терапии в 63,8% случаев выявляется снижение суммарной слезопродукции, в 69,1% случаев отмечается дестабилизация слезного покрытия передней поверхности глаза. Оптимизация состава глазных капель, способствующая сохранению прероговичной слезной пленки, в меньшей степени вызывает нарушения суммарной слезопродукции, стабилизирует слезную пленку и в конечном итоге снижает риск развития такого грозного осложнения лекарственной терапии, как синдром «сухого глаза». Таким образом, при необходимости использования у пациентов с глаукомой бетаадреноблокаторов применение арутимола, содержащего в своем составе повидон, обеспечивающий стабильность прекорнеальной слезной пленки, является оптимальным с целью предупреждения и лечения сопутствующего ССГ.
Источник


