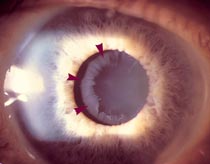
Роговица при врожденной глаукоме
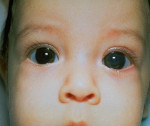
Врожденная глаукома – чаще наследственное заболевание, сопровождающееся постепенным увеличением внутриглазного давления и обусловленными этим сопутствующими зрительными нарушениями. К основным симптомам данной патологии относят увеличение размеров глаз (у грудных детей), болезненность, которая приводит к беспокойству и плаксивости ребенка, светобоязнь, миопию или астигматизм. Диагностика врожденной глаукомы производится на основании данных офтальмологического осмотра, изучения наследственного анамнеза пациента и течения беременности, генетических исследований. Лечение только хирургическое, причем оно должно быть выполнено как можно ранее до развития необратимых вторичных нарушений в органе зрения.
Общие сведения
Врожденная глаукома – генетическое, реже — приобретенное внутриутробно заболевание, которое характеризуется недоразвитием угла передней камеры глаза и трабекулярной сети, что в конечном итоге приводит к повышению внутриглазного давления. Это состояние считается в офтальмологии относительно редким и встречается примерно в одном случае на 10000 родов. Некоторые исследователи полагают, что данная статистика не совсем корректно отражает действительность, ведь некоторые формы врожденной глаукомы могут не проявлять себя вплоть до подросткового возраста. Несмотря на то, что патология наследуется по аутосомно-рецессивному механизму, среди больных несколько превалируют мальчики – половое распределение составляет примерно 3:2. По возрасту развития основных симптомов, а также наличию или отсутствию генетических дефектов выделяют несколько клинических форм этого заболевания. Важность своевременного обнаружения врожденной глаукомы обусловлена тем, что без проведенного лечения ребенок может ослепнуть через 4-5 лет после развития первых проявлений патологии.
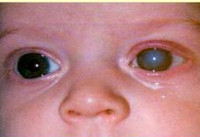
Врожденная глаукома
Причины врожденной глаукомы
Подавляющее большинство случаев врожденной глаукомы (не менее 80%) сопровождаются мутацией гена CYP1B1, который локализован на 2-й хромосоме. Он кодирует белок цитохром Р4501В1, функции которого на сегодняшний момент изучены недостаточно. Предполагается, что данный протеин каким-то образом участвует в синтезе и разрушении сигнальных молекул, которые принимают участие в формирование трабекулярной сети передней камеры глаза. Дефекты структуры цитохрома Р4501В1 приводят к тому, что метаболизм вышеуказанных соединений становится аномальным, что и способствует нарушению формирования глаза и развитию врожденной глаукомы. Сейчас известно более полусотни разновидностей мутаций гена CYP1B1, достоверно связанных с развитием этого заболевания, однако выявить взаимосвязь между конкретными дефектами гена и определенными клиническими формами пока не удалось.
Помимо этого, имеются указания на роль в развитии врожденной глаукомы другого гена – MYOC, расположенного на 1-й хромосоме. Продукт его экспрессии, протеин под названием миоциллин, широко представлен в глазных тканях и тоже участвует в формировании и функционировании трабекулярной сети глаза. Ранее было известно, что мутации этого гена являются причиной открытоугольной ювенильной глаукомы, однако при одновременном повреждении MYOC и CYP1B1 развивается врожденная разновидность этой патологии. Некоторые исследователи в области генетики полагают, что обнаружение мутации гена миоциллина на фоне дефекта CYP1B1 не играет особой клинической роли в развитии врожденной глаукомы и является просто совпадением. Мутации этих обоих генов наследуются по аутосомно-рецессивному механизму.
Кроме наследственных форм данной патологии примерно в 20% случаев диагностируется врожденная глаукома при отсутствии, как случаев заболевания, так и патологических генов у родителей. В таком случае причиной развития глазных нарушений могут выступать либо спонтанные мутации, либо же повреждение тканей глаза во внутриутробном периоде. Последнее может быть обусловлено заражением матери во время беременности некоторыми инфекциями (например, токсоплазмозом, краснухой), внутриутробными травмами плода, ретинобластомой, воздействием тератогенных факторов. Так как в такой ситуации не имеется генетического дефекта, такая патология носит название вторичной врожденной глаукомы. Кроме того, подобные нарушения органа зрения могут иметь место при некоторых других врожденных заболеваниях (синдром Марфана, ангидроз и другие).
Какой бы ни была причина врожденной глаукомы, механизм развития нарушений при этом состоянии практически одинаков. Из-за недоразвития угла передней камеры глаза и трабекулярной сети водянистая влага не может нормально покидать полость, происходит ее накопление, что сопровождается постепенным повышением внутриглазного давления. Особенностью врожденной глаукомы является тот факт, что ткани склеры и роговицы у детей обладают большей эластичностью, нежели у взрослых, поэтому при накоплении влаги происходит увеличение размеров глазного яблока (чаще всего двух сразу, очень редко только одного). Это несколько снижает внутриглазное давление, однако со временем и этот механизм становится недостаточным. Происходит уплощение хрусталика и роговицы, на последней могут появиться микроразрывы, ведущие к помутнению; повреждается диск зрительного нерва, истончается сетчатка. В конечном итоге может произойти ее отслоение – помутнение роговицы и отслойка сетчатой оболочки глаза являются ведущими причинами слепоты при врожденной глаукоме.
Классификация врожденной глаукомы
В клинической практике врожденную глаукому в первую очередь разделяют на три разновидности – первичную, вторичную и сочетанную. Первичная обусловлена генетическими нарушениями, наследуется по аутосомно-рецессивному механизму и составляет около 80% от всех случаев заболевания. Причина вторичной врожденной глаукомы заключается во внутриутробном нарушении формирования органов зрения различной негенетической природы. Сочетанная разновидность, как следует из названия, сопровождается наличием врожденной глаукомы на фоне иных наследственных заболеваний и состояний. Первичная форма, обусловленная генетическими дефектами, в свою очередь подразделяется на три клинические формы:
- Ранняя врожденная глаукома – при этой форме признаки заболевания выявляются при рождении, или они проявляются в первые три года жизни ребенка.
- Инфантильная врожденная глаукома – развивается в возрасте 3-10 лет, ее клиническое течение уже мало похоже на ранний тип и приближается к таковому у взрослых людей при других формах глаукомы.
- Ювенильная врожденная глаукома – первые проявления этой формы заболевания регистрируются чаще всего в подростковом возрасте, симптоматика очень схожа с инфантильным типом патологии.
Такой значительный разлет в возрасте развития врожденной глаукомы напрямую связан со степенью недоразвития трабекулярной сети глаза. Чем более выражены нарушения в этих структурах, тем ранее начинается накопление водянистой влаги с повышением внутриглазного давления. Если же недоразвитие угла передней камеры глаза не достигает значительных величин, то в первые годы жизни ребенка отток происходит вполне нормально, и нарушения развиваются намного позже. Попытки связать определенные клинические формы врожденной глаукомы с конкретными типами мутаций гена CYP1B1 на сегодняшний день не увенчались успехом, и механизмы развития того или иного типа заболевания до сих пор неизвестны.
Симптомы врожденной глаукомы
Наиболее своеобразными проявлениями характеризуется ранняя форма первичной врожденной глаукомы, что обусловлено анатомическими особенностями строения глаза у ребенка в возрасте до 3-х лет. В очень редких случаях глаукомные изменения можно заметить уже при рождении, чаще всего в первые 2-3 месяца жизни заболевание ничем себя не проявляет. Затем ребенок становится беспокойным, плохо спит, очень часто капризничает – это обусловлено неприятными и болезненными ощущениями, с которых дебютирует врожденная глаукома. Через несколько недель или месяцев начинается медленное увеличение размеров глазных яблок (реже — одного). Повышение внутриглазного давления и эластичность тканей склеры могут привести к значительному увеличению глаз, что внешне создает ложное впечатление красивого «большеглазого» ребенка. Затем к этим симптомам присоединяется отек, светобоязнь, слезотечение, иногда возникает помутнение роговицы.
Инфантильная и ювенильная формы врожденной глаукомы во многом очень схожи, различается только возраст развития первых проявлений заболевания. Увеличения размеров глазных яблок при этом, как правило, не происходит, патология начинается с ощущения дискомфорта и болезненности в глазах, головных болей. Ребенок может жаловаться на ухудшение зрения (появление ярких ореолов вокруг источников света, «мошки» перед глазами). Эти типы врожденной глаукомы часто сопровождаются другими нарушениями зрительного аппарата – косоглазием, астигматизмом, миопией. Со временем происходит сужение поля зрения (теряется возможность видеть предметы боковым зрением), нарушение темновой адаптации. Светобоязнь, отек и инъецирование сосудов склеры, характерные для ранней формы заболевания, при этих формах чаще всего не наблюдаются. При отсутствии лечения любая разновидность врожденной глаукомы со временем приводит к слепоте по причине отслойки сетчатки или атрофии зрительного нерва.
Диагностика врожденной глаукомы
Выявление врожденной глаукомы производится врачом-офтальмологом на основании данных осмотра, офтальмологических исследований (тонометрии, гониоскопии, кератометрии, биомикроскопии, офтальмоскопии, УЗ-биометрии). Также немаловажную роль в диагностике этого состояния играют генетические исследования, изучение наследственного анамнеза и течения беременности. При осмотре обнаруживаются увеличенные (при ранней форме) или нормальные размеры глаз, может также наблюдаться отек окружающих глазное яблоко тканей. Горизонтальный диаметр роговицы увеличен, на ней возможны микроразрывы и помутнение, склера истончена и имеет голубоватый оттенок, поражается при врожденной глаукоме и радужная оболочка – в ней возникают атрофические процессы, зрачок вяло реагирует на световые раздражители. Передняя камера глаза углублена (в 1,5-2 раза больше возрастной нормы).
На глазном дне длительное время не возникает никаких патологических изменений, так как за счет увеличения размеров глазного яблока внутриглазное давление поначалу не достигает значительных величин. Но затем довольно быстро развивается экскавация диска зрительного нерва, однако при снижении давления выраженность этого явления также уменьшается. По причине увеличения размеров глаз при врожденной глаукоме происходит истончение сетчатки, что при отсутствии лечения может привести к ее разрыву и регматогенной отслойке. Часто на фоне таких изменений обнаруживается миопия. Тонометрия показывает некоторое увеличение внутриглазного давления, однако этот показатель следует сопоставлять с передне-задним размером глаза, так как растяжение склеры сглаживает показатели ВГД.
Изучение наследственного анамнеза может выявить аналогичные изменения у родственников больного, при этом нередко удается определить аутосомно-рецессивный тип наследования – это свидетельствует в пользу первичной врожденной глаукомы. Наличие в ходе беременности инфекционных заболеваний матери, травм, воздействия тератогенных факторов указывает на возможность развития вторичной формы заболевания. Генетическая диагностика осуществляется посредством прямого секвенирования последовательности гена CYP1B1, что позволяет выявить его мутации. Таким образом, однозначно доказать наличие первичной врожденной глаукомы может только врач-генетик. Кроме того, при наличии такого состояния у одного из родителей или их родственников можно производить поиск патологической формы гена до зачатия или пренатальную диагностику путем амниоцентеза или других методик.
Лечение и прогноз врожденной глаукомы
Лечение врожденной глаукомы только хирургическое, возможно применение современных лазерных технологий. Консервативная терапия с использованием традиционных средств (капли пилокарпин, клонидин, эпинефрин, дорзоламид) является вспомогательной и может использоваться некоторое время в ходе ожидания операции. Хирургическое вмешательство сводится к формированию пути оттока водянистой влаги, что снижает внутриглазное давление и устраняет врожденную глаукому. Метод и схема проведения операции избирается в каждом конкретном случае строго индивидуально. В зависимости от клинической картины и особенностей строения глазного яблока могут выполняться гониотомия, синустрабекулэктомия, дренажные операции, лазерная циклофотокоагуляция или циклокриокоагуляция.
Прогноз врожденной глаукомы при своевременной диагностике и проведении операции чаще всего благоприятный, если же лечение произведено с опозданием, возможны различные по выраженности нарушения зрения. После устранения глаукомы необходимо не менее трех месяцев диспансерного наблюдения у офтальмолога.
Источник
Врожденная
глаукома наблюдается у 1 на 10-20 тысяч
новорожденных и чаще проявляется вскоре
после рождения. Однако если нарушения
оттока водянистой влаги выражены не
резко, то клинические проявления глаукомы
могут отодвинуться на несколько лет
(инфантильная и ювенильная глаукома).
Одной из причин врожденной глаукомы
служит неполное рассасывание эмбриональной
мезодермальной ткани в углу передней
камеры.
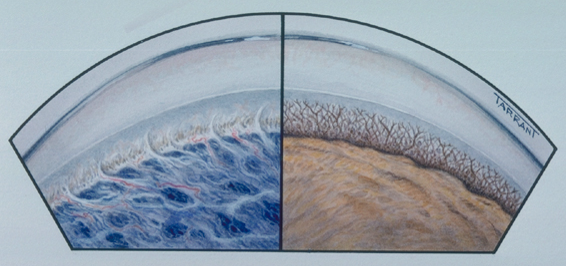
Угол
передней камеры при врожденной глаукоме
Эта
ткань закрывает доступ водянистой
влаги к трабекуле и шлеммову каналу.
Другие причины связаны с неправильным
развитием цилиарной мышцы или дефектами
в формировании трабекулы и шлеммова
канала. Врожденная глаукома нередко
комбинируется с другими дефектами
развития глаза или организма ребенка,
но может быть и самостоятельным
заболеванием. Как правило, один глаз
поражается в большей степени, чем
другой, что облегчает диагностику.
У
детей раннего возраста капсула глаза
растяжима и эластична, поэтому при
врожденной глаукоме доминируют
симптомы, связанные с растяжением
роговицы и склеры. Растяжение роговицы
приводит к раздражению в ней нервных
элементов. Сначала появляются слезотечение,
светобоязнь, затем увеличение размеров
роговицы и всего глазного яблока (рисунок
15.6) становится заметным на глаз
(гидрофтальм,
буфтальм
– бычий глаз).
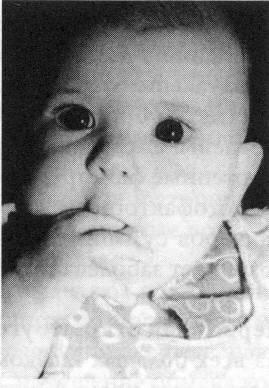
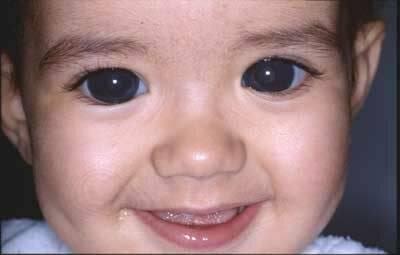
Рис.
15.6 – Ребенок с врожденной глаукомой
обоих глаз
Диаметр
роговицы увеличивается до 12 мм и
более, уменьшается ее толщина и
увеличивается радиус кривизны. Характерны
углубление передней камеры и атрофия
стромы радужки. Постепенно роговица
теряет прозрачность из-за отека ее
стромы и эндотелия. Причиной отека
служит проникновение водянистой влаги
в роговичную ткань через трещины в
перерастянутом заднем эпителии.
Одновременно значительно расширяется
лимб и его границы теряют четкость.
Экскавация ДЗН развивается быстро,
но вначале она обратима и уменьшается
при снижении ВГД.
Лечение
врожденной
глаукомы хирургическое. Медикаментозную
терапию применяют как дополнительную
меру воздействия.
В
ранней стадии болезни при открытом УПК
чаще производят гониотомию,
направленную на очищение трабекулярной
зоны с целью воссоздания дренажной
системы в углу передней камеры, или
трабекулотомию.
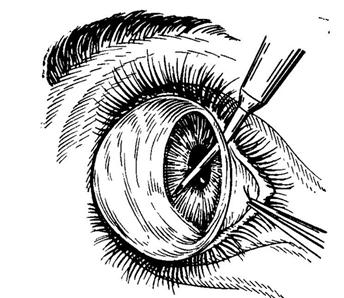
Гониотомия
В
поздних стадиях более эффективны
фистулизирующие операции, гониопунктура
(рисунок
15.7) и деструктивные вмешательства на
ресничном теле.
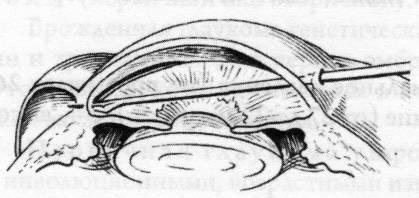
Рис.
15.7 – Гониопунктура при врожденной
глаукоме
Прогноз
удовлетворительный, но только при
своевременном выполнении оперативного
вмешательства. Зрение сохраняется в
течение всей жизни у 75% больных,
которым операция была произведена в
начальной стадии болезни, и только у
15-20% поздно прооперированных больных.
Первичная глаукома
Первичная
глаукома – одна из самых частых причин
необратимой слепоты. Частота потери
зрения вследствие глаукомы в нашей
стране и других развитых странах
устойчиво держится на уровне 14-15% от
общего числа всех слепых.
Этиология
первичной глаукомы, как открытоугольной,
так и закрытоугольной, связана не с
одним, а с большим числом патогенных
факторов, включающих индивидуальные
анатомические особенности; интенсивность
и характер возрастных изменений в
различных структурах глаза, особенно
в его дренажной системе; индивидуальные
особенности обменных процессов; состояние
нервной и эндокринной систем организма.
Все эти факторы в той или иной степени
генетически обусловлены. Следует
подчеркнуть, что у каждого больного
можно обнаружить не все патогенные
факторы, а только часть из них, поэтому
первичную глаукому относят к многофакторным
заболеваниям с пороговым эффектом.
Действие патогенных факторов суммируется
и, если их общий эффект превысит
определенный порог, возникает заболевание.
Первичная
открытоуголъная глаукома (ПОУГ)
Из
всех больных глаукомой ПОУГ наблюдается
у 70%. Заболевание, как правило, развивается
после 40-летнего возраста. Частота
первичной открытоугольной глаукомы
среди лиц возрастной группы 40-45 лет
составляет около 0,1%, среди людей 50-60 лет
она достигает 1,5-2,0%, а в возрастной группе
75 лет и старше – около
10%.
ПОУГ
возникает и в молодом возрасте, но
значительно реже.
К
факторам риска, влияющим на заболеваемость
ПОУГ, относятся следующие: пожилой
возраст, наследственность (глаукома у
близких родственников), раса (представители
негроидной расы болеют в 2-3 раза чаще,
чем европеоидной), сахарный диабет,
нарушения глюкокортикоидного обмена,
артериальная гипотензия, миопическая
рефракция, ранняя пресбиопия,
псевдоэксфолиативный синдром и
синдром пигментной дисперсии.
Патогенез
ПОУГ включает следующие патофизиологические
этапы: ухудшение оттока водянистой
влаги, вызванного дистрофическими
изменениями в трабекулярном аппарате
и повышения ВГД. Повышение ВГД обусловливает
снижение перфузионного кровяного
давления и интенсивности внутриглазного
кровообращения, а также деформацию
двух механически слабых структур –
трабекулярной диафрагмы в дренажной
системе глаза и решетчатой пластинки
склеры. Смещение кнаружи первой из этих
структур приводит к сужению и частичной
блокаде шлеммова канала (каналикулярный
блок), которая служит причиной дальнейшего
ухудшения оттока ВВ из глаза, а прогиб
и деформация решетчатой пластинки
склеры вызывают ущемление волокон
зрительного нерва в ее деформированных
канальцах. Блокада синуса легче
возникает в глазах с анатомическим
предрасположением,
которое
заключается в переднем положении
венозного синуса склеры, слабом развитии
склеральной шпоры и относительно
заднем расположении цилиарной мышцы
(рисунок 15.8).
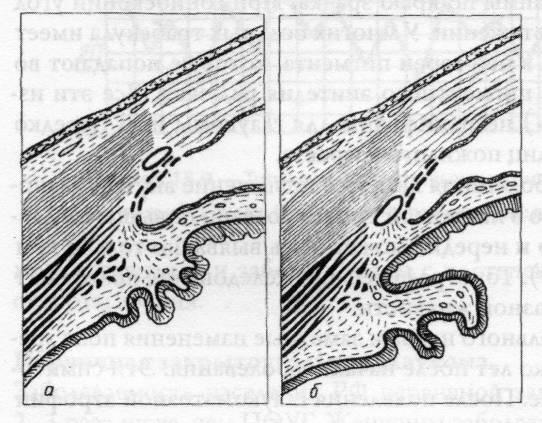
Рис.
15.8 – Переднее (а) и заднее (б) положение
венозного синуса склеры в углу передней
камеры
Эти
морфологические особенности ослабляют
эффективность механизма цилиарная
мышца – склеральная шпора – трабекула,
который поддерживает в открытом состоянии
венозный синус склеры и трабекулярные
щели.
Кроме
анатомического предрасположения,
определенное значение в возникновении
глаукоматозного процесса имеют
дистрофические изменения в трабекулярном
аппарате или интрасклеральном отделе
дренажной системы глаза.
Гемоциркуляторные
нарушения можно разделить на первичные
и вторичные. Первичные нарушения
предшествуют повышению
ВГД, вторичные возникают в результате
действия повышенного ВГД на гемодинамику
глаза.
Среди
причин возникновения метаболических
сдвигов выделяют последствия
гемоциркуляторных нарушений, приводящих
к ишемии и гипоксии внутриглазных
структур. К метаболическим нарушениям
при глаукоме относят также
псевдоэксфолиативную дистрофию,
перекисное окисление липидов, нарушение
обмена коллагена и гликозаминогликанов.
Псевдоэксфолиативный
синдром
Отрицательное
влияние на метаболизм дренажной системы
глаза оказывает возрастное снижение
активности ресничной мышцы, сосуды
которой участвуют и в питании бессосудистого
трабекулярного аппарата.
Выделяют
4 клинико-патогенетические формы ПОУГ:
простую, эксфолиативную, пигментную и
глаукому нормального давления.
Клиническая
картина простой ПОУГ
В
большинстве случаев открытоугольная
глаукома возникает и прогрессирует
незаметно для больного, который не
испытывает никаких неприятных ощущений
и обращается к врачу только тогда,
когда замечает значительное ухудшение
зрения. Только примерно у 15% больных
субъективные симптомы появляются еще
до заметного ухудшения зрительных
функций. Они заключаются в жалобах на
чувство полноты в глазу, затуманивание
зрения и появления радужных кругов при
взгляде на источник света. Все эти
симптомы возникают периодически, когда
внутриглазное давление повышается
особенно значительно.
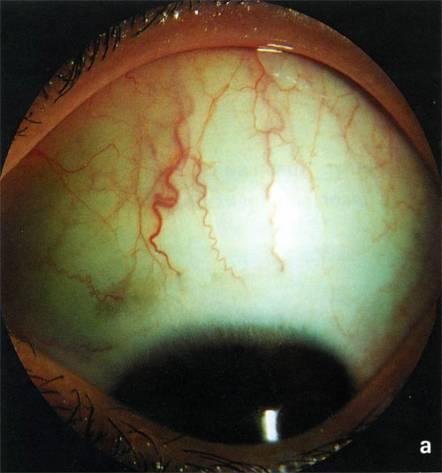
Очень
скудны и изменения в глазу с открытоугольной
глаукомой, обнаруживаемые при
объективном обследовании. В глазах с
повышенным внутриглазным давлением
передние цилиарные артерии у места
входа их в эмиссарий расширяются,
приобретая характерный вид («симптом
кобры»).
«Симптом
кобры»
При
внимательном осмотре щелевой лампой
можно видеть дистрофические изменения
в строме радужки и нарушение целости
пигментной каймы по краю зрачка. При
гониоскопии угол передней камеры открыт
на всем протяжении. У многих больных
трабекула имеет вид темной полосы из-за
отложения в ней зерен пигмента, которые
попадают во влагу передней камеры при
распаде пигментного эпителия радужки.
Все эти изменения (кроме «симптома
кобры») неспецифичны для глаукомы и их
нередко можно видеть и в здоровых глазах
у лиц пожилого возраста.
Наиболее
важным симптомом заболевания является
повышение внутриглазного давления.
Следует иметь в виду, что в начальной
стадии болезни повышение давления
носит непостоянный характер и нередко
может быть выявлено только при суточной
тонометрии (рисунок 15.9).
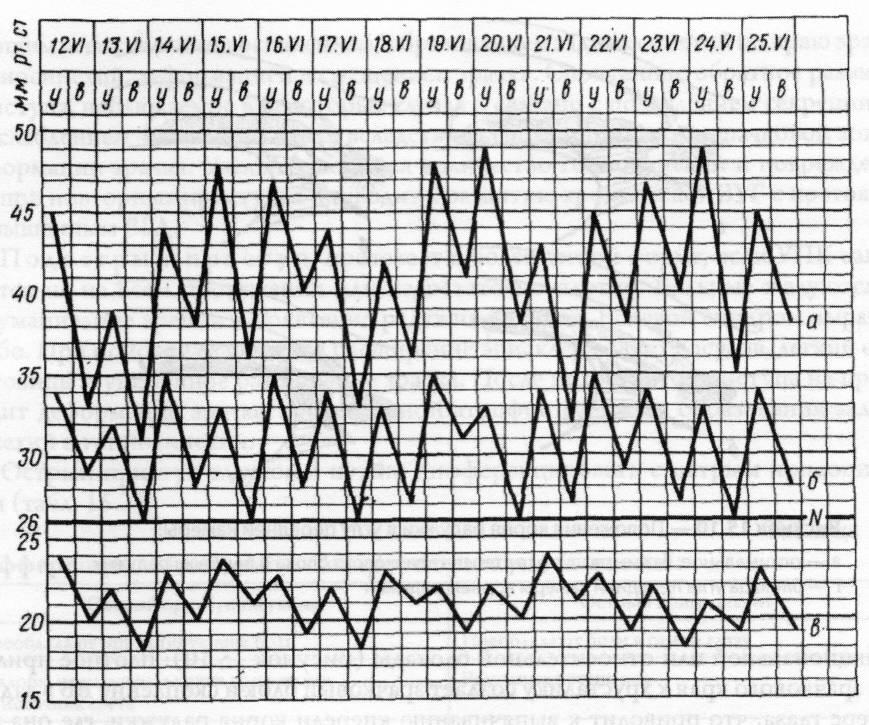
Рис.
15.9 – Типы суточных кривых внутриглазного
давления
а
– высокая кривая; б – умеренно повышенная;
в – нормальная.
Тонографические
исследования позволяют выявить ухудшение
оттока внутриглазной жидкости.
Глаукоматозная
экскавация зрительного нерва и заметные
изменения поля зрения появляются
лишь через несколько лет после начала
заболевания. Эти симптомы и их динамика
уже описаны ранее. После появления
глаукоматозной атрофии зрительного
нерва заболевание начинает прогрессировать
быстрее и при недостаточно эффективном
лечении может привести к полной слепоте.
После
полной потери зрения глаз может иметь
почти совершенно нормальный вид, и
только при внимательном осмотре
обнаруживаются расширение передних
цилиарных сосудов, тусклость роговицы
и атрофические изменения в радужке.
Однако при очень высоком уровне
офтальмотонуса может развиться синдром
терминальной болящей глаукомы,
который заключается в появлении сильных
болей в глазу, резком расширении
эписклеральных сосудов, отеке роговицы,
особенно ее эпителия, с образованием
пузырьков и эрозий (буллезный кератит).
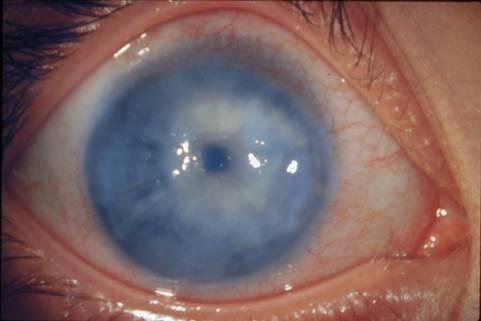
Отек
роговицы при глаукоме
На
радужке в углу передней камеры нередко
появляются новообразованные сосуды.
Хотя
открытоугольная глаукома возникает,
как правило, в обоих глазах, у 80% больных
она протекает асимметрично; один глаз
поражается раньше, и заболевание его
протекает тяжелее, чем в другом глазу.
Дифференциальный
диагноз открытоугольной глаукомы
проводится с офтальмогипертензией и
заболеваниями с постепенным и
безболезненным снижением остроты
зрения.
Первичная
закрытоугольная глаукома
Заболеваемость
населения РФ первичной закрытоугольной
глаукомой (ПЗУГ) в 2-3 раза ниже, чем ПОУГ.
Женщины заболевают в 2 раза чаще, обычно
в возрасте старше 50 лет. В отличие от
ПОУГ, эту форму глаукомы диагностируют
практически сразу после ее возникновения.
Выделяют
три этиологических фактора: анатомическое
предрасположение, возрастные изменения
в глазу и функциональный фактор,
непосредственно обусловливающий
закрытие УПК. Анатомическое предрасположение
к заболеванию включает небольшие размеры
глазного яблока, гиперметропическую
рефракцию, мелкую переднюю камеру, узкий
УПК, крупный хрусталик, а также увеличение
его толщины в связи с набуханием,
деструкцию и увеличение объема
стекловидного тела. К функциональным
факторам относятся: расширение зрачка
в глазу с узким УПК, повышение продукции
ВВ, увеличение кровенаполнения
внутриглазных сосудов.
Основным
звеном в патогенезе ПЗУГ является
внутренний блок шлеммова канала –
закрытие УПК корнем радужки. Описаны
следующие механизмы такой функциональной
или относительной блокады (рисунок
15.10): плотное прилегание зрачкового
края к хрусталику создает зрачковый
блок и скопление ВВ в задней камере
глаза, что приводит к выпячиванию кпереди
корня радужки, где она наиболее
тонкая, и блокаде УПК; образующаяся при
расширении зрачка прикорневая складка
радужки закрывает фильтрационную зону
узкого УПК; разжижение или отслоение
заднего отдела стекловидного тела и
скопления жидкости в заднем сегменте
глаза может привести к смещению
стекловидного тела кпереди и возникновению
витреохрусталикового блока. При этом
корень радужки придавливается хрусталиком
к передней стенке УПК.
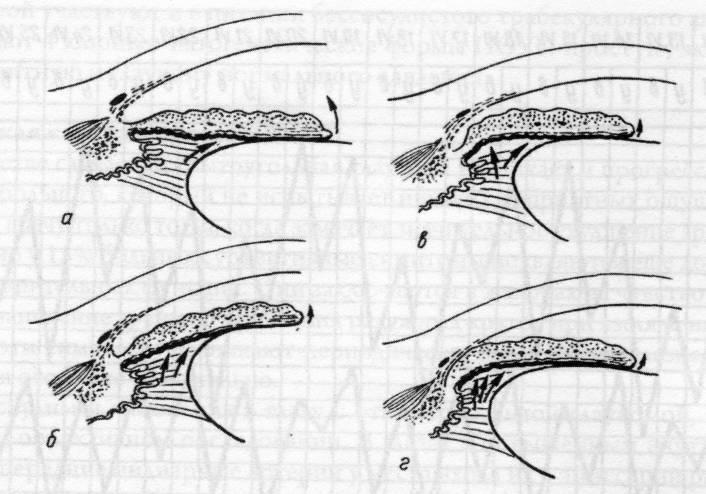
Рис.
15.10 – Положение корня радужки в углу
передней камеры:
а
– оптимальное; б, в – различная степень
зрачкового блока и бомбажа радужки; г
– блокада угла передней камеры корнем
радужки.
В
результате периодически возникающих
функциональных блоков происходит
образование спаек (гониосинехий) и
сращения корня радужки с передней
стенкой УПК. Происходит его облитерация.
Течение
болезни волнообразное, с приступами и
спокойными межприступными периодами.
Различают острые и подострые приступы
ПЗУГ.
Острый
приступ глаукомы возникает
под влиянием эмоциональных факторов,
при длительном пребывании (но без сна)
в темноте, при медикаментозном
расширении зрачка или без каких-либо
видимых причин. Больной жалуется на
боли в глазу и надбровной дуге,
затуманивание зрения и появление
радужных кругов при взгляде на источник
света. При резко выраженном приступе
могут появиться тошнота и рвота, а боли
иррадиируют в отдаленные органы (сердце,
область живота), что иногда служит
причиной грубых диагностических ошибок.
При осмотре глаза отмечают застойную
инъекцию, отек роговицы, мелкую
переднюю камеру, расширенный зрачок и
закрытый УПК при гониоскопии. ВГД
повышается до 40-60 мм рт. ст. В результате
странгуляции части сосудов развиваются
явления очагового или секторального
некроза стромы радужки с последующим
асептическим воспалением, образованием
задних синехий по краю зрачка, гониосинехий,
деформацией и смещением зрачка.
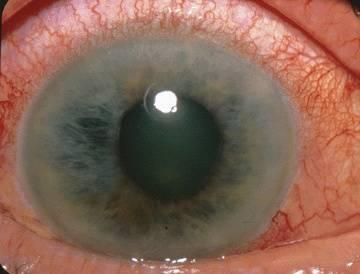
Острый
приступ глаукомы
Спонтанное
обратное развитие приступа, наблюдаемое
в некоторых случаях, связано с подавлением
секреции ВВ и ослаблением зрачкового
блока вследствие атрофии радужки в
зрачковой зоне и деформации зрачка.
Увеличивающееся количество гониосинехий
и повреждение ТА при повторных приступах
приводит к развитию хронической ЗУГ с
постоянно повышенным ВГД.
Подострый
приступ
протекает в более легкой форме, если
УПК закрывается не на всем протяжении
или недостаточно плотно. Больные жалуются
на затуманивание зрения и появление
радужных кругов. Болевой синдром выражен
слабо. При осмотре отмечается расширение
эписклеральных сосудов, легкий отек
роговицы и умеренное расширение зрачка.
После подострого приступа не происходит
деформации зрачка, сегментарной атрофии
радужки, образования задних синехий и
гониосинехий.
Острый
приступ глаукомы нужно дифференцировать
с острым иридоциклитом (табл. 15.2).
Таблица
15.2
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник


