Роговица из стволовых клеток
Мы уже неоднократно сообщали вам об успехах ученых в области использования стволовых клеток (если вам интересны подобные новости, то рекомендуем подписаться на наш Телеграм-канал). Однако испытания новой технологии на людях проходят не так уж и часто. При этом ученые разрабатывают все новые и новые методы применения стволовых клеток. И один из таких не только недавно успешно прошел первые испытания на человеке, но и может войти во врачебную практику в не самом далеком будущем. Речь идет о первой в истории пересадке искусственной роговицы, созданной из стволовых клеток.

Без роговицы наш орган зрения не может существовать
Почему роговица так важна?
Роговица (или радужная оболочка глаза) является крайне важным компонентом для восприятия нами окружающего мира. Это один из самых необходимых «элементов» глаза. Если говорить простыми словами, то роговая оболочка по сути является линзой. Если проводить аналогию с фотоаппаратом, то роговица — это объектив фотоаппарата. Роговица собирает и фокусирует в нужном направлении световые лучи, которые уже воспринимаются другими частями зрительного анализатора. Именно поэтому «выход из строя» роговой оболочки несет в себе опасность полной потери зрения.
Как стволовые клетки помогут восстановить зрение
Согласно сообщению журнала Nature, в ходе доклада на офтальмологической конференции в конце августа офтальмолог Коджи Нисида из Университета Осаки (Япония) заявил, что одна из его пациенток (имя которой не раскрывается) стала первым человеком в мире, которому восстановили роговицу с помощью перепрограммированных стволовых клеток. Доктор Нисида также сказал, что его пациентка страдала заболеванием, при котором клетки роговицы теряли прозрачность и отмирали. Это вызывает сначала «размытость» контуров и объектов, а затем и полную потерю зрения. Обычно для лечения подобных состояний используют донорскую роговицу, взятую у недавно умерших людей. Но в данном случае врачи решили поступить иначе.
Читайте также: Открыт новый вид клеток, который может спасти тысячи жизней. И это не стволовые клетки
Для того, чтобы вылечить женщину, Нисида и его команда использовали индуцированные плюрипотентные стволовые клетки (iPS-клетки). Это клетки, которые путем перепрограммирования клеток кожи переходят в эмбриональное состояние, из которого они могут затем трансформироваться в другие типы клеток. В том числе и в клетки роговой оболочки. Из iPS-клеток ученые вырастили новую роговицу, которую и пересадили пациентке. Сама операция была проведена в начале августа, но на реабилитацию потребовалось 3 недели, по истечении которых к женщине вернулось зрение. Сейчас ее зрению ничего не угрожает.
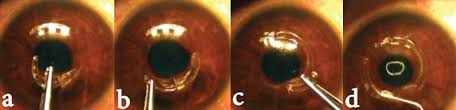
Этапы пересадки роговицы
Стоит заметить, что это не первый случай использования стволовых клеток японскими врачами. Ранее их применяли для лечения травм спинного мозга. Также ведутся работы в области лечения болезни Паркинсона. Что же касается данного случая, то после успешной операции Министерство здравоохранения Японии разрешило господину Нисиде опробовать процедуру еще на четырех добровольцах. Следующая операция планируется на конец этого года, а отработанная процедура, которую можно будет использовать для повсеместного лечения, согласно заявлению ученого, должна появиться через пять лет.
Источник

ʎɔ. / Flickr
Сотрудники Осакского университета впервые в мире провели человеку пересадку роговицы, основу которой составили потомки индуцированных плюрипотентных стволовых клеток (ИПСК), а не биоматериал погибших доноров, сообщает журнал Nature. Об этом рассказал главный автор работы, Кёдзи Нисида (Kohji Nishida), на пресс-конференции в Осакском университете 29 августа. Один из главных плюсов такого трансплантата — отсутствие в нем клеток иммунной системы и, как следствие, низкая вероятность отторжения.
Роговица — это прозрачная часть одной из оболочек глазного яблока, она служит для преломления света и образуется из клеток эпителия. К сожалению, довольно часто эта часть глаза травмируется либо биохимические процессы в эпителии роговицы нарушаются так, что это снижает ее прозрачность. Зрение при этом ухудшается, и ухудшение нередко прогрессирует.
Выход — менять роговицу на донорскую. Обычно трансплантаты берут у погибших людей. Новые роговицы неплохо приживаются, но все же существует риск, что организм реципиента отторгнет их, поскольку вместе с роговицами неизбежно пересаживается еще некоторое количество клеток чужой иммунной системы. Кроме того, наблюдается нехватка донорского материала: в Японии сейчас трансплантации ожидает около 1600 человек.
Офтальмологи из Осакского университета предложили способ увеличить количество доступных для пересадки роговиц с помощью индуцированных плюрипотентных стволовых клеток. Это нестволовые клетки, чаще всего фибробласты, которые прошли эпигенетическое перепрограммирование (то есть активность их генов была изменена) и благодаря нему вернулись в недифференцированное состояние, потеряв свою специализацию. Из ИПСК можно получать клетки различных типов, конечный результат зависит от того, какой смесью факторов дифференцировки на них действовали.
Эпителий роговицы, который получили из ИПСК донора, не содержит клеток иммунной системы этого донора, а значит, ниже вероятность отторжения такого трансплантата. Эксперименты на кроликах показали, что эта процедура улучшает зрение и не вызывает сильной реакции иммунитета. В данном случае животным пересаживали роговицы из человеческих ИПСК, то есть донор был даже другого вида.
Первым человеком-реципиентом роговицы, эпителий которой вырос из потомков индуцированных плюрипотентных стволовых клеток, стала гражданка Японии в возрасте около 40 лет. Она страдала от ретикулярной дисгенезии роговичного эпителия. Проще говоря, его клетки не обновлялись должным образом и поэтому не могли обеспечить достаточную прозрачность роговицы. 25 июля 2019 года в левый глаз пациентки пересадили тонкий слой ткани роговицы, полученный из ИПСК донора. 23 августа ее выписали из больницы. Сообщается, что зрение женщины с момента операции улучшилось.
Кёдзи Нисида ожидает, что трансплантат будет исправно работать до конца жизни пациентки, но, естественно, в ближайший год за ее самочувствием будут пристально следить. «Мы только начали работу с первым пациентом и находимся на таком этапе, когда нужно наблюдать [за состоянием реципиентов] очень внимательно», — сказал он. В то же время авторы исследования предполагают, что уже через несколько лет пересадка роговиц из потомков ИПСК получит широкое распространение.
Разрешение на использование ИПСК для создания трансплантатов роговицы Нисида получил в марте 2019 года. Тогда Министерство здравоохранения, труда и благосостояния Японии условно утвердило операции по пересадке роговиц из потомков индуцированных плюрипотентных стволовых клеток четырем добровольцам, которые страдают от дегенерации этой оболочки глаза. Также в этом году японское правительство одобрило создание химерных эмбрионов человека и животных.
Светлана Ястребова
Источник
 Японские ученые на недавней офтальмологической конференции заявили, что им удалось вырастить ткани роговицы глаза из перепрограммированных стволовых клеток. Искусственную оболочку успешно трансплантировали 40-летней пациентке, предотвратив у нее потерю зрения. Авторы метода уверяют, что в будущем он может стать альтернативой пересадке донорской роговицы, поскольку является более безопасным.
Японские ученые на недавней офтальмологической конференции заявили, что им удалось вырастить ткани роговицы глаза из перепрограммированных стволовых клеток. Искусственную оболочку успешно трансплантировали 40-летней пациентке, предотвратив у нее потерю зрения. Авторы метода уверяют, что в будущем он может стать альтернативой пересадке донорской роговицы, поскольку является более безопасным.
Роговицей называют наружную прозрачную оболочку глазного яблока, имеющую вид выпукло-вогнутой линзы. Будучи одной из светопреломляющих сред глаза, она пропускает световой поток и помогает фокусировать на сетчатке его разнонаправленные лучи. Ее нормальное функционирование обеспечивает реальность и качество восприятия глазом окружающего мира. В здоровом состоянии она способна самостоятельно регенерироваться, но при серьезных травмах или заболеваниях эта функция утрачивается.
Повреждения роговицы могут привести к частичной или полной потере зрения. Чтобы предотвратить ее, прибегают к трансплантации роговой оболочки. Чаще всего пересаживают ткани, полученные от умершего донора. Но число людей, нуждающихся в такой операции, существенно превышает объемы доступного донорского материала. В одной только Японии донорской роговицы ожидают более полутора тысяч человек.
Но даже для тех, кому повезло своевременно дождаться трансплантации, она не всегда становится решением проблемы. Нередко иммунная система реципиента отторгает чужие ткани – и тогда приходится все начинать заново: становиться в очередь на новые донорские ткани и надеяться, что на этот раз он благополучно приживется.
Революционное решение
Решить проблему нехватки донорской роговицы и снизить риск ее отторжения взялись ученые из Университета Осаки, которые предложили выращивать нужный биоматериал из стволовых клеток. Это так называемые недифференцированные клетки, которые могут превращаться в разные клетки организма – со свойственными им функциями. Одни из них способны дифференцироваться только в один тип клеток, другие – в несколько. Получают стволовые клетки из эмбрионов или пуповины новорожденных. У взрослого человека их основным источником является костный мозг; иногда их также выделяют из пульпы зуба.
Стволовые клетки успешно применяют в лечении самых разных заболеваний. Например, при некоторых видах рака крови они являются важным компонентом терапии. В настоящее время активно изучаются возможности стволовых клеток в лечении болезней Паркинсона и Альцгеймера, повреждений спинного мозга, рассеянного склероза.
Японские ученые использовали особый тип клеток – индуцированные плюрипотентные стволовые клетки. Это зрелые клетки соединительной ткани, которые методами генной инженерии перепрограммировали, вследствие чего они утратили специализацию и вернулись в эмбриональное состояние, вновь приобретя способность дифференцироваться в другие типы клеток, включая клетки роговицы.
В лабораторных условиях из этого материала вырастили лоскуты новой роговицы, одним из главных преимуществ которой, отмечают ученые, является отсутствие иммунных клеток донора, что в разы снижает риск отторжения после трансплантации реципиенту.
Полученный новым методом биоматериал сначала пересадили лабораторным кроликам с повреждениями роговой оболочки. После операции исследователи констатировали у них значительное улучшение зрения. Реакция отторжения была крайне низкой, и это притом, что животным трансплантировали роговичные лоскуты, выращенные из стволовых клеток человека, то есть донора другого вида.
После того как технология показала полную безопасность в испытаниях на кроликах, ее разработчики получили разрешение японского Минздрава опробовать ее на людях. На эксперимент согласилось несколько добровольцев. Первой, кому была проведена пересадка искусственной роговицы, стала сорокалетняя японка с редким заболеванием эпителия роговой оболочки левого глаза. При этой патологии клетки роговицы почти не обновляются, из-за чего она постепенно темнеет – человек начинает видеть предметы размыто и со временем полностью теряет зрение.
Операцию по трансплантации тканей роговой оболочки, полученных с помощью новой технологии, пациентке провели еще в конце июля. Через месяц, когда женщина полностью восстановилась после вмешательства, врачи проверили у нее зрение на прооперированном глазу, отметив его существенное улучшение. Роговица очистилась и стала прозрачной, вследствие чего пациентка снова стала хорошо видеть. Что важно, никаких побочных реакций после пересадки зафиксировано не было.
Сейчас ученые продолжают внимательно следить за ее состоянием, чтобы оценить долгосрочную эффективность и безопасность новой методики. Они надеются, что новая роговица будет исправно функционировать до конца жизни женщины. Параллельно в рамках клинических испытаний своей методики они готовятся провести аналогичную операцию еще трем добровольцам с серьезными заболеваниями роговой оболочки, грозящими потерей остроты зрения или полной слепотой. Ближайшая трансплантация запланирована на конец этого года.
В случае успешного завершения испытаний, технология будет доступна для применения в клинической практике в течение пяти лет, отмечают японские исследователи.
Источник
Итальянские стволовые клетки
Александра Брутер, Полит.ру
Значимое событие произошло в феврале в области лечения стволовыми клетками. Раньше в массовой терапии использовались только стволовые клетки крови. Теперь впервые регулирующий орган европейской страны одобрил коммерческое применение другого типа стволовых клеток для лечения больных людей.
Стволовые клетки крови использовались уже давно: пересадка костного мозга, проводимая людям с пролиферативными заболеваниями (раком) крови или людям, – это и есть замещение собственных стволовых клеток крови пациента на донорские клетки. Прогресс этого метода связан, в основном, с двумя вещами: более тщательным подбором доноров и разработкой методик выращивания большого количества стволовых клеток из небольшого. В частности, у донора сейчас берут уже не костный мозг, а кровь из вены, в крови находят стволовые клетки и их размножают.
Клетки крови недолго живут и часто обновляются. Поэтому у стволовых клеток крови пролиферативный потенциал (то есть способность делиться) выше, чем у других клеток, и для них задача интенсивного размножения в культуре была решена раньше всех.

Новый терапевтический метод зарегистрирован под названием Холоклар (Holoclar). Интервью с его автором, итальянкой Грациеллой Пеллегрини опубликовал журнал Nature (Alison Abbott, Behind the scenes of the world’s first commercial stem-cell therapy). Холоклар предназначен для лечения слепоты, возникшей из-за ожога.
На внешней поверхности глаза находится роговица. Она прозрачна, снаружи выпукла, а если смотреть изнутри глаза – вогнута. Роговица играет роль собирающей линзы, на нее приходится примерно две трети всей оптической силы глаза. Роговица частично состоит из живых клеток, а частично из высокомолекулярных белков матрикса: коллагена, ламинина и т.п. Чтобы роговица оставалась прозрачной, гладкой и здоровой, ее клетки должны обновляться. Обновляются клетки за счет деления стволовых клеток, находящихся в специальной нише – лимбе роговицы. Лимб – это тонкая полоса, проходящая по границе роговицы и белковой оболочки – склеры (часто называемой глазным белком).

Рисунок из Википедии – ВМ
Когда лимб поврежден, например, из-за ожога, белок начинает нарастать на роговицу, в роговицу прорастают сосуды, она утрачивает прозрачность, начинается воспаление, и человек в результате может утратить зрение, да и воспаление часто становится хроническим. Поправить положение могли бы стволовые клетки, если бы смогли снова заселить лимб в нужном количестве.
Иногда оказывается так, что не все стволовые клетки погибли, но оставшихся слишком мало, чтобы справиться с задачей. Именно таким клеткам могут помочь врачи. Для успеха авторам методики хватает неповрежденного фрагмента лимба размером 1 на 2 мм (диаметр роговицы равен примерно 10 мм, значит, длина границы, на которой находится лимб, составляет примерно 30 мм, ширина лимба – 1-1,5 мм, то есть достаточно всего нескольких процентов).
Оставшийся неповрежденным фрагмент культивируется на подложке из модифицированного фибрина – полимера, участвующего в свертывании крови и формировании тромба. Фибрин обладает двумя нужным свойствами: он жесткий, то есть, выращенные клетки можно будет на такой подложке перенести в глаз и трансплантировать, и он сам деградирует через некоторое время после трансплантации; для деградации фибрина у организма есть специальные методы, поскольку часто приходится растворять отслужившие свое тромбы.
Подбор среды для выращивания клеток позволяет им размножаться гораздо быстрее, чем они размножались бы в естественных условиях при постоянном воспалительном процессе. Готовым к трансплантации авторы методики считали фрагмент, содержащий 3000 стволовых клеток.
Авторы разработки говорят, что только в Европе каждый год в результате несчастных случаев у них появляется около тысячи новых пациентов: людей, пострадавших от ожогов, но сохранивших часть лимба неповрежденной.
Судьба изобретения складывалась очень непросто. Его авторы – итальянцы, и работали они в Италии. В Италии биомедицинские научные разработки поддерживают мало, и ученым приходилось непросто. Грациелла Пеллегрини и Мишель де Лука начали работать над этой темой еще в 1990 году в Женеве. В 1996 году они перебрались в католический госпиталь в Риме, но там были не слишком заинтересованы в превращении фундаментальных разработок в лекарство для людей, и авторы отправились в Венецию. В 1997 году исследователи опубликовали первые результаты: они применили технологию к первым двум полностью ослепшим пациентам, и к ним вернулось зрение. Хотя на пути к массовому клиническому применению авторы преодолели множество сложностей, они не сдались, хотя многие другие ученые наверняка бы решили, что это занятие не для них, и лучше они переключатся на решение какой-нибудь другой фундаментальной задачи. На вопрос «Почему?» Грациелла Пеллегрини в интервью ответила, что, во-первых, дело в ее итальянском характере, а, во-вторых, она видела, как к людям после 20 лет слепоты возвращается зрение. Как после этого остановиться?
В 2008 году в Модене был организован Центр регенеративной медицины Стефано Феррари, и исследование заканчивалось уже там. В 2010 году было опубликовано уже более масштабное исследование (Rama et al., Limbal stem-cell therapy and long-term corneal regeneration // N Engl J Med., 2010), включавшее 112 пациентов. К 86 пациентам вернулось зрение, еще у нескольких наступили частичные улучшения.
Прежде чем метод лечения стало можно массово использовать, ученым пришлось решить довольно много отдельных задач. В частности, выяснилось, что с области лимба есть разные стволовые клетки, и не каждое их соотношение гарантирует успех при трансплантации. В ходе исследования выяснилось, что нужные стволовые клетки могут быть обнаружены по наличию в них белка p63. Этот белок регуляторный, он запускает синтез в клетке определенных белков и необходим для поддержания клеток в состоянии стволовости. Клетки, в которых этот белок был, оказались необходимы для восстановления зрения. Когда среди пересаживаемых клеток было больше 3% клеток, несущих белок, 78% трансплантаций вели к восстановлению зрения, а, когда меньше 3% – около 11%.
Еще одна задача, на решение которой ушло много времени – это создание подложки для выращивания клеток, обладающей необходимыми свойствами. Первые подложки были слишком хрупкими, и с трансплантацией возникали проблемы.
Примечательна эта история не только с научной точки зрения (с научной точки зрения вопрос решен публикацией 2010 года), а как пример взаимодействия науки и общества.
Здесь науке было что предложить обществу, но вся отрасль находится на такой ранней ступени развития, что механизмы такого предложения вообще не разработаны. Общество хочет быть уверено, что научная новинка и безопасна, и полезна. В 2007 году в Евросоюзе были приняты новые стандарты для разрабатываемых терапевтических методов. Последние семь лет авторы работы провели в непрерывном общении с соответствующими регулирующими органами, доказывая, что их методики безопасны и воспроизводимы – то есть всех больных лечат одинаково. Итальянские ученые – первые, кому удалось преодолеть всю эту процедуру и получить одобрение регулирующих органов на использование своих клеточных технологий. Возможно, их последователям будет легче, но даже для обычных только что разработанных лекарств, представляющих из себя химическое вещество, этот процесс может занять десяток лет.
Хотя Италия и в минимальной степени по европейским меркам поддерживает развитие биотехнологической отрасли, там время от времени происходят довольно знаковые для отрасли события, как положительные, так и отрицательные.
В Италии разворачивается (и, мы надеемся, вошел в заключительную фазу) громкий скандал вокруг фонда Стамина (Stamina Foundation). Фонд был основан доктором Давидом Ваннони в 2009 году и занимался, по сути, шарлатанством, предлагая (естественно, не бесплатно) стволовые клетки как лекарство от всех болезней. В основном они лечили от нейродегенеративных заболеваний мезенхимальными стволовыми клетками. Мезенхимальные стволовые клетки легко получить, например, из жировой ткани. Авторы утверждали, что эти клетки превращаются в нейроны и сами встраиваются в нужные места. Ни безопасность, ни даже эффективность их «лекарств» никогда не была доказана, доктор Ваннони никогда не публиковал ничего похожего в рецензируемых журналах. Но у фонда было много сторонников, организовывались даже демонстрации в поддержку.
В 2013 году под действием научной и медицинской общественности итальянское правительство, наконец, инициировало клинические испытания метода, и в августе 2014 года суд города Турина постановил конфисковать оборудование и клетки из лабораторий Стамины.
Другое событие, связанное с биотехнологией и произошедшее в Италии окрашено положительно. В 1992 году здесь состоялись одни из первых клинических испытаний генной терапии врожденного генетически обусловленного иммунодефицита. Дети, рожденные с такой болезнью, вынуждены жить в полной изоляции и почти стерильных условиях. Любая встреча с инфекцией для них чревата смертью. Испытания оказались успешными.
Портал «Вечная молодость» https://vechnayamolodost.ru
10.03.2015
Источник


