Ретиналамин для лечения глаукомы
Резюме
Цель: оценить эффективность 10-дневного курса лечения Ретиналамином при внутримышечном введении у пациентов с компенсированной ПОУГ в амбулаторной практике.
Цель: оценить эффективность 10-дневного курса лечения Ретиналамином при внутримышечном введении у пациентов с компенсированной ПОУГ в амбулаторной практике.
Методы: в исследование включали пациентов с ПОУГ I–III стадий с компенсированным уровнем внутриглазного давления (ВГД). Ретиналамин назначался по 5 мг внутримышечно в течение 10 дней. Весь период наблюдения составил 3 мес. Проводилось комплексное обследование при скрининге, через 10 дней, 1 и 3 мес. после начала лечения, включавшее оценку остроты зрения, тонометрию по методу Маклакова, периметрию и офтальмоскопию.
Результаты: проводился анализ данных 453 анкет (453 пациента с ПОУГ, 453 глаза). Улучшение показателей (острота зрения, поле зрения, ВГД) после курса Ретиналамина происходит в течение 3-х мес. Наибольшая эффективность нейропротекторной терапии была зафиксирована у пациентов с I и II стадией ПОУГ.
Заключение: полученные достоверные результаты исследования позволяют рекомендовать назначение Ретиналамина у пациентов с глаукомой I–III стадий. Причем для повышения эффективности и увеличения длительности сохранения эффекта лечения нейропротекторная терапия должна быть начата в наиболее ранние сроки после стабилизации ВГД.
Ключевые слова: глаукома, нейропротекторная терапия, нейропептиды, Ретиналамин.
Abstract
Effect of Retinalamin usage in patients with compensated primary open-angle glaucoma
Egorov Е.A., Egorоva T.E., Shramko Yu. G.
Department of Ophthalmology named after acad. Nesterov A.P. of medical faculty
Russian National Research Medical University named after N.I. Pirogov, Moscow
Purpose: to evaluate the effect of 10 day course of Retinalamin administered intramusculary in patients with compensated POAG in outpatient departments.
Methods: patients with POAG of I-III stages with compensated level of IOP were enrolled into the study. Retinalamin was prescribed by 5 mg intramusculary to all patients during 10 days. Follow up lasted 3 months. Complex examination including visual acuity assessment, tonometry by Maklakov, perimetry and ophthalmoscopy was carried out.
Results: data of 453 patients (453 eyes) was included into the final analysis. Improvement of evaluated indices (visual acuity, eye field condition, IOP level) was being observed during 3 months. The effect of the therapy was mostly evident in patients with I — II stages of POAG.
Сonclusion: obtained data allow recommending Retinalamin prescription in patients with glaucoma of I-III stages. Neuroprotectve therapy should be prescribed in the early period after normalizatin of IOP level in order to increase and prolong the effect.
Key words: glaucoma, neuroprotective therapy, neuropetides, Retinalamin.
Три основных звена глаукоматозного процесса — механическое (повышение ВГД), дисциркуляторное (нарушение кровообращения) и метаболическое — являются определяющими для выбора направления лечения глаукомы. Таким образом, снижение повышенного уровня офтальмотонуса, коррекция общих и местных гемоциркуляторных и метаболических нарушений считаются патогенетически обоснованными подходами к терапии данного заболевания [1, 2].
В последние годы терапевтические мероприятия, направленные на предотвращение гибели нейрональных клеток, приобретают все большее значение. В основе изменений тактики лечения лежат результаты мультицентровых международных исследований, свидетельствующие о том, что даже при эффективном снижении ВГД возможно дальнейшее прогрессирование функциональных глаукоматозных нарушений [3, 5]. Комплекс мер, целями которого являются уменьшение дальнейшей дистрофии аксонов и сохранение структуры неповрежденных нейрональных клеток, носит название «нейпротекция». Причем клеточные изменения при глаукоме не сводятся только к глаукомной оптической нейропатии – в патологический процесс вовлечены и клетки сетчатки [2]. Таким образом, нейрональные изменения скорее попадают под определение «глаукомная нейроретинопатия», а терапевтические подходы к лечению следует рассматривать более комплексно – как нейроретинопротекцию.
Эффективность нейроретинопротекторной терапии глаукомы может быть оценена только при условии компенсации уровня ВГД [3, 6].
В настоящий момент более пристальное внимание обращено к нейропротекторным препаратам прямого действия. Данная группа препаратов осуществляет свое действие за счет непосредственного влияния на нейроны сетчатки и волокна зрительного нерва, блокируя основные факторы повреждения клеток, обусловленные ишемией. Так как эти препараты оказывают действие на основные звенья патогенеза глаукомы, то они могут быть назначены любому пациенту с глаукомой с компенсированным ВГД. Однако следует внимательно отнестись к выбору препарата. Впервые фармакологические критерии выбора препарата для нейропротекции были сформулированы Wheeler L.A. еt al. в 2001 г. [7]. Эффективный препарат для нейропротекции должен характеризоваться наличием специфических точек приложения в сетчатке, нейропротективной активности в отношении ганглионарных клеток сетчатки, достижением сетчатки и стекловидного тела в терапевтических концентрациях, наличием доказательной базы в виде результатов рандомизированных контролируемых клинических исследований.
Препараты пептидной структуры в группе прямых нейропротекторов обращают на себя внимание выраженностью тканеспецифического действия [8]. Пептиды отличаются отсутствием токсичности, аллергенности, иммуногенности, канцерогенности и тератогенности, проявляют свой эффект как при монотерапии, так и в сочетании с другими методами лечения.
К препаратам пептидной структуры, соответствующим фармакологическим критериям, приведенным выше, относят Ретиналамин. Основные эффекты Ретиналамина – это предотвращение окислительного стресса и эксайтотоксичности за счет коррекции нарушений клеточного метаболизма. У пациентов с глаукомой назначение Ретиналамина приводило к достоверному увеличению средней толщины ретинальных нервных волокон, усилению активности мюллеровских клеток, объективному улучшению центрального зрения, уменьшению количества и глубины скотом [9–11]. Также отмечались положительная динамика электрофизиологических показателей и увеличение толерантности зрительного нерва к повышенной нагрузке в начальной, развитой и далеко зашедшей стадиях глаукомы [12].
Согласно инструкции по применению, Ретиналамин может вводиться парабульбарно или внутримышечно.
Для получения дополнительных данных об эффективности препарата Ретиналамин при внутримышечном введении в период с ноября 2013 г. по май 2014 г. было проведено всероссийское скрининговое исследование эффективности применения Ретиналамина у пациентов с компенсированной ПОУГ. Целью работы являлась оценка эффективности 10-дневного курса лечения Ретиналамином при внутримышечном введении у пациентов с компенсированной ПОУГ в амбулаторной практике.
Методы
В исследование включали пациентов с ПОУГ I–III стадий с компенсированным уровнем ВГД. Ретиналамин вводился всем пациентам по 5 мг внутримышечно в течение 10 дней. Общий период наблюдения составил 3 мес. В течение этого времени протокол исследования предусматривал 4 контрольных осмотра пациентов: скрининговый визит (0), через 10 дней после начала лечения (визит 1), через 1 мес. (визит 2) и через 3 мес. (визит 3). Во время визита 0, 2-го и 3-го визитов проводилось комплексное обследование пациента, включавшее оценку остроты зрения, тонометрию по методу Маклакова с последующим пересчетом значений тонометрического ВГД в истинное, периметрию на аппарате «Периком» с оценкой полей зрения по 8 меридианам и суммы показателей полей зрения по 8 меридианам и офтальмоскопию с оценкой диаметра экскавации диска зрительного нерва. Во время 1-го визита оценивали только 3 показателя: остроту зрения с коррекцией, остроту зрения без коррекции, уровень ВГД.
Оценка значимости различия показателей остроты зрения с коррекцией и без коррекции, ВГД, а также полей зрения по 8 меридианам в динамике осуществлялась с помощью дисперсионного анализа и, в частности, критерия LSD (Liqt Square Difference) Фишера [13, 14].
Результаты и обсуждение
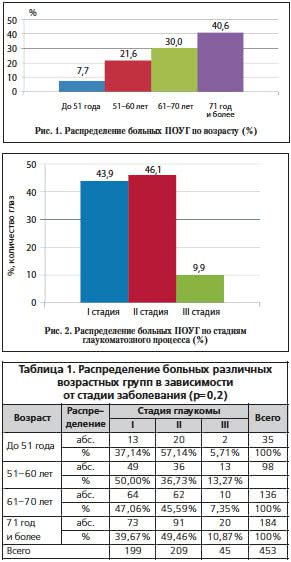
После скринингового исследования диагноз ПОУГ был подтвержден у 453 пациентов (453 глаза). В исследовании участвовали пациенты в возрасте от 28 до 89 лет, средний возраст больных составил 66,4±0,5 года (рис. 1).
У основного количества пациентов (199 глаз, 43,9% и 209 глаз, 46,1%) был диагноз ПОУГ I и II стадий соответственно. Наименьшее количество включенных в исследование пациентов было с диагнозом ПОУГ III стадии (45 глаз, 9,9%) (рис. 2).
При анализе данных распределения по возрасту и стадиям заболевания, а также в зависимости от наличия сопутствующих заболеваний не было выявлено статистически значимой связи между изучаемыми показателями (p=0,2 и p=0,6 соответственно) и, следовательно, их взаимного влияния (табл. 1, 2).
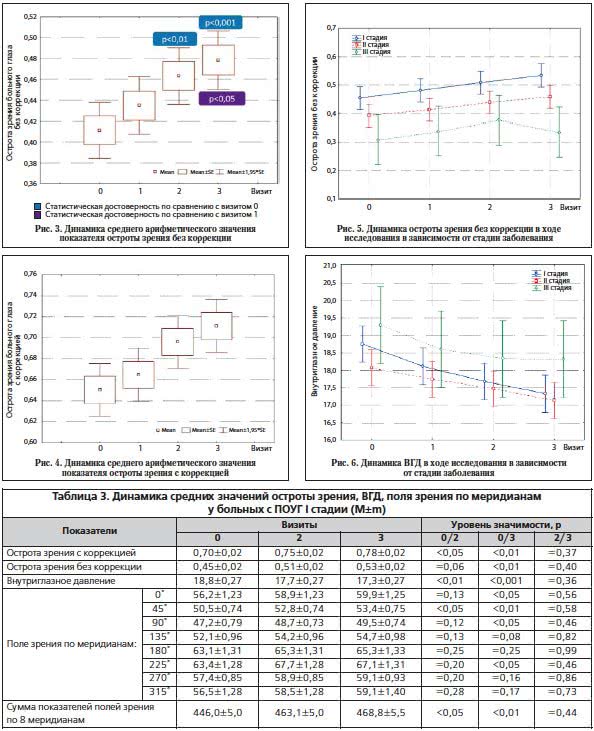
Отмечено достоверное увеличение остроты зрения с коррекцией и без таковой в течение всех 3-х мес. наблюдения. Так, острота зрения без коррекции до лечения составила 0,41±0,01 и 0,48±0,01 во время 3-го визита (р<0,001). При оценке остроты зрения с коррекцией наблюдались устойчивое увеличение показателя ко 2-му визиту и сохранение этих положительных значений к 3-му мес. исследования. Так, на визите 0 среднее значение остроты зрения с коррекцией было 0,65±0,01, во время 3-го визита – 0,71±0,01 (р<0.01) (рис. 3, 4). При анализе динамики остроты зрения в зависимости от стадии ПОУГ отмечено достоверное повышение ее значений у пациентов с I и II стадиями заболевания. У больных с I стадией ПОУГ разница между уровнем ВГД на визитах 0 и 3 составила 0,08 мм рт. ст. (р<0,01), у пациентов со II стадией ПОУГ – 0,07 мм рт. ст. (р<0,05). У пациентов с III cтадией глаукомы не наблюдалось достоверного увеличения остроты зрения (рис. 5).
Динамика показателей ВГД также была положительной для больных с I и II стадиями ПОУГ с высокой степенью достоверности (р<0,001 и р<0,05 соответственно). У пациентов с III стадией ПОУГ снижение ВГД не было статистически значимым (рис. 6).
В отношении показателя ВГД наблюдалась тенденция к снижению его уровня. При скрининге среднее значение ВГД составляло 18,5±0,20 мм рт. ст., через 1 мес. – 17,7±0,16 (р<0,001), через 3 мес. – 17,3±0,16 (р=0,23).
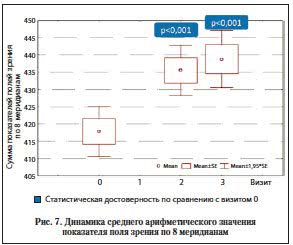
При оценке данных периметрии было зарегистрировано наиболее выраженное изменение суммы показателей полей зрения по 8 меридианам. Увеличение данного показателя было достоверным (р<0,001). На скрининговом визите сумма показателей была равна 417,8±3,7, во время 3-го визита – 438,8±4,2 (рис. 7).
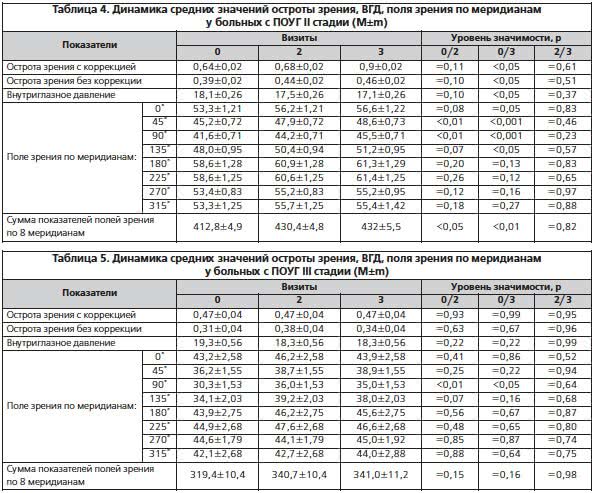
В целом в результате исследования эффективности препарата Ретиналамин у больных с различными стадиями ПОУГ установлена достоверная (p<0,05, 95% доверительные интервалы не перекрываются или перекрываются менее чем на 1/3) положительная динамика большинства изученных показателей ко 2-му визиту (через 1 мес. от начала терапии) у больных с I и II стадиями заболевания (табл. 3–5).
Данные исследования свидетельствуют об устойчивой тенденции улучшения показателя остроты зрения как с коррекцией, так и без коррекции и снижении уровня ВГД уже через 10 дней от начала курса терапии. Вышеуказанные показатели, а также динамика показателей полей зрения по большинству меридианов (ко 2-му визиту) через 1 мес. от начала терапии демонстрировали достоверную (p<0,05) положительную динамику с устойчивой их стабилизацией (p>0,05) к последнему визиту (через 3 мес. от начала терапии).
Выводы
В результате анализа результатов исследования было установлено, что применение препарата Ретиналамин при ПОУГ в течение 10 дней внутримышечно обеспечивает:
• увеличение остроты зрения на всех сроках наблюдения;
• снижение показателей ВГД на всех сроках наблюдения в рамках нормальных значений;
• расширение границ поля зрения через 1 и 3 мес. после 10-дневного курса лечения;
• стабилизацию изученных показателей на всех стадиях глаукомы;
• улучшение показателей (острота зрения, поле зрения, ВГД) после курса Ретиналамина) происходит в течение 3-х мес.;
• наибольшая эффективность нейропротекторной терапии была зафиксирована у пациентов с I и II стадиями ПОУГ.
Заключение
Результаты исследования эффективности нейропротекторного лечения препаратом Ретиналамин позволяют рекомендовать его назначение пациентам с глаукомой I–III стадий с компенсированным уровнем ВГД.
Для повышения эффективности и увеличения длительности эффекта лечения нейропротекторная терапия должна быть начата в наиболее ранние сроки после стабилизации ВГД.
Ретиналамин отвечает всем современным требованиям к фармакологическим критериям выбора нейропротекторов в офтальмологии.

Литература
1. Егоров Е.А., Астахов Ю.С, Ставицкая Т.В. Офтальмофармакология: рук-во для врачей. 3 изд., испр. и доп. М.: ГЭОТАР-Медиа, 2009.555 с.
2. Глаукома. Национальное руководство / под ред. Е.А. Егорова. М.: ГЭОТАР-Медиа, 2013. С. 95.
3. Егоров Е.А., Егоров А.Е., Брежнев А.Ю. Нейропротекторная терапия глаукомы: Метод. рекомендации. М.: Апрель, 2012. С. 4–10. 4. EGS Terminology and Guidelines for Glaucoma (3rd edition). Italy, DOGMA, 2008. P. 14–21.
5. Weinreb R.N., Gupta N., Girkin C, Goldberg I. Toronto, Ont: International Ocular Neuroprotection symposium; 2006. Workshop breakout group.
6. Sushil K. Vasudevan, Gupta V., Crowston J.G. Neuroprotection in glaucoma // Indian J. Ophthalmol. 2011. Vol. 59 (Suppl. 1). P. 102–113.
7. Wheeler L.A., Gil D.W., Woldemussie E. Role of alpha-2 adrenergic receptors in neuroprotection and glaucoma // Surv. Ophthalmol. 2001. Vol. 45. Suppl. 3. P. 290–296.
8. Хавинсон В.Х., Трофимова С.В., Хокканен В.М. Предварительные результаты применения пептидных биорегуляторов у больных диабетической ретинопатией // Офтальмол. журн. 1998. № 5. С. 393–398.
9. Астахов Ю.С., Бутин Е.В., Морозова Н.В. и др. Результаты применения ретиналамина у больных с первичной открытоугольной глаукомой // Глаукома. 2006. № 2. С. 43–47.
10. Нероев В.В., Еричев В.П., Ловпаче Д.Н. Пептиды в нейропротекторной терапии больных первичной открытоугольной глаукомой с нормализованным офтальмотонусом // Ретиналамин. Нейропротекция в офтальмологии / под ред. И.Б. Максимова, В.В. Нероева. 2007. № 6. С. 32–37.
11. Алексеев В.Н., Козлова Н.В. Применение Ретиналамина у больных с первичной открытоугольной глаукомой // Глаукома. 2013. № 1. C. 49–52.
12. Астахов Ю.С., Бутин Е.В., Морозова Н.В., Соколов В.О. Оценка нейропротекторного действия ретиналамина в лечении больных с первичной открытоугольной глаукомой // Ретиналамин. Нейропротекция в офтальмологии. 2007. C. 38–46.
13. Шеффе Г. Дисперсионный анализ / пер. с англ. М.: Физматгиз, 1980. 626 с.
14. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ Statistica. М.: Медиа Сфера, 2002. 312 с.
15. Юнкеров В.И., Григорьев С.Г., Резванцев М.В. Математико-статистическая обработка данных медицинских исследований. 3-е изд., доп. СПб.: ВМедА, 2011. 318 с.
Источник
Оренбуркина О.И., Бабушкин А.Э.
ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа
Снижение внутриглазного давления (ВГД) у больных глаукомой не всегда приводит к стабилизации зрительных функций, даже несмотря на достаточно низкие цифровые показатели. В связи с этим весьма важным является поиск новых путей лечения первичной глаукомы. Речь идет, главным образом, о путях сохранения волокон зрительного нерва или, как принято говорить, о нейропротекторном лечении [7,9,12,13].
Некоторый оптимизм в проблеме нейропротекторного лечения глаукомы обусловлен появлением препаратов, получивших название цитомедины, или пептидные биорегуляторы. Термин «цитомедины» был предложен В. Г. Морозовым и В. Х. Хавинсоном в 1983 г. Данные препараты, полученные из различных тканей с помощью метода кислотной экстракции, обладают способностью индуцировать дифференцировку в популяции клеток, являющихся исходным материалом для их получения. Иными словами, после экзогенного введения данных полипептидов происходит выброс эндогенных пептидов, для которых введенный пептид был индуктором [6, 9].
Известно, что Ретиналамин содержит 5 мг активных пептидов сетчатки глаза телят или свиней и 17 мг глицина (как стабилизатора). Ретиналамин регулирует процессы метаболизма в сетчатке, стимулирует функции клеточных элементов, способствует улучшению функционального взаимодействия пигментного эпителия и наружных сегментов фоторецепторов, усиливает активность ретинальных макрофагов, оказывает нормализующее влияние на коагуляцию крови, обладает выраженным протекторным свойством в отношении сосудистого эндотелия [1, 10].
В 2002 году на базе кафедры офтальмологии РГМУ г. Москвы совместно с ООО «ГЕРОФАРМ» (г. Санкт-Петербург) проведены исследования и опубликованы результаты терапевтической эффективности препарата ретиналамин у больных глаукомой с компенсированным офтальмотонусом.
Шилова Т. Ю. [14] оценила эффективность операции коллагенопластики склеры заднего отрезка 37 глаз у пациентов с компенсированной открытоугольной глаукомой II-III стадий в комбинации с применением препарата ретиналамин. Такой комбинированный метод, по мнению автора, позволяет улучшить биохимические свойства склеры и гемодинамику, а насыщение пористой структуры ксенопласта раствором ретиналамина и создание депо препарата оказывает выраженное и пролонгированное нейропротекторное действие. Так, в 78,4 % случаев через 3 месяца после оперативного лечения было отмечено расширение полей зрения и почти в 40 % — улучшение остроты зрения (на 0,1–0,2), а у 27 % больных — уменьшение площади экскавации ДЗН.
Шмырева В. Ф. и Мостовой Е. Н. [15] изучили нейропротекторную эффективность 518 прямых операций на склеральном канале зрительного нерва (СКЗН) при глаукоме в сочетании с клеточной терапией в сроки до 2 лет. Все больные имели нормальное ВГД. Аутологичные активированные лейкоциты в виде суспензии клеток в сыворотке крови вводили в область дисцизии СКЗН (0,1–0,2 мл). В отдаленные сроки после указанного лечения авторы наблюдали расширение или стабилизацию границ периферического поля зрения, повышение перфузионного давления, уменьшение глубины и площади экскавации ДЗН.
По мнению Якубовой Л. В. с соавт. [16], основные проблемы, препятствующие широкому распространению нейропротекторной стратегии при лечении больных глаукомой заключаются в том, что до сих пор не установлены точные механизмы, запускающие нейродегенеративные процессы при данном заболевании; не доказана связь результатов экспериментальных исследований in vitro и на модели у животных с заболеванием человека; затруднен выбор основного конечного показателя эффективности лечения; нет убедительных рандомизированных клинических исследований того, что нейропротекторная терапия может быть полезной при глаукоме.
Баранов В. И. с соавт. [5] оценили безопасность и эффективность различных способов введения ретиналамина (имплантация коллагеновой губки, пропитанной препаратом, ретробульбарная катетеризация и парабульбарные инъекции) в комплексном лечении псевдоэксфолиативной глаукомы. Авторы установили, что все три изученные способа введения ретиналамина безопасны, но наилучшие количественные показатели расширения полей зрения отмечались при субтеноновой имплантации коллагеновой губки и ретробульбарной катетеризации.
Полученные Аширматовой с соавт. данные свидетельствуют об эффективности комплексного лечения (антиглаукоматозная операция + традиционная медикаментозная терапия в сочетании с использованием ретиналамина и лимфотропной терапии — анестетик, антиоксидант и метаболик — в область крылонебной ямки и сосцевидного отростка) первичной открытоугольной глаукомы и позволяет добиться стабилизации зрительных функций у больных в развитой и далекозашедшей стадиях заболевания [4].
В исследованиях Нероева В. В. с соват. [11] отмечено, что наиболее эффективным можно считать комбинированное (внутримышечное и парабульбарное по 5 мг.) и местное (только парабульбарное по 5 мг) введение препарата, при этом зафиксирована хорошая общая и местная переносимость препарата, а также отмечено, что повторный курс лечения целесообразно проводить через 6–12 мес.
Астахов Ю. С. с соавт. [3] объективными электрофизиологическими исследованиями доказали, что препарат ретиналамин обладает нейропротекторным действием (увеличивает толерантность зрительного нерва к повышенной нагрузке) в начальной, развитой и далекозашедшей стадиях глаукомы. Проведенный анализ структурных изменений зрительного нерва (ЗН) (по данным HRT II) показал достоверное увеличение средней толщины ретинальных нервных волокон, достоверное повышение остроты зрения, уменьшение абсолютных скотом в группах пациентов, получавших ретиналамин в начальной и развитой стадиях глаукомы. В далекозашедшей стадии прослеживалась только положительная динамика изученных показателей полей и остроты зрения от начала лечения.
Алексеев В. Н. с соавт. [2] в своих исследованиях отмечают, что максимальный эффект зарегистрирован при субтеноновом введении ретиналамина. Авторы рекомендуют начинать нейропротекторное лечение с момента постановки диагноза ПОУГ и проводить курсы не реже 1 раза в год.
Проблема коррекции метаболических нарушений, вызванных как самой глаукомой, так и перепадом давления в ходе фистулизирующих операций, а также послеоперационной гипотонией, остается повседневной. При любом патологическом процессе происходит нарушение регуляции переноса информационных молекул между клетками, поэтому усиление синтеза регуляторных пептидов в самом организме, а также введение их извне может способствовать восстановлению утраченных функций [2].
Каменских Т. Г. с соавт. [8] отметили, что ретиналамин эффективен в лечении больных ПОУГ как в условиях нормального офтальмотонуса, так и в сочетании с фистулизирующими операциями при повышенном ВГД. Авторами установлено повышение амплитуды пика Р100 корковых зрительных вызванных потенциалов в результате лечения ретиналамином, что свидетельствует об активации работы зрительной системы в целом.
Бутин Е. В. в своей диссертационной работе доказал, что парабульбарные инъекции Ретиналамина (по данным вакуум-компрессионной пробы с контролем ЗВКП) по 5,0 мг в сутки в течение 10 дней целесообразно применять для улучшения функциональной активности ганглиозных клеток сетчатки и их аксонов у пациентов с ПОУГ в начальной, развитой и далекозашедшей стадиях глаукомы [7].
Выводы. Высокая клиническая эффективность терапии свидетельствует о том, что назначение пептидных препаратов является не только оправданным, но и необходимым. Следует отметить, что в одних случаях пептиды используются изолированно, а в других — должны применяться в комплексном традиционном лечении. Данный подход позволяет улучшить результаты как консервативного, так и хирургического лечения больных с глаукомой, снизить частоту рецидивов и осложнений, а также увеличить продолжительность ремиссии.
Источник


