Псевдоэксфолиативная глаукома причины возникновения
 Псевдоэксфолиативной глаукомой (ПЭГ), принято называть достаточно распространенную разновидность открытоугольной глаукомы, которая сопровождается развитием тяжелых дистрофических изменений в средах глаза со скоплением в зоне хрусталика и ресничного тела белых отложений.
Псевдоэксфолиативной глаукомой (ПЭГ), принято называть достаточно распространенную разновидность открытоугольной глаукомы, которая сопровождается развитием тяжелых дистрофических изменений в средах глаза со скоплением в зоне хрусталика и ресничного тела белых отложений.
Этим заболеванием в большей степени страдают женщины. Риск глаукомы увеличивается после возникновения псевдоэксфолиативного синдрома.
Примерно в 25% случаев ПЭГ у пациентов выявляется офтальмогипертензия. Частота данного заболевания у лиц с глаукомой напрямую связана с распространенностью в регионе проживания псевдоэксфолиативного синдрома. Методов профилактики ПЭГ не существует.
Механизм развития заболевания
Факторами развития псевдоэксфолиативной глаукомы являются деструктивные процессы, происходящие в базальной мембране хрусталикового эпителия, трабекул, цилиарного тела или радужки.
Активация данных процессов, приводит к выработке псевдоэксфолиативного материала. Этот, сероватого оттенка материал, состоит из фибрилл, при грануляции, откладывающихся на конъюнктиве и стекловидном теле. Такими отложениями перекрывается межтрабекулярное пространство и отток внутриглазной жидкости блокируется. Это становится причиной увеличения уровня внутриглазного давления.
Классификация ПЭГ
Специалисты-офтальмологи имеют разные взгляды на развитие данного заболевания, что и отразились в существующих ее классификациях. Отечественные ученые, склонны рассматривать ПЭГ, как один из видов первичной открытоугольной глаукомы. При этом, основным фактором развития заболевания признается псевдоэксфолиативный синдром (ПЭС).
В зарубежных источниках, глаукому на фоне ПЭС называют вторичной и не ограничивают открытым углом.
Мировая и российская научная офтальмология не продвинулись дальше попыток применения ПЭС классификационных схем.
Наиболее логичную, клинически обоснованную классификацию заболевания, предложили немецкие офтальмологи. В ее основе — выявление изменений, которые появляются на передней хрусталиковой капсуле. Согласно этой классификации, отдельно выделяются:
- Подозрение на ПЭС.
- Клинически определенный псевдоэксфолиативный синдром.
К первому пункту относится стадия раннего, скрытого ПЭС. В этот период выявляются отложения псевдоэксфолиативного материала на передней камере гомогенным слоем, получившим определение «матового стекла». Скрытый ПЭС сопровождается появлением задних синехий.
Дальнейшее развитие болезни приводит к стадии «мини-ПЭС», которая заканчивается формированием классического синдрома. Этот период характеризуется локальным возникновением нарушений прекапсулярного слоя, появляющихся, как правило, в верхней хрусталиковой зоне.
Благодаря электронной микроскопии удалось определить и доклиническую стадию заболевания.
Более адаптированной к практике представляется классификация, предложенная проф. Е. Б. Ерошевской. Она учитывает характер и выраженность атрофии в радужке, а также объем эксфолиативных отложений. Согласно ей:
- 1 стадия заболевания – это легкая атрофия радужки, с незначительными наслоениями по краю зрачка, а также передней капсулы хрусталика.
- 2 стадия заболевания – выраженные накопления, перераспределение пигмента и атрофия пигментной зрачковой каймы.
- 3 стадия заболевания – значительная атрофия пигментной зрачковой каймы и радужки, отложения приобретают форму целлофановой пленки.
Необходимо упомянуть, что характеристики ПЭС, не ограничиваются биомикроскопией. Четвертая стадия ПЭС была установлена по итогам ультразвуковых исследований, опираясь на данные об интенсивности эксфолиативных отложений, их локализации, состояния волокон цинновой связки, а также наличия иных типов структурных изменений переднего сегмента глаза.

Симптомы заболевания
При псевдоэксфолиативной глаукоме больные могут ощущать следующее:
- Нарастающую к вечеру усталость глаз.
- Полноту и давление в глазах.
Кроме того, отмечается болезненность в глазном яблоке, появление красных кругов перед глазами при взгляде на яркий свет, «пелена» на глазах.
При возникновении приступа, из-за повышения давления начинаются головные боли. При прогрессировании глаукомы ухудшается периферическое зрение, что влечет за собой необратимое снижение остроты зрения всей области зрительного поля. Эти патологические изменения, в итоге приводят к слепоте.
Диагностика заболевания
Диагностика заболевания начинается со сбора анамнеза с учетом жалоб больного на ухудшение зрения, возникновение «пелены» перед глазами, чувство давления. Для подтверждение диагноза, проводят детальное исследование с применением таких методов, как:
- Рефрактометрия;
- Определение остроты зрения;
- Тонография;
- Биомикроскопия радужки, роговицы, а также отделов передней камеры глаза;
- Эластотонометрия;
- Тонометрия с определением внутриглазного давления;
- Гониоскопия с обследованием угла передней камеры;
- Офтальмоскопия;
- Периметрия.
Диагноз считается подтвержденным, если тонометрия выявляет повышенное внутриглазное давление, а визуально устанавлено наличие псевдоэксфолиативных отложений на радужке, трабекулах, хрусталике.
Лечение ПЭГ
Терапия псевдоэксфолиативной глаукомы преследует цель торможения прогрессирования процесса или снижения его скорости, так как полностью ликвидировать процесс невозможно.
Наши врачи, которые сохранят Вам зрение при глаукоме:


В лечении заболевания применяют следующие методы:
- Хирургический;
- Лазерный;
- Медикаментозное лечение.
Консервативное лечение предусматривает назначение следующих групп препаратов:
- Для снижения секреции внутриглазной жидкости (Тимоптик, Бетоптик, Окупресс-Е);
- Для повышающие оттока внутриглазной жидкости по увеосклеральному каналу (Ксалатин, Траватан и пр.);
- Средства с комбинированным действием (Фотил), содержащие пилокарпин и тимолол;
- Ингибиторы карбоангидразы, для снижения выработки глазной влаги (Трусопт, Азатон).
Лазерное лечение применяют при невозможности медикаментозной терапии (непереносимость препаратов) или ее неэффективности. Это направление обычно включает:
- Лазерную трабекулопластику;
- Лазерную иридэктомию;
- Лазерную десцеметогониопунктуру.
Хирургическую операцию назначают в случае отсутствия результатов медикаментозного и лазерного лечения ПЭГ. В этом случае может быть назначена операция, призванная облегчить отток внутриглазной жидкости или вмешательство, в результате которого, выработка влаги сократится.
Раннее обнаружение и своевременная терапия данного заболевания, в большинстве случаев позволяет стабилизировать снижение зрения.

В медицинском центре «Московская Глазная Клиника» все желающие могут пройти обследование на самой современной диагностической аппаратуре, а по результатам – получить консультацию высококлассного специалиста. Клиника открыта семь дней в неделю и работает ежедневно с 9 ч до 21 ч. Наши специалисты помогут выявить причину снижения зрения, и проведут грамотное лечение выявленных патологий.
Уточнить стоимость той или иной процедуры, записаться на прием в «Московскую Глазную Клинику» Вы можете по телефонам в Москве 8 (800) 777-38-81, 8 (499) 322-36-36 (ежедневно с 9:00 до 21:00) или воспользовавшись формой онлайн-записи.
Источник
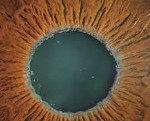
Псевдоэксфолиативный синдром – это увеопатия, характеризующаяся отложением амилоидоподобного вещества на структурах переднего сегмента глазного яблока. Клиническая картина представлена зрительной дисфункцией, появлением «помутнений» и «радужных кругов» перед глазами, затуманиванием зрения. Диагностика базируется на проведении ультразвуковой биомикроскопии, классической биомикроскопии с использованием щелевой лампы, скополаминовой пробы, УЗИ, визометрии, тонометрии, периметрии, гониоскопии. Консервативная терапия основывается на применении антиоксидантов, антигипоксантов, гипотензивных средств, витаминов группы В, А, Е.
Общие сведения
Псевдоэксфолиативный синдром впервые был описан финским ученым Дж. Линдбергом в 1917 году. Наблюдается взаимосвязь между развитием болезни и возрастом пациента. В 50-59 лет вероятность возникновения патологии составляет 1-2,5%, в 60-69 лет – 30%, после 70 лет – 42%. Согласно статистическим данным, заболевание диагностируется у 30% россиян старше 50 лет. Риск развития глаукомы у пациентов с псевдоэксфолиативным синдромом равен 64,6%. Патология чаще встречается среди представителей женского пола, однако тяжелее протекает у мужчин. Распространенность наиболее высока в серверных регионах.
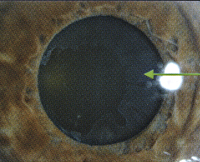
Псевдоэксфолиативный синдром
Причины псевдоэксфолиативного синдрома
Этиология заболевания до конца не изучена. Продолжительное время ученые связывали развитие патологии с изменениями строения эпителия хрусталика, однако диагностика псевдоэксфолиативного синдрома после интракапсулярной экстракции катаракты позволила опровергнуть эту теорию. На сегодняшний день ведущая роль в развитии болезни отводится действию следующих факторов:
- Ультрафиолетовое излучение. Воздействие ультрафиолета индуцирует свободно-радикальное окисление и деструкцию клеточной мембраны. Это влечет за собой атрофию с типичными признаками эксфолиации.
- Травматическое повреждение. Травмы глазного яблока приводят к локальным изменениям, которые у генетически скомпрометированных лиц являются пусковым фактором пигментной дисперсии.
- Внутриорбитальные инфекции. Многие авторы полагают, что поражение глаз обусловлено повышенной проницаемостью гематоофтальмического барьера (ГОБ). Способностью проникать через ГОБ наделена токсоплазма, вирус опоясывающего герпеса и краснухи.
- Нарушения иммунного статуса. В пользу этой этиологической теории псевдоэксфолиативного синдрома свидетельствует обнаружение в слезной жидкости повышенной концентрации интерлейкинов 6, 10, иммуноглобулина класса А и лактоферрина.
- Генетическая предрасположенность. У некоторых пациентов можно установить нарушение экспрессии генов в ядре и митохондриях. Встречаемость ПЭС среди родственников гораздо выше, чем в популяции. Прослеживается аутосомно-доминантный тип наследования.
Ученые полагают, что развитию болезни способствует курение и аутоиммунные патологии. Удается проследить взаимосвязь между возникновением ПЭС и артериальной гипертензией, атеросклерозом, аневризмой аорты в анамнезе. Некоторые исследователи полагают, что данные изменения – это следствие системной васкулопатии, поэтому пациенты с ПЭС часто страдают кардиоваскулярными заболеваниями.
Патогенез
Ключевая роль в механизме развития заболевания отводится образованию и депонированию аномального экстрацеллюлярного микрофибриллярного белка на поверхности передней капсулы хрусталика и радужки, цилиарном теле, цинновых связках, по краю зрачкового отверстия. Реже визуализируются патологические отложения в области передней камеры. Установлено, что белок относится к амилоидоподобной субстанции, за его синтез отвечает пигментный эпителий и меланоциты радужки. Согласно современным представлениям, патогенез ПЭС связан с нарушением эпителио-мезенхимальных взаимоотношений в структурах глазного яблока. Проникновение белковых структур в толщу его оболочек ведет к их дистрофическому перерождению.
Псевдоэксфолиативный синдром принято рассматривать как системное нарушение метаболизма соединительной ткани. Подтверждением этой теории является обнаружение специфических отложений в паренхиматозных органах (печень, почки, сердце, головной мозг) и кожных покровах. Учеными было обнаружено 14 антигенов главного комплекса гистосовместимости (HLA) при наследуемой форме патологии. Прогрессирование заболевания ведет к атрофии пигментной каймы, что проявляется выраженной дисперсией пигмента. Пигментоциты удается обнаружить в УПК и на радужной оболочке. Из-за поражения дренажной сети нарушается отток водянистой влаги с последующим повышением внутриглазного давления.
Классификация
В офтальмологии различают генетически детерминированный и иммуноопосредованный вариант развития. Вне зависимости от патогенеза болезнь всегда возникает в преклонном возрасте. По выраженности дистрофических изменений выделяют следующие степени псевдоэксфолиативного синдрома:
- I – проявляется легкой атрофией радужки. Патологический процесс не распространяется за пределы корня оболочки. Кайма зрачка имеет неравномерную структуру. В области хрусталика определяется маловыраженное наслоение амилоида.
- II – атрофия стромы радужной оболочки умеренная. На поверхности радужки и в зоне УПК выявляются выраженные псевдоэксфолиативные и пигментные отложения.
- III – атрофические изменения резко выражены. Пигментная кайма имеет вид «целлофановой пленки», что обусловлено дисперсией пигмента. Поражение связочного аппарата вызывает подвывих, реже – вывих хрусталика.
Клиническая классификация базируется на результатах ультразвуковой биомикроскопии. Различают следующие стадии патологического процесса:
- I – признаки поражения соответствуют псевдоэксфолиативному синдрому. Удается визуализировать точечные включения в передних отделах глаз.
- II – к вышеописанным изменениям присоединяются начальные признаки повреждения цинновой связки в виде чередования зон истончения с утолщением. Длина волокон разная.
- III – аномальные включения становятся более плотными, провоцируют разрушение связочного аппарата.
- IV – включения объединяются в большие конгломераты, которые приводят к увеличению продольной оси глазного яблока за счет удлинения переднего сегмента.
Симптомы псевдоэксфолиативного синдрома
Для заболевания характерно длительное бессимптомное течение. Вначале поражается один глаз (зачастую левый). Вовлечение второго глазного яблока, как правило, наблюдается спустя 5-10 лет после развития первых симптомов. Жалобы обычно возникают уже после массивного отложения амилоида. Пациенты отмечают появление «помутнений» перед глазами. При взгляде на источник света появляются специфические «радужные круги». Снижение остроты зрения обусловлено поражением хрусталика, повышением ВГД и атрофией сфинктера радужки. Нарушается аккомодационная способность, в дальнейшем расстройства аккомодации сопровождаются затуманиванием зрения, нарушением рефракции. Болевой синдром появляется только при повреждении связочного аппарата.
Заболевание очень медленно прогрессирует. Пациенты часто игнорируют клинические проявления. Помимо жалоб со стороны глаз при отложении белка во внутренних органах возникают симптомы их поражения. При депонировании амилоида в печени отмечается чувство тяжести в правом подреберье, реже – желтушность кожных покровов. Боль в пояснице по типу почечной колики, нарушения мочеиспускания являются типичными признаками скопления белковых масс в паренхиме почек. При распространении патологического процесса в толщу миокарда наблюдается ощущение сдавливания за грудиной, покалывание в области сердца. Доказано, что ПЭС широко распространена среди больных сенильной деменцией, когнитивными расстройствами, хронической ишемией головного мозга, болезнью Альцгеймера.
Осложнения
Отложение белка в толще хрусталиковых масс провоцирует развитие вторичной катаракты ядерного типа, которая зачастую сопровождается слабостью связочного аппарата. Это приводит к тому, что более чем у половины больных катарактой возникает сублюксация, реже – люксация хрусталика. В большинстве случаев патология осложняется офтальмогипертензией. Поражение трабекулярной сети ведет к возникновению псевдоэксфолиативной открытоугольной глаукомы, а с прогрессированием заболевания – к глаукомной оптической нейропатии или слепоте. Поражение мейбомиевых желез становится причиной ксерофтальмии.
Диагностика
Постановка диагноза на доклинической стадии затруднена. Выявить первые признаки можно только при помощи ультразвуковой биомикроскопии. Специфические методы диагностики включают:
- Биомикроскопию глаза. Позволяет визуализировать скопления белого или сероватого оттенка, напоминающи е хлопья на поверхности оболочек переднего отдела органа зрения. Хаотичные скопления пигмента могут формировать веретено Крукенберга. Псевдоэксфолиации по структуре похожи на воспалительные преципитаты.
- Гониоскопию. В передней камере определяются множественные включения, которые на поздних стадиях формируют крупные конгломераты. При нарушении проницаемости гематоофтальмического барьера в водянистой влаге обнаруживается взвесь крови. Объем камеры не изменен.
- Бесконтактную тонометрию. Характерно повышение внутриглазного давления, которое при вторичной глаукоме тяжело поддается снижению медикаментозным путем. При поражении дренажной системы дополнительно проводится электронная тонография.
- УЗИ глаза. При использовании ультразвуковой диагностики можно обнаружить разрыв цинновой связки с возникновением сферофакии. Из-за массивных отложений белка нарушается соотношение размеров переднего и заднего сегментов. Методика также применяется с целью обследования заднего сегмента глаз при снижении прозрачности оптических сред.
- Ультразвуковую биомикроскопию. Дает возможность выявить мелкоточечные включения слабой акустической плотности на оболочках глаза, разницу длины и лизис отдельных волокон цинновой связки.
- Скопаламиновую пробу. При 1 степени при проведении пробы зрачковое отверстие расширяется до 5 мм, при 2 – до 3,5-4 мм. При 3 степени патологии реакция зрачка отсутствует.
- Визометрию. Зрительная дисфункция наблюдается при помутнении оптических сред или вторичной глаукоме. При тяжелом течении острота зрения снижается вплоть до светоощущения.
- Периметрию. Определяется концентрическое сужение поля зрения. В ряде случаев удается диагностировать выпадение отдельных участков из зрительных полей, скотомы.
Пациентам с данной патологией в анамнезе показана консультация невропатолога, ревматолога, кардиолога, гастроэнтеролога, отоларинголога. Необходимость проведения комплексного обследования вызвана системным поражением фиброзной ткани. Часто выявление первых симптомов поражения глаза позволяет диагностировать отложения амилоида в других паренхиматозных органах.
Лечение псевдоэксфолиативного синдрома
Этиотропная терапия псевдоэксфолиативного синдрома не разработана. Цель консервативного лечения – предупредить развитие тяжелых осложнений. На ранних стадиях показано применение:
- Антиоксидантов. Используются лекарственные средства, в состав которых входит супероксиддисмутаза. СОД относится к классу металлопротеидов. Антиоксиданты вызывают разрушение активных форм кислорода, которые оказывают повреждающее влияние на ткани глаза.
- Антигипоксантов. С целью улучшения метаболизма и стимуляции процесса тканевого дыхания применяется цитохром С. Инстилляции препарата способствуют ускорению эпителизации и репарации повреждений структур передних сегментов глаз.
- Гипотензивных средств. Показаны при повышении внутриглазного давления, признаках офтальмогипертензии и начальных стадиях развития псевдоэксфолиативной глаукомы.
- Витаминотерапии. Доказана эффективность применения метилэтилпиридинола (структурный аналог витамина В6), который обладает фибринолитическим и антиоксидантным действием. В окислительно-восстановительных процессах также участвует витамин А (ретинола ацетат) и Е (токоферола ацетат).
При длительном течении патологии целью лечения является устранение или снижение выраженности вторичных осложнений. Медикаментозная терапия псевдоэксфолиативной глаукомы зачастую не оказывает должного эффекта. Возникает необходимость в лазерном или хирургическом вмешательстве. Наиболее целесообразно проведение ранней лазерной трабекулопластики, однако спустя 3-4 года возникают рецидивы повышения ВГД. При выборе метода удаления сублюксированного хрусталика следует отдавать предпочтение факоэмульсификации. Методикой резерва остается экстракапсулярная экстракция.
Прогноз и профилактика
Исход заболевания зависит от степени тяжести, характера поражения структур переднего отдела глаз и типа осложнений. При своевременной диагностике и лечении осложнений прогноз в отношении зрительных функций благоприятный. Возникновение вторичной глаукомы ассоциировано с резистентностью к консервативной терапии и риском необратимой потери зрения. Специфическая профилактика не разработана. Даже при ранних симптомах псевдоэксфолиативного синдрома необходима постановка на диспансерный учет у офтальмолога из-за высокой вероятности развития глаукомы. Показан регулярный контроль внутриглазного давления. Больные должны проходить комплексное офтальмологическое обследование не реже, чем два раза в год.
Источник


