Простетическая группа родопсина рецепторного белка сетчатки глаза
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 27 марта 2019;
проверки требует 1 правка.
Родопсин (зрительный пурпур) — основной зрительный пигмент. Содержится в палочках сетчатки глаза морских беспозвоночных, рыб, почти всех наземных позвоночных и человека и по данным недавнего исследования в клетках кожи меланоцитах[1]. Относится к сложным белкам хромопротеинам. Модификации белка, свойственные различным биологическим видам, могут существенно различаться по структуре и молекулярной массе. Светочувствительный рецептор клеток-палочек, представитель семейства А (или семейства родопсина) G-белоксопряженных рецепторов (GPCR-рецепторов).
Функции родопсина[править | править код]
Под действием света светочувствительный зрительный пигмент изменяется, и один из промежуточных продуктов его превращения отвечает за возникновение зрительного возбуждения. Зрительные пигменты, содержащиеся в наружном сегменте фото-рецепторной клетки, представляют собой сложные окрашенные белки (хромопротеиды). Та их часть, которая поглощает видимый свет, называется хромофором. Это химическое соединение — альдегид витамина А, или ретиналь. Белок зрительных пигментов, с которыми связан ретиналь, называется опсином.
При поглощении кванта света (фотона) хромофорная группа белка (11-цис-ретиналь) изомеризуется в транс-форму. Возбуждение зрительного нерва происходит при фотолитическом разложении родопсина за счёт изменения ионного транспорта в фоторецепторе. Впоследствии родопсин восстанавливается (регенерирует) в результате синтеза 11-цис-ретиналя и опсина или в процессе синтеза новых дисков наружного слоя сетчатки.
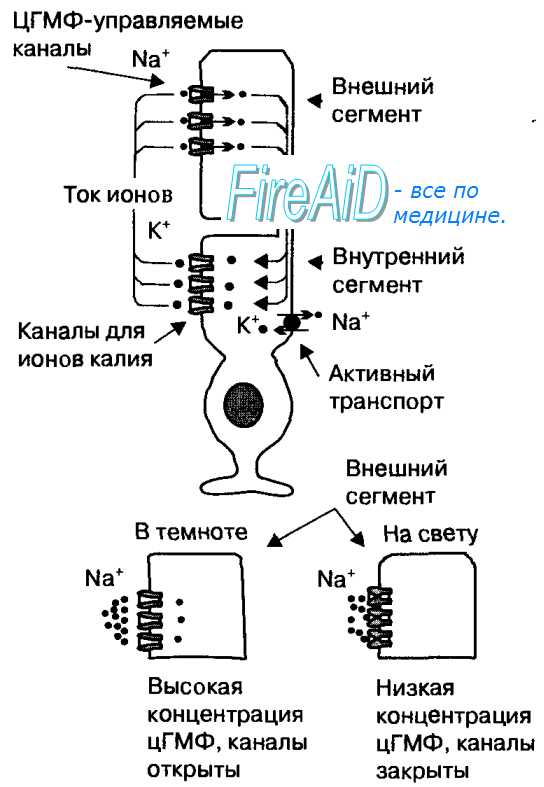
Родопсин относится к супер семейству трансмембранных рецепторов GPCR (рецепторов, связанных с G-белками). При поглощении света конформация белковой части родопсина меняется, и он активирует G-белок трансдуцин, который активирует фермент цГМФ-фосфодиэстеразу. В результате активации этого фермента в клетке падает концентрация цГМФ и закрываются цГМФ-зависимые натриевые каналы. Так как ионы натрия постоянно выкачиваются из клетки АТФ-азой, концентрация ионов натрия внутри клетки падает, что вызывает её гиперполяризацию. В результате фоторецептор выделяет меньше тормозного медиатора ГАМК, и в биполярной нервной клетке, которая «растормаживается», возникают нервные импульсы.
Спектр поглощения родопсина[править | править код]
Рис. 1. Спектр поглощения родопсина лягушки Rana temporaria в дигитониновом экстракте. Видны два максимума поглощения в видимой (500 нм) и ультрафиолетовой (280 нм) области. 1 — родопсин (восстановленный пигмент); 2 — индикатор жёлтый (обесцвеченный пигмент). По оси абсцисс — длина волны (λ); по оси ординат — оптическая плотность (D).
Специфический спектр поглощения зрительного пигмента определяется как свойствами хромофора и опсина, так и характером химической связи между ними (подробнее об этом см. обзор:[2]). Этот спектр имеет два максимума — один в ультрафиолетовой области (278 нм), обусловленный опсином, и другой — в видимой области (около 500 нм), — поглощение хромофора (см. рисунок). Превращение при действии света зрительного пигмента до конечного стабильного продукта состоит из ряда очень быстрых промежуточных стадий. Исследуя спектры поглощения промежуточных продуктов в экстрактах родопсина при низких температурах, при которых эти продукты стабильны, удалось подробно описать весь процесс обесцвечивания зрительного пигмента [3].
В живом глазу, наряду с разложением зрительного пигмента, постоянно идёт и процесс его регенерации (ресинтеза). При темновой адаптации этот процесс заканчивается только тогда, когда весь свободный опсин соединился с ретиналем.[4]
Дневное и ночное зрение[править | править код]
Из спектров поглощения родопсина видно, что восстановленный родопсин (при слабом «сумеречном» освещении) отвечает за ночное зрение, а при дневном «цветовом зрении» (ярком освещении) он разлагается, и максимум его чувствительности смещается в синюю область. При достаточном освещении палочка работает совместно с колбочкой, являясь приёмником синей области спектра[5]. Полное восстановление родопсина у человека занимает около 30 минут.
Родопсин в клетках кожи[править | править код]
По данным исследования 2011 года, проведенного в Брауновском университете, клетки кожи меланоциты также содержат родопсин. Родопсин реагирует на ультрафиолетовое излучение и запускает выработку меланина[1]
Примечания[править | править код]
- ↑ 1 2 Skin ‘sees’ UV light, starts producing pigment
- ↑ Островский М. А., Федорович С. Е., Голубев И. Н., 1967, Биофизика, 12 : 877.
- ↑ Hubbard R., Bownds D., Yoshizawa T., 1965. Cold Spring Harbor Symp. Biol., 30 : 301.
- ↑ АН СССР, объединённый научный совет «физиология человека и животных», Физиология сенсорных систем. Ч. 1. Физиология зрения. 1971 г., Издательство «Наука», Ленинградское отделение. Стр. 94 — 101
- ↑ С. Д. Ременко, «Цвет и зрение», «Картеа Молдовеняскэ», Кишинёв, 1982 г.
Этимология[править | править код]
Название «родопсин» происходит от др.-греч. ρόδον — роза и др.-греч. όπσις — зрение.
См. также[править | править код]
- Бактериородопсин
- Сенсорный родопсин II
- Родопсинкиназа
Ссылки[править | править код]
Источник
Родопсин — это распространенный зрительный пигмент, входящий в состав палочковидных зрительных рецепторов сетчатки глаза позвоночных животных. Это вещество имеет очень высокую фоточувствительность и является ключевым компонентом фоторецепции. Иное название родопсина — зрительный пурпур.
В настоящий момент к родопсинам относят пигменты не только палочек, но и рабдомерных зрительных рецепторов членистоногих.
Общая характеристика пигмента
По химической природе родопсин — это мембранный белок животного происхождения, содержащий в своей структуре хромофорную группу. Именно она обуславливает способность пигмента улавливать кванты света. Белок родопсин имеет молекулярную массу примерно 40 кДА и содержит 348 аминокислотных звеньев.
Спектр светопоглощения родопсина состоит из трех полос:
- α (500 нм);
- β (350 нм);
- γ (280 нм).
Лучи γ поглощаются ароматическими аминокислотами в составе полипептидной цепи, а β и α — хромофорной группой.
Родопсин — это вещество, способное распадаться под действием света, что запускает электротонический путь передачи сигнала по нервным волокнам. Данное свойство характерно и для других пигментов фоторецепторов.
Структура родопсина
По химической структуре родопсин — это хромогликопротеид, в состав которого входят 3 компонента:
- хромофорная группа;
- 2 олигосахаридные цепочки;
- водонерастворимый белок опсин.
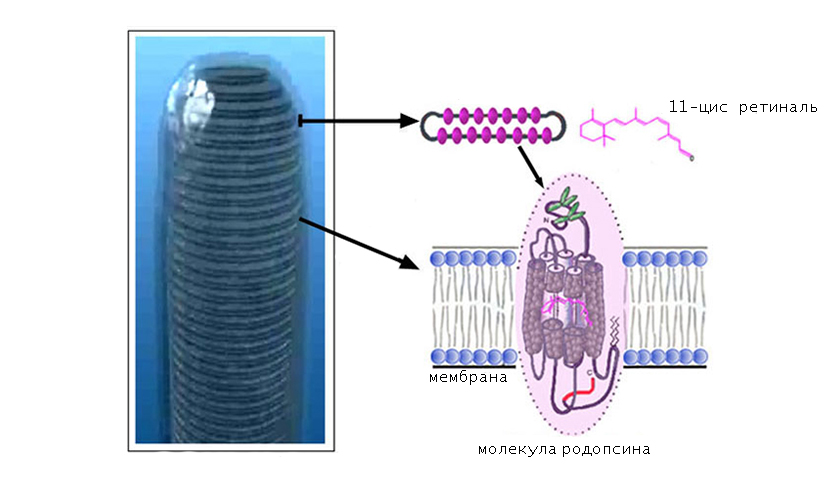
В качестве хромофорной группы выступает альдегид витамина А (ретиналь), который находится в 11-цисформе. Это означает, что длинная часть цепочки ретиналя изогнута и скручена с образованием нестабильной конфигурации.
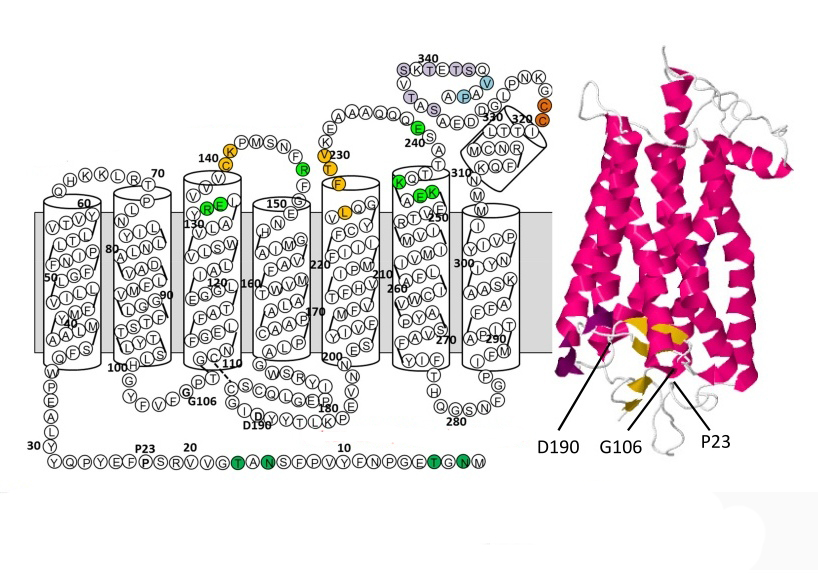
В пространственной организации молекулы родопсина выделяют 3 домена:
- внутримембранный;
- цитоплазматический;
- внутридисковый.
Хромофорная группа расположен во внутримембранном домене. Ее связь с опсином осуществляется через Шиффово основание.
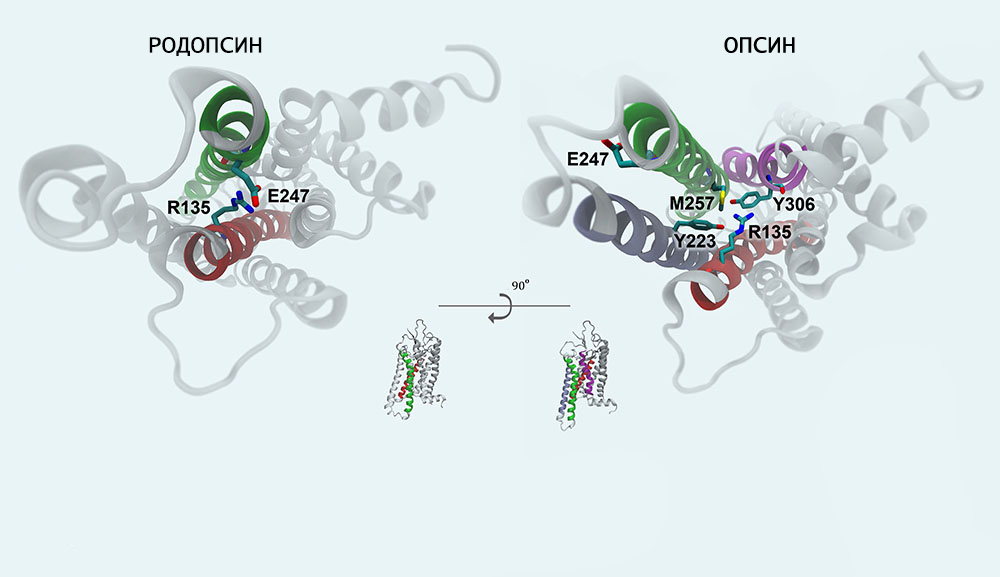
Схема фотопревращения
Механизм фотопревращения пигмента родопсина под действием света основан на реакции цис-транс-изомеризации ретиналя — т. е. на конформационном переходе 11-цис-формы хромофорной группы в выпрямленную транс-форму. Этот процесс осуществляется с огромной скоростью (меньше 0,2 пикосекунды) и активирует ряд дальнейших превращений родопсина, которые происходят уже без участия света (темновая фаза).
Образующийся под действием светового кванта продукт называют фотородопсином. Его особенность в том, что транс-ретиналь еще связан с полипептидной цепью опсина.
От завершения первой реакции до конца темновой фазы родопсин последовательно претерпевает следующий ряд превращений:
- фотородопсин;
- батородопсин;
- люмиродопсин;
- метародопсин Ia;
- метародопсин Ib;
- метародопсин II;
- опсин и полностью-транс ретиналь.
Эти превращения сопровождаются стабилизацией, полученной от светового кванта энергии, и конформационной перестройкой белковой части родопсина. В результате хромофорная группа окончательно отделяется от опсина и тут же удаляется из мембраны (транс-форма обладает токсичным действием). После этого запускается процесс регенерации пигмента в исходное состояние.
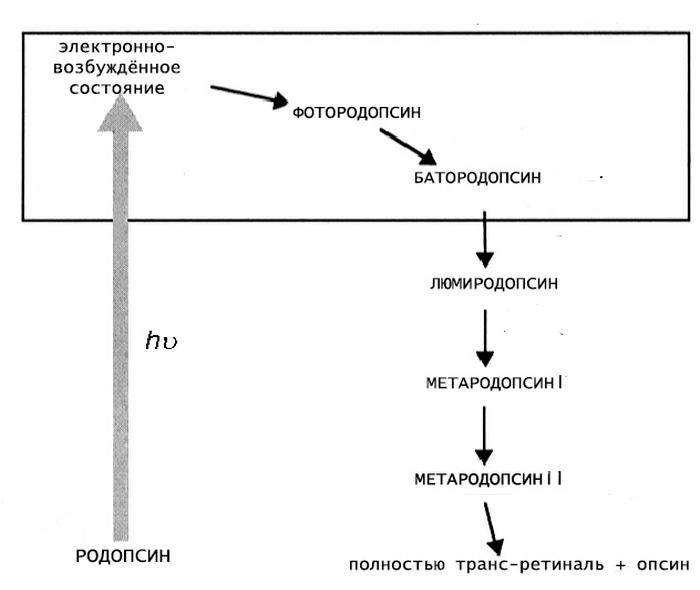
Регенерация родопсина происходит благодаря тому, что за пределами мембраны транс-ретиналь снова приобретает цис-форму, а затем возвращается обратно, где снова образует с опсином ковалентную связь. У позвоночных восстановление имеет характер ферментативного ресинтеза и происходит с затратой энергии, а у беспозвоночных осуществляется за счет фотоизомеризации.
Механизм передачи сигнала от пигмента в нервную систему
Действующим компонентом запуска фототрансдукции является метародопсин II. В таком состоянии пигмент способен взаимодействовать с белком трансдуцином, тем самым активируя его. В результате связанный с трандуцином ГДФ заменяется на ГТФ. На данной стадии происходит одновременная активизация огромного числа молекул трансдуцина (500—1000). Этот процесс называют первым этапом усиления светового сигнала.
Затем молекулы активированного трансдуцина вступают во взаимодействие с фотодиэстэразой (ФДЭ). Этот фермент в активном состоянии способен очень быстро разрушать соединение цГМФ, необходимое для поддержки в открытом состоянии ионных каналов в мембране рецептора. После вызванной трансдуцином активизации молекул ФДЭ, концентрация цГМФ падает до такого уровня, что каналы закрываются, и в клетку перестают поступать ионы натрия.
Уменьшение концентрации Na+ в цитоплазме наружной части рецептора приводит цитоплазматическую мембрану в состояние гиперполяризации. В результате возникает трансмембранный потенциал, который распространяется до пресинаптического окончания, уменьшая выброс медиатора. Именно это и является смысловым итогом процесса всех преобразований в зрительном рецепторе.
Источник
Известны и такие сочетания кофермента с белком, в которых связи между ними прочны и разделить кофермент и белок можно только с большим трудом. Тогда вместо термина кофермент применяют термин простетическая группа. Такие прочные связи обнаружены в ферментах, содержащих гел( — комплексное соединение железа (см. далее). [c.356]
Более подробно выяснено значение витамина А в процессе свето-ощущения. В этом важном физиологическом процессе большую роль играет особый хромолипопротеин—сложный белок родопсин, или зрительный пурпур, являющийся основным светочувствительным пигментом сетчатки, в частности палочек, занимающих ее периферическую часть. Установлено, что родопсин состоит из липопротеина опсина и простетической группы, представленной альдегидом витамина А (ретиналь) связь между ними осуществляется через альдегидную группу витамина и свободную -КН,-группу лизина молекулы белка с образованием шиффова основания. На свету родопсин расщепляется на белок опсин и ретиналь последний подвергается серии конформационных изменений и превращению в транс-форму. С этими превращениями каким-то образом связана трансформация энергии световых лучей в зрительное возбуждение—процесс, молекулярный механизм которого до сих пор остается загадкой. В темноте происходит обратный процесс—синтез родопсина, требующий наличия активной формы альдегида—11-гтранс-ретиналя, или транс-формы витамина А при участии двух специфических ферментов—дегидрогеназы и изомеразы. Более подробно цикл превращений родопсина в сетчатке глаза на свету и в темноте можно представить в виде схемы [c.211]
Что такое фермент Простетическая группа Сложный белок Кофермент Субстрат [c.427]
Итак, если считать, что белок является ферментной системой, т. е. что он обладает специфическими каталитическими свойствами, то эти свойства его зависят от строения, от архитектурных форм его молекулы и от свойств тех простетических групп, которые его активируют. Свойства белка как поверхностно-активного вещества ни разу серьезно экспериментально не привлекались для трактовки механизма его каталитического действия-. [c.440]
Кристаллические энзимы — белки (стр. 333) с очень высоким молекулярным весом. Многие из них содержат простетическую группу, которая имеет относительно низкий молекулярный вес. Простетические группы обычно легко отделяются (например, диализом) от белковой части. Например, энзим пероксидаза состоит из гематина (стр. 595, простетическая группа), связанного с белком. Простетическую группу (в виде химического соединения) называют коэнзимом. Обе части — коэнзим и белок — должны присутствовать в системе, чтобы энзим был активным. [c.304]
Эффектором в зрительном рецепторе является светопоглощающая группировка — белок родопсин с простетической группой — 11-цыс-рети-налем, который образуется из витамина А (транс-ретинола). В клетках спиртовая группа ретинола превращается в альдегидную, затем ретиналь-изомераза превращает его в цмс-форму. Ниже показаны структурные переходы от Апрднс-ретинола (витамина А) к транс- и цмс-ретиналю (рис. 54). [c.110]
Фосфопротеины в качестве простетической группы содержат ортофосфор-ную кислоту связанную с гидроксилом серина или треонина. К фосфопро-теинам относятся многие питательные белки, например основной белок молока — казеин, который кроме фосфорной группы имеет также в своем составе углеводный компонент. Белок яичного желтка — вителлин, икры рыб — ихту-лин. [c.49]
Фосфопротеиды — белки, содержащие в качестве простетической группы остаток фосфорной кислоты. Представители казеин — белок коровьего молока вителлин белок, входящий в состав желтка куриного яйца. [c.297]
Название кофермент (коэнзим) иногда употребляют для протеи-ноидного фермента, необходимого для активации другого фермента, но часто коферментом называют простетическую группу, без которой белок неактивен. Донорный фермент требует акцепторного фермента со специфическим окислительно-восстановительным потенциалом и не может функционировать с другим акцептором даже в тех случаях, когда простетические группы акцепто])ов очень близки по строению. Специфическая единица в простетической группе в каждом акцепторном ферменте способна принять два атома водорода. В ряде случаев этой единицей является никотинамидная группа (никотинамид — незаменимый компонент пищи многих животных). [c.718]
Эти простетические группы также, как и их способы соединения с белками, могут быть очень различными. Так, в фосфопротеидах собственно белок соединен с фосфорной ли пирофосфорной кислотами эфирообразно через гидроксильные группы оксиаминокислот. В хромопротеидах простетической группой является красящее вещество гем, представляющее собою соединение порфиринового ряда, содержащее металл. В гемоглобине (красящем веществе крови), который является переносчиком кислорода у позвоночных, гем содержит железо в гемоцианине, содержащемся в крови и гемолимфе некоторых беспозвоночных животных, гем содержит медь. Железо содержат и ряд других представителей этой обширной и важной группы белков, например, цитохром С — катализатор клеточного дыхания, каталаза и пероксидаза — окислительные ферменты и т. д. Различен также и характер связи простетической группы с белком в хромопротеидах. Согласно современным представлениям, белок (глобин) в гемоглобине связан с гемом водородными связями, возникающими между атомом железа гема и имидазольным кольцом гистидиновых остатков в белке. В цитохроме связующим звеном, по-видимому, является тиоэфирная группа (см. рис. 10). [c.533]
Наиболее интересной и важной группой из числа сложных белков являются нуклеопротеиды, в них белок соединен с нуклеиновой кислотой. В отличие от других сложных белков нуклеопротеиды состоят из сравнительно простого и низкомолекулярного белка основного характера — протамина или гистона, и высокомолекулярной простетической группы — нуклеиновой кислоты. Нуклеопротеиды входят в состав всех клеток живого организма, являются важной частью хромозом и т. д. К этому классу соединений относятся и молекулы ]-иганты — вирусы, инициаторы многих инфекционных заболеваний, например, полиомиелита. [c.533]
Для некоторых белков образование нативной конформации зависит от присутствия специфических лигандов, часто ионов металлов или других простетических групп [94, 413]. Наличие лиганда не обязательно приводит к существенно иной конформации свернутого белка, но способствует стабилизации его нативной формы. На основании опытов по водородному обмену [415], а также с помощью кривых денатурации мочевиной [461] апомиоглобина, глобулярного белка с ДОобщ 9 ккал/моль, установлено, что этот белок должен быть на 4 ккал/моль менее стабилен, чем миоглобин. Противоположным примером является цитохром с, присутствие в котором ковалентно связанной группы гема абсолютно необходимо для стабильности белковой структуры. При удалении этой группы белок перестает быть глобулярным [462. Если удалить только ион железа, белок остается глобулярным, хотя и менее стабильным, например, к термической денатурации [463]. [c.190]
Четвертичные структуры белка образуются тогда, когда молекула белка включает в свою структуру химически связанные комплексы хлорофилла, протопорфирина железа (II), или гема, группировки из ионов металлов (Ре, Си, 2п, Со, Мо и др.), углеводы, фосфорную кислоту, жиры и т. д. В этом случае белки являются не простыми, а сложными и называются протеидами. К числу протеидов (сложных белков) относятся хромопротеиды (белок связан с молекулой — хромофором), гликопротеиды (белок связан с углеводами), липопротеиды (белок связан с липидом), фосфопротеиды (белок этерифицирован фосфорной кислотой, как, например, в казеине молока), нуклео-протеиды (белок связан с нуклеиновой кислотой). Небелковая часть молекулы протеида называется простетической группой. [c.722]
Сложные белки, как было отмечено, содержат два компонента—простой белок и небелковое вещество. Последнее называют простетической группой (от греч. prostheto—присоединяю). Простетические группы, как правило, прочно связаны с белковой молекулой. Далее представлены сведения [c.78]
Следует подчеркнуть, однако, что значительно больший удельный вес имеет посттрансляционная химическая модификация белков, затрагивающая радикалы отдельных аминокислот. Одной из таких существенных модификаций является ковалентное присоединение простетической группы к молекуле белка. Например, только после присоединения пиридоксальфосфата к -аминогруппе остатка лизина белковой части—апо-ферменту—образуется биологически активная трехмерная конфигурация аминотрансфераз, катализирующих реакции трансаминирования аминокислот. Некоторые белки подвергаются гликозилированию, присоединяя олигосахаридные остатки (образование гликопротеинов), и обеспечивают тем самым доставку белков к клеткам-мишеням. Широко представлены химические модификации белков в результате реакции гидроксилирования остатков пролина, лизина (при формировании молекул коллагена), реакции метилирования (остатки лизина, глутамата), ацети-лирования ряда N-концевых аминокислот, реакции карбоксилирования остатков глутамата и аспартата ряда белков (добавление экстра-карбоксильной группы). В частности, протромбин (белок свертывающей [c.532]
Все высшие растения содержат фитохром — сине-зеленый фотохромный пигмент, который контролирует большое число разнообразных метаболических процессов, а также различные стадии развития организмов. Фитохром представляет собой белок с мол. массой 120 000. В качестве хромофора простетической группы он содержит линейный тетрапиррол, или билин. Фитохром существует и функционирует в двух формах — в форме Рг, которая имеет максимум поглощения в красном диапазоне спектра (660 нм), и в форме Ргг с максимумом поглощения в дальней красной области (730 нм). Эти две формы легко переходят друг в друга при поглощении красного света форма Рг превращается в форму Ргг, которая в свою очередь дает форму Рг в результате поглощения дальнего красного света. [c.194]
Многие аспекты роста и морфологии растений регулируются светом. Большинство (если не все) реакций растений на свет опосредованы одним чрезвычайно важным фоторецепторным пигментом — фитохромом, который содержится в клетках в очень небольших количествах. В структурном отношении фитохром представляет собой белок, имеющий в качестве простетической группы (и хромофора) линейный тетрапиррол (билин). Детали структуры и свойств фитохрома приведены в гл. 5 (рис. 5.16). [c.369]
Примером двухкомпонентного фермента является карбоксилаза, катализирующая расщепление пировиноградной кислоты на уксусный альдегид и углекислоту. Простетической группой ее является витамин В[ в соединении с двумя молекулами фосфорной кислоты. Коллоидным носителем — специфический белок. [c.520]
ФМН — простетическая группа НАД(Ф) х X Нз — дегидрогеназы ФАД — простетическая группа сукцинатдегидрогеназы Ре8 — железосеросодержащий белок Ь, С , с, а, 3 — цитохромы [c.366]
Гликопротвид — 1) сложный белок, в котором углеводный фрагмент ковалентно связан с полипептидными цепями белка О- или М-гликозид-ными связями 2) сложные белки, простетической группой которых являются углеводы. [c.82]
С АПБ ковалентно связываются промежуточные продукты биосинтеза жирных кислот. АПБ — сравнительно небольшой термостабильный белок, имеющий молекулярную массу равную 9000 Да. В АПБ имеется простетическая группа, которая носит название 4 -фо-сфопантетеин, он входит также в состав кофермента А. В состав [c.303]
Образование, вернее удлинение, цепи жирной кислоты может стартовать только после того, как обе сульфгидрильные группы синтазной системы войдут во взаимодействие с ацильными группами. Условно это можно представить в следующем виде. Комплекс 7 ферментов синтазной системы представим буквами ЕФ и центральный ацилпереносящий белок вместе с простетической группой АПБ-Ф-8Н. В комплексе ХФ есть также свободная — 8Н ЕФ-цистеин-8Н. [c.305]
Фосфопротеиды, простетическая группа — ортофосфорная кислота НзРОрастворимой кальциевой соли, при под-кнслепни молока образующаяся молочная кислота связывает ионы Са2+, а казеин, мало растворимый в воде, выпадает в осадок. [c.550]
Небелковые простетические группы, определяющие активность многи.ч ферментов, могут быть обратимо отделены от белкового компонента молекулы фермента. Дейл [86] нашел, что простетическая группа оксидазы -аминокислот—аллоксазин-адениндинуклеотид — инактивируется так же легко, как и белок, если их облучать отдельно. При смешивании обоих компонентов инактивация, ло-видимому, аддитивна. При облучении же растворов интактного фермента белок защищает простетическукэ [c.243]
Это — желтое маслянистое вещество, содержащееся в сливочном масле и в рыбьем жире. Недостаток витамина А приводит к ослаблению зрения, нарушению нормального состояния кожи и сопровождается пониженной сопротивляемостью глаз и кожи к инфекционным заболеваниям. Кроме того, недостаток этого витамина приводит к ухудшению ночного зрения куриная слепота). Существует два механизма зрения один при помощи колбочек сетчатки глаза, которые сосредоточены главным образом вблизи центральной ямки, и другой при помощи палочек сетчатки. Восприятие цвета, свойственное обычному зрению, возможно только при нормальном освещении — оно осуществляется при помощи колбочек сетчатки. Сумеречное, или ночное зрение, при очень небо.тьшой интенсивности света осуществляется с участием палочек сетчатки глаза, которые неспособны воспринимать цвет. Установлено, что белок родопсин (или зрительный пурпур), содержащийся в палочках, участвует в процессе восприятия слабого света при сумеречном освещении. Витамин А является простетической группой молекулы родопсина— сложного белка зрительного пурпура, и недостаток этого витамина вызывает ухудшение ночного зрения. [c.493]
Нуклеопротеидами, тромбоциты содержат липопротеид про-тромбокиназу, в состав простетической группы которого входит кефалин. Содержание гемоглобина в эритроцитах доходит до 40%. В цельной крови взрослого человека содержание гемоглобина составляет 12—14%, что соответствует 75—85% по гемометру Сали Ч Кроме гемоглобина, в эритроцитах содержится сложный белок, содержащий медь, называемый купреином, и фермент карбоангидраза, в состав которого входит цинк. Из небелковых органических веществ в эритроцитах содержится в среднем 350 мг% лецитина, 150 мг% холестерина и др. Содержание глюкозы в эритроцитах меньше, чем в плазме, и составляет 60—70 мг%. Из минеральных веществ в эритроцитах содержится особенно много калия (около 470 мг%) и железа (около 105 мг%) и очень мало натрия (около 80 мг%). [c.226]
Многие инвариантные аминокислотные остатки гомологичньгх белков, т. е. остатки, присутствующие всегда в определенных положениях полипептидных цепей независимо от вида организма, из которого получен белок, по всей вероятности, занимают наиболее важные в структурном отношении места в полипептидной цепи. Одни из инвариантных остатков встречаются вблизи изгибов цепи или в самих изгибах, тогда как другие, например остатки цистина, находятся в тех местах цепи, где между близко расположенными петлями третичной структуры возникают поперечные связи. Ряд инвариантных аминокислотных остатков занимает строго определенное положение в каталитических центрах ферментов или в местах связывания простетических групп, например гемогруппы в цитохроме с. [c.196]
На следующей стадии цикла (рис. 16-13) сукцинат, образовавшийся из сукцинил-СоА, дегидрируется с образованием фумарата. Эта реакция катализируется флавопротеином сукцинатдеги-дрогеназой, молекула которого содержит ковалентно связанный флавинадениндинуклеотид. Эта простетическая группа, способная восстанавливаться, служит акцептором водорода в следующей реакции (Е означает здесь ферментный белок) [c.489]
Рис, 19-2, Простетическая группа трансаминаз, Пиродоксальфосфат ( 4) и его аминированная форма-пиридоксаминфосфат (Б)-это прочно связанные коферменты трансаминаз. Функциональные группы, от которых зависит их действие, показаны на красном фоне, В. Пиридоксальфосфат играет роль промежуточного переносчика аминогрупп при действии трансаминаз. Е означает здесь ферментный белок, а -прочно связан- Hj—с—СОО + Н+-> Hj—с—н + СО, [c.573]
Гемопротеин. Белок, содержащий в качестве простетической группы гем. [c.1009]
Сложный белок. Белок, содержащий в качестве простетической группы металл или органическое соединение, или и то, и другое. [c.1018]
Флавопротеин. Белок, содержащий в качестве простетической группы флавиновый нуклеотид. [c.1020]
Биохимия Издание 2 (1962) — [
c.41
]
Источник