Прогрессирования первичной открытоугольной глаукомы
Статья посвящена морфофункциональным характеристикам прогрессирования первичной открытоугольной глаукомы
Глаукома относится к наиболее распространенным нейрооптикопатиям с преимущественно хроническим прогредиентным течением и серьезным прогнозом при отсутствии систематизированного подхода в лечебно-диагностическом процессе [1–4]. В большинстве случаев переход из стадии в стадию болезни происходит в промежутке от 3 до 5 лет [5–7]. К сожалению, прогресс в изучении и лечении этого заболевания нередко преувеличен. Вместе с тем до половины случаев слепоты вследствие глаукомы можно было бы предотвратить при своевременной диагностике и использовании рациональных подходов к лечению, основанных на изучении характера прогрессирования заболевания [8–12].
С появлением возможности точной оценки состояния ДЗН и диагностики изменений поля зрения была отмечена взаимосвязь между структурными изменениями в ДЗН и слое нервных волокон сетчатки (СНВС) и функциональными характеристиками при глаукоме. В настоящее время корреляция между этими изменениями, в т. ч. и как характеристика прогрессирования глаукомы, доказана множеством работ как следствие развития высокотехнологичных методов [13, 14]. Вместе с тем даже на современном этапе развития науки все еще недостаточно сформулированы методы оценки и отдельные специфические характеристики прогрессирования глаукомного процесса, включая определение показателя скорости прогрессирования заболевания и его индивидуальных характеристик в зависимости от стадии заболевания [15–19].
Целью данной работы стало определение морфофункциональных характеристик прогрессирования ПОУГ у пациентов с различными стадиями заболевания при длительном сроке наблюдения с использованием современных типов мониторирования на фоне проводимого лечения.
Материал и методы
Комбинированное динамическое научно-клиническое исследование было проведено на базе офтальмологического отделения ФКУ «Центральный военный клинический госпиталь им. П.В. Мандрыка» МО РФ в период 2005–2016 гг. Первый этап (ретроспективный) подразумевал анализ историй болезни и амбулаторных карт пациентов, находившихся на стационарном лечении в указанном выше офтальмологическом отделении в период с 2005 по 2013 г. Во время проспективного этапа работы (2014–2016 гг.) пациенты активно вызывались для проведения дополнительного специализированного обследования.
Всего для анализа были отобраны данные 89 пациентов (153 глаза), из них 46 мужчин (51,7%) и 43 женщины (48,3%) с разными стадиями ПОУГ. Пациенты были разделены на подгруппы в соответствии со стадией заболевания, а ее верификация была основана на полученных данных статической автоматической периметрии (САП) и ее показателя, характеризующего состояние светочувствительности сетчатки (MD, mean deviation) [11, 20, 21]. При анализе прогрессирования глаукомы были использованы рекомендации проф. В.В. Волкова (2008), базирующиеся на ранее выполненных исследованиях, в которых таким критерием также было принято считать результаты САП. Динамика зрительных функций принимается за стабилизированную при изменении показателя MD не более чем на 0,5 дБ/год, а в остальных случаях процесс является прогрессирующим (медленно и/или быстро) [22].
В зависимости от стадии глаукомы, а также от характера прогрессирования глаукомного процесса все больные были распределены на 6 групп: I стадия глаукомы, стабилизированная и прогрессирующая (подгруппы 1-я и 2-я – 62 и 18 глаз); II стадия глаукомы, стабилизированная и прогрессирующая (подгруппы 3-я и 4-я – 22 и 26 глаз); III стадия глаукомы, стабилизированная и прогрессирующая (подгруппы 5-я и 6-я – 13 и 12 глаз).
Возраст пациентов на момент начала наблюдения находился в интервале от 60 до 80 лет и в среднем составил 69,2±0,35 года. Группы были сопоставимы по половым, возрастным характеристикам и сопутствующей системной патологии. Средний срок наблюдения во всех группах составил 5,1 (3,9; 6,4) года. Во всех случаях диагноз был документально верифицирован и подтвержден согласно системе дифференциальной диагностики заболеваний. Уровень ВГД у всех пациентов был компенсированным на фоне проводимого лечения. Наряду с традиционными методами обследование пациентов включало проведение Гейдельбергской ретинотомографии (HRT) и САП. Ретинотомографическое исследование проводилось на приборе HRT 3 (версия программы 1.9.10.0, Heidelberg Engineering, Германия). Исследование полей зрения выполнялось по стандартному протоколу на статических автоматических периметрах HFA 745i и 750i (программа пороговой периметрии SITA Threshold 30-2, Carl Zeiss-Meditec Inc., США). В ходе работы оценивались 4 наиболее информативных стереометрических показателя ДЗН: площадь нейроретинального пояска (rim area) и его объем (rim volume), горизонтальное соотношение экскавация/диск (horizontal cup/disk ratio), вертикальное соотношение экскавация/ диск (vertical cup/disk ratio), а также 2 функциональных показателя: средняя светочувствительность сетчатки (MD, mean deviation) и ее стандартное отклонение (PSD, pattern standard deviation) [23–25].
Во всех случаях включение пациента в исследование, заполнение дополнительной документации (кроме необходимой в лечебно-диагностическом процессе) происходили только после получения письменного согласия, как это указано в «Этических принципах проведения медицинских исследований с участием человека в качестве субъекта» (коррекция от октября 2013 г. (как это указано здесь https://www.wma.net/en/30publications/10policies/b3/)).
Критерии включения и исключения
Критериями включения являлись: установленный диагноз «ПОУГ» разных стадий у пациентов европеоидной расы; возраст пациентов – от 50 до 80 лет (на момент начала наблюдения); период документированного наблюдения – не менее 3-х лет; не менее 3-х исследований на каждом из вышеуказанных приборов (HRT3 и HFA) за указанный промежуток времени. На момент финального обследования пациенты могли получать любую антиглаукомную гипотензивную терапию или не получать ее по причине удачно выполненной антиглаукомной операции.
Критериями исключения стали: другие формы глаукомы; недостаточно прозрачные оптические среды глаза и острота зрения ниже 0,7, с указанной ниже коррекцией, при которых было невозможно проведение качественного структурно-функционального исследования; отсутствие устойчивой фиксации, что могло усложнить проведение исследований и ухудшить их результат); миопия и гиперметропия высокой степени (±6 Д) и астигматизм более ±3,0 Д. Также были исключены пациенты с другими заболеваниями сетчатки и зрительного нерва («влажная» форма макулодистрофии – любая стадия, «сухая» форма – не более I стадии по классификации AREDS (2001); состояние после сосудистых нарушений, диабетическая ретинопатия, любой тип отслойки сетчатки); пациенты с травмами и заболеваниями органа зрения в анамнезе, затрудняющими проведение тонометрии; пациенты после проведенной интракапсулярной экстракции катаракты, «классической» экстракапсулярной экстракции катаракты или факоэмульсификации, прошедших с осложнениями (например, частичной потерей стекловидного тела, в т. ч. и в случае наличия послеоперационного астигматизма более ±3 Д); пациенты с любой формой отслойки сетчатки (оперированная или неоперированная); пациенты с общими (системными) заболеваниями, требующими гормональной терапии, как это принято согласно методике проведения клинических исследований (как это указано здесь https://clinicaltrials.gov).
Методы статистического анализа
Информация, содержащаяся в протоколах исследования приборов HRT3 и Humphrey, вводилась в компьютер вручную (использовалась лицензионная программа MS Excel 2010), после чего проводилась визуальная, а также программная проверка данных на полноту и допустимые диапазоны. Статистическая обработка данных проводилась с помощью прикладного пакета IBM SPSS Statistics 21 (США). В настоящей работе использованы следующие модули пакета: «описательные статистики»; «сравнение средних», процедура «t-критерий для независимых выборок»; «непараметрические критерии» для независимых выборок; U-критерий Манна – Уитни; критерий Колмогорова – Смирнова для проверки на нормальность; критерий Краскела – Уоллиса для сравнения групп критическим уравнением значимости. Для сравнения групп критическим критерием значимости при проверке гипотез принимался р<0,05. В качестве суммарного измерения каждого параметра во времени использовался анализ валидности (достоверности) диагностических тестов, которые оценивали по показателю площади под ROC-кривой (интегральная эффективность исследования по отношению к идеальному).
Результаты и обсуждение
Был проведен подсчет скорости прогрессирования согласно делению всех пациентов на группы со стабилизированной и прогрессирующей глаукомой. Было установлено, что средняя скорость прогрессирования заболевания для стабилизированной глаукомы у всех подгрупп наших пациентов составила -0,11 дБ/год, а для прогрессирующей – -1,31 дБ/год. В таблице 1 приведены данные распределения значений 6 изучаемых параметров САП для каждой из подгрупп на начало и конец наблюдения (Me; Q25%; Q75%), а также указана скорость изменения показателя MD в течение года.
Согласно полученным результатам, скорость изменения параметра MD у пациентов с I стадией глаукомы составила 0,0752 дБ/год при стабильном течении и 0,2917 дБ/год при прогрессирующей глаукоме, у больных с развитой стадией заболевания этот показатель составил 0,0912 и 0,5778 дБ/год, а у лиц с далеко зашедшей стадией глаукомы – 0,0990 и 0,7531 дБ/год соответственно. Было установлено, что скорость ухудшения зрительных функций при прогрессирующем течении заболевания в сравнении со стабильным течением изменяется следующим образом: на I стадии больше в 3 раза, на II и III – больше в 5 раз и 6,5 раза соответственно. Характеристики показателя «скорость» изменения параметра MD при попарном сравнении всех 3-х стадий статистически достоверно отличались и соответствовали представленной ранее классификации (p<0,05). Достоверная разница между скоростью прогрессирования при внутригрупповом сравнении также была выявлена во всех случаях (р=0,000, р=0,001 и р=0,034 соответственно).
В таблице 2 представлены результаты сравнения значимости изменений между начальными и конечными данными показателя MD по подгруппам.
Были установлены статистически достоверные различия показателя MD у пациентов с развитой и далеко зашедшей стадиями глаукомы между группами со стабилизированным и прогрессирующим течением. Максимальные значения изменений параметра MD были установлены у пациентов с III стадией глаукомы, при стабилизированном течении (р=0,0004). У лиц с начальной глаукомой таких различий не было обнаружено, что, по всей видимости, связано с большей эффективностью лечения на первой стадии и достижением показателей «давления цели» у большинства пациентов. Значимости изменений показателя PSD при разных стадиях ПОУГ не было выявлено.
В таблице 3 показаны результаты сравнения функциональных и морфометрических параметров в 6 группах (сравнение значимости). Сравнивались результаты трех исследований, проведенных с разницей во времени не более одного года.
Из таблицы 3 следует, что достоверные отличия во всех подгруппах были выявлены при анализе функционального показателя MD. Во 2-й подгруппе (I стадия, прогрессирующее течение) изменения также были установлены при 3-м исследовании при анализе морфометрического показателя – «горизонтальное и вертикальное соотношение экскавация/диск», р=0,015 и р=0,049 соответственно. Более выраженные изменения были выявлены у пациентов с развитой стадией глаукомы. Так, в 3-й и 4-й подгруппах достоверные изменения были установлены в морфометрических и функциональных параметрах: MD и «горизонтальное и вертикальное соотношение экскавация/диск». В 4-й подгруппе (прогрессирующее течение заболевания) также было установлено изменение объема нейроретинального пояска при финальном исследовании (p=0,049). В 5-й подгруппе (III стадия, стабилизированное течение) были выявлены достоверные отличия при сравнении параметра «вертикальное соотношение экскавация/диск» в 1-м исследовании (р=0,05); а в 6-й подгруппе – и при 1-м, и при 2-м исследованиях, р=0,046 и р=0,035 соответственно.
На следующем этапе обработки данных нами были рассчитаны площади под ROC-кривыми зависимости показателей «параметр/время». Анализируемый период времени во всех случаях был равен ровно 3 годам. В таблице 4 представлены средние значения (медиана) и квартили (Q25%; Q75%) полученных площадей под ROC-кривой в каждой подгруппе.
Средние значения по разным параметрам были следующими: параметр MD составил -3731,31 (–8567,98; –1874,48); PSD – 2018,53 (1648,15; 4999,37); «площадь нейроретинального пояска» – 1437,95 (1217,44; 1643,75); «объем нейроретинального пояска» – 332,83 (233,74; 458,63); «соотношение горизонтального и вертикального параметров экскавация/диск» – 577,11 (329,49; 789,24) и 510,05 (229,36; 735,81) соответственно. Изменение площадей под ROC-кривой в зависимости от групп закономерно и связано с тем, что форма графика зависимости «параметр/время» становилась более крутой или пологой в разных группах. К примеру, если обратить внимание на показатель MD, то эта закономерность особенно четко прослеживается в динамике: от 1-й подгруппы, где площадь в среднем составила 2255,10 (3632,67; 1377,47), до 6-й подгруппы, где она уже составила 20361,28 (28211,07; 15722,46).
За весь период наблюдения были выявлены достоверные изменения 2-х параметров между 1-й, 3-й и 5-й подгруппами (стабилизированный характер глаукомы) и изменение 5 параметров между 2-й, 4-й и 6-й подгруппами (прогрессирующая глаукома). При стабильном течении глаукомного процесса были выявлены различия в изменении функциональных показателей MD и PSD (р<0,01) у пациентов с начальной и развитой стадиями глаукомы, а также у больных с начальной и далеко зашедшей стадиями соответственно. Достоверные изменения были также установлены и при сравнении данных лиц со II и III стадиями заболевания (показатель MD, р=0,011). При сравнении начальной и далеко зашедшей стадии заболевания, кроме установленных достоверных различий в функциональном статусе, были также выявлены различия в показателе «вертикальное соотношение экскавация/диск» (р=0,037). У лиц с прогрессирующей глаукомой также были обнаружены статистически достоверные различия при попарном сравнении функциональных показателей (p<0,01, во всех случаях). Вместе с тем если глаукомный процесс неуклонно прогрессировал, то при сравнении стадий различия были выявлены в большем количестве морфометрических параметров. Так, уже при сравнении результатов морфометрических показателей I и II стадии различия были выявлены в вертикальном соотношении экскавация/диск (р=0,025). Далее, при анализе данных лиц с развитой и далеко зашедшей глаукомой к этим параметрам также присоединилась и разница в горизонтальном соотношении экскавация/диск (р=0,03). При анализе данных I и III стадий выявлялись максимальные различия по всем морфометрическим параметрам, кроме показателя «площадь нейроретинального пояска», критерий значимости которого составил 0,074.
Полученные данные свидетельствуют о том, что в случае прогрессирования глаукомного процесса достоверные изменения определяются почти по всем изученным нами параметрам – как по данным статической периметрии, так и по данным исследования ДЗН (MD, PSD, rim volume, horizontal cup/disk ratio, vertical cup/disk ratio). В случае же стабилизированного течения заболевания (анализ в пределах одной стадии болезни) внимание следует обращать в первую очередь на функциональные, а не на морфометрические изменения. Изменения, скорее всего, становятся заметными при анализе периметрических индексов.
При сравнении групп с одинаковой стадией, но разным характером прогрессирования нами были получены результаты, приведенные в таблице 5.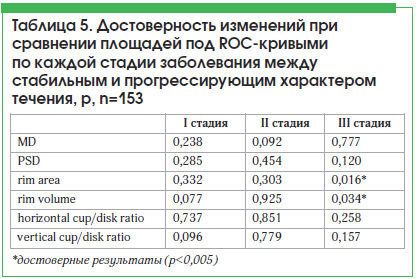
Достоверно значимые различия были выявлены только у лиц с далеко зашедшей стадией глаукомы и только между показателями «площадь нейроретинального пояска» и «объем нейроретинального пояска» (р=0,016 и р=0,034 соответственно). Таким образом, можно сделать вывод, что изменения параметров в пределах I или II стадии не зависят от характера прогрессирования, значимость характера прогрессирования появляется при переходе из одной стадии глаукомного процесса в следующую. Однако изменения параметров «rim area» и «rim volume» на III стадии могут говорить о прогрессирующем характере течения заболевания.
Заключение
Деление глаукомы на стабилизированную и прогрессирующую все еще условно, и даже на современном этапе недостаточно сформулированы специфические характеристики прогрессирования глаукомного процесса (показатель скорости прогрессирования заболевания и его индивидуальные характеристики), в зависимости в т. ч. от стадии заболевания.
Установленные результаты позволяют сделать вывод о приоритетах отдельных морфофункциональных показателей, являющихся несомненным предметом мониторинга для определения характера прогрессирования глаукомного процесса, в зависимости от стадии заболевания. К числу таких показателей следует отнести: MD – при оценке функциональных изменений (но в случае отсутствия сопутствующей патологии преломляющих сред); «горизонтальное и вертикальное соотношение экскавация/диск» – при оценке морфометрических параметров. Полученные данные свидетельствуют о том, что в случае прогрессирования глаукомного процесса достоверные изменения определяются почти по всем изученным нами параметрам (MD, PSD, rim volume, horizontal cup/disk ratio, vertical cup/disk ratio) – как по данным САП, так и по данным исследования ДЗН. В случае же стабилизированного течения заболевания в пределах отдельно взятой одной стадии глаукомы внимание следует обращать в первую очередь на функциональные, а не на морфометрические изменения.
Скорость прогрессирования глаукомного процесса зависит от стадии болезни, а также от характера прогрессирования. При прогрессирующей глаукоме скорость ухудшения функций больше на 0,678 дБ/год по сравнению со стабилизированной глаукомой.
Три года наблюдения являются достаточным сроком для определения характера прогрессирования заболевания на фоне проводимого лечения.
Источник
Открытоугольная глаукома – хроническое прогрессирующее нарушение работы глаз, которое выражается в повышении внутриглазного давления и, как следствие, повреждении зрительного нерва. К основным симптомам глаукомы относят снижение остроты зрения, нарушение аккомодации, дискомфорт и даже боли.

Открытоугольная глаукома и ее особенности
Отличие открытоугольной глаукомы от закрытоугольной заключается в том, что внутриглазное давление нестабильно при открытом угле передней камеры глазного яблока. В этом состоянии у человека периодами или регулярно повышаются значения внутриглазного давления выше индивидуальной нормы. Это провоцирует разрушение диска зрительного нерва и клеток сетчатки, что существенно влияет на характеристики зрения.
Считается, что задержка внутриглазной жидкости обусловлена повышенным сопротивлением оттока продуктами обмена, белками и пигментами. Нарушение имеет тенденцию ухудшаться, болезнь прогрессирует и появляются выраженные симптомы. Длительная задержка глазной влаги провоцирует стойкое повышение внутриглазного давления и губительно влияет на зрительный нерв. Регулярное повышение ВГД неминуемо приводит к атрофии волокон нерва и слепоте.
Помимо механического повреждения нервной ткани, давление негативно влияет на сосуды, снижая кровоснабжение сетчатки и зрительного нерва. Симптомы повреждения проявляются постепенно. Обычно человек даже не замечает основной симптом глаукомы – сужение или выпадение периферических полей зрения.
Открытоугольная глаукома нередко становится причиной инвалидности по зрению. Это заболевание является второй самой распространенной причиной слепоты. По данным ВОЗ более 70 миллионов людей страдают от открытоугольной глаукомы в той или иной степени. Чаще всего болезнь диагностируют у людей старше 60 лет, хотя возможно развитие глаукомы у молодых людей и даже детей.
Стадии развития и особенности протекания глаукомы
По степени выраженности повреждений разделяют начальную, развитую, далекозашедшую и терминальную стадии глаукомы. На начальном этапе болезнь прогрессирует медленно, но без лечения от развития глаукомы до потери зрения проходит 4-7 лет.
Вне зависимости от стадии глаукома может быть:
- компенсированной, когда значения давления при лечении сохраняются в пределах индивидуальной нормы (ниже 26 мм. рт. ст.);
- субкомпенсированной, когда давление выше нормы (26-32 мм. рт. ст.);
- некомпенсированной, когда значения выше 33 мм. рт. ст.
По скорости прогрессирования нарушений и поддаваемости лечению различают стабильную и нестабильную глаукому. Стабильное течение отличается тем, что показатели давления хорошо корректируются препаратами и длительное время нет отрицательной динамики в состоянии зрительного нерва. Нестабильная глаукома не всегда компенсируется даже самыми эффективными методами лечения, а состояние зрительного нерва постоянно ухудшается.

Причины открытоугольной глаукомы
У большинства пациентов причиной нарушения стала генетическая предрасположенность. Установлено, что при наличии глаукомы у родителей, братьев или сестер, вероятность появления нарушений повышается в 3-4 раза. Открытоугольная глаукома наследуется по полигенному типу, то есть при изменении условий среды признаки болезни могут не проявить или проявиться в слабом виде. Это делает возможной и очень важной профилактику полигенных заболеваний.
Предпосылок к глаукоме множеством, но пусковые факторы на данный момент медициной не установлены. Поэтому представление об этиологии открытоугольной глаукомы остается размытым. Считается, что важную роль в развитии болезни играет блокада склеральной пазухи.
Какие аномалии развития глаза могут вызывать глаукому:
- уменьшение угла наклона Шлеммова канала;
- патологии крепления склеральной шпоры, а иногда еще и цилиарной мышцы;
- низкая дифференциация склеральной споры.
Как правило, такие аномалии с возрастом усугубляются. Человек может сам поспособствовать развитию глаукомы, принимая глюкокортикоиды длительное время. Эти препараты снижают проницаемость трабекулярной сети и угнетают отток водянистой влаги. Важным фактором также является нарушение механизмов кровообращения в зоне диска зрительного нерва.
При каких заболеваниях повышается риск развития глаукомы:
- атеросклероз;
- близорукость;
- сахарный диабет;
- гипертоническая болезнь;
- серьезные нарушения метаболизма.
Симптоматика открытоугольной глаукомы
Скорость развития болезни и симптомы зависят от формы глаукомы. Особенности клинической картины определяются причинами повышения внутриглазного давления.
Формы открытоугольной глаукомы:
- Простая первичная. Для этой формы характерно поражение обоих глаз. На раннем этапе развития болезни симптомы, как правило, не проявляются. В дальнейшем отмечаются субъективные признаки: снижение аккомодации, радужные круги в поле зрения при взгляде на источники света, затуманенность зрения, эффект мерцания. Непосредственно во время приступа глаукомы пациенты жалуются на головные боли, распространяющиеся на глаза и брови.
- Псевдоэксфолиативная. Обычно эту форму диагностируют у людей, которые имеют в анамнезе эксфолиативный синдром. Заболевание характеризуется отложением слоя амилоидоподобного вещества в переднем полюсе глаза. Нарушение метаболизма в организме приводит к отложению псевдоэксфолиаций на цилиарном теле и поверхности хрусталика. Это отложения белкового происхождения, которые могут заблокировать дренажную систему. Наличие псевдоэксфолиаций также указывает на слабость связочного аппарата хрусталика. Установить наличие глаукомы можно по изменению контура зрачка, дрожи хрусталика при движении глаз, депигментации центра радужки. Псевдоэксфолиативная глаукома отличается от других форм более высокими значениями внутриглазного давления.
- Пигментная. Эта форма глаукомы развивается при попадании пигмента радужки в область роговично-склеральной перегородки посредством оттока внутриглазной жидкости. Даже у здорового человека пигмент из радужки вымывается и скапливается в дренажной сети угла переднего отрезка глаза, но при глаукоме его в разы больше.
- Глаукома нормального давления. В подавляющем большинстве случаев эту форму диагностируют у людей старше 35 лет, и нарушение функциональности глаз происходит в разной степени. Заболевание развивается при нормальных значениях давления и открытом угле передней камеры, а причиной становится артериальная гипертензия из-за спазма сосудов.

Диагностика глаукомы
Даже первичный офтальмологический осмотр позволяет заподозрить глаукому при ее наличии. Основной диагностики открытоугольной глаукомы является измерение внутриглазного давления по методикам тонометрии, суточной тонометрии, эластотонометрии. С их помощью офтальмолог может фиксировать изменения на протяжении дня и при определенных условиях.
Для уточнения диагноза проверяют состояние глазного дна, угол передней камеры и обследуют поле зрения. Открытоугольная глаукома провоцирует сужение полей зрения и появление скотом (парацентральные, скотомы Бьеррума). Сужение полей развивается с половины от носа.
Методы диагностики открытоугольной глаукомы:
- тонометрия (измерение внутриглазного давления);
- офтальмоскопия (осмотр глазного дна);
- периметрия (обследование полей зрения);
- оптическая когерентная томография (высокоинформативный метод обследования сетчатки и зрительного нерва);
- гониоскопия (визуализация угла передней камеры и области роговично-склеральной трабекулы для выявления склерозивных изменений и усиленной пигментации).
При осмотре глазного дна видны бледность и значительное расширение сосудистой воронки ДЗН. Стремительное прогрессирование открытоугольной глаукомы провоцирует атрофию второй пары черепных нервов и сплетений сосудов в глазном яблоке. Впоследствии развивается кольцо препапилярной атрофии.
Оптическая когерентная томография и сканирующая офтальмоскопия позволяют детальнее изучить патологический процесс. Дифференциальную диагностику проводят с сенильной катарактой.
Консервативное лечение открытоугольной глаукомы
Врач должен выбирать стратегию лечения исходя из стадии глаукомы и типа ее течения. Возможно консервативное, лазерное и хирургическое снижение внутриглазного давления.
Чтобы повлиять непосредственно на причину открытоугольной глаукомы, пациенту назначают гипотензивные препараты для улучшения оттока глазной жидкости. Для этого подходят простагландины (Травопрост, Латанопрост) и М-холиномиметики (пилокарпина гидрохлорид).
Для угнетения секреции внутриглазной жидкости необходимо принимать адреноблокаторы (Проксодолол, Тимолол), ингибиторы карбоангидразы (Диакарб), альфа-2-агонисты (Бримонидин). В комплексе также назначают осмотические диуретики вроде Маннитола.
Задача нейропротекторной терапии при глаукоме заключается в защите нейронов сетчатки и нервных волокон зрительного нерва. Для этих целей назначают витамины, флавоноиды (альфа-токоферол, гамма-аминомасляная кислота), блокаторы каналов кальция (Нифедипин), неферментные антиоксиданты.

Лазерная терапия глаукомы
Показания к лазерному лечению при открытоугольной глаукоме очень ограничены. Лазерную иридэктомию проводят лишь при узком роговично-склеральном угле, а трабекулопластику – при неэффективности консервативных методов.
Лазерная иридэктомия подразумевает создание на периферии радужки небольшого отверстия, которое позволяет устранить функциональный зрачковый блок и нормализовать внутриглазное давление. Такую операцию проводят при 1-3 стадиях первичной открытоугольной глаукомы, когда имеется выраженная подвижность иридохрусталиковой диафрагмы.
Иридэктомию проводят в амбулаторных условиях с применением местной анестезии. На глаз пациента устанавливают гониолинзу, которая будет фокусировать луч лазера на выбранный участок радужки. Обычно для прокалывания выбирают верхний сектор радужки.
Возможные осложнения:
- формирование несквозного отверстия;
- кровотечения;
- помутнение роговицы;
- повреждение капсулы хрусталика;
- эффект второго зрачка.
Во избежание осложнений врач должен провести гониоскопию перед процедурой и добиться максимального сужения зрачка непосредственно перед операцией. При правильном проведении и отсутствии осложнений лазерная иридэктомия оказывается эффективной в 95% случаев.
Лазерная трабекулопластика считается самым безопасным и эффективным лазерным методом лечения глаукомы на сегодняшний день. Операция позволяет нормализовать давление даже у тех пациентов, которые плохо отвечают на лечение антиглаукоматозными каплями.
Хотя такая лазерная операция не может вернуть остроту и качество зрения, она останавливается прогрессирование глаукомы и предотвращает тяжелые осложнения, в том числе слепоту. Вмешательство также проводят амбулаторно. С помощью лазерного луча на трабекулярную сеть – часть дренажной системы – наносят крошечные точечные ожоги. Процедура занимает примерно 30 минут.
Лазерная трабекулопластика показана при первичной открытоугольной или узкоугольной глаукоме после иридотомии. Эффективность операции высока, но возможно неполное выполнение с необходимостью повторного вмешательства. У некоторых пациентов через 2 года отмечается критическое повышение ВГД. В таких случаях назначают обычную операцию.

Возможные осложнения трабекулопластики:
- инфицирование;
- аллергическая реакция;
- временный скачок внутриглазного давления (в первую неделю после операции);
- недостаточная результативность (у 12% пациентов).
Хирургическое лечение глаукомы
Оперативное лечение открытоугольной глаукомы предполагает синустрабекулэктомию. Это непроникающая фильтрующая операция, которую проводят в несколько этапов. Обычно перерыв между операциями составляет 4-6 недель.
В ходе операции врач создает новый путь для оттока внутриглазной влаги из обеих камер глазного яблока. Под склерой и слизистой создается фильтрационная подушка, которая стабилизирует давление. Модификацией техники считается имплантация под склеральный лоскут мини-шунта, то есть миниатюрного дренажа. Благодаря его конструкции обеспечивается стабильный отток жидкости.
После операции глаз закрывают повязкой на несколько дней. Терапия каплями обязательна. Поверхностные швы снимают через 7-10 дней. В период реабилитации рекомендуется ограничить потребление соли и маринованной пищи, а также алкоголя. Нельзя тереть глаза в течение 10 дней. Важно защищать прооперированную область от воды и пыли. Спать рекомендуется на боку, противоположном от глаза, в которое проводилось вмешательство. Во избежание травм лучше ограничить физическую активность.
Преимущества синустрабекулэктомии:
- пациент возвращается домой почти сразу после операции;
- процедура оперирования одного глаза занимается 20 минут;
- безболезненность;
- быстрая реабилитация (1-3 недели);
- отсутствие постельного режима;
- минимальные ограничения в период восстановления.
Положительный эффект после синустрабекулэктомии отмечается в 60-80%. У остальных пациентов возникает необходимость повторить операцию. После лечения проходить обследования нужно дважды в год, чтобы вовремя выявить осложнения и другие нарушения в работе зрительной системы.

Прогноз и профилактика
Несмотря на то, что даже современные методы лечения не позволяют избавиться от глаукомы навсегда, терапия помогает сохранить зрение и обеспечить комфортную жизнь пациенту. Даже если глаукома не сопровождается выраженными симптомами, нельзя отказываться от лечения, ведь патология постоянно прогрессирует и на позднем этапе развития приводит к необратимой слепоте.
Факторы риска:
- возраст от 40 лет;
- наличие глаукомы у родственников;
- рефракционные нарушения;
- сахарный диабет;
- наличие псевдоэксфолиаций;
- длительная терапия кортикостероидами (лечение бронхиальной астмы, аутоиммунных заболеваний);
- сбои в центральном кровообращении (гипертония или гипотония, инфаркт миокарда, вегетососудистая дистония, нарушения мозгового кровообращения);
- сбои в местном и региональном кровообращении (сосудистые спазмы, мигрень, сужение просвета сонной артерии);
- болезни щитовидной железы.
Наличие каждого из факторов риска повышается вероятность развития глаукомы. Если имеется сразу несколько тревожных сигналов, рекомендуется чаще посещать окулиста и реагировать на все симптомы. На ранней стадии глаукомы прогноз, как правило, благоприятен. Человек может осуществлять жизнедеятельность и работать практически на любой должности.
Профилактика глаукомы у людей без предрасположенности сводится к прохождению


