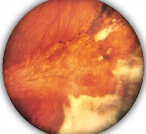
Пигментная абиотрофия сетчатки фото
Абиотрофия сетчатки – разнородная группа наследственных заболеваний дистрофического характера, обусловленных постепенным разрушением сетчатки со снижением остроты зрения, а при некоторых формах — полной слепотой. Симптомы вариабельны: может наблюдаться снижение остроты зрения, гемералопия, нарушения цветового восприятия. Диагностика осуществляется офтальмологическими и генетическими методами (офтальмоскопия, электроретинография, флуоресцентная ангиография, изучение семейного анамнеза и выявлением дефектных генов). При большинстве форм абиотрофии сетчатки специфическое лечение отсутствует, симптоматическая и поддерживающая терапия способна ослабить некоторые симптомы и замедлить прогрессирование болезни.
Общие сведения
Абиотрофия сетчатки (дегенерация сетчатки, дистрофия сетчатки) – патология органа зрения, при которой развивается дистрофия сетчатой оболочки глаза. Может быть частью симптомокомплекса некоторых наследственных заболеваний, выступать как самостоятельная патология, в некоторых случаях возможна вторичная дегенерация после травм и других воздействий.
Самостоятельные наследственные формы абиотрофии сетчатки имеют разную распространенность, в среднем она колеблется в пределах 1-10:10000. Механизм наследования различных форм может быть аутосомно-доминантным, аутосомно-рецессивным и сцепленным с полом. По этой причине наблюдаются сильные различия и в половом распределении заболевания – от равной поражаемости лиц обоих полов до практически полного превалирования мужчин среди заболевших (при Х-сцепленном наследовании). Генетически обусловленная абиотрофия сетчатки — наиболее распространенная причина потери зрения наследственного характера.
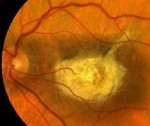
Абиотрофия сетчатки
Причины
Этиология абиотрофии сетчатки различается в зависимости от конкретного типа заболевания. Общий механизм – мутация определенного гена или генов, которые кодируют специфические белки, участвующие в жизнедеятельности сетчатой оболочки глаза. При этом патогенез большинства форм изучен недостаточно.
Пигментная дистрофия сетчатки. Причиной наиболее распространенной формы абиотрофии сетчатки – пигментной дистрофии – могут являться более 150 вариантов мутаций в нескольких десятках генов, большинство из которых наследуются по аутосомно-доминантному типу. Почти четверть всех случаев пигментной абиотрофии сетчатки обусловлена различными мутациями в гене белка опсина. В гене белка фоторецепторов CRB1 мутация имеет рецессивный характер наследования, а в генах RP2 и RPGR – сцепленный с Х-хромосомой.
Существует редчайшая форма пигментной абиотрофии сетчатки с мутацией в митохондриальной ДНК и, следовательно, наследованием от матери потомству. Несмотря на огромное количество разнообразных вариантов первичного нарушения при пигментном ретините, патогенез заболевания в целом одинаков – происходит нарушение утилизации отработанных палочек, в результате чего они становятся источником токсинов в сетчатке. Из-за того, что концентрация палочек растет по направлению к периферии сетчатой оболочки, патологические изменения начинаются именно там, образование новых фоточувствительных клеток замедляется, что и ведет к снижению светочувствительности.
Белоточечная абиотрофия сетчатки ассоциируется с мутациями одного из четырех генов — RHO, PRPH2, RDH5 или RLBP1, при этом наиболее распространена форма, обусловленная изменениями гена PRPH2, кодирующего белок периферин. Заболевание наследуется по аутосомно-рецессивному типу. Предполагается, что периферин участвует в стабилизации мембран фоторецепторов, главным образом палочек, поэтому нарушения в его структуре делают их менее устойчивыми и приводит к их разрушению. Белоточечная абиотрофия сетчатки имеет прогрессирующее течение, при этом первые нарушения (которые заметны при осмотре глазного дна в виде белых точек) образуются на периферии сетчатки.
Желтопятнистая абиотрофия сетчатки (болезнь Штаргардта) также обусловлена мутациями нескольких генов. Наиболее распространенная форма желтопятнистой дегенерации сетчатой оболочки связана с нарушением структуры белка ABCA4, который выполняет транспортные и энергетические функции в мембранах фоторецепторов. Эта форма заболевания наследуется по аутосомно-рецессивному типу. Изменение структуры трансмембранного белка ABCA4 приводит к накоплению в сетчатке токсичных метаболитов (в частности, липофусцина), что и вызывает дистрофию светочувствительного слоя.
Другой вариант болезни Штаргардта с аутосомно-доминантным наследованием обусловлен изменением структуры белка ELOVL4, который контролирует образование длинноцепочных жирных кислот в тканях глаза. В этом случае дегенерация фоторецепторов связана с нарушением синтеза некоторых компонентов их мембран. Еще один тип желтопятнистой абиотрофии сетчатки ассоциируется с мутацией гена PROM1. Патогенез нарушений в этом случае досконально не изучен.
Абиотрофия сетчатки Беста вызвана мутациями гена BEST1, продуктом транскрипции которого является белок бестрофин, относящийся к классу анионных каналов. Наследование аутосомно-доминантное, патогенез дистрофии неизвестен.
Врожденная стационарная ночная слепота является генерализованной абиотрофией сетчатки с преимущественным поражением палочек, она также сопровождается другими нарушениями органа зрения – косоглазием, катарактой. Выделяют полную и неполную формы врожденной стационарной ночной слепоты, обе наследуются по Х-сцепленному механизму.
Полный тип обусловлен мутацией гена NYX, кодирующего белок, обеспечивающий передачу возбуждения от палочек биполярным клеткам. В результате этого передача информации от фоторецепторов нарушается, возникает гемералопия с практически полным отсутствием зрения в темноте, при этом острота и цветовое восприятие обычно не страдают.
Неполная форма связана с мутацией гена CACNA1F, продуктом которого является схожий белок, но он имеется как у палочек, так и у колбочек. При этом, однако, передача импульса не блокируется полностью, поэтому сумеречное зрение только ослаблено, но также страдает острота и цветовое восприятие.
Классификация
В офтальмологии все наследственные формы дистрофии сетчатой оболочки глаза делят на три группы:
- Периферические, при которых нарушения возникают преимущественно по краям глазного дна, но при некоторых формах абиотрофии они могут прогрессировать и захватывать центральные области, вплоть до желтого пятна. Кроме того, при них сильнее всего страдает периферическое зрение, нарушается адаптация глаза к темноте, часто возникает гемералопия. К ним относят пигментную и белоточечную абиотрофию сетчатки.
- Центральные, которые характеризуются преимущественным поражением желтого пятна и центральных областей глазного дна. При этом нарушается цветовое восприятие, сильно падает острота зрения. Именно такие проявления сопровождают болезнь Штаргардта и болезнь Беста.
- Генерализованные. При некоторых мутациях или их сочетании абиотрофия сетчатки может затрагивать всю сетчатую оболочку глаза, поэтому некоторые исследователи выделяют и третью группу дистрофий – генерализованные. Врожденная стационарная ночная слепота относится именно к такому типу. Генерализованные нарушения сетчатки сопровождают другие наследственные заболевания – например, амавроз Лебера.
При этом из-за большого количества различных мутаций вышеописанное разделение несколько условно. Так, некоторые формы пигментной дистрофии могут приобретать генерализованный характер, а при мутации гена PROM1 (четвертый тип болезни Штаргардта) абиотрофия от центральных областей сетчатки может распространяться на периферию.
Симптомы абиотрофии сетчатки
Симптомы абиотрофии сетчатки довольно вариабельны из-за большого количества различных мутаций, которые приводят к развитию данной патологии. Но в тоже время, между различными вариантами дистрофии в пределах одной группы (периферические, центральные или генерализованные абиотрофии) имеется ряд схожих проявлений.
Периферические абиотрофии сетчатки (пигментная дистрофия, белоточечная абиотрофия) начинаются с преимущественного поражения палочек, поэтому одним из первых симптомов заболевания будет гемералопия. С прогрессированием патологии, при дальнейшем разрушении палочек, снижение ночного зрения может перерасти в его полную потерю – никталопию. Нарушается периферическое зрение, возникает концентрическая скотома, после которой поле зрения сужается настолько, что становится «трубчатым».
При белоточечной абиотрофии сетчатки более тяжелые нарушения чаще всего не развиваются, дневное зрение и цветовосприятие остается без изменений. В ряде случаев пигментной дистрофии в патологический процесс вовлекаются и колбочки, что ведет к падению дневного зрения, снижению его остроты и иногда полной слепоте. Течение заболевания может занимать десятки лет, хотя встречаются и быстротечные, а также ювенильные формы.
Центральные абиотрофии сетчатки характеризуются преимущественным поражением колбочек, концентрация которых наиболее высокая в области желтого пятна – поэтому их также называют макулодистрофиями. На первый план выступает резкое снижение остроты зрения, нарушается восприятие цветов, при полном разрушении фоторецепторов в центре глазного дна развивается центральная скотома.
Если патологический процесс не распространяется на периферические области сетчатки, то периферическое и сумеречное зрение затрагивается слабо. При формах абиотрофии, характеризующихся очаговым поражением фоторецепторов, развиваются слепые пятна в поле зрения. При особо тяжелых формах может возникать атрофия волокон зрительного нерва и полная слепота.
Полная форма врожденной стационарной ночной слепоты характеризуется выраженной никталопией с сохранением дневного зрения и цветового восприятия. При этом прогрессирования заболевания не происходит. Симптомами неполной формы ВСНС является умеренная гемералопия, пониженная острота зрения, аномалии цветового зрения, сложность адаптации к пониженной освещенности.
Диагностика
Пациенты с абиотрофией сетчатки должны быть проконсультированы генетиком и офтальмологом. Определение дистрофических процессов в сетчатой оболочке глаза производится на основании данных осмотра глазного дна, электроретинографии, исследования остроты зрения и цветового восприятия. Немаловажную роль играет изучение наследственного анамнеза, а также генетические исследования на предмет выявления мутаций в генах, ассоциированных с тем или иным типом абиотрофии сетчатки.
При пигментной дистрофии по периферии глазного дна выявляются очаги отложения пигмента, также они могут наблюдаться и на центральных участках при соответствующей форме заболевания. Отмечается сужение артериол сетчатки, а на поздних этапах возникает атрофия капилляров сосудистой оболочки глаза. В ряде случаев выявляется восковидная атрофия диска зрительного нерва. Электроретинография показывает значительное снижение амплитуды всех волн, что свидетельствует о резком уменьшении количества фоторецепторов в сетчатке. Секвенирование ДНК с целью выявления мутаций наиболее часто производится в отношении генов RP1, RHO, RDS, RLBP1, PRPF8 и ряда других.
Белоточечная абиотрофия сетчатки при осмотре глазного дна характеризуется наличием белых, иногда с металлическим оттенком, очагов, расположенных по периферии сетчатки. Артериолы сетчатой оболочки сужены, пигментные отложения представлены в единичном количестве, выявляется побледнение диска зрительного нерва. Изменения на электроретинографии выражены слабо и не являются надежным диагностическим критерием. Генетическая диагностика представлена секвенированием гена PRPH2.
При болезнях Штаргардта и Беста при офтальмоскопии обнаруживаются атрофические очаги светлого оттенка, нередко окруженные отложениями пигмента. Размеры и количество очагов может значительно отличаться и отражает тяжесть поражения сетчатой оболочки глаза. В основном они располагаются в центральных зонах, но могут распространяться и на периферию. На электроретинографии выявляется резкое снижение амплитуды волны А, что свидетельствует о преимущественном разрушении колбочек. Генетическая диагностика сводится к выявлению мутаций в генах ABCA4 и CNGB3 и изучению наследственного анамнеза.
Лечение абиотрофии сетчатки
Специфического этиотропного лечения любой формы абиотрофии сетчатки на сегодняшний момент не существует. В качестве поддерживающего лечения, задерживающего прогрессирование заболевания, используются препараты витаминов А, Е, рибофлавина. Сосудорасширяющие средства позволяют улучшить кровоснабжение сетчатки, что также замедляют дистрофические процессы.
В последние годы появились данные об успешном применении бионических имплантатов сетчатки (Argus, Argus 2), позволивших частично вернуть зрение пациентам, полностью утратившим его из-за абиотрофии. Некоторые наработки в области использования стволовых клеток, генной терапии также преследуют цель найти метод лечения абиотрофии сетчатки.
Прогноз
Из-за большого количества мутаций, которые являются причиной абиотрофии, и различного клинического течения дистрофических процессов в сетчатке прогноз практически всегда неопределенный. Некоторые типы пигментной дистрофии могут ограничиться гемералопией и нарушением периферического зрения, тогда как другие формы этой патологии ведут к полной слепоте. Путем приема препаратов витамина А в ряде случаев удается замедлить прогрессирование абиотрофии сетчатки, по некоторым данным использование солнцезащитных очков также позволяет достичь аналогичного результата.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 марта 2018;
проверки требуют 13 правок.
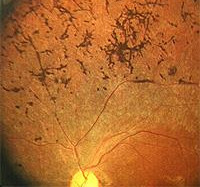
Пигментный ретинит (RP) — наследственное, дегенеративное заболевание глаз, которое вызывает сильное ухудшение зрения и часто слепоту[1]. Прогрессирование RP не является последовательным. Некоторые люди могут иметь симптомы с детства, другие могут заметить симптомы позднее[2]. В общем, чем позже начало, тем быстрее ухудшение зрения. Те, кто не имеет RP, имеют 90-градусное периферийное зрение, в то время как люди, имеющие RP, имеют периферийное зрение менее 90 градусов.
Как форма дистрофии сетчатки, RP вызвана аномалиями фоторецепторов (палочек и колбочек) или пигментного эпителия сетчатки (ПЭС) , ведущими к прогрессирующей потере зрения. Пострадавшие люди могут испытывать дефектную адаптацию от светлого к тёмному, от тёмного к светлому или никталопию (ночную слепоту), в результате дегенерации периферического поля зрения (так называемое туннельное зрение). Иногда раньше теряется центральное зрение, вынуждая человека смотреть искоса на объекты.
Эффект RP лучше всего иллюстрируется сравнением с экраном телевизора или компьютера. Светящиеся пикселы, формирующие изображение на экране можно приравнять к миллионам световых рецепторов на сетчатке глаза. Чем меньше пикселей на экране, тем менее отчётливо будет отображаться изображение. Менее 10 процентов фоторецепторов в глазе способны воспринимать цвет, при высокой интенсивности света в условиях яркого освещения или дневного света. Эти рецепторы расположены в центре круга сетчатки. Остальные 90 процентов фоторецепторов получают серую шкалу при низкой интенсивности света, используются при низкой освещённости и ночном видении и расположены по периферии сетчатки. RP разрушает световые рецепторы снаружи внутрь, от центра к краю, или по спорадическим путям с соответствующим снижением эффективности зрения. Это вырождение является прогрессирующим и не имеет никакого известного лечения.
Признаки и симптомы[править | править код]
Тот же вид с туннельным зрением от пигментного ретинита. Чернота вокруг центра изображения указывает не на тьму, а на отсутствие визуальной информации.
RP характеризуется прогрессирующей потерей фоторецепторов и в конечном итоге может привести к слепоте[3]. У людей могут возникнуть один или несколько следующих симптомов:
- Ночная слепота или никталопия;
- Туннельное зрение (отсутствует периферийное зрение);
- Периферийное зрение (отсутствует центральное зрение);
- Сеточное зрение;
- Антипатия к яркому свету;
- Медленная регулировка от темного к светлому, и наоборот;
- Нечеткость зрения;
- Плохое различение цветов;
- Крайняя усталость.
Ассоциированные условия[править | править код]
RP может быть:
(1) несиндромальной, то есть, это происходит в одиночку, без каких-либо других клинических данных,
(2) Синдромный с другими нейросенсорными расстройствами, нарушениями развития или сложными клиническими данными, или
(3) Вторичным к другим системным заболевания[4].
- RP в сочетании с глухотой (врождённой или прогрессирующей) называется синдромом Ушера.
- RP в сочетании с офтальмоплегией, дисфагией, атаксией, и пороками сердца, видимыми как митихондриальным DNA нарушением — Синдром Барде — Бидля (также известный как рваная красная волоконная миопатия)
- RP в сочетании с отсталостью, периферической невропатией, акантозными (с шипами) эритроцитами, атаксией, стеатореей, указывает на недостаток ЛПОНП, видимо из-за абеталипопротеинемии.
- RP с клинически видимым сочетанием с рядом других редких генетических заболеваний (в том числе мышечной дистрофией и хронической гранулематозной болезнью) как часть синдрома Маклеода. Это X-хромосомный рецессивный фенотип характеризуется полным отсутствием поверхностных XK-клеточных белков, и поэтому указывает на снижение экспрессии всех красных кровяных клеток келл-антигенов. Для целей переливания эти пациенты считаются полностью несовместимы со всеми нормальными и К0 / К0 донорами.
- RP, связанные с гипогонадизмом, и задержкой развития с аутосомно-рецессивным типом наследования, по-видимому с синдромом Лоуренс-Луна-Барде-Biedl
Другие условия включают в себя нейросифилис, токсоплазмоз ( Emedicine «Retinitis Pigmentosa») и синдром Рефсума.
Генетика[править | править код]
Пигментный ретинит (RP) является одним из наиболее распространённых форм наследственной дегенерации сетчатки[5]. Существуют различные гены, которые, будучи мутированы, способны привести к фенотипу пигментного ретинита[6]. В 1989, мутаций в гене родопсина, пигмент, который играет существенную роль в визуальной фототрансдукции в условиях низкой освещённости, выявлено не было. С тех пор, более 100 мутаций были обнаружены в этом гене, что составляет 15% от всех видов дегенерации сетчатки. Большинство из этих мутаций миссенс-мутации и наследуются в основном в доминирующей манере.
Типы включают в себя:
| OMIM | Ген | Тип |
|---|---|---|
| 180100 | RP1 | Пигментный ретинит-1 |
| 312600 | RP2 | Пигментный ретинит-2 |
| 300029 | RPGR | Пигментный ретинит-3 |
| 608133 | PRPH2 | Пигментный ретинит-7 |
| 180104 | RP9 | Пигментный ретинит-9 |
| 180105 | IMPDH1 | Пигментный ретинит-10 |
| 600138 | PRPF31 | Пигментный ретинит-11 |
| 600105 | CRB1 | Пигментный ретинит-12, аутосомно-рецессивный |
| 600059 | PRPF8 | Пигментный ретинит-13 |
| 600132 | TULP1 | Пигментный ретинит-14 |
| 600852 | CA4 | Пигментный ретинит-17 |
| 601414 | HPRPF3 | Пигментный ретинит-18 |
| 601718 | ABCA4 | Пигментный ретинит-19 |
| 602772 | EYS | Пигментный ретинит-25 |
| 608380 | CERKL | Пигментный ретинит-26 |
| 607921 | FSCN2 | Пигментный ретинит-30 |
| 609923 | TOPORS | Пигментный ретинит-31 |
| 610359 | SNRNP200 | Пигментный ретинит 33 |
| 610282 | SEMA4A | Пигментный ретинит-35 |
| 610599 | PRCD | Пигментный ретинит-36 |
| 611131 | NR2E3 | Пигментный ретинит-37 |
| 268000 | MERTK | Пигментный ретинит-38 |
| 268000 | USH2A | Пигментный ретинит-39 |
| 612095 | PROM1 | Пигментный ретинит-41 |
| 612943 | KLHL7 | Пигментный ретинит-42 |
| 268000 | CNGB1 | Пигментный ретинит-45 |
| 613194 | BEST1 | Пигментный ретинит-50 |
| 613464 | TTC8 | Пигментный ретинит 51 |
| 613428 | C2orf71 | Пигментный ретинит 54 |
| 613575 | ARL6 | Пигментный ретинит 55 |
| 613617 | ZNF513 | Пигментный ретинит 58 |
| 613861 | DHDDS | Пигментный ретинит 59 |
| 613194 | BEST1 | Пигментный ретинит, концентрический |
| 608133 | PRPH2 | Пигментный ретинит, дигенический |
| 613341 | LRAT | Пигментный ретинит, ювенильный |
| 268000 | SPATA7 | Пигментный ретинит, ювенильный, аутосомно-рецессивный |
| 268000 | CRX | Пигментный ретинит, запоздалый доминирующий |
| 300455 | RPGR | Пигментный ретинит, X-хромосомный, с синореспираторной инфекцией, с глухотой или без неё |
Ген родопсина кодирует главный белок наружных сегментов фоторецепторов. Исследования показывают, что мутации в этом гене ответственны примерно за 25% аутосомно-доминантных форм RP[5][7].
Мутации в четырёх пре-мРНК факторах сплайсинга как известно, вызывают аутосомно-доминантный пигментный ретинит. Это PRPF3 (человек с PRPF3 является с HPRPF3, а также с PRP3), PRPF8 , PRPF31 и PAP1 . Эти факторы экспрессируются повсеместно, и предполагается, что дефекты в повсеместном факторе (белок, экспрессируемый повсеместно) должны вызывать заболевание только в сетчатке, так как клетки фоторецепторов сетчатки имеют гораздо большую потребность в обработке белка (родопсина), чем любой другой тип клеток.
О свыше 150 мутациях, зарегистрированных на сегодняшний день в гене опсина, связанного с RP мутацией Pro23His в интрадискальном домене белка впервые было сообщено в 1990 году. Эти мутации встречаются по всему гена опсина и распределяются по трём областям белка (внутридисковому, трансмембранному и цитоплазматическому доменам). Одной из основных биохимических причин RP в случае мутаций белка родопсина является фолдинг белка и молекулярные шапероны.[8] Было обнаружено, что мутация кодона 23 в гене родопсина, в котором пролин преобразуется в гистидин, приходится наибольшая доля мутаций родопсина в Соединённых Штатах. Ряд других исследований сообщили о других мутациях, которые также коррелируют с болезнью. Эти мутации включают Thr58Arg, Pro347Leu, Pro347Ser, а также удаление Ile-255[7][9][10][11][12]. В 2000 году сообщалось о редкой мутации в кодоне 23 вызывающей аутосомно-доминантный пигментный ретинит, в которой пролин изменялся на аланин. Тем не менее, это исследование показало, что дистрофии сетчатки, связанная с этой мутацией была характерна мягкая форма и течение. Кроме того, тем более сохранено в электроретинографии амплитуд, чем более преобладала мутация Pro23His[13].
Патофизиология[править | править код]
Опыты на животных показывают, что пигментный эпителий неудачно фагоцитирует потерянные палочки внешнего сегмента диска, что ведёт к накоплению мусора из палочек внешнего сегмента. У мышей с гомозиготно-рецессивной дегенеративной мутацией сетчатки палочки фоторецепторов прекращают развитие и подвергаются дегенерации до завершения созревания клеток. Также присутствует дефект цГМФ-фосфодиэстеразы; это приводит к токсичным уровням цГМФ.
Симптомы[править | править код]
Пигментный ретинит (как правило, называют «RP») является заболеванием, которое характеризуется потерей светочувствительных клеток фоторецепторов, расположенных в задней части глаза, как плёнка в камере. Обычно палочки фоторецепторов (ответственные за ночное зрение) поражаются первыми, поэтому потеря ночного зрения (никталопия), является как правило, первым симптомом. Дневное зрение (при посредничестве колбочек) обычно сохраняется до поздних стадий заболевания. Пятнистость пигментного эпителия сетчатки с чёрной боне-спикулярной пигментацией (или патогномоничный симптом, как правило, указывает из пигментный ретинит. Другие глазные функции включают в себя паллор головки зрительного нерва, ослабление (истончение) сосудов сетчатки, целлофановую макулопатию, кистозный макулярный отёк и заднюю субкапсулярную катаракту.
Диагностика[править | править код]
Диагноз пигментного ретинита опирается на документацию прогрессирующей потери функций клеток фоторецепторов посредством электроретинографии (ЭРГ) и визуального тестирования поля.
Режим наследования RP определяется историей семьи. По крайней мере, 35 различных генов или локусов, как известно, вызывают «несиндромальный RP» (RP, не являющийся результатом другого заболевания или частью более широкого синдрома).
ДНК-тестирование доступно на клинической основе для:
- RLBP1 (аутосомно-рецессивный, тип Bothnia RP)
- RP1 (аутосомно-доминантный, RP1)
- RHO (аутосомно-доминантный, RP4)
- RDS (аутосомно-доминантный, RP7)
- PRPF8 (аутосомно-доминантный, RP13)
- PRPF3 (аутосомно-доминантный, RP18)
- CRB1 (аутосомно-рецессивный, RP12)
- ABCA4 (аутосомно-рецессивный, RP19)
- RPE65 (аутосомно-рецессивный, RP20)
Для всех других генов (например, DHDDS), молекулярное генетическое тестирование доступно только на исследовательской основе.
RP может быть унаследован аутосомно-доминантным, аутосомно-рецессивным, или Х-хромосомым образом. Х-хромосомный RP может быть или рецессивный, затрагивающий в первую очередь только мужчин, или доминирующий, затрагивающие как мужчин, так и женщин, хотя на мужчин, как правило, более мягко влияет. Некоторые дигенические (контролируемые двумя генами) и митохондриальные формы были также описаны.
Генетическое консультирование зависит от точного диагноза, определения типа наследования в каждой семье, и результатов молекулярно-генетического тестирования.
Лечение[править | править код]
В настоящее время нет лекарств от пигментного ретинита, но лечение, теперь доступно в некоторых странах. Прогрессирование заболевания может быть снижено за счёт ежедневного потребления 15000 МЕ (соответствует 4,5 мг) витамина А пальмитата у некоторых пациентов[14]. Последние исследования показали, что правильные витаминные добавки могут отсрочить слепоту до 10 лет (за счёт снижение годовых потерь с 10% до 8,3%) у некоторых пациентов в определённых стадиях заболевания[15]., Получивший признание на рынке, в феврале 2011 года, протез сетчатки Argus стал первым одобренным средством для лечения этого заболевания, доступен в Германии, Франции, Италии и Великобритании. Операция протезирования здесь описана. Промежуточные результаты долгосрочных исследований 30 пациентов были опубликованы в 2012 году[16].
Имплантат сетчатки Argus II также получил разрешение для экспериментального использования в США.[17][18][19] Устройство может помочь взрослым с RP, которые потеряли способность воспринимать формы и движения, чтобы быть более мобильными и выполнять ежедневные мероприятия. В июне 2013 года 12 больниц в США объявили в ближайшее время начать консультации для пациентов с RP в рамках подготовки к запуску Argus II в том же году[20].
Исследования[править | править код]
Лечение в будущем может включать трансплантацию сетчатки, искусственные имплантаты сетчатки[21], генную терапию, стволовые клетки, пищевые добавки, и / или лекарственную терапию.
2006: Стволовые клетки: Исследователи Великобритании, работающие с мышами, пересаживали мышам стволовые клетки уже на продвинутой стадии развития, и уже программировали развитие клеток фоторецепторов мышей, которые были генетически индуцированны, чтобы имитировать человеческие условия пигментного ретинита и возрасто-зависимую дегенерацию жёлтого пятна. Эти фоторецепторы развились и сделали необходимые нервные связи в сетчатке глаза животного, ключевой шаг в восстановлении зрения. Ранее считалось, что зрелая сетчатка не имеет регенеративной способности. Это исследование может в будущем привести к использованию пересадки на людях, чтобы облегчить слепоту[22].
2008: Учёные Биологического научного института Осака выявили белок, названный Пикачурин, который, по их мнению, может привести к лечению пигментного ретинита [23][24]
2010: Доступная генная терапия, кажется, работает на мышах[1].
2010: R-Tech Ueno (японский медицинское производственное предприятие) завершает вторую фазу клинических исследований офтальмологического раствора UF-021 (название продукта Ocuseva (TM)) для пигментного ретинита.
2012: Учёные из Медицинского центра Колумбийского университета показали, на животной модели, что генная терапия и терапия индуцированных плюрипотентных стволовых клеток могут быть жизнеспособными вариантами для лечения пигментного ретинита в будущем[25].
2012: Учёные из Университета Майами института глаза Баском Палмер представили данные, показывающие защиту фоторецепторов в животной модели, когда в глаза были введены мезенцефалические астроциты нейротрофического фактора (MANF)[26].
2014: исследование, проведённое в Университете Аликанте в Испании показали, что каннабиноиды из марихуаны могут замедлить потерю зрения в случаях пигментного ретинита[27].
Исследователи из Университета Беркли Калифорния, смогли восстановить зрение слепым мышам, эксплуатируя «photoswitch», который активизирует ганглиозные клетки сетчатки в образце с повреждёнными клетками палочек и колбочек[28].
2019: Ученые из Офтальмологического института Вилмера, Медицинской школы университета имени Джона Хопкинса и компании MD 3Nacuity Pharmaceuticals объявили о том, что исследовательский принимаемый во внутрь препарат N-ацетилцистеин (N-acetylcysteine) улучшает функционирование фоторецепторов-колбочек сетчатки глаза у пациентов с пигментным ретинитом.
Известные случаи[править | править код]
- Деррик Морган, ямайский ска, рокстеди и регги — музыкант.
- Нил Fachie, британский паралимпийский велосипедист. [29]
- Линди Хоу, австралийский тандем-велосипедист и пловец [30]
- Джон Уэллнер, американский актёр [31]
- Стив Уинн, американский бизнес-магнат и разработчик казино в Лас-Вегасе [32]
- Рэйчел Leahcar, австралийская певица
- Вилли Браун, бывший мэр Сан-Франциско
- Стив Лонеган, мэр Боготы, Нью-Джерси, Республиканский кандидат в Сенат США
- Аманда Своффорд, американская модель[33]
- Ричард Бернштейн, Мичиган судья Верховного суда.
- Ян Трехерн, британский фотограф.
- Мэтью Бентон, суперзвезда кабаре и владелец / управляющий директор / художественный руководитель танцоров Мэтью Бентон.
- Молли Бёрк, мотивационный спикер, блогер.
Примечания[править | править код]
- ↑ 1 2 Genetic Reactivation of Cone Photoreceptors Restores Visual Responses in Retinitis pigmentosa.
- ↑ Koenekoop, R.K.; Loyer, Magali; Hand, Collette K; Al Mahdi, Huda; Dembinska, Olga; Beneish, Raquel; Racine, Julie; Rouleau, Guy A. Novel RPGR mutations with distinct retinitis pigmentosa phenotypes in French-Canadian families (англ.) // American Journal of Ophthalmology (англ.)русск. : journal. — 2003. — Vol. 136, no. 4. — P. 678—668. — doi:10.1016/S0002-9394 (03)00331-3.
- ↑ Farrar G.J., Kenna P.F., Humphries P. On the genetics of retinitis pigmentosa and on mutation-independent approaches to therapeutic intervention (англ.) // The EMBO Journal (англ.)русск. : journal. — 2002. — March (vol. 21, no. 5). — P. 857—864. — doi:10.1093/emboj/21.5.857. — PMID 11867514.
- ↑ Daiger SP, Sullivan LS, Bowne SJ. Genes and mutations causing retinitis pigmentosa.
Clin Genet 2013: 84: 132–141. - ↑ 1 2 Hartong D.T., Berson E.L., Dryja T.P. Retinitis pigmentosa (англ.) // The Lancet. — Elsevier, 2006. — November (vol. 368, no. 9549). — P. 1795—1809. — doi:10.1016/S0140-6736 (06)69740-7. — PMID 17113430.
- ↑ OMIM 268000
- ↑ 1 2 Berson E.L., Rosner B., Sandberg M.A., Dryja T.P. Ocular findings in patients with autosomal dominant retinitis pigmentosa and a rhodopsin gene defect (Pro-23-His) (англ.) // JAMA Ophthalmology (англ.)русск. : journal. — 1991. — January (vol. 109, no. 1). — P. 92—101. — doi:10.1001/archopht.1991.01080010094039. — PMID 1987956.
- ↑ Senin I.I., Bosch L., Ramon E., et al. Ca2+/recoverin dependent regulation of phosphorylation of the rhodopsin mutant R135L associated with retinitis pigmentosa (англ.) // Biochemical and Biophysical Research Communications (англ.)русск. : journal. — 2006. — October (vol. 349, no. 1). — P. 345—352. — doi:10.1016/j.bbrc.2006.08.048. — PMID 16934219.
- ↑ Dryja T.P., McGee T.L., Reichel E., et al. A point mutation of the rhodopsin gene in one form of retinitis pigmentosa (англ.) // Nature : journal. — 1990. — January (vol. 343, no. 6256). — P. 364—366. — doi:10.1038/343364a0. — PMID 2137202.
- ↑ Dryja T.P., McGee T.L., Hahn L.B., et al. Mutations within the rhodopsin gene in patients with autosomal dominant retinitis pigmentosa (англ.) // The New England Journal of Medicine : journal. — 1990. — November (vol. 323, no. 19). — P. 1302—1307. — doi:10.1056/NEJM199011083231903. — PMID 2215617.
- ↑ Berson E.L., Rosner B., Sandberg M.A., Weigel-DiFranco C., Dryja T.P. Ocular findings in patients with autosomal dominant retinitis pigmentosa and rhodopsin, proline-347-leucine (англ.) // American Journal of Ophthalmology (англ.)русск. : journal. — 1991. — May (vol. 111, no. 5). — P. 614—623. — PMID 2021172.
- ↑ Inglehearn C.F., Bashir R., Lester D.H., Jay M., Bird A.C., Bhattacharya S.S. A 3-bp deletion in the rhodopsin gene in a family with autosomal dominant retinitis pigmentosa (англ.) // American Journal of Human Genetics (англ.)русск. : journal. — 1991. — January (vol. 48, no. 1). — P. 26—30. — PMID 1985460.
- ↑ Oh, Kean T.; Weleber, RG; Lotery, A; Oh, DM; Billingslea, AM; Stone, E.M. Description of a New Mutation in Rhodopsin, Pro23Ala, and Comparison With Electroretinographic and Clinical Characteristics of the Pro23His Mutation (англ.) // JAMA Ophthalmology (англ.)русск. : journal. — 2000. — 1 September (vol. 118, no. 9). — P. 1269—1276. — doi:10.1001/archopht.118.9.1269. — PMID 10980774.
- ↑ Berson, Eliot L.; Rosner, B; Sandberg, MA; Hayes, KC; Nicholson, BW; Weigel-DiFranco, C; Willett, W. A Randomized Trial of Vitamin A and Vitamin E Supplementation for Retinitis Pigmentosa (англ.) // JAMA Ophthalmology (англ.)русск. : journal. — 1993. — 1 June (vol. 111, no. 6). — P. 761—772. — doi:10.1001/archopht.1993.01090060049022. — PMID 8512476.
- ↑ Berson E.L. Long-term visual prognoses in patients with retinitis pigmentosa: the Ludwig von Sallmann lecture (англ.) // Exp. Eye Res. : journal. — 2007. — Vol. 85, no. 1. — P. 7—14. — doi:10.1016/j.exer.2007.03.001. — PMID 17531222.This is not verified by many Doctors
- ↑ Humayun, MS; Dorn, JD; da Cruz, L; Dagnelie, G; Sahel, JA; Stanga, PE; Cideciyan, AV; Duncan, JL; Eliott, D; Filley, E; Ho, AC; Santos, A; Safran, AB; Arditi, A; Del Priore, LV; Greenberg, RJ; Argus II Study, Group. Interim results from the international trial of Second Sight’s visual prosthesis (англ.) // Ophthalmology : journal. — 2012. — April (vol. 119, no. 4). — P. 779—788. — doi:10.1016/j.ophtha.2011.09.028. — PMID 22244176.
- ↑ FDA approves first retinal implant for rare eye disease. Reuters (14 февраля 2013). Дата обращения 14 февраля 2013.
- ↑ FDA approves first retinal implant for adults with rare genetic eye disease (недоступная ссылка). Food and Drug Administration (14 февраля 2013). Дата обращения 5 января 2015. Архивировано 23 декабря 2014 года.
- ↑ The blind may soon see again as science prepares to market high-tech cyborg eye. Daily Mail (9 февраля 2013). Дата обращения 12 февраля 2013.
- ↑ ‘First Bionic Eye’ Retinal Chip for Blind (29 июня 2013). Дата обращения 30 июня 2013.
- ↑ Rush University Medical Center (2005-01-31). Ophthalmologists Implant Five Patients with Artificial Silicon Retina Microchip To Treat Vision Loss from Retinitis Pigmentosa. Пресс-релиз. Архивировано из первоисточника 8 февраля 2005. Проверено 2007-06-16.
- ↑ MacLaren, RE; RA Pearson; A MacNeil; RH Douglas; TE Salt; M Akimoto; A Swaroop; JC Sowden; RR Ali. Retinal repair by transplantation of photoreceptor precursors (англ.) // Nature (journal) : journal. — 2006. — 9 November (vol. 444, no. 7116). — P. 203—207. — doi:10.1038/nature05161. — PMID 17093405.
- ↑ Sato S., Omori Y., Katoh K., et al. Pikachurin, a dystroglycan ligand, is essential for photoreceptor ribbon synapse formation (англ.) // Nat. Neurosci. : journal. — 2008. — August (vol. 11, no. 8). — P. 923—931. — doi:10.1038/nn.2160. — PMID 18641643.
- ↑ Lightning-Fast Vision Protein Named After Pikachu July 24, 2008
- ↑ Experiments show retinitis pigmentosa is treatable December 22, 2012
- ↑ OASIS
- ↑ THC May Slow Vision Loss From Retinitis Pigmentosa
- ↑ Restoring Visual Function to Blind Mice with a Photoswitch that Exploits Electrophysiological Remodeling of Retinal Ganglion Cells: Neuron
- ↑ Neil Fachie https://www.paralympics.org.uk/gb/athletes/neil-fachie Архивная копия от 31 августа 2012 на Wayback Machine
- ↑ McDonald, Margie. Wheel turns a full circle as proud Lindy rides for two countries in Beijing, The Australian (31 мая 2008), С. 54. Дата обращения 1 февраля 2012.
- ↑ CSI Cast: Jon Wellner. CBS. Дата обращения 5 октября 2010.
- ↑ Paumgarten, Nick Doh! Dept: The $40-Million Elbow. The New Yorker. Дата обращения 13 августа 2012.
- ↑ Interview with Metro Online. Дата обращения 4 сентября 2006.
Ссылки[править | править код]
- GeneReviews/NCBI/NIH/UW entry on Retinitis Pigmentosa Overview
- Patient support gr