Первичная открытоугольная глаукома журналы
Статье посвящена проблеме медикаментозного лечения первичной открытоугольной глаукомы и разработке индивидуального подхода. Рассматривается возможность применения программного приложения для расчета толерантного внутриглазного давления у пациентов с первичной открытоугольной глаукомой.
Актуальность
Глаукома остается одной из главных причин слепоты и слабовидения и является в настоящее время одной из актуальнейших проблем офтальмологии.
По данным Всемирной организации здравоохранения, число больных глаукомой в мире колеблется от 60,5 млн до 105 млн человек, причем в ближайшие 10 лет оно увеличится еще на 10 млн [1, 2].
Во многих высокоразвитых странах мира на долю глаукомы приходится 13–28% всей слепоты [3–9]. Среди причин слепоты и слабовидения в России глаукома занимает первое место. В нозологической структуре инвалидности доля глаукомы возросла с 20 до 28%, а в контингенте инвалидов пенсионного возраста — до 40% [3, 5, 10].
Определение толерантного внутриглазного давления
Повышенное внутриглазное давление (ВГД) является основным фактором риска развития глаукомной оптической нейропатии (ГОН) и снижения зрительных функций у больных первичной глаукомой. В настоящее время в литературе широко используются термины «индивидуальное», «толерантное», «интолерантное» и «целевое ВГД».
Впервые определение толерантного ВГД при глаукоме
было предложено А.М. Водовозовым в 1975 г. Индивидуально переносимое (толерантное, P tl) давление — максимальный уровень офтальмотонуса, не оказывающий повреждающего действия на внутренние структуры глазного яблока [11–17]. Толерантное ВГД можно определить у больных глаукомой по достоверному улучшению зрительных функций при медикаментозном снижении офтальмотонуса. Постоянное или периодическое повышение офтальмотонуса выше толерантного давления является основным фактором риска развития ГОН и снижения зрительных функций у больных первичной открытоугольной глаукомой (ПОУГ) [18].
Увеличение суточных колебаний ВГД на 1 мм рт. ст. приводит к увеличению риска прогрессирования ПОУГ на 30%. Снижение ВГД на 1 мм рт. ст. позволяет снизить риск прогрессирования глаукомы на 19% [19]. Доказано, что снижение повышенного офтальмотонуса до индивидуального уровня ВГД у больных ПОУГ способствует длительному сохранению зрительных функций [13, 17].
Цели лечения больных глаукомой: сохранение зрительных функций; достижение терапевтического эффекта при минимальном числе препаратов с минимумом побочных действий; сохранение качества жизни при доступных затратах [1, 2].
Эффективность лечения больных ПОУГ следует оценивать по следующим критериям: 1) нормализация офтальмотонуса — по достижении индивидуального ВГД; 2) стабилизация зрительных функций — по данным периметрии; 3) отсутствие прогрессирования ГОН — по данным оптической когерентной томографии (ОКТ) диска зрительного нерва (ДЗН) и сетчатки.
Целевое ВГД — условно выбранный офтальмологом безопасный уровень ВГД, который определяется как 20–30–40% снижение от исходного значения офтальмотонуса. В настоящее время целевое давление определяется с учетом стадии глаукомы (табл. 1) [1, 2]. Недостатком определения целевого давления является то, что не учитываются индивидуальные особенности пациента.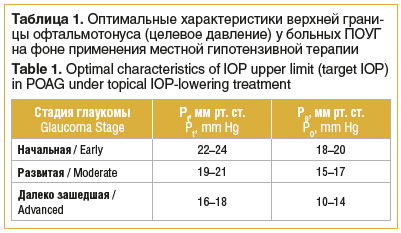
Верхняя граница индивидуальной нормы ВГД (толерантное ВГД) зависит в основном от диастолического уровня артериального давления (АД) в плечевой артерии и возраста пациента [17]. Таблица с соответствующими значениями доступна в литературе и приводится в Национальном руководстве по глаукоме для практикующих врачей [1, 2].
Таким образом, для достижения стабилизации
глаукомного процесса необходимо, чтобы офтальмотонус на фоне медикаментозного лечения у больных ПОУГ был ниже уровня толерантного давления на 2,5 мм рт. ст., а суточные колебания ВГД не превышали толерантное давление [17].
Применение программного приложения для определения толерантного ВГД
Для определения значения толерантного истинного ВГД у больных ПОУГ разработано программное обеспечение под Windows и для мобильных устройств Toliop на операционных системах IOS 8–10 и Аndroid. Данные программные продукты при расчете толерантного ВГД учитывают, помимо возраста и диастолического АД в плечевой артерии, также стадию глаукомы и офтальмобиометрические показатели: переднезадний размер глаза и толщину роговицы в центральной оптической зоне [11, 20–24], прогнозируют скорость прогрессирования глаукомы по величине индекса интолерантности (I int):
![]()
При величине I int менее 5,0 мм рт. ст. прогнозируется медленное прогрессирование глаукомного процесса, при I int свыше 5 мм рт. ст. — быстрое прогрессирование.
Для определения толерантного давления с помощью программного обеспечения необходимо ввести данные пациента: возраст, значения систолического и диастолического АД в плечевой артерии, фактическое ВГД (P0) на момент обследования, переднезадний размер глазного яблока, толщину роговицы в центральной оптической зоне и стадию глаукомы.
На рисунке 1 продемонстрирован пример расчета толерантного ВГД у пациента 60 лет. Толерантное ВГД (P0 tl) на OD равно 15,8 мм рт. ст., на OS — 11,7 мм рт. ст. Более низкое значение толерантного давления на левом глазу обусловлено «тонкой» роговицей в центральной оптической зоне и переднезадним размером глазного яблока, который был равен 26,7 мм. I int на OS равен 6,3 мм рт. ст., что указывает на вероятность быстрого прогрессирования глаукомы. Данный расчет можно распечатать и (или) сохранить в архиве. Время на внесение данных о пациенте и определение толерантного ВГД составляет 30 с.
Определение толерантного ВГД имеет важное значение для оценки и прогнозирования динамики зрительных функций у больных ПОУГ.
По данным исследователей, при стабилизированной глаукоме (1549 глаз, 94,6% случаев) среднее значение I int составило —1,5±0,04 мм рт. ст. Из них у 94,4% больных ПОУГ (1463 глаза) I int был меньше нуля и выражался отрицательным числом. У 5,6% больных ПОУГ (86 глаз) I int был менее 2 мм рт. ст. Это подтверждает, что для стабилизации зрительных функций необходимо, чтобы ВГД не превышало толерантное давление [17].
Определение уровня индивидуального ВГД у больного ПОУГ позволяет врачу:
своевременно скорректировать лечение для достижения индивидуальной нормы;
прогнозировать стабилизацию или прогрессирование глаукомного процесса, а также скорость прогрессирования ПОУГ;
своевременно направлять пациента на лазерное или хирургическое лечение глаукомы.
Важно знать, что прогрессирование глаукомы на фоне медикаментозного лечения может отмечаться при нормальных значениях офтальмотонуса в 36–42% случаев, когда колебания ВГД превышают уровень толерантного [17]. Если колебания офтальмотонуса не превышают толерантное ВГД, стабилизация зрительных функций наблюдается у больных ПОУГ в 94,6% случаев [17].
Принципы выбора местной гипотензивной терапии
Применение местных гипотензивных препаратов возможно в комбинации друг с другом, а также в сочетании с лазерными и хирургическими методами лечения.
Во время лечения необходимо снизить повышенное ВГД до уровня индивидуальной нормы, суточные колебания офтальмотонуса не должны превышать значений толерантного ВГД.
Лечение начинают с монотерапии лекарственным средством первого выбора [25].
При неэффективности или плохой переносимости пациентом лечения выполняют замену на лекарственный препарат из другой фармакологической группы или переходят к комбинированной терапии.
При комбинированной терапии не следует использовать более двух лекарственных средств одновременно, предпочтительно их применение в виде фиксированных комбинаций [26].
При проведении комбинированной терапии не следует применять препараты из одной фармакологической группы (два разных β-адреноблокатора, два разных простагландина).
Следует учитывать наличие противопоказаний к применению лекарственных препаратов у пациента, их переносимость и безопасность, наличие консервантов, содержащихся в лекарственном препарате, особенно при длительном лечении.
Для исключения тахифилаксии и побочных действий лекарственного препарата своевременно проводить плановую замену 2–3 раза в год на лекарственные средства из другой фармакологической группы.
Адекватность лечения регулярно проверяется исследованием состояния ДЗН и зрительных функций (при начальной стадии — 1 раз в 6 мес., при развитой и далеко зашедшей глаукоме — 1 раз в 3–4 мес.). Контроль ВГД проводится ежемесячно.
При снижении повышенного офтальмотонуса на фоне комбинированного медикаментозного лечения до уровня индивидуального ВГД больным с начальной стадией ПОУГ можно рекомендовать проведение селективной лазерной трабекулопластики (СЛТ) с целью улучшения оттока водянистой влаги (ВВ), возможности возврата на монотерапию или отмены антиглаукомных препаратов, улучшения качества жизни пациента и повышения приверженности больного лечению.
При неэффективности комбинированной медикаментозной терапии, когда колебания офтальмотонуса превышают уровень толерантного ВГД, больным ПОУГ следует рекомендовать хирургическое лечение глаукомы.
На рисунке 2 приводится алгоритм лечения пациентов с ПОУГ.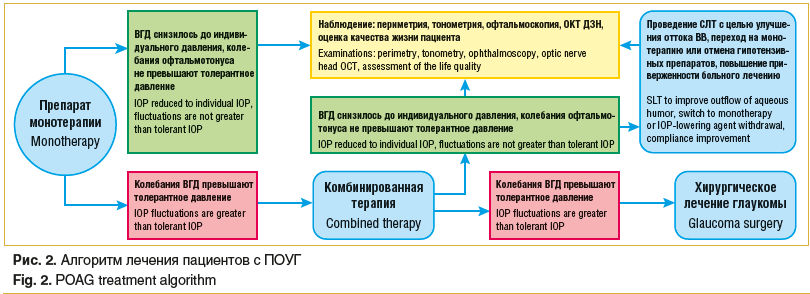
В таблице 2 представлены фармакологические группы для лечения глаукомы. Для снижения повышенного офтальмотонуса до индивидуального ВГД у больных ПОУГ предпочтение следует отдавать препаратам, которые эффективно снижают ВГД за счет улучшения оттока ВВ.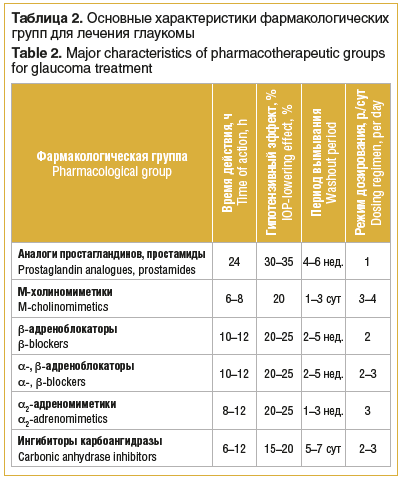
Многочисленные исследования показали, что в качестве препаратов первого выбора у пациентов с ПОУГ наиболее целесообразно использовать аналоги простагландинов и простамиды.
Аналоги простагландинов и простамиды — пролекарства, которые обладают выраженным гипотензивным действием: снижают офтальмотонус на 30–35% от исходного уровня за счет улучшения преимущественно увеосклерального пути оттока ВВ. К аналогам простагландина F2a относятся: латанопрост 0,005%, травопрост 0,004% и тафлупрост 0,0015%, к простамидам — биматопрост 0,03%.
Латанопрост представляет собой пролекарство в форме сложного изопропилового эфира — аналога простагландина F2α, обладающего высокой селективностью по отношению к FP-подтипу простаноидных рецепторов. После попадания в ткань роговицы латанопрост полностью гидролизуется эстеразами (считается, что никакими иными способами препарат в глазу не метаболизируется). Вслед за этим кислота латанопроста поступает в переднюю камеру глаза. Латанопрост не обладает биологической активностью до тех пор, пока не подвергнется гидролизу в роговице и не превратится в свободную гидрофильную кислоту латанопроста. Отмечалось, что латанопрост имеет очень низкую тропность к простаноидным рецепторам, отвечающим за воспалительные реакции, и высокую тропность к тем простаноидным рецепторам, которые обеспечивают снижение ВГД. Гипотензивный эффект латанопроста (как и других препаратов этой группы) достигается за счет усиления в основном увеосклерального пути оттока внутриглазной жидкости. Латанопрост никак не влияет на ее продукцию. Также не было выявлено какого-либо воздействия латанопроста на сосуды сетчатки или проницаемость гематоретинального барьера [27].
Латанопрост оказывает длительное гипотензивное действие (24 ч) после инстилляции, закапывается в нижний конъюнктивальный свод по 1 капле 1 р./сут (вечером). Такая большая длительность эффекта может быть объяснена, в частности, высокой липофильностью пролекарства и последующим накоплением в роговице активной деэтерифицированной формы препарата [27]. Латанопрост хорошо переносится, хотя иногда может вызывать гиперемию конъюнктивы легкой степени, и его использование не связано с системными побочными эффектами. Некоторые пациенты отмечают усиление пигментации радужки, усиление роста ресниц и гиперпигментацию кожи век.
Несмотря на появление на рынке в начале XXI в. других, помимо латанопроста, препаратов из группы аналогов простагландинов, наиболее часто назначаемым антиглаукомным препаратом в США и Великобритании, например, до сих пор является латанопрост [27]. Следует уточнить, что появившиеся в 2012 г. дженерики Ксалатана обеспечили значимый вклад в эту «популярность» латанопроста, но при описании результатов большинства клинических исследований под латанопростом почти всегда следует понимать оригинальный Ксалатан, который часто выбирается в качестве эталона для сравнения благодаря хорошо изученному и подтвержденному практикой эффекту.
Следует принимать во внимание, что хотя оригинальный препарат и дженерики считаются биоэквивалентными, это не должно приравниваться к их терапевтической эквивалентности, которая может различаться вследствие использования в дженериках иных буферов и консервантов, уровня рН, вязкости и осмолярности раствора. Эти параметры препарата могут существенно влиять на биодоступность и клиническую эффективность лекарственного средства.
Зарегистрированный в России в 2017 г. препарат Трилактан (SOLOPHARM («Гротекс», Россия)) производится из той же фармацевтической субстанции, что и оригинальный препарат («Хиноин Завод Фармацевтических и Химических Продуктов» ЗАО, Венгрия). Трилактан не отличается от оригинального препарата вспомогательными веществами, консервантами, неактивными ингредиентами и т. д., что делает его клиническую эффективность более прогнозируемой и соответствующей ожидаемой офтальмологом эффективности.
В проведенном А.О. Татаринцевой исследовании применения препарата Трилактан оценивались степень гипотензивного эффекта и выраженность нежелательных явлений у 47 пациентов с ПОУГ на разных стадиях заболевания. Снижение офтальмотонуса было достигнуто у всех пациентов (р>0,05). Лечение переносилось хорошо. Местные и системные побочные эффекты при применении Трилактана не отличались от возможных побочных эффектов других препаратов данной группы по составу и частоте встречаемости [28].
Результаты исследования, выполненного в клинике Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова», по изучению гипотензивной эффективности аналогов простагландина F2α представлены в таблице 3.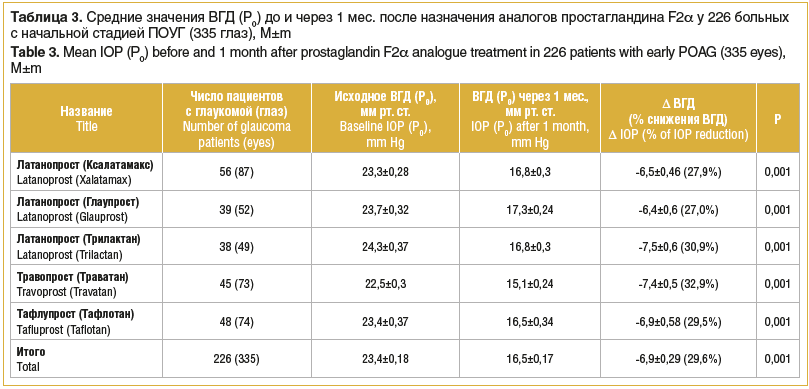
Из таблицы 3 видно, что гипотензивная эффективность латанопроста колеблется от 27% (Глаупрост) до 30,9% (Трилактан, SOLOPHARM, Россия).
А.В. Корнеева и соавт. в своем исследовании с участием 120 пациентов с ПОУГ (150 глаз) продемонстрировали, что препарат Трилактан показал хороший, сопоставимый с оригинальным препаратом, гипотензивный эффект как в монотерапии, так и в комбинации с другими гипотензивными препаратами. Снижение ВГД в группе первичных пациентов составило 31% от исходного уровня, в группе пациентов на гипотензивной терапии при добавлении Трилактана произошло снижение ВГД на 20% от исходного уровня. В группе пациентов, ранее получавших оригинальный латанопрост, уровень ВГД достоверно не изменился. Стабильное снижение и поддержание ВГД на необходимом уровне прослеживались на протяжении всего срока наблюдения и были сопоставимы с таковыми при применении оригинального препарата [29].
Широкое использование латанопроста, а затем и остальных аналогов простагландинов вывело медикаментозную терапию глаукомы на качественно иной уровень, позволив сочетать высокую терапевтическую эффективность в снижении офтальмотонуса с комфортным для пациента режимом инстилляции препарата, что способствует повышению приверженности лечению. В настоящее время латанопрост остается эффективным, безопасным и хорошо переносимым препаратом, который следует рассматривать в качестве возможного варианта лечения у всех пациентов с повышенным уровнем ВГД.
Заключение
На современном этапе исследование толерантного и индивидуального ВГД имеет клиническое значение в диагностике, лечении и мониторинге больных ПОУГ, позволяет у больных глаукомой с «нормальными» значениями ВГД определить, что офтальмотонус в 37–42% случаев превышает толерантное ВГД — находится в зоне повышенного интолерантного ВГД. Индивидуальный подход к лечению, учитывающий толерантное давление, по нашим данным, дал возможность у больных с начальной стадией ПОУГ на фоне медикаментозного лечения добиться стабилизации глаукомного процесса на 513 глазах из 528 в 97,1% случаев, на фоне лазерного лечения на 538 глазах из 575 — в 93,6% случаев, после хирургического лечения на 498 глазах из 535 — в 93,1% случаев. Индивидуальный подход к лечению больных ПОУГ на основе определения толерантного ВГД позволил своевременно и обоснованно увеличить количество лазерных операций на 68,9%, хирургических операций — на 23,5% [17].
Таким образом, благодаря индивидуальному подходу к лечению больных ПОУГ врач может своевременно оценивать эффективность лечения и принимать решение о его достаточности, когда колебания офтальмотонуса находятся в пределах границ среднестатистической нормы, но превышают толерантное давление.
Сведения об авторах:
Балалин Сергей Викторович — д.м.н., заведующий научным отделом Волгоградского филиала;
Фокин Виктор Петрович — д.м.н., профессор, директор Волгоградского филиала.
ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России. 400138, Россия, г. Волгоград, ул. Землячки, д. 80.
Контактная информация: Балалин Сергей Викторович, e-mail: sergej-balalin@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 23.10.2018.
About the authors:
Sergey V. Balalin — MD, PhD, Head of the Scientific Department of the Volgograd branch;
Viktor P. Fokin—MD, PhD, Professor, Director of the Volgograd branch.
S. Fyodorov Eye Microsurgery Federal State Institution, Volgograd branch. 80, Zemlyachki str., Volgograd, 400138, Russian Federation. Contact information: Sergey V. Balalin, e-mail: s.v.balalin@gmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 23.10.2018.
Источник
1. Егоров Е.А., Васина М.В. Внутриглазное давление и толщина роговицы. Глаукома. 2006;2:34-36.
2. Куроедов А.В., Голубев С.Ю., Шафранов Г.В. Глаукома. 2005;2:7-19.
3. Либман Е.С., Чумаева Е.А., Елькина Я.Э. Эпидемиологические характеристики глаукомы. Глаукома: теории, тенденции, технологии. Сб. статей международной конференции, 4-й. М., 2006; 207-212.
4. Chen P.P. Blindness in patients with treated open-angle glaucoma. Ophthalmology. 2003;110:726-733.
5. Ernest P.J., Schouten J.S., Beckers H.J. et al. An evidence-based review of prognostic factors for glaucomatous visual field progression. Ophthalmology. 2013;120:512-519.
6. Global Initiative for the Elimination of Avoidable Blindness: action plan 2006-2011. WHO Headquarters, Geneva, Switzerland, 11-13 July 2006.
7. Grobbee D.E., Hoes A.W. Clinical epidemiology: principles, methods, and applications for clinical research. London, Jones and Bartlett Publ., 2009. 104-106 pp.
8. Heijl A., Bengtsson B., Hyman L., Leske M.C. Early Manifest Glaucoma Trial Group. Natural history of open-angle glaucoma. Ophthalmology. 2009;116:2271-2276.
9. Katz J., Tielsch J.M., Quigley H.A. et al. Automated suprathreshold screening for glaucoma: the Baltimore Eye Study. Invest Ophthalmol Vis Sci 1993;34(12):3271-3277.
10. Kwon Y.H., Fingert J.H., Kuehn M.H., Alward W.L. Primary openangle glaucoma. N Engl J Med. 2009;360(11):1113-1124.
11. Quigley H.A., Addicks E.M., Green W.R. Optic nerve damage in human glaucoma: III. Quantitative correlation of nerve fiber loss and visual field defect in glaucoma, ischemic neuropathy, papilledema, and toxic neuropathy. Arch Ophthalmol 1982;100(1):135-146.
12. Quigley H.A., Dunkelberger G.R., Green W.R. Retinal ganglion cell atrophy correlated with automated perimetry in human eyes with glaucoma. Am J Ophthalmol. 1989;107(5):453-464.
13. Quigley H.A., Broman A.T. The number of people with glaucoma worldwide in 2010 and 2020. Br J Ophthalmol. 2006;90:262-267.
14. Егоров Е.А., Астахов Ю.С., Еричев В.П. Национальное руководство по глаукоме. М.: ГЭОТАР-Медиа 2015; 456.
15. Егоров Е.А., Куроедов А.В. Отдельные клинико-эпидемиологические характеристики глаукомы в странах СНГ и Грузии. Результаты многоцентрового открытого ретроспективного исследования (часть 1). РМЖ Клиническая офтальмология. 2011;3:97-100.
16. Егоров Е.А., Куроедов А.В. Отдельные клинико-эпидемиологические характеристики глаукомы в странах СНГ и Грузии. Результаты многоцентрового открытого ретроспективного исследования (часть 2). РМЖ Клиническая офтальмология. 2012;1:19-22.
17. Авдеев Р.В., Александров А.С., Басинский А.С. и др. Факторы риска, патогенные факторы развития и прогрессирования по результатам многоцентрового исследования Российского глаукомного общества. Медико-биологические проблемы жизнедеятельности. 2012;2(8):57-69.
18. Авдеев Р.В., Александров А.С., Басинский А.С. Клиническое многоцентровое исследование эффективности синусотрабекулэктомии. Национальный журнал глаукома. 2013;12(2):53-60.
19. Авдеев Р.В., Александров А.С., Басинский А.С. и др. Степень взаимного влияния и характеристики морфофункциональных взаимоотношений между первичной открытоугольной глаукомой и макулодистрофией. Офтальмологические ведомости. 2014;7(1):19-27.
20. Авдеев Р.В., Александров А.С., Бакунина Н.А. и др. Прогнозирование продолжительности сроков заболевания и возраста пациентов с разными стадиями первичной открытоугольной глаукомы. Национальный журнал глаукома. 2014;13(2):60-69.
21. Абышева Л.Д., Авдеев Р.В., Александров А.С. и др. Многоцентровое исследование по изучению показателей офтальмотонуса у пациентов с продвинутыми стадиями первичной открытоугольной глаукомы на фоне проводимого лечения. Офтальмологические ведомости. 2015;8(1):43-60.
22. Куроедов А.В., Абышева Л.Д., Авдеев Р.В. и др. Результаты изучения соотношения эффективности и стоимости затрат при применении местной гипотензивной терапии у пациентов с продвинутыми стадиями первичной открытоугольной глаукомы (многоцентровое исследование). Российский офтальмологический журнал. 2015;8(3):10-22.
23. Абышева Л.Д., Авдеев Р.В., Александров А.С. и др. Оптимальные характеристики верхней границы офтальмотонуса у пациентов с развитой стадией первичной открытоугольной глаукомы с точки зрения доказательной медицины. РМЖ Клиническая офтальмология. 2015;16(3):111-123.
24. Куроедов А.В., Авдеев Р.В., Александров А.С. и др. Первичная открытоугольная глаукома: в каком возрасте пациента и при какой длительности заболевания может наступить слепота. Медико-биологические проблемы жизнедеятельности. 2014;2(12):74-84.
25. Авдеев Р.В., Александров А.С., Бакунина Н.А. и др. Модель манифестирования и исходов первичной открытоугольной глаукомы. Клиническая медицина. 2014;92(12):64-72.
26. Авдеев Р.В., Александров А.С., Басинский А.С. и др. Многоцентровое исследование по определению структурно-функционального статуса зрительного анализатора при одновременном наличии в глазу глаукомы и возрастной макулярной дегенерации с выявлением их корреляционных связей и степени взаимного влияния. Офтальмология Восточная Европа. 2013;4:15-25.
27. Куроедов А.В., Авдеев Р.В., Александров А.С. и др. Предполагаемый возраст пациентов и период болезни для проведения интенсивных лечебно-профилактических манипуляций при первичной глаукоме. Офтальмология Восточная Европа. 2014;3(22):60-71.
28. Абышева Л.Д., Александров А.С., Арапиев М.У. и др. Оптимизация лечебно-диагностического процесса у пациентов с первичной открытоугольной глаукомой. Национальный журнал глаукома. 2016;15(2):19-35.
29. Gordon M.O., Gao F., Beiser J.A. et al. The 10-year incidence of glaucoma among patients with treated and untreated ocular hypertension. Arch Ophthalmol. 2011;129(12):1630-1631.
30. Brandt J.D., Beiser J.A., Gordon M.O. et al. Central corneal thickness and measured IOP response to topical ocular hypotensive medication in the Ocular Hypertension Treatment Study. Am J Ophthalmol. 2004;138(5):717-722.
31. Coleman A.L., Gordon M.O., Beiser J.A. et al. Baseline risk factors for the development of primary open-angle glaucoma in the Ocular Hypertension Treatment Study. Am J Ophthalmol. 2004; 138(4): 684-685.
32. Brandt J.D., Beiser J.A., Kass M.A. et al. Central corneal thickness in the Ocular Hypertension Treatment Study (OHTS). Ophthalmology. 2001;108(10):1779-1788.
33. Алексеев В.Н., Литвин И.Б. Влияние толщины роговицы на уровень внутриглазного давления и прогноз при первичной открытоугольной глаукоме. РМЖ Клиническая офтальмология. 2008;4:130.
34. Gordon M.O., Beiser J.A., Brandt J.D. et al. The Ocular Hypertension Treatment Study: baseline factors that predict the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120(6):714-720.
Источник