Первичная открытоугольная глаукома литература
Статье посвящена проблеме медикаментозного лечения первичной открытоугольной глаукомы и разработке индивидуального подхода. Рассматривается возможность применения программного приложения для расчета толерантного внутриглазного давления у пациентов с первичной открытоугольной глаукомой.
Актуальность
Глаукома остается одной из главных причин слепоты и слабовидения и является в настоящее время одной из актуальнейших проблем офтальмологии.
По данным Всемирной организации здравоохранения, число больных глаукомой в мире колеблется от 60,5 млн до 105 млн человек, причем в ближайшие 10 лет оно увеличится еще на 10 млн [1, 2].
Во многих высокоразвитых странах мира на долю глаукомы приходится 13–28% всей слепоты [3–9]. Среди причин слепоты и слабовидения в России глаукома занимает первое место. В нозологической структуре инвалидности доля глаукомы возросла с 20 до 28%, а в контингенте инвалидов пенсионного возраста — до 40% [3, 5, 10].
Определение толерантного внутриглазного давления
Повышенное внутриглазное давление (ВГД) является основным фактором риска развития глаукомной оптической нейропатии (ГОН) и снижения зрительных функций у больных первичной глаукомой. В настоящее время в литературе широко используются термины «индивидуальное», «толерантное», «интолерантное» и «целевое ВГД».
Впервые определение толерантного ВГД при глаукоме
было предложено А.М. Водовозовым в 1975 г. Индивидуально переносимое (толерантное, P tl) давление — максимальный уровень офтальмотонуса, не оказывающий повреждающего действия на внутренние структуры глазного яблока [11–17]. Толерантное ВГД можно определить у больных глаукомой по достоверному улучшению зрительных функций при медикаментозном снижении офтальмотонуса. Постоянное или периодическое повышение офтальмотонуса выше толерантного давления является основным фактором риска развития ГОН и снижения зрительных функций у больных первичной открытоугольной глаукомой (ПОУГ) [18].
Увеличение суточных колебаний ВГД на 1 мм рт. ст. приводит к увеличению риска прогрессирования ПОУГ на 30%. Снижение ВГД на 1 мм рт. ст. позволяет снизить риск прогрессирования глаукомы на 19% [19]. Доказано, что снижение повышенного офтальмотонуса до индивидуального уровня ВГД у больных ПОУГ способствует длительному сохранению зрительных функций [13, 17].
Цели лечения больных глаукомой: сохранение зрительных функций; достижение терапевтического эффекта при минимальном числе препаратов с минимумом побочных действий; сохранение качества жизни при доступных затратах [1, 2].
Эффективность лечения больных ПОУГ следует оценивать по следующим критериям: 1) нормализация офтальмотонуса — по достижении индивидуального ВГД; 2) стабилизация зрительных функций — по данным периметрии; 3) отсутствие прогрессирования ГОН — по данным оптической когерентной томографии (ОКТ) диска зрительного нерва (ДЗН) и сетчатки.
Целевое ВГД — условно выбранный офтальмологом безопасный уровень ВГД, который определяется как 20–30–40% снижение от исходного значения офтальмотонуса. В настоящее время целевое давление определяется с учетом стадии глаукомы (табл. 1) [1, 2]. Недостатком определения целевого давления является то, что не учитываются индивидуальные особенности пациента.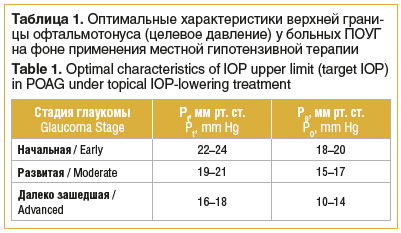
Верхняя граница индивидуальной нормы ВГД (толерантное ВГД) зависит в основном от диастолического уровня артериального давления (АД) в плечевой артерии и возраста пациента [17]. Таблица с соответствующими значениями доступна в литературе и приводится в Национальном руководстве по глаукоме для практикующих врачей [1, 2].
Таким образом, для достижения стабилизации
глаукомного процесса необходимо, чтобы офтальмотонус на фоне медикаментозного лечения у больных ПОУГ был ниже уровня толерантного давления на 2,5 мм рт. ст., а суточные колебания ВГД не превышали толерантное давление [17].
Применение программного приложения для определения толерантного ВГД
Для определения значения толерантного истинного ВГД у больных ПОУГ разработано программное обеспечение под Windows и для мобильных устройств Toliop на операционных системах IOS 8–10 и Аndroid. Данные программные продукты при расчете толерантного ВГД учитывают, помимо возраста и диастолического АД в плечевой артерии, также стадию глаукомы и офтальмобиометрические показатели: переднезадний размер глаза и толщину роговицы в центральной оптической зоне [11, 20–24], прогнозируют скорость прогрессирования глаукомы по величине индекса интолерантности (I int):
![]()
При величине I int менее 5,0 мм рт. ст. прогнозируется медленное прогрессирование глаукомного процесса, при I int свыше 5 мм рт. ст. — быстрое прогрессирование.
Для определения толерантного давления с помощью программного обеспечения необходимо ввести данные пациента: возраст, значения систолического и диастолического АД в плечевой артерии, фактическое ВГД (P0) на момент обследования, переднезадний размер глазного яблока, толщину роговицы в центральной оптической зоне и стадию глаукомы.
На рисунке 1 продемонстрирован пример расчета толерантного ВГД у пациента 60 лет. Толерантное ВГД (P0 tl) на OD равно 15,8 мм рт. ст., на OS — 11,7 мм рт. ст. Более низкое значение толерантного давления на левом глазу обусловлено «тонкой» роговицей в центральной оптической зоне и переднезадним размером глазного яблока, который был равен 26,7 мм. I int на OS равен 6,3 мм рт. ст., что указывает на вероятность быстрого прогрессирования глаукомы. Данный расчет можно распечатать и (или) сохранить в архиве. Время на внесение данных о пациенте и определение толерантного ВГД составляет 30 с.
Определение толерантного ВГД имеет важное значение для оценки и прогнозирования динамики зрительных функций у больных ПОУГ.
По данным исследователей, при стабилизированной глаукоме (1549 глаз, 94,6% случаев) среднее значение I int составило —1,5±0,04 мм рт. ст. Из них у 94,4% больных ПОУГ (1463 глаза) I int был меньше нуля и выражался отрицательным числом. У 5,6% больных ПОУГ (86 глаз) I int был менее 2 мм рт. ст. Это подтверждает, что для стабилизации зрительных функций необходимо, чтобы ВГД не превышало толерантное давление [17].
Определение уровня индивидуального ВГД у больного ПОУГ позволяет врачу:
своевременно скорректировать лечение для достижения индивидуальной нормы;
прогнозировать стабилизацию или прогрессирование глаукомного процесса, а также скорость прогрессирования ПОУГ;
своевременно направлять пациента на лазерное или хирургическое лечение глаукомы.
Важно знать, что прогрессирование глаукомы на фоне медикаментозного лечения может отмечаться при нормальных значениях офтальмотонуса в 36–42% случаев, когда колебания ВГД превышают уровень толерантного [17]. Если колебания офтальмотонуса не превышают толерантное ВГД, стабилизация зрительных функций наблюдается у больных ПОУГ в 94,6% случаев [17].
Принципы выбора местной гипотензивной терапии
Применение местных гипотензивных препаратов возможно в комбинации друг с другом, а также в сочетании с лазерными и хирургическими методами лечения.
Во время лечения необходимо снизить повышенное ВГД до уровня индивидуальной нормы, суточные колебания офтальмотонуса не должны превышать значений толерантного ВГД.
Лечение начинают с монотерапии лекарственным средством первого выбора [25].
При неэффективности или плохой переносимости пациентом лечения выполняют замену на лекарственный препарат из другой фармакологической группы или переходят к комбинированной терапии.
При комбинированной терапии не следует использовать более двух лекарственных средств одновременно, предпочтительно их применение в виде фиксированных комбинаций [26].
При проведении комбинированной терапии не следует применять препараты из одной фармакологической группы (два разных β-адреноблокатора, два разных простагландина).
Следует учитывать наличие противопоказаний к применению лекарственных препаратов у пациента, их переносимость и безопасность, наличие консервантов, содержащихся в лекарственном препарате, особенно при длительном лечении.
Для исключения тахифилаксии и побочных действий лекарственного препарата своевременно проводить плановую замену 2–3 раза в год на лекарственные средства из другой фармакологической группы.
Адекватность лечения регулярно проверяется исследованием состояния ДЗН и зрительных функций (при начальной стадии — 1 раз в 6 мес., при развитой и далеко зашедшей глаукоме — 1 раз в 3–4 мес.). Контроль ВГД проводится ежемесячно.
При снижении повышенного офтальмотонуса на фоне комбинированного медикаментозного лечения до уровня индивидуального ВГД больным с начальной стадией ПОУГ можно рекомендовать проведение селективной лазерной трабекулопластики (СЛТ) с целью улучшения оттока водянистой влаги (ВВ), возможности возврата на монотерапию или отмены антиглаукомных препаратов, улучшения качества жизни пациента и повышения приверженности больного лечению.
При неэффективности комбинированной медикаментозной терапии, когда колебания офтальмотонуса превышают уровень толерантного ВГД, больным ПОУГ следует рекомендовать хирургическое лечение глаукомы.
На рисунке 2 приводится алгоритм лечения пациентов с ПОУГ.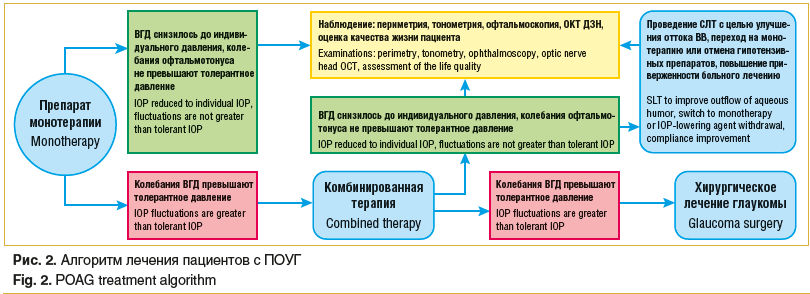
В таблице 2 представлены фармакологические группы для лечения глаукомы. Для снижения повышенного офтальмотонуса до индивидуального ВГД у больных ПОУГ предпочтение следует отдавать препаратам, которые эффективно снижают ВГД за счет улучшения оттока ВВ.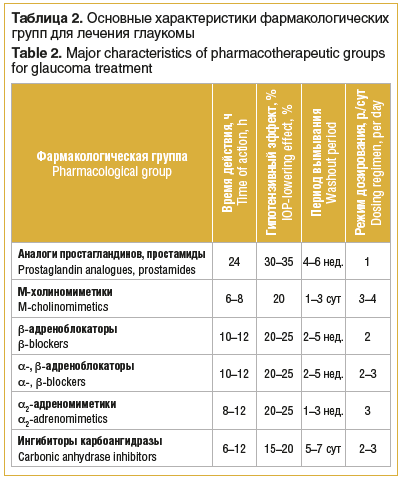
Многочисленные исследования показали, что в качестве препаратов первого выбора у пациентов с ПОУГ наиболее целесообразно использовать аналоги простагландинов и простамиды.
Аналоги простагландинов и простамиды — пролекарства, которые обладают выраженным гипотензивным действием: снижают офтальмотонус на 30–35% от исходного уровня за счет улучшения преимущественно увеосклерального пути оттока ВВ. К аналогам простагландина F2a относятся: латанопрост 0,005%, травопрост 0,004% и тафлупрост 0,0015%, к простамидам — биматопрост 0,03%.
Латанопрост представляет собой пролекарство в форме сложного изопропилового эфира — аналога простагландина F2α, обладающего высокой селективностью по отношению к FP-подтипу простаноидных рецепторов. После попадания в ткань роговицы латанопрост полностью гидролизуется эстеразами (считается, что никакими иными способами препарат в глазу не метаболизируется). Вслед за этим кислота латанопроста поступает в переднюю камеру глаза. Латанопрост не обладает биологической активностью до тех пор, пока не подвергнется гидролизу в роговице и не превратится в свободную гидрофильную кислоту латанопроста. Отмечалось, что латанопрост имеет очень низкую тропность к простаноидным рецепторам, отвечающим за воспалительные реакции, и высокую тропность к тем простаноидным рецепторам, которые обеспечивают снижение ВГД. Гипотензивный эффект латанопроста (как и других препаратов этой группы) достигается за счет усиления в основном увеосклерального пути оттока внутриглазной жидкости. Латанопрост никак не влияет на ее продукцию. Также не было выявлено какого-либо воздействия латанопроста на сосуды сетчатки или проницаемость гематоретинального барьера [27].
Латанопрост оказывает длительное гипотензивное действие (24 ч) после инстилляции, закапывается в нижний конъюнктивальный свод по 1 капле 1 р./сут (вечером). Такая большая длительность эффекта может быть объяснена, в частности, высокой липофильностью пролекарства и последующим накоплением в роговице активной деэтерифицированной формы препарата [27]. Латанопрост хорошо переносится, хотя иногда может вызывать гиперемию конъюнктивы легкой степени, и его использование не связано с системными побочными эффектами. Некоторые пациенты отмечают усиление пигментации радужки, усиление роста ресниц и гиперпигментацию кожи век.
Несмотря на появление на рынке в начале XXI в. других, помимо латанопроста, препаратов из группы аналогов простагландинов, наиболее часто назначаемым антиглаукомным препаратом в США и Великобритании, например, до сих пор является латанопрост [27]. Следует уточнить, что появившиеся в 2012 г. дженерики Ксалатана обеспечили значимый вклад в эту «популярность» латанопроста, но при описании результатов большинства клинических исследований под латанопростом почти всегда следует понимать оригинальный Ксалатан, который часто выбирается в качестве эталона для сравнения благодаря хорошо изученному и подтвержденному практикой эффекту.
Следует принимать во внимание, что хотя оригинальный препарат и дженерики считаются биоэквивалентными, это не должно приравниваться к их терапевтической эквивалентности, которая может различаться вследствие использования в дженериках иных буферов и консервантов, уровня рН, вязкости и осмолярности раствора. Эти параметры препарата могут существенно влиять на биодоступность и клиническую эффективность лекарственного средства.
Зарегистрированный в России в 2017 г. препарат Трилактан (SOLOPHARM («Гротекс», Россия)) производится из той же фармацевтической субстанции, что и оригинальный препарат («Хиноин Завод Фармацевтических и Химических Продуктов» ЗАО, Венгрия). Трилактан не отличается от оригинального препарата вспомогательными веществами, консервантами, неактивными ингредиентами и т. д., что делает его клиническую эффективность более прогнозируемой и соответствующей ожидаемой офтальмологом эффективности.
В проведенном А.О. Татаринцевой исследовании применения препарата Трилактан оценивались степень гипотензивного эффекта и выраженность нежелательных явлений у 47 пациентов с ПОУГ на разных стадиях заболевания. Снижение офтальмотонуса было достигнуто у всех пациентов (р>0,05). Лечение переносилось хорошо. Местные и системные побочные эффекты при применении Трилактана не отличались от возможных побочных эффектов других препаратов данной группы по составу и частоте встречаемости [28].
Результаты исследования, выполненного в клинике Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова», по изучению гипотензивной эффективности аналогов простагландина F2α представлены в таблице 3.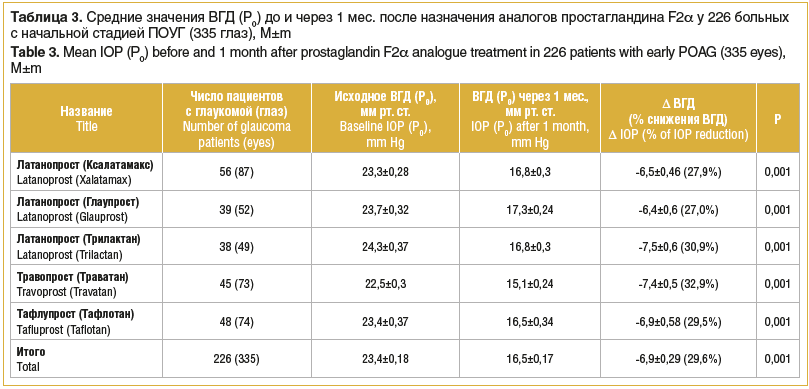
Из таблицы 3 видно, что гипотензивная эффективность латанопроста колеблется от 27% (Глаупрост) до 30,9% (Трилактан, SOLOPHARM, Россия).
А.В. Корнеева и соавт. в своем исследовании с участием 120 пациентов с ПОУГ (150 глаз) продемонстрировали, что препарат Трилактан показал хороший, сопоставимый с оригинальным препаратом, гипотензивный эффект как в монотерапии, так и в комбинации с другими гипотензивными препаратами. Снижение ВГД в группе первичных пациентов составило 31% от исходного уровня, в группе пациентов на гипотензивной терапии при добавлении Трилактана произошло снижение ВГД на 20% от исходного уровня. В группе пациентов, ранее получавших оригинальный латанопрост, уровень ВГД достоверно не изменился. Стабильное снижение и поддержание ВГД на необходимом уровне прослеживались на протяжении всего срока наблюдения и были сопоставимы с таковыми при применении оригинального препарата [29].
Широкое использование латанопроста, а затем и остальных аналогов простагландинов вывело медикаментозную терапию глаукомы на качественно иной уровень, позволив сочетать высокую терапевтическую эффективность в снижении офтальмотонуса с комфортным для пациента режимом инстилляции препарата, что способствует повышению приверженности лечению. В настоящее время латанопрост остается эффективным, безопасным и хорошо переносимым препаратом, который следует рассматривать в качестве возможного варианта лечения у всех пациентов с повышенным уровнем ВГД.
Заключение
На современном этапе исследование толерантного и индивидуального ВГД имеет клиническое значение в диагностике, лечении и мониторинге больных ПОУГ, позволяет у больных глаукомой с «нормальными» значениями ВГД определить, что офтальмотонус в 37–42% случаев превышает толерантное ВГД — находится в зоне повышенного интолерантного ВГД. Индивидуальный подход к лечению, учитывающий толерантное давление, по нашим данным, дал возможность у больных с начальной стадией ПОУГ на фоне медикаментозного лечения добиться стабилизации глаукомного процесса на 513 глазах из 528 в 97,1% случаев, на фоне лазерного лечения на 538 глазах из 575 — в 93,6% случаев, после хирургического лечения на 498 глазах из 535 — в 93,1% случаев. Индивидуальный подход к лечению больных ПОУГ на основе определения толерантного ВГД позволил своевременно и обоснованно увеличить количество лазерных операций на 68,9%, хирургических операций — на 23,5% [17].
Таким образом, благодаря индивидуальному подходу к лечению больных ПОУГ врач может своевременно оценивать эффективность лечения и принимать решение о его достаточности, когда колебания офтальмотонуса находятся в пределах границ среднестатистической нормы, но превышают толерантное давление.
Сведения об авторах:
Балалин Сергей Викторович — д.м.н., заведующий научным отделом Волгоградского филиала;
Фокин Виктор Петрович — д.м.н., профессор, директор Волгоградского филиала.
ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России. 400138, Россия, г. Волгоград, ул. Землячки, д. 80.
Контактная информация: Балалин Сергей Викторович, e-mail: sergej-balalin@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 23.10.2018.
About the authors:
Sergey V. Balalin — MD, PhD, Head of the Scientific Department of the Volgograd branch;
Viktor P. Fokin—MD, PhD, Professor, Director of the Volgograd branch.
S. Fyodorov Eye Microsurgery Federal State Institution, Volgograd branch. 80, Zemlyachki str., Volgograd, 400138, Russian Federation. Contact information: Sergey V. Balalin, e-mail: s.v.balalin@gmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 23.10.2018.
Источник
Первичная глаукома часто встречается у людей старше 40 лет. Характеризуется она высоким внутриглазным давлением. Для развития болезни имеет значение множество факторов: изменения глазных сосудов, наследственность, иные нарушения.
Разновидности
Учитывая формы, стадии, а также уровень внутриглазного давления, используется следующая классификация первичной глаукомы: открытоугольная, закрытоугольная и смешанная.
загрузка…
Открытоугольная
Первичная открытоугольная глаукома (ПОУГ) – это хроническая болезнь, поражающая зрительный нерв и способная привести к слепоте. Чаще всего заболевание остается незамеченным, поскольку глазное давление повышается медленно, а роговая оболочка адаптируется к нему.
загрузка…
Делится на несколько видов:
- простая;
- пигментная;
- глаукома нормального давления;
- псевдоэксфолиативная.
Закрытоугольная
Первичная закрытоугольная глаукома диагностируется, когда радужная оболочка (ее корень) закрывает переднюю камеру. Это происходит из-за плотного прилегания хрусталика к радужке. При подобной ситуации нарушается движение жидкости из задней камеры глаза в переднюю. В результате, в задней камере увеличивается давление и происходит выдавливание радужной оболочки вперед (поэтому передняя камера закрывается).
Закрытоугольная глаукома подразделяется на несколько форм:
- со зрачковым блоком;
- ползучая;
- с витреохрусталиковым блоком;
- с плоской радужкой.
Подробнее о закрытоугольной глаукоме читайте в соответствующей статье у нас на сайте.
Смешанная
Для указанной разновидности характерно первостепенное установление открытоугольной глаукомы, к симптомам которой впоследствии присоединяются признаки закрытоугольной (таким образом, происходит своего рода наслоение).
Признаки
Как правило, человек не ощущает развитие первичной глаукомы, потому что на ранних стадиях болезнь незаметна.
Самые первые признаки, на которые нужно обратить внимание:
- резь в глазах;
- затуманенное зрение в утренние часы, после подъема (обычно проходит, когда человек выполняет любую физическую нагрузку);
- падение зрения;
- радужные круги при направлении взгляда на свет;
- тяжесть в глазах;
- ощущение влажности;
- приступы головной боли;
- чувство затвердения глаз.
Если у человека появились неприятные ощущения, описанные выше, обязательно нужно обратиться к специалисту.
При более запущенной стадии наблюдается:
- нарушение работы зрительных нервов.
- повышенное внутриглазное давление.
- уменьшение полей зрения.
Диагностика
Врач будет делать выводы о наличии заболевания по результатам проведенных обследований, а также исходя из жалоб пациента.
Исследование внутриглазного давления (ВГД)
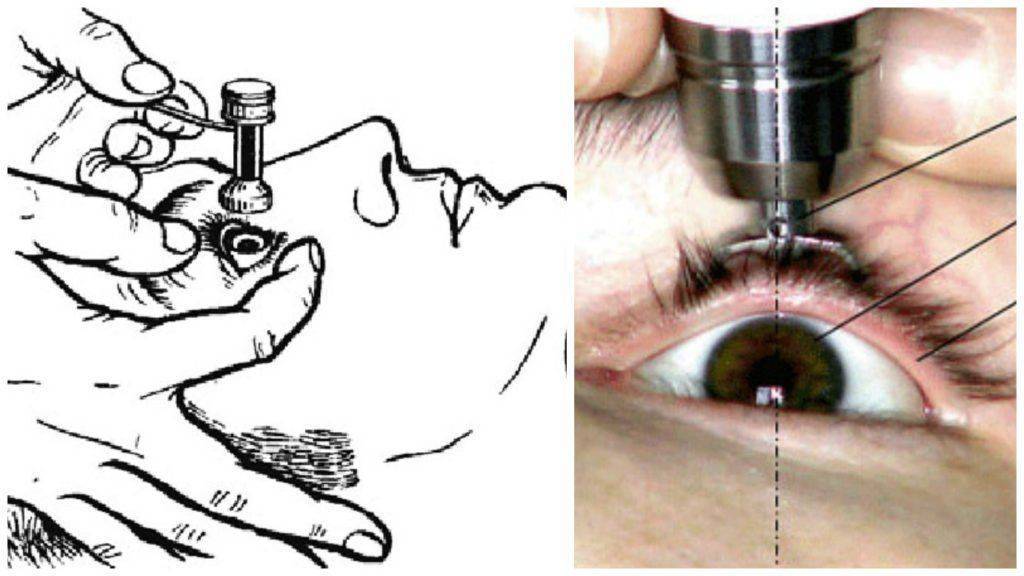
- Основным методом исследования внутриглазного давления является тонометрия. Измерение проводят используя тонометр с грузом в 10 грамм. Пациент при этом должен лежать. Также важно помнить, что ВГД измеряется утром и вечером.
- Эластотонометрия – ВГД при данном методе определяется при помощи тонометров с грузиками разной массы. В процессе увеличения массы ВГД измеряется несколько раз.
Исследование полей зрения

Поля зрения при глаукоме
Определение границ поля зрения путем периметрии, основными видами которой являются:
- изоптопериметрия (помогает определить границы поля зрения используя объекты разной площади);
- кампиметрия (помогает определить дефекты центрального поля зрения).
Исследование оттока глазной жидкости
Осуществляется при помощи тонографии. Для проведения диагностики используются электронные тонографы. Суть заключается в продленном проведении тонометрии (до 4-х минут).
*нормальное ВГД не должно быть больше 26 мм рт. ст., умеренно повышенное может быть от 27 до 32 мм рт. ст., высокое от 33 мм рт. ст. (исследуется с помощью тонометрии)
**состояние зрительных функций зависит от поля зрения пациента. Если 6 месяцев поле зрения не меняется, то зрительные функции стабилизированы.
Этиология
Первичная глаукома развивается сама по себе (то есть без других патологических изменений зрительных органов). На ее появление и развитие могут оказывать влияние следующие факторы:
- Наследственная предрасположенность. Когда один из родителей или оба имели подобное заболевание, то вероятность его появления у ребенка увеличивается. Однако наличие генетического дефекта будет носить лишь предрасполагающий характер для развития глаукомы.
- Нарушения в работе зрительных органов, возникающие в результате возрастных изменений. Подобные изменения, как правило, приводят к нарушению оттока внутриглазной жидкости, что, в свою очередь, увеличивает ВГД.
- Неправильная работа центральной нервной системы, которая нарушает движение внутриглазной жидкости.
- Принадлежность к определенной расе. В результате исследований было выявлено, что у афроамериканцев увеличенное ВГД по сравнению с европейцами. Поэтому риск развития глаукомы у людей, принадлежащих к этой расе, намного выше.
- Наличие таких офтальмологических заболеваний как близорукость и дальнозоркость.
- Нарушение обменных процессов глазных систем. Плохое кровоснабжения около зрительных нервов и сетчатки снижает их устойчивость, вследствие чего при увеличении ВГД могут проявляться зрительные нарушения, характерные для глаукомы.
Лечение
Опасным последствием глаукомы является потеря зрения. Взрослым можно восстановить его только при обнаружении на ранней стадии. Поэтому незамедлительное обращение к специалистам является просто необходимой мерой.
Медикаментозное лечение
Применяется чтобы:
- уменьшить внутриглазное давление.
- улучшить кровоснабжение зрительных органов.
- улучшить обмен веществ глазных тканей.
Обычно офтальмолог прописывает применение антиглаукомных глазных капель, которые подразделяются на несколько групп:
- улучшающие отток жидкости внутри глаз (миотики, симпатомиметики).
- ограничивающие продукты внутриглазной жидкости (бета-адреноблокаторы, ингибиторы карбоангидразы, селективные симпатомиметики).
- смешанные.
Хирургическая операция
При диагностировании запущенной стадии болезни, либо при неэффективности консервативных методов лечения и продолжающемся ухудшении зрения, больным проводится хирургическая операция.
Лазер
Данный метод лечения имеет ряд преимуществ: не требуется помещение больного в стационар, короткий срок реабилитации, проведение операции под местным наркозом.
Предусмотрено два вида лазерной операции:
- Лазерная иридэктомия. На радужной оболочке делается небольшое отверстие, которое способствует оттоку внутриглазной жидкости. Суть операции состоит в следующем: делается небольшое отверстие в отделе радужной оболочки для улучшения давления в глазных камерах.
- Лазерная трабекулопластика. Лазером растягивают трабекулы глаза в шлеммовом канале. В результате проведенных действий улучшается движение внутриглазной жидкости, и, как следствие, уменьшается внутриглазное давление.
Также можно выделить следующие разновидности хирургических операций:
- Проникающие – при данном виде создается фильтрующий рубец.
- Непроникающие – не предполагает создание сквозного отверстия. Делается иссечение участка ткани на глазу.
- Лечение, предполагающее использование дренажных систем (применяются искусственные препараты, которые будут осуществлять отток жидкости из камеры). Указанный метод используется при неэффективности иных видов хирургического вмешательства.
Послеоперационный период
После проведения операции следует выполнять некоторые рекомендации, которые будут способствовать восстановлению органов зрения. Пациентам, обычно, дают следующие рекомендации:
- Запрещается тереть глаза.
- Нельзя мочить их водой в течение нескольких дней (не меньше 10).
- Не допускать зрительной нагрузки (запрещено смотреть телевизор, вышивать).
- Уменьшить употребление жидкости, а газированные напитки лучше вовсе исключить.
- Не следует поднимать тяжести (больше 5 кг).
- Отказаться от посещения бани (в течение первых двух месяцев после операции).
Источник


