Первичная открытоугольная глаукома диссертация
Введение к работе
Актуальность проблемы. Глаукома является одной из актуальнейших проблем в офтальмологии. Несмотря на существенные успехи в медикаментозном, лазерном и хирургическом лечении этого заболевания, процент слепоты и слабовидения в результате глаукомы остается стабильным и не имеет тенденции к снижению.
В нозологической структуре первичной инвалидности вследствие глазной заболеваемости глаукома стоит на одном из первых мест, составляя в среднем по России 21,6 % инвалидов. (Е.С.Либман с соавторами, 1998)
Число больных первичной глаукомой в 2000 г. достигло 66 миллионов, из них с двухсторонней слепотой 6,6 миллиона. Это делает очевидным ее огромное медицинское и социальное значение.
Как правило, глаукома возникает у лиц старше 40 лет и частота ее с возрастом увеличивается. (А.П.Нестеров с соавторами 1995, 1996)
Возрастные изменения организма служат фоном, на котором развивается целый ряд патологических процессов. При сочетании определенных факторов механизмы физиологического старения могут приобретать патологический характер с ослаблением адаптационных резервов оргашгзма и нарушением гомеостаза.
Исследователи относят первичную открытоугольную глаукому к многофакторным заболеваниям с пороговым эффектом. (А.П.Нестеров, 1996)
Многофакторность патогенеза глаукомы усложняет процесс ее лечения.
Несмотря, на достигнутые успехи в лечении глаукомы, эта проблема не решена до сих пор. Известно, что добиться нормализации офтальмотонуса при глаукоме гораздо легче, чем стабшпгзации зрительных функций. (Б.Н.Алексеев, 1987; В.В.Алексеев, 1992; А.М.Водовозов, 1989; А.П.Нестеров, 1972, 1982, 1996; В.Ф.Шмырева, 1998 и др.)
Кроме этого, медикаментозное лечение предусматривает постоянное закапывание, что обременительно для больного и накладывает неблагоприятный отпечаток на его образ жизни. (С.Н.Федоров с соавторами, 1989)
Однако наиболее существенным недостатком является в большинстве случаев отсутствие патогенетической направленности действия препаратов. Известно, что глаукома часто прогрессирует на фоне медикаментозного лечения. (С.Н.Федоров с соавторами, 1989)
В настоящее время сохраняется стабильно высокий процент (25%) больных с запущенными стадиями глаукомы, а также несвоевременно госпитализируются более половины больных с развитой и далеко зашедшей стадиями глаукомы.
Хирургический метод лечения глаукомы продолжает оставаться наиболее надежным средством стабилизации глаукоматозного процесса.
Как известно, стабилизация зрительных функций глаза и нормализация
внутриглазного давления во многом зависит от выбора способа и своевременности проведения хирургического лечения глаукомы и точности определения места основной ретенции камерной влаги. (С.Н.Федоров с соавторами, 1989; Ю.А.Чеклаков; Ф.Э.Кадымова; С.В.Копаев, 1990)
Трудность определения локализации ретенции в клинической практике оправдывает поиск новых антиглаукоматозішіх операций. В частности, операций с использованием для оттока камерной влаги собственной сосудистой системы глаза. (С.Н.Федоров с соавторами, 1983,1985,1989)
Клинические наблюдения показали, что стойкость гипотензивного эффекта хирургического лечения глаукомы зависит от патогенетической обоснованности и минимальной травматичности проведения операции. (Ю.А.Чеклаков, 1989)
В течение ряда лет ведется активный поиск высоко эффективных хирургических вмешательств. Среди большого многообразия существующих антиглаукоматозных операций наиболее часто используются два основных типа операций; проникающего типа со вскрытием полости глаза и операции непроникающего типа без вскрытия полости глаза.
К операциям проникающего типа относятся такие хирургические вмешательства, как трабекулэктомия, ее многочисленные варианты, глубокая склерэктомия. (В.Г.Абрамов, с соавторами 1976, 1979, 1991; Т.И.Брошевский, с соавторами 1978; М.М.Краснов 1974; Э.Г.Сидоров с соавторами 1992; HJD.Jampel, 1992 и др.)
Отличительными особенностями данных операций является их универсальность в применении к различным формам ретенции. Однако, так как операции носят проникающий характер, то риск интра и послеоперационных осложнений достаточно велик. В момент вскрытия передней камеры создается резкий перепад внутриглазного давления, что может привести к различным осложнениям: синдром мелкой передней камеры, отслойка сосудистой оболочки, быстрое прогрессирование катаракты, геморрагические и воспалительные осложнения, послеоперационная гипотония.
Относительно недавно начало развиваться новое направление в хирургическом лечении открытоугольной глаукомы операции непроникающего типа: синусотомия, непроникающая глубокая склерэктомия. Вследствие того, что при проведении операций непроникающего типа полость глаза не вскрывается, интраоперационных осложнений практически не бывает.
Анализ литературных данных показывает, что при правильном определении показаний и безупречном техническом выполнении операции непроникающего типа позволяют нормализовать внутриглазное давление в среднем 80 % — 95 %. (М.М.Краснов, 1980; Л.А.Малахова, 1974 и др.)
Однако, в ряде случаев отмечается лишь кратковременное снижение офтальмотонуса. Основными причинами неустойчивого гипотензивного эффекта является нарушение фильтрации водянистой влаги в месте операцион-
ной фистулы в связи с рубцеванием и сращением конъюнктивы с подлежащими тканями. Данное осложнение в 26,7 % случаев приводит к повторным оперативным вмешательствам. (А.П.Нестеров с соавторами 1990; Б.М.Саидов, 1997 и др.)
В связи с этим разработка эффективной, безопасной, нетоксичной и малотравматичной методики, обладающей пролонгированным гипотензивным действием и обеспечивающей профилактику избыточного рубцевания в послеоперационном периоде является актуальной задачей настоящего времени.
Цель исследования: Разработать оптимальную хирургическую методику на основе непроникающей глубокой склерэктомии, обеспечивающей повышенный гипотензивный эффект и профилактику избыточного рубцевания при хирургическом лечении открытоуголыюй глаукомы.
Задачи исследования:
Провести сравнительный анализ результатов хирургического лечения открытоугольной глаукомы, частоты интраоперационных и послеоперационных осложнений с помощью операций глубокой склерэктомии и непроникающей глубокой склерэктомии.
Разработать и применить на практике модификацию непроникающей глубокой склерэктомии, обладающую пролонгирующим гипотензивным свойством и обеспечивающую профилактику рубцовых сращений и формирование путей оттока внутриглазной жидкости.
Изучить клиническое течение послеоперационного периода, частоту и характер операционных и послеоперационных осложнений в зависимости от уровня офтальмотонуса и стадии глаукоматозного процесса.
Провести сравнительный анализ эффективности результатов хирургического лечения открытоугольной глаукомы с помощью непроникающей глубокой склерэктомии по классической методике и модификации непроникающей глубокой склерэктомии.
Разработать оптимальную хирургическую тактику профилактики Рубцовых сращений при повторных хирургических вмешательствах по поводу открытоугольной глаукомы ( модификация непроникающей глубокой склерэктомии и интраоперационное применение митомицина С).
Выработать показания и противопоказания к проведению модификации непроникающей глубокой склерэктомии в хирургическом лечении открытоугольной глаукомы и сочетанного применения модификации непроникающей глубокой склерэктомии и митомицина С.
Научная новизна исследования:
Разработана малотравматичная, достаточно эффективная техника непроникающей глубокой склерэктомии, обеспечивающая пролонгирующее действие гипотензивного эффекта и способствующая формированию новых
путей оттока внутриглазной жидкости.
Доказаны преимущества данной операции по сравнению с непроникающей глубокой склерэктомией в классическом исполнении, как в отношении гипотензивного эффекта, так и сохранности зрительных функций.
Впервые проведен сравнительный анализ операционных, послеоперационных осложнений, непосредственных и отдаленных результатов при выполнении глубокой склерэктомии, непроникающей глубокой склерэктомии в классическом исполнении и модификации непроникающей глубокой склерэктомии в зависимости от уровня офтальмотонуса и стадии глаукомы.
Проведенное исследование позволило выявить преимущества модификации непроникающей глубокой склерэктомии, выработать конкретные показания и противопоказания для этого вида операции.
Практическая значимость:
Применение модификации непроникающей глубокой склерэктомии в хирургическом лечении открытоугольнои глаукомы увеличило пролонгирующий гипотензивный эффект, уменьшило число пациентов нуждающихся в повторном оперативном лечении, сократило число операционных и послеопера-ционных осложнений.
Предложенная модификация непроникающей глубокой склерэктомии для хирургического лечения открытоугольнои глаукомы, характеризуется малым числом и незначительной тяжестью осложнений во время операций, в ближайшие и отдаленные сроки после нее, устойчивым гипотензивным эффектом, может быть использована в широкой офтальмологической практике.
Впервые показано, что при повторном оперативном вмешательстве у пациентов с избыточным рубцеванием применение модификации непроникающей глубокой склерэктомии и интраоперационного применения митомицина С, обеспечивало выраженный гипотензивный эффект. Двух минутное воздействие в ходе операции, с последующим тщательным его удалением позволило уменьшить явления склерозирования и приводило к формированию аваскулярной и разлитой формы фильтрационной подушечки.
Гидродинамические показатели подтвердили достаточно стабильный клинический эффект, незначительную травматизацию и отсутствие токсического эффекта интраоперационного применения митомицина С в комплексном лечении открытоугольнои глаукомы у пациентов при повторных оперативных вмешательствах с выраженной тенденцией к рубцеванию.
Основные положения диссертации, выносимые на защиту.
1. Результаты лечения открытоугольнои глаукомы с помощью операций глубокой склерэктомии и непроникающей глубокой склерэктомии, анализ спектра и тяжести операционных и послеоперационных осложнений, возникающих в ходе выполнения этих операций.
Разработка и внедрение модификации непроникающей глубокой склерэктомии, обеспечивающей достаточно выраженный гипотензивный эффект и предотвращающей избыточное рубцевание, а также сравнительный анализ результатов названной операции в модификации и в классическом исполнении.
Анализ результатов модификации непроникающей глубокой склерэктомии в сочетании с интраоперационным применением митоми-цина С при повторных хирургических вмешательствах по поводу открытоугольной глаукомы.
Реализация результатов исследования:
Модификация непроникающей глубокой склерэктомии внедрена в отделе глаукомы, в отделе патологии хрусталика и в отделе реабилитации Азербайджанского НИИ глазных болезней им. акад. З.А.Алиевой.
Апробация диссертации.
Основные положения диссертации доложены на заседании Ученого совета НИИ глазных болезней им. акад. З.А.Алиевой и на заседании отделов, на базе которых проводились исследования.
Публикации
По теме диссертации опубликовано 6 научных работ (из них 4 статьи, 1 тезис, 1 методические рекомендации), внесено 2 рационализаторских предложения.
Объем и структура работы
Диссертация содержит 132 страницы, состоит из введения, 6 глав, заключения, выводов и библиографического указателя, который содержит 307 источников (207 отечественных и 100 зарубежных). Работа иллюстрирована 24 таблицами, 10 рисунками, 39 графиками и 3 фото.
Похожие диссертации на Определение эффективности современных методов хирургического лечения открытоугольной глаукомы





Источник
Статье посвящена проблеме медикаментозного лечения первичной открытоугольной глаукомы и разработке индивидуального подхода. Рассматривается возможность применения программного приложения для расчета толерантного внутриглазного давления у пациентов с первичной открытоугольной глаукомой.
Актуальность
Глаукома остается одной из главных причин слепоты и слабовидения и является в настоящее время одной из актуальнейших проблем офтальмологии.
По данным Всемирной организации здравоохранения, число больных глаукомой в мире колеблется от 60,5 млн до 105 млн человек, причем в ближайшие 10 лет оно увеличится еще на 10 млн [1, 2].
Во многих высокоразвитых странах мира на долю глаукомы приходится 13–28% всей слепоты [3–9]. Среди причин слепоты и слабовидения в России глаукома занимает первое место. В нозологической структуре инвалидности доля глаукомы возросла с 20 до 28%, а в контингенте инвалидов пенсионного возраста — до 40% [3, 5, 10].
Определение толерантного внутриглазного давления
Повышенное внутриглазное давление (ВГД) является основным фактором риска развития глаукомной оптической нейропатии (ГОН) и снижения зрительных функций у больных первичной глаукомой. В настоящее время в литературе широко используются термины «индивидуальное», «толерантное», «интолерантное» и «целевое ВГД».
Впервые определение толерантного ВГД при глаукоме
было предложено А.М. Водовозовым в 1975 г. Индивидуально переносимое (толерантное, P tl) давление — максимальный уровень офтальмотонуса, не оказывающий повреждающего действия на внутренние структуры глазного яблока [11–17]. Толерантное ВГД можно определить у больных глаукомой по достоверному улучшению зрительных функций при медикаментозном снижении офтальмотонуса. Постоянное или периодическое повышение офтальмотонуса выше толерантного давления является основным фактором риска развития ГОН и снижения зрительных функций у больных первичной открытоугольной глаукомой (ПОУГ) [18].
Увеличение суточных колебаний ВГД на 1 мм рт. ст. приводит к увеличению риска прогрессирования ПОУГ на 30%. Снижение ВГД на 1 мм рт. ст. позволяет снизить риск прогрессирования глаукомы на 19% [19]. Доказано, что снижение повышенного офтальмотонуса до индивидуального уровня ВГД у больных ПОУГ способствует длительному сохранению зрительных функций [13, 17].
Цели лечения больных глаукомой: сохранение зрительных функций; достижение терапевтического эффекта при минимальном числе препаратов с минимумом побочных действий; сохранение качества жизни при доступных затратах [1, 2].
Эффективность лечения больных ПОУГ следует оценивать по следующим критериям: 1) нормализация офтальмотонуса — по достижении индивидуального ВГД; 2) стабилизация зрительных функций — по данным периметрии; 3) отсутствие прогрессирования ГОН — по данным оптической когерентной томографии (ОКТ) диска зрительного нерва (ДЗН) и сетчатки.
Целевое ВГД — условно выбранный офтальмологом безопасный уровень ВГД, который определяется как 20–30–40% снижение от исходного значения офтальмотонуса. В настоящее время целевое давление определяется с учетом стадии глаукомы (табл. 1) [1, 2]. Недостатком определения целевого давления является то, что не учитываются индивидуальные особенности пациента.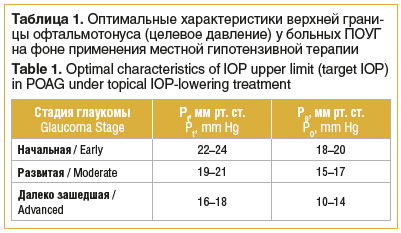
Верхняя граница индивидуальной нормы ВГД (толерантное ВГД) зависит в основном от диастолического уровня артериального давления (АД) в плечевой артерии и возраста пациента [17]. Таблица с соответствующими значениями доступна в литературе и приводится в Национальном руководстве по глаукоме для практикующих врачей [1, 2].
Таким образом, для достижения стабилизации
глаукомного процесса необходимо, чтобы офтальмотонус на фоне медикаментозного лечения у больных ПОУГ был ниже уровня толерантного давления на 2,5 мм рт. ст., а суточные колебания ВГД не превышали толерантное давление [17].
Применение программного приложения для определения толерантного ВГД
Для определения значения толерантного истинного ВГД у больных ПОУГ разработано программное обеспечение под Windows и для мобильных устройств Toliop на операционных системах IOS 8–10 и Аndroid. Данные программные продукты при расчете толерантного ВГД учитывают, помимо возраста и диастолического АД в плечевой артерии, также стадию глаукомы и офтальмобиометрические показатели: переднезадний размер глаза и толщину роговицы в центральной оптической зоне [11, 20–24], прогнозируют скорость прогрессирования глаукомы по величине индекса интолерантности (I int):
![]()
При величине I int менее 5,0 мм рт. ст. прогнозируется медленное прогрессирование глаукомного процесса, при I int свыше 5 мм рт. ст. — быстрое прогрессирование.
Для определения толерантного давления с помощью программного обеспечения необходимо ввести данные пациента: возраст, значения систолического и диастолического АД в плечевой артерии, фактическое ВГД (P0) на момент обследования, переднезадний размер глазного яблока, толщину роговицы в центральной оптической зоне и стадию глаукомы.
На рисунке 1 продемонстрирован пример расчета толерантного ВГД у пациента 60 лет. Толерантное ВГД (P0 tl) на OD равно 15,8 мм рт. ст., на OS — 11,7 мм рт. ст. Более низкое значение толерантного давления на левом глазу обусловлено «тонкой» роговицей в центральной оптической зоне и переднезадним размером глазного яблока, который был равен 26,7 мм. I int на OS равен 6,3 мм рт. ст., что указывает на вероятность быстрого прогрессирования глаукомы. Данный расчет можно распечатать и (или) сохранить в архиве. Время на внесение данных о пациенте и определение толерантного ВГД составляет 30 с.
Определение толерантного ВГД имеет важное значение для оценки и прогнозирования динамики зрительных функций у больных ПОУГ.
По данным исследователей, при стабилизированной глаукоме (1549 глаз, 94,6% случаев) среднее значение I int составило —1,5±0,04 мм рт. ст. Из них у 94,4% больных ПОУГ (1463 глаза) I int был меньше нуля и выражался отрицательным числом. У 5,6% больных ПОУГ (86 глаз) I int был менее 2 мм рт. ст. Это подтверждает, что для стабилизации зрительных функций необходимо, чтобы ВГД не превышало толерантное давление [17].
Определение уровня индивидуального ВГД у больного ПОУГ позволяет врачу:
своевременно скорректировать лечение для достижения индивидуальной нормы;
прогнозировать стабилизацию или прогрессирование глаукомного процесса, а также скорость прогрессирования ПОУГ;
своевременно направлять пациента на лазерное или хирургическое лечение глаукомы.
Важно знать, что прогрессирование глаукомы на фоне медикаментозного лечения может отмечаться при нормальных значениях офтальмотонуса в 36–42% случаев, когда колебания ВГД превышают уровень толерантного [17]. Если колебания офтальмотонуса не превышают толерантное ВГД, стабилизация зрительных функций наблюдается у больных ПОУГ в 94,6% случаев [17].
Принципы выбора местной гипотензивной терапии
Применение местных гипотензивных препаратов возможно в комбинации друг с другом, а также в сочетании с лазерными и хирургическими методами лечения.
Во время лечения необходимо снизить повышенное ВГД до уровня индивидуальной нормы, суточные колебания офтальмотонуса не должны превышать значений толерантного ВГД.
Лечение начинают с монотерапии лекарственным средством первого выбора [25].
При неэффективности или плохой переносимости пациентом лечения выполняют замену на лекарственный препарат из другой фармакологической группы или переходят к комбинированной терапии.
При комбинированной терапии не следует использовать более двух лекарственных средств одновременно, предпочтительно их применение в виде фиксированных комбинаций [26].
При проведении комбинированной терапии не следует применять препараты из одной фармакологической группы (два разных β-адреноблокатора, два разных простагландина).
Следует учитывать наличие противопоказаний к применению лекарственных препаратов у пациента, их переносимость и безопасность, наличие консервантов, содержащихся в лекарственном препарате, особенно при длительном лечении.
Для исключения тахифилаксии и побочных действий лекарственного препарата своевременно проводить плановую замену 2–3 раза в год на лекарственные средства из другой фармакологической группы.
Адекватность лечения регулярно проверяется исследованием состояния ДЗН и зрительных функций (при начальной стадии — 1 раз в 6 мес., при развитой и далеко зашедшей глаукоме — 1 раз в 3–4 мес.). Контроль ВГД проводится ежемесячно.
При снижении повышенного офтальмотонуса на фоне комбинированного медикаментозного лечения до уровня индивидуального ВГД больным с начальной стадией ПОУГ можно рекомендовать проведение селективной лазерной трабекулопластики (СЛТ) с целью улучшения оттока водянистой влаги (ВВ), возможности возврата на монотерапию или отмены антиглаукомных препаратов, улучшения качества жизни пациента и повышения приверженности больного лечению.
При неэффективности комбинированной медикаментозной терапии, когда колебания офтальмотонуса превышают уровень толерантного ВГД, больным ПОУГ следует рекомендовать хирургическое лечение глаукомы.
На рисунке 2 приводится алгоритм лечения пациентов с ПОУГ.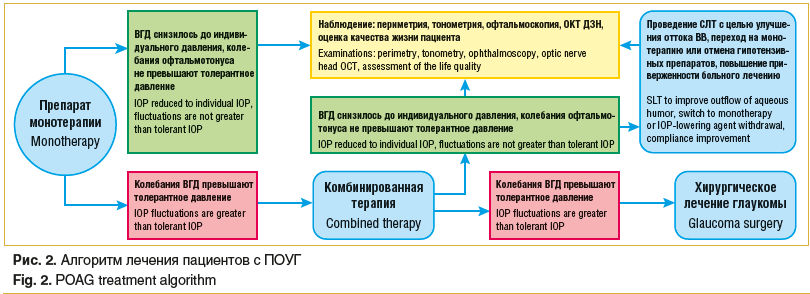
В таблице 2 представлены фармакологические группы для лечения глаукомы. Для снижения повышенного офтальмотонуса до индивидуального ВГД у больных ПОУГ предпочтение следует отдавать препаратам, которые эффективно снижают ВГД за счет улучшения оттока ВВ.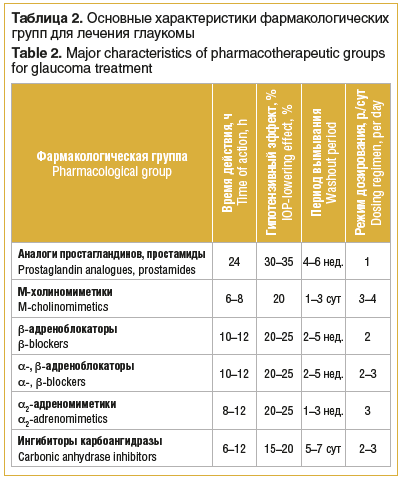
Многочисленные исследования показали, что в качестве препаратов первого выбора у пациентов с ПОУГ наиболее целесообразно использовать аналоги простагландинов и простамиды.
Аналоги простагландинов и простамиды — пролекарства, которые обладают выраженным гипотензивным действием: снижают офтальмотонус на 30–35% от исходного уровня за счет улучшения преимущественно увеосклерального пути оттока ВВ. К аналогам простагландина F2a относятся: латанопрост 0,005%, травопрост 0,004% и тафлупрост 0,0015%, к простамидам — биматопрост 0,03%.
Латанопрост представляет собой пролекарство в форме сложного изопропилового эфира — аналога простагландина F2α, обладающего высокой селективностью по отношению к FP-подтипу простаноидных рецепторов. После попадания в ткань роговицы латанопрост полностью гидролизуется эстеразами (считается, что никакими иными способами препарат в глазу не метаболизируется). Вслед за этим кислота латанопроста поступает в переднюю камеру глаза. Латанопрост не обладает биологической активностью до тех пор, пока не подвергнется гидролизу в роговице и не превратится в свободную гидрофильную кислоту латанопроста. Отмечалось, что латанопрост имеет очень низкую тропность к простаноидным рецепторам, отвечающим за воспалительные реакции, и высокую тропность к тем простаноидным рецепторам, которые обеспечивают снижение ВГД. Гипотензивный эффект латанопроста (как и других препаратов этой группы) достигается за счет усиления в основном увеосклерального пути оттока внутриглазной жидкости. Латанопрост никак не влияет на ее продукцию. Также не было выявлено какого-либо воздействия латанопроста на сосуды сетчатки или проницаемость гематоретинального барьера [27].
Латанопрост оказывает длительное гипотензивное действие (24 ч) после инстилляции, закапывается в нижний конъюнктивальный свод по 1 капле 1 р./сут (вечером). Такая большая длительность эффекта может быть объяснена, в частности, высокой липофильностью пролекарства и последующим накоплением в роговице активной деэтерифицированной формы препарата [27]. Латанопрост хорошо переносится, хотя иногда может вызывать гиперемию конъюнктивы легкой степени, и его использование не связано с системными побочными эффектами. Некоторые пациенты отмечают усиление пигментации радужки, усиление роста ресниц и гиперпигментацию кожи век.
Несмотря на появление на рынке в начале XXI в. других, помимо латанопроста, препаратов из группы аналогов простагландинов, наиболее часто назначаемым антиглаукомным препаратом в США и Великобритании, например, до сих пор является латанопрост [27]. Следует уточнить, что появившиеся в 2012 г. дженерики Ксалатана обеспечили значимый вклад в эту «популярность» латанопроста, но при описании результатов большинства клинических исследований под латанопростом почти всегда следует понимать оригинальный Ксалатан, который часто выбирается в качестве эталона для сравнения благодаря хорошо изученному и подтвержденному практикой эффекту.
Следует принимать во внимание, что хотя оригинальный препарат и дженерики считаются биоэквивалентными, это не должно приравниваться к их терапевтической эквивалентности, которая может различаться вследствие использования в дженериках иных буферов и консервантов, уровня рН, вязкости и осмолярности раствора. Эти параметры препарата могут существенно влиять на биодоступность и клиническую эффективность лекарственного средства.
Зарегистрированный в России в 2017 г. препарат Трилактан (SOLOPHARM («Гротекс», Россия)) производится из той же фармацевтической субстанции, что и оригинальный препарат («Хиноин Завод Фармацевтических и Химических Продуктов» ЗАО, Венгрия). Трилактан не отличается от оригинального препарата вспомогательными веществами, консервантами, неактивными ингредиентами и т. д., что делает его клиническую эффективность более прогнозируемой и соответствующей ожидаемой офтальмологом эффективности.
В проведенном А.О. Татаринцевой исследовании применения препарата Трилактан оценивались степень гипотензивного эффекта и выраженность нежелательных явлений у 47 пациентов с ПОУГ на разных стадиях заболевания. Снижение офтальмотонуса было достигнуто у всех пациентов (р>0,05). Лечение переносилось хорошо. Местные и системные побочные эффекты при применении Трилактана не отличались от возможных побочных эффектов других препаратов данной группы по составу и частоте встречаемости [28].
Результаты исследования, выполненного в клинике Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова», по изучению гипотензивной эффективности аналогов простагландина F2α представлены в таблице 3.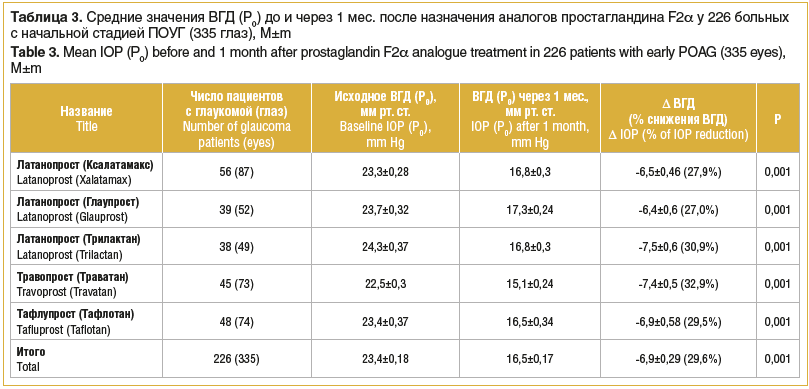
Из таблицы 3 видно, что гипотензивная эффективность латанопроста колеблется от 27% (Глаупрост) до 30,9% (Трилактан, SOLOPHARM, Россия).
А.В. Корнеева и соавт. в своем исследовании с участием 120 пациентов с ПОУГ (150 глаз) продемонстрировали, что препарат Трилактан показал хороший, сопоставимый с оригинальным препаратом, гипотензивный эффект как в монотерапии, так и в комбинации с другими гипотензивными препаратами. Снижение ВГД в группе первичных пациентов составило 31% от исходного уровня, в группе пациентов на гипотензивной терапии при добавлении Трилактана произошло снижение ВГД на 20% от исходного уровня. В группе пациентов, ранее получавших оригинальный латанопрост, уровень ВГД достоверно не изменился. Стабильное снижение и поддержание ВГД на необходимом уровне прослеживались на протяжении всего срока наблюдения и были сопоставимы с таковыми при применении оригинального препарата [29].
Широкое использование латанопроста, а затем и остальных аналогов простагландинов вывело медикаментозную терапию глаукомы на качественно иной уровень, позволив сочетать высокую терапевтическую эффективность в снижении офтальмотонуса с комфортным для пациента режимом инстилляции препарата, что способствует повышению приверженности лечению. В настоящее время латанопрост остается эффективным, безопасным и хорошо переносимым препаратом, который следует рассматривать в качестве возможного варианта лечения у всех пациентов с повышенным уровнем ВГД.
Заключение
На современном этапе исследование толерантного и индивидуального ВГД имеет клиническое значение в диагностике, лечении и мониторинге больных ПОУГ, позволяет у больных глаукомой с «нормальными» значениями ВГД определить, что офтальмотонус в 37–42% случаев превышает толерантное ВГД — находится в зоне повышенного интолерантного ВГД. Индивидуальный подход к лечению, учитывающий толерантное давление, по нашим данным, дал возможность у больных с начальной стадией ПОУГ на фоне медикаментозного лечения добиться стабилизации глаукомного процесса на 513 глазах из 528 в 97,1% случаев, на фоне лазерного лечения на 538 глазах из 575 — в 93,6% случаев, после хирургического лечения на 498 глазах из 535 — в 93,1% случаев. Индивидуальный подход к лечению больных ПОУГ на основе определения толерантного ВГД позволил своевременно и обоснованно увеличить количество лазерных операций на 68,9%, хирургических операций — на 23,5% [17].
Таким образом, благодаря индивидуальному подходу к лечению больных ПОУГ врач может своевременно оценивать эффективность лечения и принимать решение о его достаточности, когда колебания офтальмотонуса находятся в пределах границ среднестатистической нормы, но превышают толерантное давление.
Сведения об авторах:
Балалин Сергей Викторович — д.м.н., заведующий научным отделом Волгоградского филиала;
Фокин Виктор Петрович — д.м.н., профессор, директор Волгоградского филиала.
ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России. 400138, Россия, г. Волгоград, ул. Землячки, д. 80.
Контактная информация: Балалин Сергей Викторович, e-mail: sergej-balalin@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 23.10.2018.
About the authors:
Sergey V. Balalin — MD, PhD, Head of the Scientific Department of the Volgograd branch;
Viktor P. Fokin—MD, PhD, Professor, Director of the Volgograd branch.
S. Fyodorov Eye Microsurgery Federal State Institution, Volgograd branch. 80, Zemlyachki str., Volgograd, 400138, Russian Federation. Contact information: Sergey V. Balalin, e-mail: s.v.balalin@gmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 23.10.2018.
Источник