Пересадка роговицы глаз ребенку
Сквозная кератопластика при аномалиях развития переднего сегмента глаза у ребенка
Исторически сложилось, что сквозная кератопластика у младенцев считается неблагодарной операцией, приносящей плохие результаты. Однако сообщается о приживлении 35% трансплантатов с семилетним сроком наблюдения после операции при аномалии Петерса и о высоких зрительных функциях после ранней сквозной кератопластики (penetrating keratoplasty— РКР).При выполнении сквозной кератопластики крайне важно помнить, что ткани глаза ребенка обладают иными свойствами, нежели ткани глаза взрослого.
То, в каком возрасте глаз ребенка по своим свойствам приближается к глазу взрослого, вызывает споры, но исходя из опыта, ткани глаза ребенка в возрасте старше десяти лет ведут себя почти также, как и ткани глаза взрослого.
Высокочастотное ультразвуковое исследование — надежный метод исследования переднего сегмента, особенно при наличии помутнений роговицы. Это одно из наиболее сложных состояний, требующих хирургического лечения, но использование высокочастотного ультразвукового исследования помогает выбрать оптимальный доступ в переднюю камеру.
Во всех случаях требуется применение кольца Flieringa, поскольку склера гораздо менее ригидная, чем у взрослых. Кольцо подшивается нейлоном 8/0 в четырех квадрантах, концы нитей оставляют длинными, чтобы фиксировать их с помощью пластыря Steri—Strips и таким образом фиксировать глазное яблоко. Для разметки роговицы и центровки трепана используется детский радиальный роговичный маркер. Выполняется небольшой парацентез, передняя камера туго заполняется вискоэластиком, обычно используется Healon GV.
Перед выполнением трепанации реципиенту внутривенно вводится маннитол в соответствующей весу и возрасту ребенка дозе с целью снизить внутриглазное давление и уменьшить риск экспульсивного кровотечения.
Используются ручные трепаны, и, если имеются роговично-хрусталиковые или обширные радужко-роговичные сращения, переднюю камеру трепаном не вскрывают. Вакуумные трепаны, например трепаны Barron-Hessburg, достаточно малого диаметра обычно не производятся промышленностью.
После выполнения на роговице реципиента несквозного надреза трепаном, одноразовым 15° лезвием иссекается сквозной лоскут роговицы и формируется ложе реципиента, при этом стараются не повредить радужку и/или хрусталик. При наличии роговично-хрусталикового сращения хрусталик можно аккуратно отсепаровать от роговицы, но обычно такие действия приводят к формированию катаракты в течение нескольких недель после кератопластики.
Это является аргументом в пользу выполнения аспирации хрусталика с сохранением задней капсулы; для этого требуется капсулэктомия через pars plicata цилиарного тела, обычно также в течение нескольких недель; если капсулэктомия выполняется дальше от роговицы, это, по крайней мере, делает операцию менее травматичной для эпителия донорской роговицы. Во всех случаях аномалии Петерса или склерокор-неа следует выполнять иридэктомию в четырех квадрантах с целью снизить частоту развития глаукомы. Во всех таких случаях размер лоскута донорской роговицы должен превышать размер ложа на 1 мм, чтобы, помимо прочего, увеличить глубину передней камеры.
Опубликованы данные, что этот прием приносит лучшие результаты. Трансплантат подшивается минимум шестнадцатью узловыми швами нейлон 10/0.
Во всех случаях в конце операции выполняется субконъюнктивальная инъекция антибиотика и стероида. Авторы обычно не вводят дексаметазон в переднюю камеру.
Наиболее частые причины врожденных помутнений роговицы включают в себя «склерокорнеа» и аномалию Петерса; вероятно, оба этих состояния являются неотъемлемой частью патологического спектра аномалий развития переднего сегмента.
При уточнении диагноза ультразвуковая биомикроскопия является более надежным методом, чем одно лишь клиническое обследование. Определение наличия или отсутствия хрусталика, радужки, роговично-хрусталиковых и радужко-роговичных сращений способствует разработке плана оперативного вмешательства и уточнению прогноза хирургического лечения. Предложенная классификация врожденных помутнений роговицы поможет читателю в прогнозировании.
Необходимо исключить глаукому. Если до операции глаукома уже развилась, это также является неблагоприятным прогностическим признаком. В такой ситуации и при наличии двусторонних помутнений роговицы в нижних квадрантах под контролем ультразвуковой биомикроскопии выполняется лазерная циклоабляция (обычно циклодиодным лазером). Это позволяет добиться контроля над глаукомой с помощью соответствующих местных препаратов, после чего выполняется сквозная кератопластика; при этом нужно помнить, что впоследствии для контроля глаукомы, вероятно, потребуется имплантация дренажа.
Авторы не рекомендуют одновременно выполнять сквозную кератопластику и имплантировать дренажную трубку.
Из-за реактивности тканей младенца для предотвращения выпадения фибрина, образования синехий и отторжения трансплантата необходимо интенсивное местное лечение комбинированными препаратами стероид/анти-биотик. В первые сутки они назначаются каждые полчаса вместе с циклоплегиком в каплях — три раза в день и мазью со стероидом и антибиотиком на ночь, чтобы младенец мог поспать. Интенсивность закапывания капель постепенно снижают в течение двух месяцев, циклоплегию можно продолжать в течение этого периода.
Младенец осматривается два раза в неделю в течение первых шести недель, поскольку даже небольшое ослабление или васкуляризация шва требует его удаления под анестезией в течение 24 часов. В противном случае наблюдается быстрое отторжение эпителия. В любом случае у младенца все швы должны быть удалены, самое позднее, через шесть недель после операции.
Через две недели с целью профилактики отторжения трансплантата роговицы назначается циклоспорин A (ciclosporin А—CsA) местно в глазных каплях (2% на кукурузном масле) дважды в день на неопределенно долгий срок. Получены данные о том, что при местном применении циклоспорин А достигает необходимой для иммуносупрессии концентрации в роговице, но не в полостях глаза, и что использование комбинации циклоспорина А и стероидов в каплях снижает частоту отторжения при трансплантации высокого риска по сравнению с применением только стероидов.
В 1977 г. Waring и Laibson заявили: «Мы не рекомендуем выполнять сквозную кератопластику пациентам с односторонними врожденными помутнениями роговицы. Однако пациентам с двусторонними помутнениями роговицы следует попытаться выполнить кератопластику как можно раньше, насколько позволяет возраст». Авторы почти полностью согласны с этим положением; единственно, в некоторых случаях так называемый «нормальный» глаз не является нормальным, а лишь измененным в меньшей степени.
В таких случаях родителей следует информировать о возможности выполнения кератопластики, но при этом добиться четкого понимания того, что, вдобавок к опасности отторжения, развития инфекции и глаукомы, прогноз для зрения все равно остается плохим вследствие физиологического феномена амблиопии.
Без сомнения, если присутствует понимание того, что целью оперативного лечении является всего лишь функциональное, а не идеальное, зрение, и что хотя бы частично прозрачный лоскут, позволяющий обеспечить функциональное зрение все же является хорошим результатом, то выполненная младенцу проникающая кератопластика может принести удовлетворение хирургу и пользу пациенту.
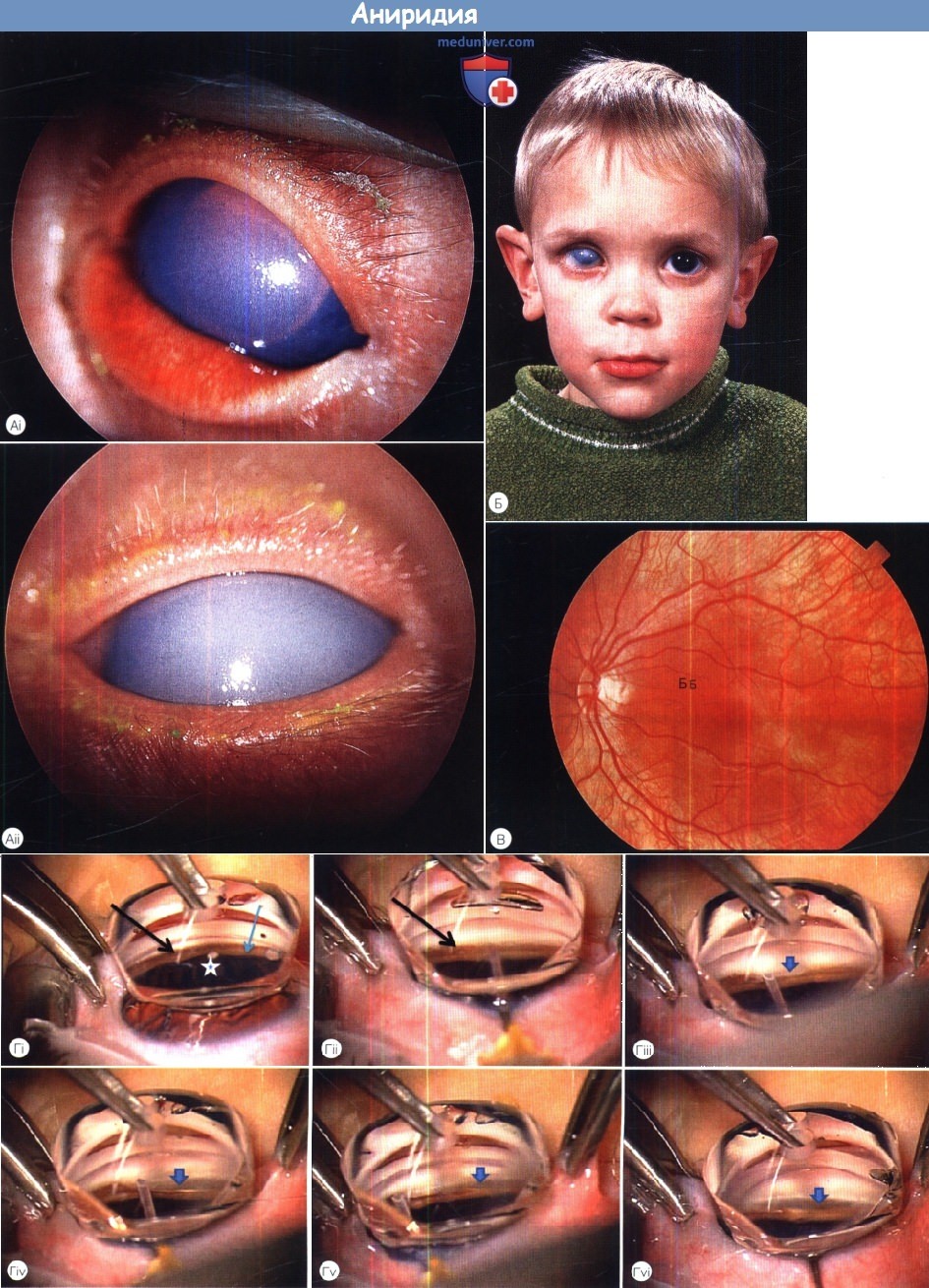
Аниридия:
(А) Двусторонняя тяжелая врожденная глаукома при аниридии.
(Б) Тот же пациент после неоднократных хирургических вмешательств: неконтролируемая глаукома правого глаза и контролируемая глаукома левого.
(В) На глазном дне левого глаза того же пациента выявляется легкая гипоплазия центральной ямки. Острота зрения составляла 6/18.
(Г) выполнение гониотомии ребенку. Звездочкой отмечены цилиарные отростки.
Виден рудимент корня радужки (зрачок НЕ расширен) и аномально измененный угол передней камеры.
Стрелкой показан желобок, образующийся при успешной гониотомии.
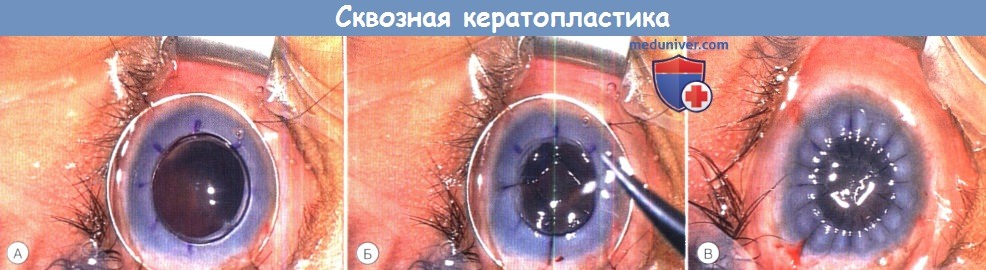
Сквозная кератопластика у ребенка с аномалиями развития переднего сегмента.
Обратите внимание на кольцо Flieringa и 16 узловых швов нейлон 10/0.
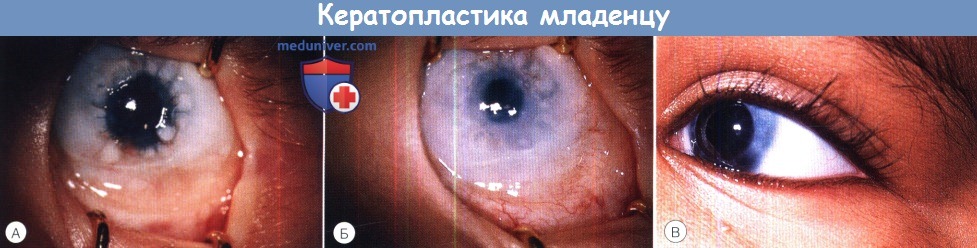
Кератопластика младенцу:
(А) Через четыре недели после сквозной кератопластики по поводу полной склерокорнеа наблюдается образование слизистых муфт вокруг ослабевших швов.
(Б) Тот же пациент, что и на фото (А) четыре месяца спустя. Отмечается помутнение периферии и рубцевание, перекрывающее зрительную ось.
(В) Два года спустя после сквозной кератопластики по поводу аномалии Петерса. Ребенок продолжает получать циклоспорин на ночь.
— Также рекомендуем «Аномалии развития роговицы у ребенка»
Оглавление темы «Аномалии переднего сегмента глаза у детей.»:
- Микрокорнеа у ребенка
- Аномалия Петерса у ребенка
- Склерокорнеа у ребенка
- Плоская роговица (cornea plana) у ребенка
- Аутосомно-доминантный кератит у ребенка
- Аниридия у ребенка
- Сквозная кератопластика при аномалиях развития переднего сегмента глаза у ребенка
Источник
Плескова А.В., Мазанова Е.В.
Врожденные помутнения роговицы (ВПР) – группа аномалий переднего отрезка глаза, встречающаяся в европейской популяции с частотой 3 случая на 100 000 новорожденных [4-6]. При всей разнородности клинических и морфологических проявлений ВПР ее функциональные нарушения однотипны и существенны – по сути приводящие к инвалидности по зрению [7, 8].
Единственный способ лечения ВПР – сквозная кератопластика (СКП) [1, 3, 9, 10, 12]. Однако пересадка роговицы в детском возрасте сопряжена с многочисленными техническими трудностями и осложнениями, так что большинство офтальмохирургов предпочитают отказываться у детей от радикальной операции и переносить ее на более поздний срок, особенно у детей до года. В то же время обскурационная амблиопия при ВПР развивается так быстро, что откладывание пересадки роговицы на старший возраст делает ее функционально бессмысленной [2, 13-16].
Решение этой проблемы видится только в одном – в продолжении накопления клинического опыта СКП в грудном возрасте, оценке практических приемов и улучшении биологических и функциональных результатов операции.
В настоящее время уже не обсуждается как таковая целесообразность СКП при детской патологии роговицы. На повестке дня стоит иной вопрос: как сделать эту операцию у детей по-настоящему эффективным и результативным способом лечения. Задача эта сама по себе непростая, упирающаяся в многочисленные проблемы. Среди них — сложность общения с малолетним пациентом, особая пластичность тканей детского глаза, тяжелый, как правило, сочетанный характер патологии, предрасположенность к бурным воспалительным реакциям, пр. [17-20]. В многолетней практике, по большей части методом проб и ошибок, эти проблемы постепенно находят свое решение.
Цель
Оценить ближайшие и отдаленные результаты сквозной кератопластики у детей, оперированных на 1-м году жизни по поводу ВПР.
Материал и методы
Все пациенты были разделены на 2 группы. В первую группу вошли дети с ВПР, которым была выполнена СКП, во вторую – дети с ВПР, которым была выполнена лимбокератопластика. В первой группе к анализу приняли результаты 42 СКП кадаверной роговицы, выполненных у 40 детей на 42 глазах, во второй группе к анализу были приняты результаты сквозной лимбокератопластики у 8 детей (8 глаз) в возрасте от 2 до 12 мес. за период 2008-2014 гг. Средний возраст составил 7,2±2,1 мес. Соотношение мальчиков и девочек было приблизительно одинаковым. В 22 случаях помутнение роговицы было исходом внутриутробной инфекции (ЦМВ), подтвержденной иммунологически, в 7 случаях – аномалией Петерса, в 8 – склерокорнеа, в 8 – стафиломой роговицы, в 2 случаях – врожденной наследственной эндотелиальной дистрофией. Еще у 1 ребенка сочетанная патология: врожденная глаукома + помутнение роговицы. Послеоперационные наблюдения продолжались от 3 мес. до 6,5 лет, при этом средний период наблюдения в выборке составил 26,1±8 мес. Биологический результат операции оценивали в терминах прозрачное и непрозрачное приживление трансплантата. Результаты СКП у 48 детей, оперированных в грудном возрасте (до года), сравнили с результатами СКП у 22 детей, оперированных по той же самой причине (ВПР) в возрасте старше 1 года. Средний возраст пациентов в этой группе на момент операции составил 25,0±6 мес. Нозологический состав в целом соответствовал таковому в группе детей, оперированных в грудном возрасте. Клинико-функциональное и офтальмологическое обследование у всех проводилось в условиях медикаментозного сна и включало биомикроскопию, ультразвуковое А- и В-сканирование и ультразвуковую биомикроскопию (УБМ) (А/В Scan 835, Hamphrey, США; UD 6000, Tomey, Япония), регистрацию общей, ритмической электроретинограммы, зрительных вызванных потенциалов (Нейро МВП-2, Россия; Neuropto, Medelec, Англия). У детей со стафиломой роговицы (8 глаз) в связи с неправильностью сферичности эктазии оценить гидродинамику глаза объективными средствами было невозможно. Все операции проведены в условиях эндотрахеального наркоза. Операцию лимбокератопластики начинали с наложения блефаростата на веки, кантотомии и наложения уздечного шва на верхнюю и нижнюю прямые мышцы. Проводили диатермокоагуляцию сосудов в зоне основания лимба и окаймляющую диатермокоагуляцию в самой стафиломе, отступя 1 мм от ее основания. Далее отступя 1 мм алмазным лезвием делали окаймляющий надрез, после чего роговичными ножницами право-лево иссекали эктазированную мутную роговицу, отделяли сращения с радужкой. Выраженная толщина роговицы создавала технические сложности при ее выкраивании. Выполняли сквозную тотальную кератопластику в границах лимба. Донорскую роговицу адаптировали в ложе реципиента 8 узловыми швами 8,00 и непрерывным обвивным швом 10,00. Переднюю камеру восстанавливали стерильным воздухом. Узловые швы снимали через 1 нед. после операции, обвивной – через 2-3 мес. после операции. Биологический результат оценивали в терминах прозрачное или мутное приживление. Функциональный результат оценивали ориентировочно: по слежению ребенка за игрушками с определенного расстояния и методом предпочтительного взора. В качестве донорского материала использовали неконсервированную кадаверную роговицу с давностью забора от момента смерти до операции не более 48 часов. Возраст доноров колебался от 18 до 40 лет.
Результаты
В 1 группе в течение 1 года после операции частота прозрачного приживления трансплантата у детей грудного возраста не отличалась от таковой в старшей возрастной группе (65 и 81% соответственно). На 2 и 3-м году наблюдения число прозрачных трансплантатов у детей до 1 года продолжало сокращаться, в то время как в группе сравнения помутнение трансплантата через 2-3 года после операции отмечали относительно редко. В конечном итоге через 2 года после операции прозрачное приживление трансплантата у детей грудного возраста составило 56%, а через 3 года после операции – 54%. В группе сравнения прозрачных трансплантатов в эти же сроки было 78 и 64% соответственно (разница по критерию z между обеими группами была неслучайной, p
Удовлетворительные биологические и функциональные результаты отмечены при врожденных дистрофиях роговицы и при аномалии Петерса (рис. 2а, б), неудовлетворительные – при стафиломах роговицы и при ВПР на фоне ЦМВ-инфекции (рис. 3а, б). По нашим наблюдениям, послеоперационное течение у детей до года принципиально не отличается от такового у детей старшей возрастной группы, однако чем младше ребенок, тем проблематичней за ним уход – не только поверхностные манипуляции, но и контрольные осмотры приходится проводить у них под наркозом. Невозможно ожидать от грудного ребенка и жалоб на боль в глазу, чувство инородного тела или фотофобию. В таких условиях высока вероятность того, что развитие послеоперационного осложнения окажется незамеченным, а его лечение – отсроченным.
Означает ли это, что следует воздерживаться по возможности от кератопластики у детей грудного возраста? Обскурационная амблиопия при ВПР развивается быстро, так что откладывание пересадки роговицы в этой группе детей на более поздний срок делает ее функционально бессмысленной.
Мы считаем, что двустороннее ВПР у новорожденного является абсолютным показанием к пересадке роговицы в сроки до 6 мес., если только нет столь же абсолютного противопоказания (например, некомпенсированной глаукомы).
Дополнительным аргументом в пользу «ранних» кератопластик служит и то, что состояние иммунитета у новорожденного благоприятствует бесконфликтному, прозрачному приживлению трансплантата. Иммунная система человека, как известно, закладывается на самых ранних этапах гестации, однако созревание свое заканчивает после рождения. В первые 2 недели жизни полностью отсутствует секреторный IgA; сывороточный IgA появляется через месяц. Уровень сывороточного IgG и IgM весь первый год жизни ребенка составляет всего 10% от аналогичного уровня у взрослых. В системе клеточного иммунитета у детей грудного возраста преобладают Т-супрессоры. В-лимфоциты, несмотря на нормальное количество, функционально еще мало активны. В целом состояние клеточного иммунитета у новорожденных определяется скорее недоразвитием самих межклеточных связей, чем отсутствием или недееспособностью какой-либо отдельной клеточной фракции [11].
Подобные особенности иммунитета новорожденных приводят к тому, что в 1-й месяц жизни ребенка обычно избегают проведения календарных прививок, по большей части из опасений вызвать толерантность к бактериальным антигенам и ослабить ответ при контакте с ними в последующем. По аналогии, донорская роговица, пересаженная на фоне незрелого иммунитета в первые месяцы жизни ребенка, имеет все шансы превратиться в настоящую химеру, т.е. существовать вместе с макроорганизмом, не вызывая с его стороны реакции отторжения.
Заключение
В сравнительном аспекте биологические результаты СКП у новорожденных несколько хуже, чем у детей старшего возраста. В то же время функциональный результат при раннем (до года) лечении ВПР превосходит таковой при лечении отсроченном (старше года). Если у детей, оперированных в грудном возрасте, удовлетворительную остроту зрения после СКП наблюдали в половине случаев, то у детей, оперированных в старшем возрасте – только в 1 случае из 10. Пересадка роговицы в грудном возрасте – наиболее оптимальный способ избавить ребенка от амблиопии и инвалидности по зрению. Еще 10 лет тому назад такое утверждение показалось бы излишне оптимистичным. Сегодня же случаи успешной кератопластики при ВПР в возрасте нескольких месяцев и даже нескольких недель жизни перестали быть чем-то исключительным. Риск помутнения трансплантата в этой возрастной категории остался прежним, однако число случаев прозрачного приживления трансплантата, а вместе с тем и удовлетворенность хирургов биологическими и функциональными результатами операции существенно выросли. Приведенная выше серия наблюдений демонстрирует тот факт, что при определенных условиях (жестком отборе пациентов к операции, щадящей микрохирургической технике, тщательном послеоперационном мониторинге состояния глаза, своевременном лечении осложнений) хирургическое лечение ВПР в ранние сроки может быть вполне успешным.
Поступила 18.11.2015
Источник


