Неповрежденные клетки роговицы лягушки
Задание
№1. Изучить строение мозаичной
модели биологической мембраны.
Рассмотрите
рисунок. Обозначьте структурные
компоненты мембраны клетки и опишите
их функции.
1. 2 3._____________________________ 4._____________________________ | 5._________________________________ 6._________________________________ 7.__________________________________ |
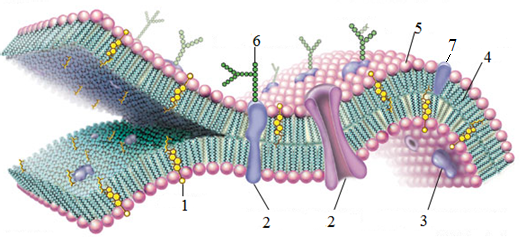 Рис.
Рис.
1. Строение мозаичной модели биологической
мембраны.
Задание
№2. Изучение рецепторной функции
мембраны.
По
рис. №2 ознакомьтесь с принципами работы
аденилатциклазной системы.
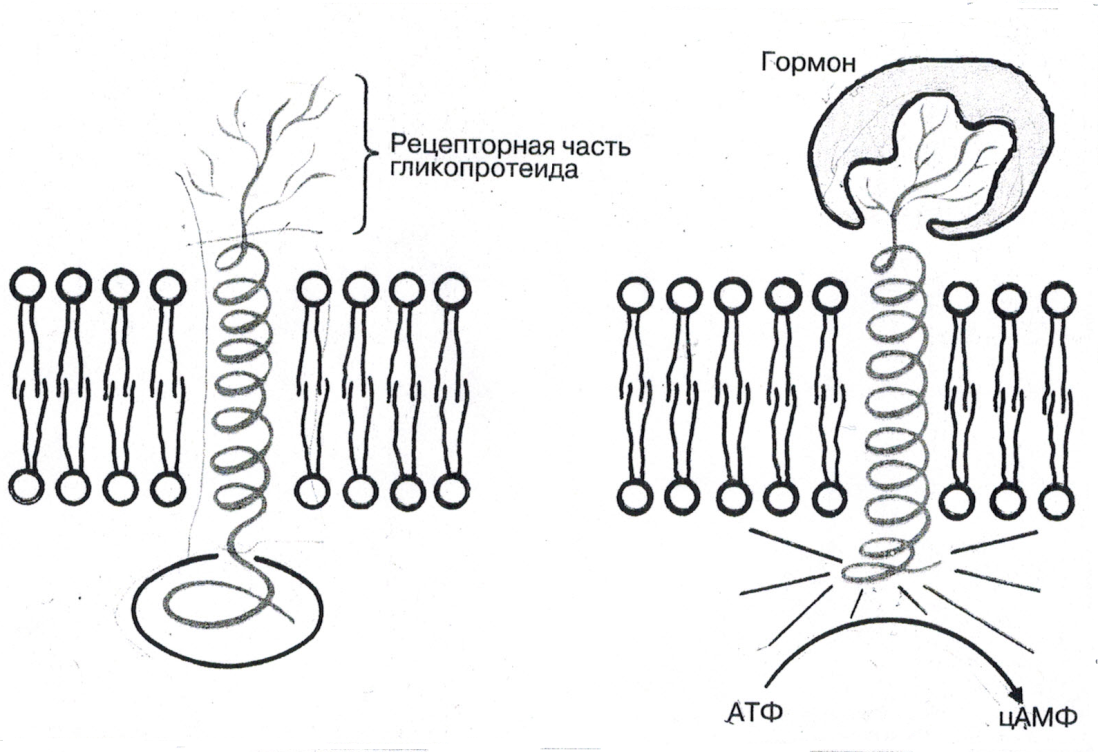
Рис.
2. Схема работы аденилатциклазной
системы.
Задание
№3. На примере клеток листа
элодеи изучите явления плазмолиза и
деплазмолиза.
3.1.
Положите кусочек листа элодеи на
предметное стекло и нанесите 10% раствор
хлорида натрия. Под большим увеличением
микроскопа (ув.7х40) рассмотрите явление
плазмолиза. Зарисуйте и опишите явление
плазмолиза.
Рис.1.
Явление плазмолиза в клетках листа
элодеи.
3.2.
Затем пипеткой по краю покровного стекла
наносим дистиллированную воду, происходит
замещение гипертонического раствора
на гипотонический и под микроскопом
наблюдаем явление деплазмолиза. Зарисуйте
явление деплазмолиза.
Рис.2.
Явление деплазмолиза в клетках листа
элодеи.
Задание
№4. Изучите метод витального
окрашивания нормальных и повреждённых
клеток плёнки семени подсолнечника.
Семена
подсолнечника освободите от кожуры.
Затем лезвием бритвы обрежьте оба конца
семени и лёгким нажимом продольно,
разрежьте верхний слой плёнки и снимите
её пинцетом. Снятую плёнку поместите
на предметное стекло, в некоторых местах
на плёнку семени подсолнечника нанесите
механические повреждения препаровальной
иглой. Сверху нанесите 0,25% раствор
нейтрального красного. Наблюдайте за
состоянием клеток при большом увеличении
микроскопа. В цитоплазме неповреждённыхклеток наблюдаем скопление гранул
нейтрального красного, ядро оптически
пустое (не прокашивается красителем,
его не видно). Повреждённые клетки
равномерно окрашиваются (без гранул) в
красный цвет, ядро прокрашивается более
интенсивно по сравнению с цитоплазмой.
Зарисовать
неповреждённые и повреждённые клетки
плёнки семени подсолнечника. Обозначьте:
гранулы красителя и ядро.
Рис.1.
Неповреждённые клетки
Рис. 2. Повреждённые клетки
плёнки
семени подсолнечника
плёнки семени подсолнечника
Задание
№5. Знакомство с методикой двойного
витального окрашивания клеток с
использованием рисунка таблицы.
По
таблице рассмотреть и зарисовать: 1)
повреждённые клетки (диффузно равномерно
окрашены в синий цвет азуром и интенсивно
окрашенное ядро; 2) неповреждённые клетки
(окрашены нейтральным красным с
образованием гранул красителя, ядро
оптически пустое).
Зарисуйте
с учебной таблицы повреждённые и
неповреждённые клетки. На рисунке
обозначьте: 1- цитоплазму 2- гранулы
красителя 3- ядро
Рис.1.
Неповреждённые и поврежденные клетки
роговицы лягушки.
Самостоятельная
работа студентов.
Вопросы
для самостоятельного изучения дисциплины
студентами.
1.
Мембранный принцип организации клеток.
Строение и функции плазматической
мембраны.
3.
Гипо-, гипер- и изотонические растворы
и их использование в медицине.
4.
Явления плазмолиза и деплазмолиза.
5.
Принцип работы мембранных насосов,
механизмы пассивного и активного
транспорта.
6.
Характеристика учения о паранекрозе и
использование его в различных разделах
биологии и медицины.
Рекомендации
по самостоятельному выполнению задания.
Для
того, чтобы успешно подготовиться к
занятию, следует:
изучить
конспект лекций;изучить
вопросы темы по материалам учебной
литературы;выучить
методические разработки для студентов
по соответствующей теме;ответить
на тестовые задания и решить ситуационные
задачи.
ВЫВОДЫ:
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Приложение
Живая
клетка, входит ли она в состав
многоклеточного, или представляет собой
одноклеточный организм, находится в
постоянном взаимодействии с внешней
средой. Всякие воздействия внешней
среды,
выходя
за пределы физиологической нормы для
данной клетки, вызывают в ее протоплазме
характерные реактивные изменения. Эти
изменения в зависимости от характера
и интенсивности действующего фактора
могут иметь все градации от едва заметных,
быстровосстанавливающихся, до очень
глубоких, необратимых.
Изучение
функциональных и субстанциональных
изменений в клетке при повреждении было
начато еще в 30-х годах нашего столетия
Д. Н. Насоновым и его учениками.
В
результате многочисленных исследований
было установлено, что при действии самых
разнообразных физических и химических
раздражителей, применяемых в определенной
дозе, клетка всегда отвечает одинаковым
комплексом изменений, которые являются
выражением единой реакции, возникающей
в результате воздействия на клетку
любого агента.
К
числу наиболее типичных изменений живой
протоплазмы, относятся:
1.
Уменьшение степени дисперсности
коллоидов протоплазмы, что выражается
в возникновении в клетке видимых
структур,
2.
Повышение вязкости протоплазмы клеток.
Нередко изменение вязкости бывает
двухфазным. При действии слабых
раздражителей она может уменьшаться,
при усилении же раздражителя вязкость
начинает повышаться.
3.
Подавление гранулообразующей деятельности
клетки и усиление ее способности
связывать прижизненные красители. При
этом цитоплазма и ядро начинают сильно
прокрашиваться диффузно, причем, в
ряде случаев этот процесс в ядре
выявляется раньше, чем в цитоплазме.
4.Сдвиг
внутриклеточной реакции цитоплазмы и
ядра в кислую сторону, а также выход из
альтерированных клеток различных
веществ, как, например, ионов калия,
магния, кальция, фосфатов, нуклеиновых
кислот и др. и одновременное проникновение
в клетку ионов натрия и хлора.
Все
эти перечисленные признаки альтерированной
протоплазмы в начальной фазе хорошо
обратимы. Прекращение действия
раздражителя приводит к исчезновению
ядерных и цитоплазматических структур,
что связано с повышением степени
дисперсности коллоидов. Повышенная
способность протоплазмы связывать
краситель исчезает. Цитоплазма и
ядро обесцвечиваются благодаря переходу
красителя в окружающий раствор. Вязкость
протоплазмы понижается. Вещества,
вышедшие из раздраженной протоплазмы,
вновь поступают в клетку.
Если
действие альтерирующих агентов зашло
слишком далеко, то вышеописанные
изменения становятся необратимыми, что
приводит клетку к гибели. Указанный
комплекс изменений живой протоплазмы,
вызываемый действием повреждающих
(альтерирующих) агентов в обратимой
фазе, был назван Д. Н. Насоновым и В. Я.
Александровым (1934) паранекрозом. Эти
исследователи установили (1940), что в
основе паранекротической реакции живой
протоплазмы лежат
молекулярные изменения ее белков,
близкие по своей природе к начальным
фазам денатурационных изменений нативных
протеинов. Изменения могут заходить
более или менее глубоко и приводят к
ряду процессов, характеризующих
повреждение клетки.
Учение
о паранекрозе широко используется, в
разных разделах биологии и медицины и
пополняется все новыми данными. Особого
внимания заслуживают те перестройки и
изменения живой клетки, которые вызываются
разнообразными факторами внешней среды
и наблюдаются при различных патологических
состояниях организма.
Для
определения ответной реакции клеток
при различных повреждающих воздействиях,
наряду с другими цитологическими
методами исследования, широко используется
метод прижизненного окрашивания. Для
окраски живого объекта применяют
витальные красители, обладающие
минимальной токсичностью. Прижизненные
красители бывают кислыми (трипановая
синь, метиловый кармин) или основными
(нейтральный красный, янус зеленый,
метиленовый синий). Различают также
диффузные и гранулярные витальные
красители. Красители вводят животному
либо внутривенно — в этом случае краска
наиболее полно проникает в органы
исследуемого животного, либо окрашивают
изолированные живые ткани.
Удобными
объектами для исследования являются
тонкие пленки растительных и животных
тканей, форменные элементы крови
(эритроциты, лейкоциты), изолированные
железы личинок насекомых (хирономуса,
дрозофилы), роговица лягушки, отпечатки
клеток печени и др. Для изучения
растительных клеток можно рекомендовать
так называемую плаценту или пленку,
одевающую семя подсолнечника. После
слабого размачивания сухого семени она
легко снимается и может быть подвергнута
любым цитологическим исследованиям.
Очень
удобным материалом для исследования
живых клеток являются культуры животных
и растительных тканей и особенно культура
лейкоцитов. Преимущество метода культуры
тканей заключается в том, что клетка в
условиях культуры оказывается в более
благоприятных условиях, чем в условиях
так называемого «переживания». Это дает
возможность вести длительные, не
ограниченные временем, наблюдения.
Наконец, в условиях культуры легче найти
место, где клетки расположены в один
слой, что является идеальным для тонких
наблюдений и при значительных увеличениях.
В
качестве приборов, которые применяют
для исследования живых клеток, следует
назвать обычный микроскоп и ряд его
модификаций — изучение препаратов с
применением темного поля,
фазовоконтрастного устройства,
интерференционного и аноптралыюго
микроскопов. Исключительно интересным
для исследования живых клеток является
применение люминесцентного микроскопа.
Проведение
работы с живыми «переживающими» клетками
требует соблюдения определенных мер
предосторожности, гарантирующих
нормальное состояние клетки. Животные
клетки обычно изучаются в рингеровском
или в рингер-локковском солевом растворе
или, наконец, в капле кровяной плазмы
того животного, от которого взята
исследуемая ткань.
Растительные
клетки обычно изучаются в водопроводной
воде или в растворах сахара. Окрашивание
производится в чашках Петри при
температуре воздуха 20-25°С и при
определенной концентрации красителя,
которая устанавливается экспериментальным
путем, индивидуально для каждой ткани
(примерное разведение красителя 1:1000;
1:5000 и т. д.).
С первых же минут
контакта красителя с тканью в цитоплазме
неповрежденных клеток постепенно
образуются мелкие гранулы в виде зерен,
капелек. С течением времени количество
гранул и их размеры
увеличиваются. Ядро остается при этом
неокрашенным. В поврежденных клетках
цитоплазма и ядро окрашиваются диффузно.
Весьма
интересным и перспективным является
метод двойной витальной окраски,
разработанный на кафедре биологии (И.
Е. Камнев, Л. Ф. Гордеева, 1959). Этот метод
заключается в том, что ткани окрашиваются
нейтральным красным в сочетании с азуром
I.
Оптимальные
концентрации для различных тканей
оказались различными. Так, для эпителия
роговицы-лягушки лучшими оказались
нейтральный красный в концентрации
0,05% и азур I-0,1%. Растворы этих красителей
готовятся отдельно на дистиллированной
воде, а затем перед экспериментом
сливаются вместе в соотношении 10 частей
нейтрального красного и 3 части азура
I, после чего смешиваются с равным
количеством двойного солевого раствора
Рингера. Преимущество этого метода
заключается в том, что в результате
такого окрашивания возникает четко
видимая разница между нормальными и
поврежденными клетками. Цитоплазма
интактных клеток почти бесцветна и
содержит большое количество гранул
нейтрального красного, а поврежденные
клетки диффузно окрашиваются азуром I
в синий цвет.
Использование
витальных красителей дает возможность
судить как о субстанциональных изменениях
исследуемых клеток, так и об их
функциональном состоянии. Причем, это
окрашивание позволяет выявить такие
тонкие начальные изменения, которые не
обнаруживаются другими методами. Поэтому
метод прижизненной окраски нашел широкое
применение для решения и трактовки ряда
как общетеоретических, так и прикладных
вопросов.
Домашнее
задание Подготовить
практическую работу № 3
.
Записать термины..
Подготовить вопросы для проверки
исходного уровня..
Решить тестовые задания.
Подпись
преподавателя ______________________________
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
ПАРАНЕКРОЗ
Живая
клетка, входит ли она в состав
многоклеточного организма или представляет
собой одноклеточный организм, находится
в
постоянном взаимодействии с внешней
средой. Всякие воздействия
внешней среды, выходя за пределы
физиологической
нормы для данной клетки, вызывают в ее
протоплазме
характерные реактивные изменения. Эти
изменения в зависимости
от характера и интенсивности действующего
фактора могут иметь все градации от
едва заметных, быстровосстанавливающихся,
до очень глубоких, необратимых.
Паранекроз
(от
греч — para.
возле, мимо, вне, nekros
— мёртвый — вблизи смерти)
— это
совокупность
обратимых неспецифических изменений
в живых клетках, возникающих в ответ на
действие повреждающих агентов,
сопровождающейся нарушением функциональных
свойств клеток. Пограничное состояние
между жизнью и смертью.
Изучение
функциональных и субстанциональных
изменений
в клетке при повреждении было начато
еще в 30-х годах
20 столетия Д. Н. Насоновым. При
действии самых разнообразных физических
и химических раздражителей, применяемых
в определенной дозе, клетка всегда
отвечает одинаковым комплексом
изменений, которые являются выражением
единой реакции,
возникающей в результате воздействия
на клетку любого
агента.
К
числу наиболее типичных изменений живой
протоплазмы,
относятся:
Повышение
вязкости
протоплазмы клеток. Нередко изменение
вязкости бывает двухфазным. При действии
слабых
раздражителей она может уменьшаться,
но при
усилении
раздражителя вязкость начинает
повышаться. На действие раздражителя
размер коллоидной частицы увеличивается.
Уменьшение
степени дисперсности
коллоидов протоплазмы,
что выражается в возникновении в клетке
видимых структур,
![]() Вязкость
Вязкость
повышается, а дисперсность уменьшается,
например, при повреждении клеток, размеры
коллоидных частиц укрупняются, за счёт
набухания и их агрегации. Между размерами
коллоидных частиц и дисперсностью
обратная зависимость.
3.
Подавление
гранулообразующей деятел
ьностии
усиление ее способности связывать
прижизненные красители. При этом
цитоплазма и ядро начинают сильно
прокрашиваться
диффузно, причем, в ряде случаев этот
процесс в ядре выявляется раньше,
чем в цитоплазме.
4.Сдвиг
внутриклеточной реакции цитоплазмы и
ядра в кислую
сторону,
а также выход из альтерированных клеток
различных веществ, например, ионов
калия, магния, кальция,
фосфатов, нуклеиновых кислот и др. и
одновременное
проникновение в клетку ионов натрия и
хлора.
Указанный
комплекс изменений живой протоплазмы,
вызываемый действием повреждающих
(альтерирующих) агентов в обратимой
фазе, был назван Д. Н. Насоновым и В. Я.
Александровым (1934) паранекрозом.
Все
эти перечисленные признаки альтерированной
протоплазмы в
начальной фазе обратимы.
Прекращение действия раздражителя
приводит к “исчезновению” ядерных
и цитоплазматических структур, что
связано с повышением степени
дисперсности коллоидов. Повышенная
способность протоплазмы связывать
краситель исчезает. Цитоплазма и
ядро обесцвечиваются благодаря переходу
красителя в окружающий раствор.
Вязкость протоплазмы понижается.
Вещества, вышедшие из раздраженной
протоплазмы, вновь поступают в клетку.
Если действие альтерирующих агентов
зашло слишком далеко, то вышеописанные
изменения становятся необратимыми,
что приводит клетку к гибели.
В
основе паранекротической реакции живой
протоплазмы лежат
молекулярные изменения ее белков,
близкие по своей природе к начальным
фазам денатурационных изменений нативных
протеинов.
Изменения могут заходить более или
менее глубоко и приводят к ряду процессов,
характеризующих повреждение клетки.
Учение
о паранекрозе широко используется в
разных разделах биологии и медицины и
пополняется все новыми данными. Особого
внимания заслуживают те перестройки и
изменения живой клетки, которые вызываются
разнообразными факторами внешней
среды и наблюдаются при различных
патологических состояниях организма.
Метод
прижизненного окрашивания
Для
определения ответной реакции клеток
при различных повреждающих воздействиях,
наряду с другими цитологическими
методами исследования, широко используется
метод прижизненного окрашивания.
Для окраски живого объекта применяют
витальные
красители,
обладающие минимальной токсичностью.
Прижизненные красители бывают:
а)
кислыми
(трипановая
синь, метиловый кармин)
б)
основными
(нейтральный
красный, янус зеленый, метиленовый
синий).
Различают
также диффузные и гранулярные витальные
красители. Красители вводят животному
либо внутривенно — в этом случае краска
наиболее полно проникает в органы
исследуемого животного, либо окрашивают
изолированные живые ткани.
Удобными
объектами для исследования являются
тонкие пленки растительных и животных
тканей, форменные элементы крови
(лейкоциты), изолированные железы личинок
насекомых, роговица лягушки. Проведение
работы с живыми «переживающими» клетками
требует соблюдения определенных мер
предосторожности, гарантирующих
нормальное состояние клетки.
Животные
клетки обычно изучаются в рингеровском
или в рингер-локковском солевом растворе
или, наконец, в капле кровяной плазмы
того животного, от которого взята
исследуемая ткань.
Растительные
клетки обычно, изучаются в водопроводной
воде или в растворах сахара. Окрашивание
производится в чашках Петри при
температуре воздуха 20 — 25°С и при
определенной концентрации красителя,
которая устанавливается экспериментальным
путем, индивидуально для каждой ткани.
Неповрежденные
клетки.
В
цитоплазме
неповрежденных
клеток образуются мелкие
гранулы красителя в виде зерен, капелек.
Ядро
остается
при этом неокрашенным (воспринимается
как оптическая пустота).
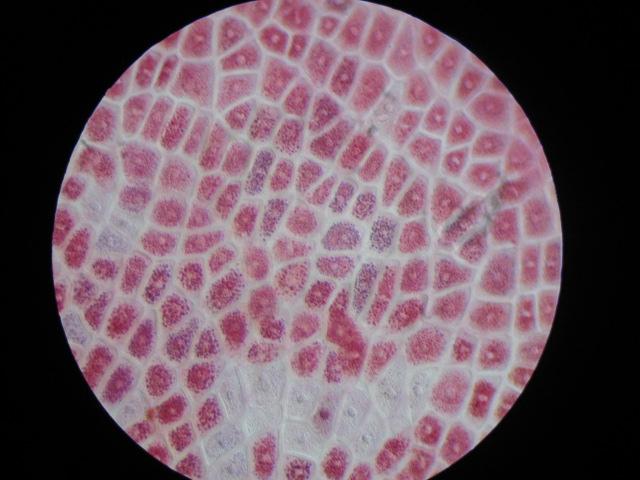
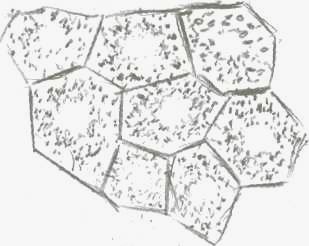
Неповрежденные
клетки (нейтральный красный 1,5 %).
Ядро
не окрашено — оптическая пустота, в
цитоплазме гранулы красителя.
Поврежденные
клетки.
В
поврежденных
клетках цитоплазма
и ядро окрашиваются
красителем диффузно.
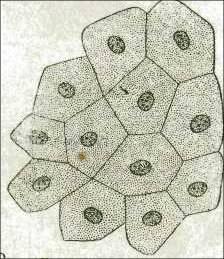
Поврежденные
клетки
Ядра
и цитоплазма окрашиваются диффузно
Двойное
витальное окрашивание.
Интересным
и перспективным является метод двойной
витальной окраски, разработанный на
кафедре биологии (И. Е. Камнев, Л. Ф.
Гордеева, 1959). Этот метод заключается в
том, что ткани окрашиваются нейтральным
красным в сочетании с азуром I.
В
основе методаизбирательная
способностьповреждённых
и неповреждённых клеток взаимодействовать
с красителями. Преимущество этого метода
заключается в том, что в результате
такого окрашивания возникает четко
видимая разница между нормальными и
поврежденными клетками на изучаемом
препарате.
Цитоплазма
интактных
клеток почти бесцветна и содержит
большое
количество гранул нейтрального красного.
Ядро
не окрашено. В
поврежденных клеткахцитоплазма
и ядро
диффузно окрашиваются
азуром I
в синий цвет.
Окрашивание
позволяет выявить такие тонкие начальные
изменения, которые не обнаруживаются
другими методами. Поэтому метод
прижизненной окраски нашел широкое
применение для решения и трактовки ряда
как общетеоретических, так и прикладных
вопросов.
3
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник