Морфологические изменения при глаукоме
В статье приведены результаты исследования морфологических изменений при глаукоме на фоне повышенного ВГД и при длительной гипотензивной терапии по результатам конфокальной микроскопии роговицы
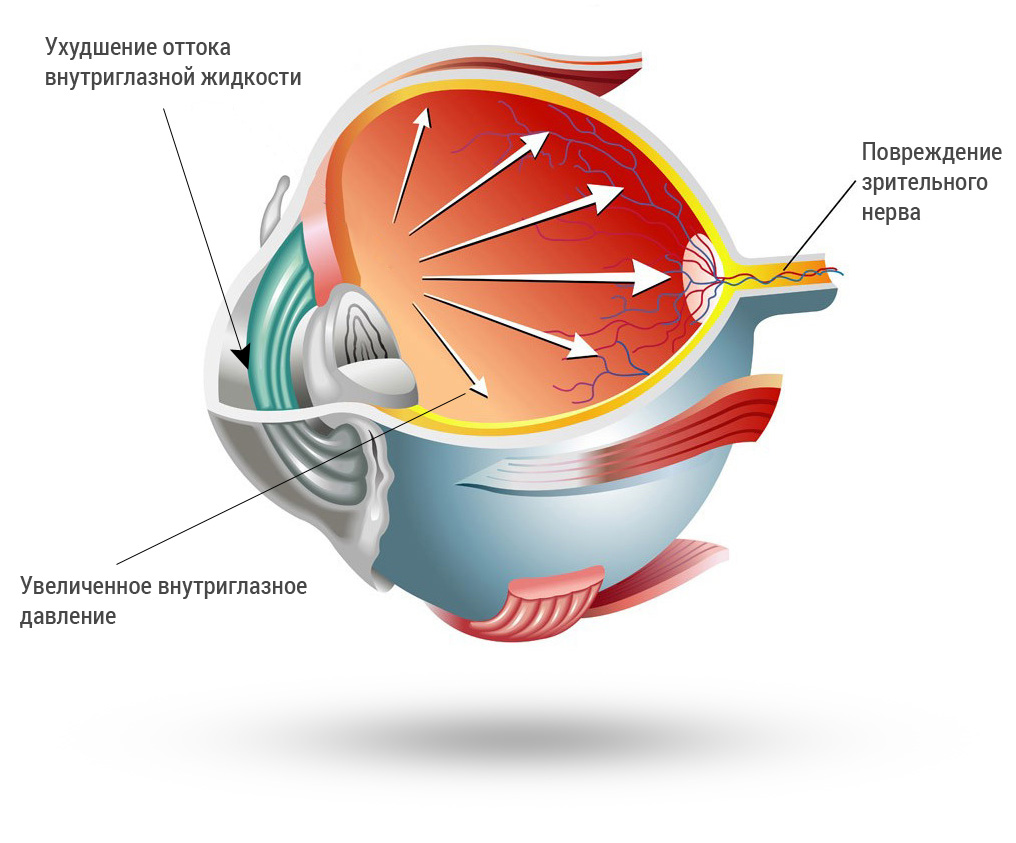
Глаукома – это хроническое заболевание, одним из главных симптомов которого является повышение ВГД. Повышенный уровень ВГД при глаукоме является также важнейшим патогенетическим фактором развития глаукомной оптической нейропатии, что определяет необходимость лечебных мероприятий с целью достижения гипотензивного эффекта. Лечение пациентов, как правило, начинается с медикаментозной терапии [1].
Существует определенный диапазон значений ВГД, индивидуальный для каждого пациента, в пределах которого колебания ВГД не приводят к снижению зрительных функций [2, 3]. Для поддержания ВГД на безопасном для каждого конкретного пациента уровне требуется постоянное применение антиглаукомных гипотензивных препаратов на протяжении многих лет и в ряде случаев – в течение всей жизни.
Однако антиглаукомные препараты за небольшим исключением содержат в своем составе консерванты, причем наиболее часто используемым из них является бензалкония хлорид (БАХ). Это высокоэффективный консервант, который обладает способностью растворять стенки бактерий, благодаря чему в низких концентрациях (от 0,004 до 0,025%) широко используется в составе различных глазных капель. Однако действие БАХ является недостаточно специфичным. БАХ является катионным детергентом, поверхностно активным веществом (ПАВ), обладает способностью снижать поверхностное натяжение на границе водной и жировой фаз, что дает возможность четко разделенным фазам «проникать» друг в друга, т. е. растворяться. С липидами, белками, каротиноидами и другими нерастворимыми в воде веществами детергенты образуют смешанные мицеллы, способствуя тем самым переходу этих веществ в раствор. Данный механизм объясняет непосредственное разрушающее действие БАХ на липидный слой слезной пленки, вследствие чего нарушается ее структура, увеличивается испарение ее водной составляющей, снижается ее стабильность [5]. Дестабилизация слезной пленки ведет к нарушению смачиваемости глазной поверхности и снижению ее роли как фактора защиты от воздействия консерванта.
Консервант оказывает также прямое повреждающее воздействие на эпителий глазной поверхности, разрушая плазмолемму, вызывая гибель клеток и нарушение барьерных функций переднего эпителия. Все это лежит в основе нежелательных побочных эффектов при длительном применении глазных капель [4].
Непосредственное токсическое воздействие БАХ на клетки эпителиального слоя глазной поверхности связано с его способностью связываться с белками клеточных мембран.
В результате этого взаимодействия мембранные белки переходят в раствор в виде комплексов с детергентом, в состав которых также входят связанные с белками молекулы липидов. При разрушении липидных комплексов клеточных мембран повышается их проницаемость, образуются дефекты, нарушается ионное равновесие. Возникают отек клеток, повреждение внутриклеточных структур, что может вести к их гибели [1, 6].
Воздействие БАХ не ограничивается зоной поверхностного слоя эпителия – он в значительной степени накапливается во всех слоях роговично-конъюнктивального эпителия и строме роговицы, в меньшей степени – в радужной оболочке, хрусталике, сосудистой оболочке и сетчатке глаза. Присутствие БАХ определялось в данных структурах в течение 1 нед. после его применения [7, 8]. Необходимо отметить и раздражающий эффект данного консерванта. Нередко он может быть причиной воспалительных и иммуно-аллергических реакций [9].
Негативный эффект воздействия БАХ на эпителий конъюнктивы проявляется и в снижении плотности бокаловидных клеток. Нарушение дифференцировки клеток переднего эпителия может привести к их полному исчезновению, следствием чего является недостаточность муцинового слоя слезной пленки [10].
Разрушение слезной пленки в совокупности с цитотоксическим действием консерванта и нарушением структуры эпителиального слоя глазной поверхности обычно протекает по типу синдрома «сухого глаза». Побочные эффекты, связанные с длительным применением антиглаукомных препаратов, могут приводить к ухудшению их переносимости и потенциально снизить гипотензивный эффект лечения.
Регистрация изменений глазной поверхности, возникающих под воздействием консервантов антиглаукомных препаратов, важна и необходима для оценки степени морфологических нарушений, уточнения причин появления субъективного и зрительного дискомфорта, а также для оценки эффективности лечебных мероприятий. Контроль состояния глазной поверхности возможен с помощью метода конфокальной микроскопии. Данный метод прижизненной микроскопии роговицы обеспечивает визуализацию всех ее слоев и выявление характерных изменений при различных заболеваниях и воздействии различных неблагоприятных факторов [11–13]. Однако вариантов течения заболевания и медикаментозного режима при глаукоме достаточно много, кроме того, на результаты конфокальной микроскопии могут влиять возрастные изменения.
Для объективной оценки морфологических изменений под воздействием антиглаукомных препаратов на первом этапе исследований необходимо выявить исходное состояние всех слоев роговицы до назначения гипотензивной терапии.
Цель работы: с помощью метода конфокальной микроскопии оценить морфологические изменения роговицы до назначения гипотензивной терапии на фоне повышенного ВГД и при его компенсации на фоне длительного применения антиглаукомных препаратов.
Материал и методы
Было обследовано 42 (84 глаза) пациента с глаукомой, возраст больных – от 52 до 74 лет. Пациенты были разделены на 2 группы: 1-я включала 20 первичных больных (40 глаз), которые не использовали антиглаукомные препараты. 2-ю группу составили 22 пациента (44 глаза) с различным стажем (от 2 мес. до 17 лет) использования антиглаукомных препаратов, содержащих БАХ.
Исследование было выполнено на конфокальном микроскопе Confoscan-4 фирмы Nidek (Япония).
Результаты и обсуждение
На основе анализа результатов конфокальной микроскопии были выявлены характерные морфологические изменения в слоях роговицы при первичном обследовании пациентов с первичной открытоугольной глаукомой на фоне повышенного ВГД и после длительной гипотензивной терапии препаратами, содержащими БАХ. В регистрируемых изменениях роговицы прослеживается определенная закономерность. При обследовании пациентов с первично выявленной глаукомой (без медикаментозного режима) было выявлено, что основные изменения, определяемые при конфокальной микроскопии роговицы, локализуются в средних и задних слоях стромы (рис. 1).

Эпителий остается достаточно сохранным, в ряде случаев отмечали небольшую эпителиопатию. Практически неизменной оставалась и архитектоника субэпителиального нервного сплетения.
Изменения в передней строме – незначительные и непостоянные. Может наблюдаться умеренное снижение прозрачности межклеточного матрикса. Границы ядер кератоцитов остаются четкими, степень их рефлективности – в пределах нормы. Изменения стромы нарастают по направлению к ее средним слоям. В средних слоях регистрируются явные признаки отека: диффузное снижение прозрачности межклеточного матрикса, в результате чего границы клеточных структур становятся размытыми, нечеткими.
В задней строме, особенно в зоне, прилежащей к десцеметовой мембране, наблюдаются изменения в виде характерного свечения – проявление эффекта отражения света от слоя эндотелия. Согласно законам оптики, повышенный световой рефлекс от более оптически плотного слоя эндотелия проявляется светорассеиванием в предлежащих слоях стромы роговицы. Повышению уровня светорассеивания способствует отек межуточного вещества в средних и задних слоях стромы роговицы вследствие нарушения водного баланса.
Изменения со стороны эндотелия незначительны, плотность клеток соответствовала возрастной норме. Можно отметить умеренно выраженные явления поли- и плеоморфизма и полимегатизма. В 56% случаев были выявлены локальные изменения в виде расширенных межклеточных контактов, контурирование ядер эндотелиоцитов, нарушение рельефа клеточного слоя и неравномерного светового рефлекса с поверхности клеточных мембран.
Таким образом, при глаукоме на фоне повышенного ВГД основные изменения были отмечены в средних и задних слоях стромы роговицы.
В данной работе были обследованы пациенты с различной длительностью глаукомного процесса с целью оценки степени морфологических нарушений и их зависимости от стажа заболевания и использования антиглаукомных средств.
Обследование пациентов на фоне длительного медикаментозного режима при компенсированном ВГД выявило также определенную закономерность с максимальными изменениями морфологической картины эпителия и передних слоев стромы (рис. 2, выделено красным).

Морфологические нарушения со стороны эпителия роговицы выражены в различной степени в зависимости от длительности применения антиглаукомных препаратов. Нарушены структура, ход и взаиморасположение нервов субэпителиального нервного сплетения.
Максимальные изменения можно наблюдать в передних слоях стромы роговицы, видны явные нарушения структуры, уменьшается количество кератоцитов, происходит резкое снижение прозрачности вещества роговицы. Состояние же средней и задней стромы по сравнению с микроскопической картиной, получаемой при некомпенсированном ВГД и отсутствии медикаментозного режима, на фоне использования гипотензивной терапии улучшается. Уменьшается световой рефлекс от слоя эндотелия, что свидетельствует о снижении степени светорассеивания в предлежащих слоях стромы, а значит, об уменьшении степени отека. Это свидетельствует о том, что на фоне медикаментозного режима происходит стабилизация метаболических процессов в роговице. Эндотелий остается достаточно сохранным, по данным конфокальной микроскопии претерпевает незначительные изменения, т. е. выдерживает и высокое давление, и длительный медикаментозный режим.
Со стороны эпителия роговицы наблюдали нарастание явлений эпителиопатии по мере увеличения длительности заболевания и медикаментозного режима.
В данной работе были обследованы пациенты с различной длительностью глаукомного процесса с целью оценки степени морфологических нарушений и их зависимости от стажа заболевания и использования антиглаукомных средств.
В результате применения медикаментозного режима в течение 2-х мес. при глаукоме эпителий претерпевает незначительные изменения, структура поверхностного слоя в целом сохранена, границы клеток различимы, ядра достаточно четкие. Через 1 год появляются характерный отек эпителиоцитов и нарушение межклеточных контактов. Через 5 лет может быть выявлен другой вариант эпителиопатии – поверхностный слой эпителия представлен слоем полиморфных клеток, ядра которых не визуализируются. Их строение не является характерным для данного слоя, а больше соответствует морфологии клеток промежуточных слоев эпителия.
Через 15 лет эпителиопатия проявлялась увеличением размера ядер и повышенной десквамацией клеток. Через 17 лет медикаментозного режима эпителий приобретает черты кератинизирующего эпителия с уплотненной поверхностной плазмолеммой и пониженной прозрачностью. Более выраженными становятся клеточный полиморфизм, расширение межклеточных контактов (рис. 3).

Изменения в передней строме роговицы также прогрессировали по мере увеличения стажа заболевания с применением гипотензивных препаратов. После 2-месячного медикаментозного режима можно отметить умеренную степень дезорганизации структуры стромы, но границы ядер кератоцитов оставались достаточно четкими, не было выраженного снижения прозрачности межуточного вещества. Через 1 год имеют место снижение четкости микроскопической картины, прозрачности межклеточного вещества, изменение пространственной ориентации, четкости очертаний и формы ядер кератоцитов. В дальнейшем происходило нарастание изменений в виде «гомогенизации» и потери клеточности стромы, результатом чего являлись резкое снижение прозрачности, прогрессирующее снижение количества визуализируемых ядер кератоцитов (рис. 4).

Таким образом, результаты исследований свидетельствуют о том, что при повышении ВГД нарушается водный баланс стромы роговицы, возникают морфологические нарушения с признаками хронического отека преимущественно задних и средних слоев стромы.
Проникновение жидкости в строму роговицы ограничено 2 структурными элементами: передним и задним эпителием, специфические функции которых обеспечивают ее водный баланс.
В соответствии со своей функцией в качестве барьера передний эпителий роговицы отличается наличием плотных межклеточных контактов, относительно низкой ионной проводимостью через его апикальные клеточные мембраны и высоким сопротивлением парацеллюлярному транспорту.
Плотные контакты (tight junction) между эпителиальными клетками образуют барьер, значительно ограничивающий поступление воды из слезной пленки в строму. Водный баланс обеспечивается эпителиальным транспортом ионов натрия и хлора. В естественных условиях важность этого транспорта в поддержании нормальной толщины и прозрачности роговицы минимальна по сравнению с таковым роговичного эндотелия, этот ток жидкости имеет большее значение для обеспечения эпителиального гомеостаза.
Эндотелий представляет собой барьер для проникновения жидкости в роговицу, однако этот барьер неполный (избирательный) – жидкость проникает в строму через слой эндотелия по межклеточным пространствам. Концепция же строго определенного уровня гидратации роговицы, определяющего ее прозрачность, представляет баланс между объемом поступающей в роговицу влаги, в т. ч. и через слой эндотелия, и функцией активного метаболического насоса. Функция метаболического насоса (эндотелиальных помп) обеспечивает активный транспорт ионов. При нормальном функционировании эндотелиальных помп поддерживается постоянное динамическое равновесие между притоком жидкости в строму через эндотелиальный барьер и поступлением воды обратно в переднюю камеру по градиенту осмотического давления [14, 15].
Таким образом, основным механизмом поддержания водного баланса роговицы является перемещение ионов и жидкости из роговицы в переднюю камеру глаза, что обеспечивает отток жидкости из задних слоев стромы и направление ее движения из передних слоев роговицы к ее задним отделам. При некомпенсированном ВГД гидростатическое давление водянистой влаги может создать препятствие для осуществления нормального тока жидкости из роговицы в переднюю камеру через слой эндотелия и усилить ток жидкости через неполный эндотелиальный барьер в роговицу. Одним из факторов накопления жидкости в строме роговицы может быть нарушение функции метаболического насоса в результате давления на клетки эндотелия, что может нарушать их специфические функции.
С учетом направления тока жидкости в строме роговицы от ее передних слоев к задним отделам вполне объяснимым является появление признаков хронического отека в средних и задних слоях при нарушении специфической функции эндотелия, обеспечивающей активный транспорт жидкости из роговицы в переднюю камеру, и гидростатическом сопротивлении влаги передней камеры.
При компенсации ВГД на фоне инстилляций гипотензивных антиглаукомных препаратов работа метаболического насоса нормализуется, что приводит к уменьшению признаков стромального отека в задних и средних слоях. Однако параллельно нарастают патологические изменения в эпителии и передних слоях стромы роговицы, что, по-видимому, связано с токсическим действием консервантов, являющихся составляющей частью медикаментозных средств, используемых при глаукоме.
Заключение
Таким образом, результаты исследований подтверждают необходимость снижения риска возникновения морфологических нарушений в роговице при глаукоме. Наряду со снижением ВГД необходимо минимизировать неблагоприятное воздействие консервирующих агентов. Идеальным является вариант использования бесконсервантных препаратов (Тафлотан, Santen). Возможно применение препаратов с более «мягким» консервантом (пурит, распадается на ионы натрия, хлора, кислород и воду) (Альфаган, Allergan Inc.). Одним из вариантов снижения токсического действия консерванта является введение в состав препарата дополнительных увлажняющих агентов (поливиниловый спирт) (Люксфен®, Bausch & Lomb). Существует еще один путь смягчения действия консерванта – назначение слезозаменителей и/или кератопротекторов дополнительно к медикаментозному режиму пациентов.
Источник
Обзор посвящен морфологическим особенностям склеры при глаукоме. Описывается строение склеры в норме и при глаукомном поражении. Представлены подходы к разработкам хирургического лечения, связанные с особенностями морфологии склеры при глаукоме. Приведены исследования толщины склеры различными методами, данные которых различаются.
Склера, как известно, является частью фиброзной оболочки глаза, которая составляет большую ее часть, и в основном выполняет защитную функцию, поддерживает форму глаза и способствует устойчивости внутренних структур к изменениям внутриглазного давления (ВГД).
Наружный слой склеры рыхлый и хорошо васкуляризированный, он связан соединительнотканными тяжами с теноновой капсулой. Эта часть склеры называется эписклерой и благодаря своему строению представляет особый интерес с позиции оперативного лечения глаукомы.
Собственно склеральная ткань в отличие от роговицы практически лишена чувствительных нервных окончаний и бедна сосудами [1]. Этот факт также позволяет рассматривать склеру как интересный объект для исследований, тем более что существуют гипотезы, предполагающие питание и образование коллагена в ткани склеры за счет внутриглазной жидкости [2]. В состав склеры входят пучки, состоящие из коллагеновых и эластических волокон, расположенных в разных плоскостях под разными углами, между которыми находятся фиброциты. При этом эластические волокна занимают около 2% объема пучка. Интересно, что 2/3 всех эластических волокон расположены во внутреннем слое склеры, 1/3 – в среднем слое, в поверхностном слое – отсутствуют. Это позволяет склере сохранять прочность при изменении внутреннего объема глаза и ВГД. Важно, что старение наружного слоя склеры, лишенного эластических волокон, увеличивает ригидность склеры в 3 раза, а при глаукоме – более чем в 5 раз [3].
Э.С. Аветисов и соавт. в 1979 г. обнаружили дистрофические изменения в коллагеновых фибриллах склеры с возрастом, связанные с их рассасыванием. В ткани склеры обнаруживаются активные фиброкласты, которые резорбируют обломки фибрилл [4].
E.H. Иомдина и соавт. в 2009 г. обнаружили значительное повышение поперечной связанности в коллагеновой структуре склеры с прогрессированием глаукомы, что, в свою очередь, повышает жесткость склеры [5]. Последние данные говорят о прогрессирующих нарушениях в структуре эластических волокон склеры – в основном у пожилых людей и при развитии глаукомного процесса [6].
В.В. Серова и соавт. показали, что коллаген собственного вещества склеры относится к I, VI, VIII типам с преобладанием I типа. Коллаген III типа представлен преимущественно в эписклере [7].
Интересен тот факт, что распределение коллагена в строме склеры глаукомных глаз, особенно в далеко зашедших стадиях, имеет особенности, которые нельзя не учитывать при разработке хирургических методик. Так, например, Л.Д. Андреевой и соавт. были зафиксированы факты накопления в строме склеры коллагена III типа, в норме не свойственного ее структуре.
Специфика иммуноморфологических изменений соединительной ткани склеры выражается еще и в том, что интенсивное очаговое накопление коллагена III типа, а также фибронектина и гликозоаминогликанов происходит в ее средних и глубоких слоях [8]. По данным F. Keeley et al., разница между передним и задним отделами глазного яблока по типовому составу коллагена склеры отсутствует [9].
В литературе встречается различная информация, касающаяся параметров толщины склеры в разных ее отделах. У зрительного нерва, по данным разных авторов, толщина ее составляет от 0,8 до 1,2 мм, а самая тонкая ее часть (0,3–0,5 мм) зафиксирована в районе прикрепления наружных мышц глаза.
Так, R.E. Normann et al. в 2009 г. исследовали 11 кадаверных глаз человека, 4 из которых получены от умерших, страдавших при жизни глаукомой. Средняя толщина всей склеры составила 670,8 мм (в диапазоне от 564 до 832 мм), а толщина в области лимба и заднего полюса – 588,63 и 99,181 мм соответственно [10].
По данным Т. Olsen et al., толщина склеры в среднем в области лимба – около 500–600 мкм, в области экватора — 400–500 мкм, а в области заднего полюса глаза у зрительного нерва — до 1500 мкм [11].
М.В. Шевченко и соавт. в 2009 г. также были проведены исследования кусочков склеры, взятых прижизненно от пациентов, которым выполнялась задняя трепанация склеры во время антиглаукомной операции, в 10–13 мм от лимба. Толщина склеры в этой зоне составила от 1,2 до 2,2 мм [12].
Э.В. Егорова и соавт. в 2015 г. опубликовали результаты акустических измерений склеры в области лимба и в 4 мм от склеральной шпоры, проведенных у больных, страдающих глаукомой. Оказалось, что в экваториальной зоне толщина склеры составила от 0,21 до 0,23 мм, а в области лимба – от 0,42 до 0,63 мм [13].
Исследования В.В. Страхова и соавт. подтвердили снижение толщины склеры по мере прогрессирования глаукомного процесса. Толщина склеры в районе шпорной борозды в нормальных глазах в среднем составила 1,32 мм, тогда как у больных глаукомой – 1,14 мм [14].
Такая большая разница в данных, касающихся толщины склеры в различных ее отделах, по всей видимости, зависит от множества факторов. Конечные результаты напрямую зависят от методов измерения, методики забора и обработки материала, а также от типа прижизненной рефракции.
Склера непосредственно участвует в оттоке водянистой влаги, причем как по основному, так и по дополнительному пути. Так, основной элемент дренажной зоны глаза – шлеммов канал расположен в толще склеры, в задненаружной части внутренней склеральной бороздки. Он связан с интра- и эписклеральными венами посредством коллекторных канальцев, количество которых варьирует от 37 до 49, а диаметр – от 20 до 45 мкм. Коллекторные канальцы, или выпускники, различаются размерами и направлением. Эти проводники водянистой влаги впадают в сосуды интра- и эписклерального венозного сплетения, в сосуды венозной сети цилиарного тела или, отходя от синуса в параллельном направлении, обратно впадают в него. Соединяясь между собой, коллекторные канальцы I типа образуют водяные вены. Они содержат влагу чистую или с примесью крови [15].
Склера также участвует в оттоке водянистой влаги по дополнительному пути. Первые эксперименты, доказывающие проницаемость склеры для внутриглазной жидкости, были проведены учеными в 1960–1970-х гг. Известный термин «увеосклеральный отток» возник после описания движения радиоактивных частиц из передней камеры глазного яблока через цилиарную мышцу в супрахориоидальное пространство, а затем через эмиссарии в склеру [16–18].
Увеосклеральный отток включает в себя нескольких составляющих: увеальный, супрахориоидальный и склеральный. Через продольную часть ресничной мышцы водянистая влага оттекает в супрацилиарное и супрахориоидальное пространство, а дальше через склеру в периорбитальную область [19].
По данным A. Bill (1966), увеосклеральный путь составляет 1/3–1/5 часть общего минутного объема жидкости [20], а по более поздним данным A. Bill и C.G. Phillips (1971), увеосклеральным путем оттекает 4–27% внутриглазной жидкости [21]. Исследования I. Fatt также показали, что через склеру может оттекать до 21% минутного объема внутриглазной жидкости [22].
Экспериментами А.П. Нестерова и соавт. было показано, что основная часть увеосклерального оттока приходится именно на трансклеральный путь [23, 24].
Изучая проницаемость склеры на кадаверных глазах человека, А.П. Нестеров, И.Н. Черкасова и O.A. Румянцева в 1977 г. определили, что при средних размерах глазного яблока площадь склеры составляет 1700 мм2. На фоне вакуум-компрессии передних путей оттока и при перфузионном уровне ВГД в 20 мм рт. ст. коэффициент легкости оттока был равен 0,06 мм3/мин/мм рт. ст. Объем оттекающей жидкости при этом со всей поверхности склеры составил 1,2 мм3/мин [25].
Исследования И.Н. Черкасовой с соавт. в 1979 г. доказали, что через дополнительные пути может оттекать от 1,19 до 7,19 мм3/мин водянистой влаги в зависимости от уровня ВГД. При повышении давления в капсуле глаза до 30 мм рт. ст. отток со всей поверхности склеры составил 1,72 мм3/мин, а при 40 мм рт. ст. – 2,58 мм3/мин. Таким образом, склера непосредственно участвует в оттоке жидкости из глаза, и ее проницаемость зависит от ВГД [24]. Подтверждена также линейная зависимость между фильтрующим давлением и транссклеральным оттоком [26].
В эксперименте на кроликах Н.В. Косых с соавт. (2001) выявили, что склеральная составляющая подчиняется закону Пуазейля и увеличивается при возрастании офтальмотонуса, а увеальная – напротив, несколько уменьшается [27].
Особенность репаративных процессов в склере после хирургического воздействия является одним из важнейших факторов, влияющих на стабильность ВГД и сохранение зрительных функций.
В.Н. Кулешовой и соавт. (2014) было проведено исследование кусочков склеры, взятых во время антиглаукомных вмешательств, проводимых впервые и повторно в сроки от 2 до 13 лет. У повторно оперированных пациентов все образцы резко отличались пролиферативной активностью матрикс-продуцирующих клеток и полиморфизмом волокон соединительной ткани [28].
Интересны результаты работы авторов, изучавших иммуногистохимический маркер CD34 в кусочках склеры. Этот маркер участвует в развитии воспаления и миграции стромальных клеток. Присутствие CD34-позитивных клеток в различных тканях связано с вовлечением клеток с низким уровнем дифференцировки. Исследования тканей глаза больных рефрактерной глаукомой показали, что он имел место в эндотелиальных клетках и перицитах коллекторных каналов дренажной системы глаза, сочетаясь с расширением их просветов. При этом в структуре водяных вен и сосудисто-нервных пучках склеры меченные клетки выявлялись крайне редко [29].
Раневой процесс после антиглаукомных операций на дренажной зоне значительно схож с процессом заживления кожной раны. Белки плазмы и клетки крови, выпущенные в рану, образуют фибриновый сгусток. Затем происходит миграция нейтрофилов и макрофагов, которые и растворяют сгусток [30].
Излишнее рубцевание и образование склеро-склеральных и склеро-конъюнктивальных сращений являются причинами нестойкого снижения ВГД после оперативных пособий. Эти процессы протекают в области трабекулы, шлеммова канала, а также между конъюнктивой, теноновой капсулой и эписклерой [31, 32]. После удаления эписклеры, богатой кровеносными сосудами, и теноновой оболочки в зоне хирургического воздействия удается снизить риски излишнего рубцевания [33].
В литературе также имеется достаточно данных об угнетении пролиферативных процессов в склере после применения цитостатиков и ингибиторов ангиогенеза в ходе операции [34, 35]. Применение вискоэластичных растворов в антиглаукомных хирургических пособиях не только снижает интраоперационные риски, но и уменьшает ответную воспалительную реакцию тканей глаза на операционную травму [36, 37].
В исследованиях также изучался фактор роста соединительной ткани CTGF, который участвует в образовании фиброзной ткани. D. Esson (2004), применив метод иммунолокализации, установил, что после фильтрующей хирургии CTGF обнаруживается в сосудистой оболочке, конъюнктиве и склере [38].
Особенности морфологии склеры позволили разработать новые подходы к снижению рубцевания в зоне хирургического воздействия. Так, для снижения пролиферации и продления гипотензивного эффекта разработаны метод денервации будущей фильтрационной зоны оперативного вмешательства [39], а также методики, направленные на удаление эписклеры и теноновой оболочки в области операционного поля и применение различных дренажей [40, 41].
Изучение морфологических и функциональных особенностей склеры представляется весьма интересным для создания новых безопасных и эффективных подходов к лечению глаукомы.
Сведения об авторе: Корчуганова Елена Александровна – к.м.н., старший научный сотрудник. ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России. 117997, Российская Федерация, Москва, ул. Островитянова, 1. Контактная информация: Корчуганова Елена Александровна, e-mail: korchuganovaelena@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 02.11.2017.
About the author: Elena A. Korchuganova – PhD, Research Officer. Russian National Research Medical University named after N.I. Pirogov. 1, Ostrovityanova str., Moscow, 117997, Russian Federation. Contact information: Elena A. Korchuganova, e-mail: korchuganovaelena@yandex.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 02.11.2017.
Источник