Медикаментозное лечения первичной открытоугольной глаукомы
Статье посвящена проблеме медикаментозного лечения первичной открытоугольной глаукомы и разработке индивидуального подхода. Рассматривается возможность применения программного приложения для расчета толерантного внутриглазного давления у пациентов с первичной открытоугольной глаукомой.
Актуальность
Глаукома остается одной из главных причин слепоты и слабовидения и является в настоящее время одной из актуальнейших проблем офтальмологии.
По данным Всемирной организации здравоохранения, число больных глаукомой в мире колеблется от 60,5 млн до 105 млн человек, причем в ближайшие 10 лет оно увеличится еще на 10 млн [1, 2].
Во многих высокоразвитых странах мира на долю глаукомы приходится 13–28% всей слепоты [3–9]. Среди причин слепоты и слабовидения в России глаукома занимает первое место. В нозологической структуре инвалидности доля глаукомы возросла с 20 до 28%, а в контингенте инвалидов пенсионного возраста — до 40% [3, 5, 10].
Определение толерантного внутриглазного давления
Повышенное внутриглазное давление (ВГД) является основным фактором риска развития глаукомной оптической нейропатии (ГОН) и снижения зрительных функций у больных первичной глаукомой. В настоящее время в литературе широко используются термины «индивидуальное», «толерантное», «интолерантное» и «целевое ВГД».
Впервые определение толерантного ВГД при глаукоме
было предложено А.М. Водовозовым в 1975 г. Индивидуально переносимое (толерантное, P tl) давление — максимальный уровень офтальмотонуса, не оказывающий повреждающего действия на внутренние структуры глазного яблока [11–17]. Толерантное ВГД можно определить у больных глаукомой по достоверному улучшению зрительных функций при медикаментозном снижении офтальмотонуса. Постоянное или периодическое повышение офтальмотонуса выше толерантного давления является основным фактором риска развития ГОН и снижения зрительных функций у больных первичной открытоугольной глаукомой (ПОУГ) [18].
Увеличение суточных колебаний ВГД на 1 мм рт. ст. приводит к увеличению риска прогрессирования ПОУГ на 30%. Снижение ВГД на 1 мм рт. ст. позволяет снизить риск прогрессирования глаукомы на 19% [19]. Доказано, что снижение повышенного офтальмотонуса до индивидуального уровня ВГД у больных ПОУГ способствует длительному сохранению зрительных функций [13, 17].
Цели лечения больных глаукомой: сохранение зрительных функций; достижение терапевтического эффекта при минимальном числе препаратов с минимумом побочных действий; сохранение качества жизни при доступных затратах [1, 2].
Эффективность лечения больных ПОУГ следует оценивать по следующим критериям: 1) нормализация офтальмотонуса — по достижении индивидуального ВГД; 2) стабилизация зрительных функций — по данным периметрии; 3) отсутствие прогрессирования ГОН — по данным оптической когерентной томографии (ОКТ) диска зрительного нерва (ДЗН) и сетчатки.
Целевое ВГД — условно выбранный офтальмологом безопасный уровень ВГД, который определяется как 20–30–40% снижение от исходного значения офтальмотонуса. В настоящее время целевое давление определяется с учетом стадии глаукомы (табл. 1) [1, 2]. Недостатком определения целевого давления является то, что не учитываются индивидуальные особенности пациента.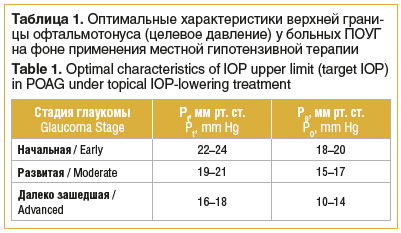
Верхняя граница индивидуальной нормы ВГД (толерантное ВГД) зависит в основном от диастолического уровня артериального давления (АД) в плечевой артерии и возраста пациента [17]. Таблица с соответствующими значениями доступна в литературе и приводится в Национальном руководстве по глаукоме для практикующих врачей [1, 2].
Таким образом, для достижения стабилизации
глаукомного процесса необходимо, чтобы офтальмотонус на фоне медикаментозного лечения у больных ПОУГ был ниже уровня толерантного давления на 2,5 мм рт. ст., а суточные колебания ВГД не превышали толерантное давление [17].
Применение программного приложения для определения толерантного ВГД
Для определения значения толерантного истинного ВГД у больных ПОУГ разработано программное обеспечение под Windows и для мобильных устройств Toliop на операционных системах IOS 8–10 и Аndroid. Данные программные продукты при расчете толерантного ВГД учитывают, помимо возраста и диастолического АД в плечевой артерии, также стадию глаукомы и офтальмобиометрические показатели: переднезадний размер глаза и толщину роговицы в центральной оптической зоне [11, 20–24], прогнозируют скорость прогрессирования глаукомы по величине индекса интолерантности (I int):
![]()
При величине I int менее 5,0 мм рт. ст. прогнозируется медленное прогрессирование глаукомного процесса, при I int свыше 5 мм рт. ст. — быстрое прогрессирование.
Для определения толерантного давления с помощью программного обеспечения необходимо ввести данные пациента: возраст, значения систолического и диастолического АД в плечевой артерии, фактическое ВГД (P0) на момент обследования, переднезадний размер глазного яблока, толщину роговицы в центральной оптической зоне и стадию глаукомы.
На рисунке 1 продемонстрирован пример расчета толерантного ВГД у пациента 60 лет. Толерантное ВГД (P0 tl) на OD равно 15,8 мм рт. ст., на OS — 11,7 мм рт. ст. Более низкое значение толерантного давления на левом глазу обусловлено «тонкой» роговицей в центральной оптической зоне и переднезадним размером глазного яблока, который был равен 26,7 мм. I int на OS равен 6,3 мм рт. ст., что указывает на вероятность быстрого прогрессирования глаукомы. Данный расчет можно распечатать и (или) сохранить в архиве. Время на внесение данных о пациенте и определение толерантного ВГД составляет 30 с.
Определение толерантного ВГД имеет важное значение для оценки и прогнозирования динамики зрительных функций у больных ПОУГ.
По данным исследователей, при стабилизированной глаукоме (1549 глаз, 94,6% случаев) среднее значение I int составило —1,5±0,04 мм рт. ст. Из них у 94,4% больных ПОУГ (1463 глаза) I int был меньше нуля и выражался отрицательным числом. У 5,6% больных ПОУГ (86 глаз) I int был менее 2 мм рт. ст. Это подтверждает, что для стабилизации зрительных функций необходимо, чтобы ВГД не превышало толерантное давление [17].
Определение уровня индивидуального ВГД у больного ПОУГ позволяет врачу:
своевременно скорректировать лечение для достижения индивидуальной нормы;
прогнозировать стабилизацию или прогрессирование глаукомного процесса, а также скорость прогрессирования ПОУГ;
своевременно направлять пациента на лазерное или хирургическое лечение глаукомы.
Важно знать, что прогрессирование глаукомы на фоне медикаментозного лечения может отмечаться при нормальных значениях офтальмотонуса в 36–42% случаев, когда колебания ВГД превышают уровень толерантного [17]. Если колебания офтальмотонуса не превышают толерантное ВГД, стабилизация зрительных функций наблюдается у больных ПОУГ в 94,6% случаев [17].
Принципы выбора местной гипотензивной терапии
Применение местных гипотензивных препаратов возможно в комбинации друг с другом, а также в сочетании с лазерными и хирургическими методами лечения.
Во время лечения необходимо снизить повышенное ВГД до уровня индивидуальной нормы, суточные колебания офтальмотонуса не должны превышать значений толерантного ВГД.
Лечение начинают с монотерапии лекарственным средством первого выбора [25].
При неэффективности или плохой переносимости пациентом лечения выполняют замену на лекарственный препарат из другой фармакологической группы или переходят к комбинированной терапии.
При комбинированной терапии не следует использовать более двух лекарственных средств одновременно, предпочтительно их применение в виде фиксированных комбинаций [26].
При проведении комбинированной терапии не следует применять препараты из одной фармакологической группы (два разных β-адреноблокатора, два разных простагландина).
Следует учитывать наличие противопоказаний к применению лекарственных препаратов у пациента, их переносимость и безопасность, наличие консервантов, содержащихся в лекарственном препарате, особенно при длительном лечении.
Для исключения тахифилаксии и побочных действий лекарственного препарата своевременно проводить плановую замену 2–3 раза в год на лекарственные средства из другой фармакологической группы.
Адекватность лечения регулярно проверяется исследованием состояния ДЗН и зрительных функций (при начальной стадии — 1 раз в 6 мес., при развитой и далеко зашедшей глаукоме — 1 раз в 3–4 мес.). Контроль ВГД проводится ежемесячно.
При снижении повышенного офтальмотонуса на фоне комбинированного медикаментозного лечения до уровня индивидуального ВГД больным с начальной стадией ПОУГ можно рекомендовать проведение селективной лазерной трабекулопластики (СЛТ) с целью улучшения оттока водянистой влаги (ВВ), возможности возврата на монотерапию или отмены антиглаукомных препаратов, улучшения качества жизни пациента и повышения приверженности больного лечению.
При неэффективности комбинированной медикаментозной терапии, когда колебания офтальмотонуса превышают уровень толерантного ВГД, больным ПОУГ следует рекомендовать хирургическое лечение глаукомы.
На рисунке 2 приводится алгоритм лечения пациентов с ПОУГ.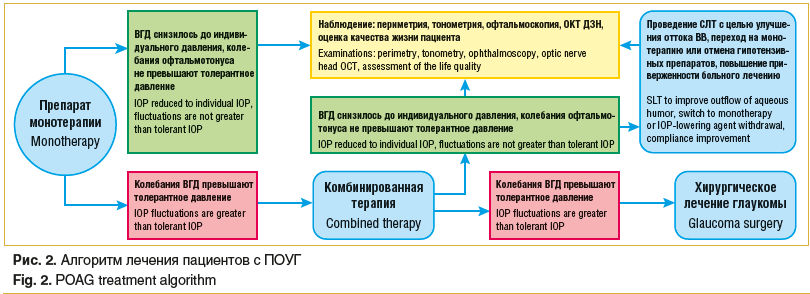
В таблице 2 представлены фармакологические группы для лечения глаукомы. Для снижения повышенного офтальмотонуса до индивидуального ВГД у больных ПОУГ предпочтение следует отдавать препаратам, которые эффективно снижают ВГД за счет улучшения оттока ВВ.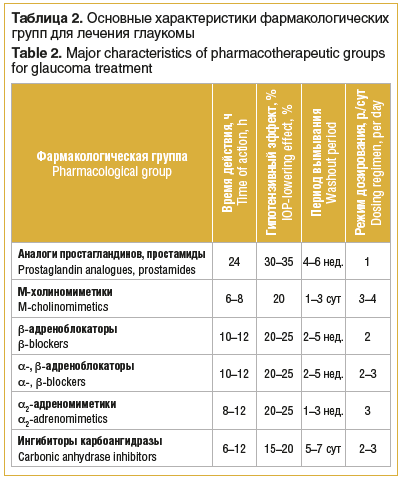
Многочисленные исследования показали, что в качестве препаратов первого выбора у пациентов с ПОУГ наиболее целесообразно использовать аналоги простагландинов и простамиды.
Аналоги простагландинов и простамиды — пролекарства, которые обладают выраженным гипотензивным действием: снижают офтальмотонус на 30–35% от исходного уровня за счет улучшения преимущественно увеосклерального пути оттока ВВ. К аналогам простагландина F2a относятся: латанопрост 0,005%, травопрост 0,004% и тафлупрост 0,0015%, к простамидам — биматопрост 0,03%.
Латанопрост представляет собой пролекарство в форме сложного изопропилового эфира — аналога простагландина F2α, обладающего высокой селективностью по отношению к FP-подтипу простаноидных рецепторов. После попадания в ткань роговицы латанопрост полностью гидролизуется эстеразами (считается, что никакими иными способами препарат в глазу не метаболизируется). Вслед за этим кислота латанопроста поступает в переднюю камеру глаза. Латанопрост не обладает биологической активностью до тех пор, пока не подвергнется гидролизу в роговице и не превратится в свободную гидрофильную кислоту латанопроста. Отмечалось, что латанопрост имеет очень низкую тропность к простаноидным рецепторам, отвечающим за воспалительные реакции, и высокую тропность к тем простаноидным рецепторам, которые обеспечивают снижение ВГД. Гипотензивный эффект латанопроста (как и других препаратов этой группы) достигается за счет усиления в основном увеосклерального пути оттока внутриглазной жидкости. Латанопрост никак не влияет на ее продукцию. Также не было выявлено какого-либо воздействия латанопроста на сосуды сетчатки или проницаемость гематоретинального барьера [27].
Латанопрост оказывает длительное гипотензивное действие (24 ч) после инстилляции, закапывается в нижний конъюнктивальный свод по 1 капле 1 р./сут (вечером). Такая большая длительность эффекта может быть объяснена, в частности, высокой липофильностью пролекарства и последующим накоплением в роговице активной деэтерифицированной формы препарата [27]. Латанопрост хорошо переносится, хотя иногда может вызывать гиперемию конъюнктивы легкой степени, и его использование не связано с системными побочными эффектами. Некоторые пациенты отмечают усиление пигментации радужки, усиление роста ресниц и гиперпигментацию кожи век.
Несмотря на появление на рынке в начале XXI в. других, помимо латанопроста, препаратов из группы аналогов простагландинов, наиболее часто назначаемым антиглаукомным препаратом в США и Великобритании, например, до сих пор является латанопрост [27]. Следует уточнить, что появившиеся в 2012 г. дженерики Ксалатана обеспечили значимый вклад в эту «популярность» латанопроста, но при описании результатов большинства клинических исследований под латанопростом почти всегда следует понимать оригинальный Ксалатан, который часто выбирается в качестве эталона для сравнения благодаря хорошо изученному и подтвержденному практикой эффекту.
Следует принимать во внимание, что хотя оригинальный препарат и дженерики считаются биоэквивалентными, это не должно приравниваться к их терапевтической эквивалентности, которая может различаться вследствие использования в дженериках иных буферов и консервантов, уровня рН, вязкости и осмолярности раствора. Эти параметры препарата могут существенно влиять на биодоступность и клиническую эффективность лекарственного средства.
Зарегистрированный в России в 2017 г. препарат Трилактан (SOLOPHARM («Гротекс», Россия)) производится из той же фармацевтической субстанции, что и оригинальный препарат («Хиноин Завод Фармацевтических и Химических Продуктов» ЗАО, Венгрия). Трилактан не отличается от оригинального препарата вспомогательными веществами, консервантами, неактивными ингредиентами и т. д., что делает его клиническую эффективность более прогнозируемой и соответствующей ожидаемой офтальмологом эффективности.
В проведенном А.О. Татаринцевой исследовании применения препарата Трилактан оценивались степень гипотензивного эффекта и выраженность нежелательных явлений у 47 пациентов с ПОУГ на разных стадиях заболевания. Снижение офтальмотонуса было достигнуто у всех пациентов (р>0,05). Лечение переносилось хорошо. Местные и системные побочные эффекты при применении Трилактана не отличались от возможных побочных эффектов других препаратов данной группы по составу и частоте встречаемости [28].
Результаты исследования, выполненного в клинике Волгоградского филиала ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова», по изучению гипотензивной эффективности аналогов простагландина F2α представлены в таблице 3.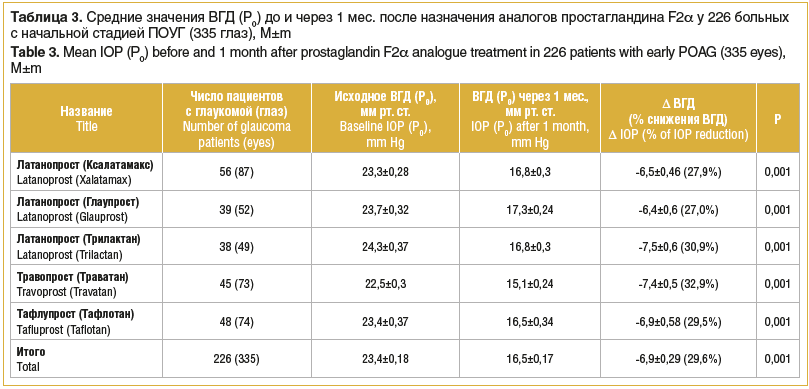
Из таблицы 3 видно, что гипотензивная эффективность латанопроста колеблется от 27% (Глаупрост) до 30,9% (Трилактан, SOLOPHARM, Россия).
А.В. Корнеева и соавт. в своем исследовании с участием 120 пациентов с ПОУГ (150 глаз) продемонстрировали, что препарат Трилактан показал хороший, сопоставимый с оригинальным препаратом, гипотензивный эффект как в монотерапии, так и в комбинации с другими гипотензивными препаратами. Снижение ВГД в группе первичных пациентов составило 31% от исходного уровня, в группе пациентов на гипотензивной терапии при добавлении Трилактана произошло снижение ВГД на 20% от исходного уровня. В группе пациентов, ранее получавших оригинальный латанопрост, уровень ВГД достоверно не изменился. Стабильное снижение и поддержание ВГД на необходимом уровне прослеживались на протяжении всего срока наблюдения и были сопоставимы с таковыми при применении оригинального препарата [29].
Широкое использование латанопроста, а затем и остальных аналогов простагландинов вывело медикаментозную терапию глаукомы на качественно иной уровень, позволив сочетать высокую терапевтическую эффективность в снижении офтальмотонуса с комфортным для пациента режимом инстилляции препарата, что способствует повышению приверженности лечению. В настоящее время латанопрост остается эффективным, безопасным и хорошо переносимым препаратом, который следует рассматривать в качестве возможного варианта лечения у всех пациентов с повышенным уровнем ВГД.
Заключение
На современном этапе исследование толерантного и индивидуального ВГД имеет клиническое значение в диагностике, лечении и мониторинге больных ПОУГ, позволяет у больных глаукомой с «нормальными» значениями ВГД определить, что офтальмотонус в 37–42% случаев превышает толерантное ВГД — находится в зоне повышенного интолерантного ВГД. Индивидуальный подход к лечению, учитывающий толерантное давление, по нашим данным, дал возможность у больных с начальной стадией ПОУГ на фоне медикаментозного лечения добиться стабилизации глаукомного процесса на 513 глазах из 528 в 97,1% случаев, на фоне лазерного лечения на 538 глазах из 575 — в 93,6% случаев, после хирургического лечения на 498 глазах из 535 — в 93,1% случаев. Индивидуальный подход к лечению больных ПОУГ на основе определения толерантного ВГД позволил своевременно и обоснованно увеличить количество лазерных операций на 68,9%, хирургических операций — на 23,5% [17].
Таким образом, благодаря индивидуальному подходу к лечению больных ПОУГ врач может своевременно оценивать эффективность лечения и принимать решение о его достаточности, когда колебания офтальмотонуса находятся в пределах границ среднестатистической нормы, но превышают толерантное давление.
Сведения об авторах:
Балалин Сергей Викторович — д.м.н., заведующий научным отделом Волгоградского филиала;
Фокин Виктор Петрович — д.м.н., профессор, директор Волгоградского филиала.
ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России. 400138, Россия, г. Волгоград, ул. Землячки, д. 80.
Контактная информация: Балалин Сергей Викторович, e-mail: sergej-balalin@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 23.10.2018.
About the authors:
Sergey V. Balalin — MD, PhD, Head of the Scientific Department of the Volgograd branch;
Viktor P. Fokin—MD, PhD, Professor, Director of the Volgograd branch.
S. Fyodorov Eye Microsurgery Federal State Institution, Volgograd branch. 80, Zemlyachki str., Volgograd, 400138, Russian Federation. Contact information: Sergey V. Balalin, e-mail: s.v.balalin@gmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 23.10.2018.
Источник
Открытоугольная глаукома – хроническое прогрессирующее нарушение работы глаз, которое выражается в повышении внутриглазного давления и, как следствие, повреждении зрительного нерва. К основным симптомам глаукомы относят снижение остроты зрения, нарушение аккомодации, дискомфорт и даже боли.

Открытоугольная глаукома и ее особенности
Отличие открытоугольной глаукомы от закрытоугольной заключается в том, что внутриглазное давление нестабильно при открытом угле передней камеры глазного яблока. В этом состоянии у человека периодами или регулярно повышаются значения внутриглазного давления выше индивидуальной нормы. Это провоцирует разрушение диска зрительного нерва и клеток сетчатки, что существенно влияет на характеристики зрения.
Считается, что задержка внутриглазной жидкости обусловлена повышенным сопротивлением оттока продуктами обмена, белками и пигментами. Нарушение имеет тенденцию ухудшаться, болезнь прогрессирует и появляются выраженные симптомы. Длительная задержка глазной влаги провоцирует стойкое повышение внутриглазного давления и губительно влияет на зрительный нерв. Регулярное повышение ВГД неминуемо приводит к атрофии волокон нерва и слепоте.
Помимо механического повреждения нервной ткани, давление негативно влияет на сосуды, снижая кровоснабжение сетчатки и зрительного нерва. Симптомы повреждения проявляются постепенно. Обычно человек даже не замечает основной симптом глаукомы – сужение или выпадение периферических полей зрения.
Открытоугольная глаукома нередко становится причиной инвалидности по зрению. Это заболевание является второй самой распространенной причиной слепоты. По данным ВОЗ более 70 миллионов людей страдают от открытоугольной глаукомы в той или иной степени. Чаще всего болезнь диагностируют у людей старше 60 лет, хотя возможно развитие глаукомы у молодых людей и даже детей.
Стадии развития и особенности протекания глаукомы
По степени выраженности повреждений разделяют начальную, развитую, далекозашедшую и терминальную стадии глаукомы. На начальном этапе болезнь прогрессирует медленно, но без лечения от развития глаукомы до потери зрения проходит 4-7 лет.
Вне зависимости от стадии глаукома может быть:
- компенсированной, когда значения давления при лечении сохраняются в пределах индивидуальной нормы (ниже 26 мм. рт. ст.);
- субкомпенсированной, когда давление выше нормы (26-32 мм. рт. ст.);
- некомпенсированной, когда значения выше 33 мм. рт. ст.
По скорости прогрессирования нарушений и поддаваемости лечению различают стабильную и нестабильную глаукому. Стабильное течение отличается тем, что показатели давления хорошо корректируются препаратами и длительное время нет отрицательной динамики в состоянии зрительного нерва. Нестабильная глаукома не всегда компенсируется даже самыми эффективными методами лечения, а состояние зрительного нерва постоянно ухудшается.

Причины открытоугольной глаукомы
У большинства пациентов причиной нарушения стала генетическая предрасположенность. Установлено, что при наличии глаукомы у родителей, братьев или сестер, вероятность появления нарушений повышается в 3-4 раза. Открытоугольная глаукома наследуется по полигенному типу, то есть при изменении условий среды признаки болезни могут не проявить или проявиться в слабом виде. Это делает возможной и очень важной профилактику полигенных заболеваний.
Предпосылок к глаукоме множеством, но пусковые факторы на данный момент медициной не установлены. Поэтому представление об этиологии открытоугольной глаукомы остается размытым. Считается, что важную роль в развитии болезни играет блокада склеральной пазухи.
Какие аномалии развития глаза могут вызывать глаукому:
- уменьшение угла наклона Шлеммова канала;
- патологии крепления склеральной шпоры, а иногда еще и цилиарной мышцы;
- низкая дифференциация склеральной споры.
Как правило, такие аномалии с возрастом усугубляются. Человек может сам поспособствовать развитию глаукомы, принимая глюкокортикоиды длительное время. Эти препараты снижают проницаемость трабекулярной сети и угнетают отток водянистой влаги. Важным фактором также является нарушение механизмов кровообращения в зоне диска зрительного нерва.
При каких заболеваниях повышается риск развития глаукомы:
- атеросклероз;
- близорукость;
- сахарный диабет;
- гипертоническая болезнь;
- серьезные нарушения метаболизма.
Симптоматика открытоугольной глаукомы
Скорость развития болезни и симптомы зависят от формы глаукомы. Особенности клинической картины определяются причинами повышения внутриглазного давления.
Формы открытоугольной глаукомы:
- Простая первичная. Для этой формы характерно поражение обоих глаз. На раннем этапе развития болезни симптомы, как правило, не проявляются. В дальнейшем отмечаются субъективные признаки: снижение аккомодации, радужные круги в поле зрения при взгляде на источники света, затуманенность зрения, эффект мерцания. Непосредственно во время приступа глаукомы пациенты жалуются на головные боли, распространяющиеся на глаза и брови.
- Псевдоэксфолиативная. Обычно эту форму диагностируют у людей, которые имеют в анамнезе эксфолиативный синдром. Заболевание характеризуется отложением слоя амилоидоподобного вещества в переднем полюсе глаза. Нарушение метаболизма в организме приводит к отложению псевдоэксфолиаций на цилиарном теле и поверхности хрусталика. Это отложения белкового происхождения, которые могут заблокировать дренажную систему. Наличие псевдоэксфолиаций также указывает на слабость связочного аппарата хрусталика. Установить наличие глаукомы можно по изменению контура зрачка, дрожи хрусталика при движении глаз, депигментации центра радужки. Псевдоэксфолиативная глаукома отличается от других форм более высокими значениями внутриглазного давления.
- Пигментная. Эта форма глаукомы развивается при попадании пигмента радужки в область роговично-склеральной перегородки посредством оттока внутриглазной жидкости. Даже у здорового человека пигмент из радужки вымывается и скапливается в дренажной сети угла переднего отрезка глаза, но при глаукоме его в разы больше.
- Глаукома нормального давления. В подавляющем большинстве случаев эту форму диагностируют у людей старше 35 лет, и нарушение функциональности глаз происходит в разной степени. Заболевание развивается при нормальных значениях давления и открытом угле передней камеры, а причиной становится артериальная гипертензия из-за спазма сосудов.

Диагностика глаукомы
Даже первичный офтальмологический осмотр позволяет заподозрить глаукому при ее наличии. Основной диагностики открытоугольной глаукомы является измерение внутриглазного давления по методикам тонометрии, суточной тонометрии, эластотонометрии. С их помощью офтальмолог может фиксировать изменения на протяжении дня и при определенных условиях.
Для уточнения диагноза проверяют состояние глазного дна, угол передней камеры и обследуют поле зрения. Открытоугольная глаукома провоцирует сужение полей зрения и появление скотом (парацентральные, скотомы Бьеррума). Сужение полей развивается с половины от носа.
Методы диагностики открытоугольной глаукомы:
- тонометрия (измерение внутриглазного давления);
- офтальмоскопия (осмотр глазного дна);
- периметрия (обследование полей зрения);
- оптическая когерентная томография (высокоинформативный метод обследования сетчатки и зрительного нерва);
- гониоскопия (визуализация угла передней камеры и области роговично-склеральной трабекулы для выявления склерозивных изменений и усиленной пигментации).
При осмотре глазного дна видны бледность и значительное расширение сосудистой воронки ДЗН. Стремительное прогрессирование открытоугольной глаукомы провоцирует атрофию второй пары черепных нервов и сплетений сосудов в глазном яблоке. Впоследствии развивается кольцо препапилярной атрофии.
Оптическая когерентная томография и сканирующая офтальмоскопия позволяют детальнее изучить патологический процесс. Дифференциальную диагностику проводят с сенильной катарактой.
Консервативное лечение открытоугольной глаукомы
Врач должен выбирать стратегию лечения исходя из стадии глаукомы и типа ее течения. Возможно консервативное, лазерное и хирургическое снижение внутриглазного давления.
Чтобы повлиять непосредственно на причину открытоугольной глаукомы, пациенту назначают гипотензивные препараты для улучшения оттока глазной жидкости. Для этого подходят простагландины (Травопрост, Латанопрост) и М-холиномиметики (пилокарпина гидрохлорид).
Для угнетения секреции внутриглазной жидкости необходимо принимать адреноблокаторы (Проксодолол, Тимолол), ингибиторы карбоангидразы (Диакарб), альфа-2-агонисты (Бримонидин). В комплексе также назначают осмотические диуретики вроде Маннитола.
Задача нейропротекторной терапии при глаукоме заключается в защите нейронов сетчатки и нервных волокон зрительного нерва. Для этих целей назначают витамины, флавоноиды (альфа-токоферол, гамма-аминомасляная кислота), блокаторы каналов кальция (Нифедипин), неферментные антиоксиданты.

Лазерная терапия глаукомы
Показания к лазерному лечению при открытоугольной глаукоме очень ограничены. Лазерную иридэктомию проводят лишь при узком роговично-склеральном угле, а трабекулопластику – при неэффективности консервативных методов.
Лазерная иридэктомия подразумевает создание на периферии радужки небольшого отверстия, которое позволяет устранить функциональный зрачковый блок и нормализовать внутриглазное давление. Такую операцию проводят при 1-3 стадиях первичной открытоугольной глаукомы, когда имеется выраженная подвижность иридохрусталиковой диафрагмы.
Иридэктомию проводят в амбулаторных условиях с применением местной анестезии. На глаз пациента устанавливают гониолинзу, которая будет фокусировать луч лазера на выбранный участок радужки. Обычно для прокалывания выбирают верхний сектор радужки.
Возможные осложнения:
- формирование несквозного отверстия;
- кровотечения;
- помутнение роговицы;
- повреждение капсулы хрусталика;
- эффект второго зрачка.
Во избежание осложнений врач должен провести гониоскопию перед процедурой и добиться максимального сужения зрачка непосредственно перед операцией. При правильном проведении и отсутствии осложнений лазерная иридэктомия оказывается эффективной в 95% случаев.
Лазерная трабекулопластика считается самым безопасным и эффективным лазерным методом лечения глаукомы на сегодняшний день. Операция позволяет нормализовать давление даже у тех пациентов, которые плохо отвечают на лечение антиглаукоматозными каплями.
Хотя такая лазерная операция не может вернуть остроту и качество зрения, она останавливается прогрессирование глаукомы и предотвращает тяжелые осложнения, в том числе слепоту. Вмешательство также проводят амбулаторно. С помощью лазерного луча на трабекулярную сеть – часть дренажной системы – наносят крошечные точечные ожоги. Процедура занимает примерно 30 минут.
Лазерная трабекулопластика показана при первичной открытоугольной или узкоугольной глаукоме после иридотомии. Эффективность операции высока, но возможно неполное выполнение с необходимостью повторного вмешательства. У некоторых пациентов через 2 года отмечается критическое повышение ВГД. В таких случаях назначают обычную операцию.

Возможные осложнения трабекулопластики:
- инфицирование;
- аллергическая реакция;
- временный скачок внутриглазного давления (в первую неделю после операции);
- недостаточная результативность (у 12% пациентов).
Хирургическое лечение глаукомы
Оперативное лечение открытоугольной глаукомы предполагает синустрабекулэктомию. Это непроникающая фильтрующая операция, которую проводят в несколько этапов. Обычно перерыв между операциями составляет 4-6 недель.
В ходе операции врач создает новый путь для оттока внутриглазной влаги из обеих камер глазного яблока. Под склерой и слизистой создается фильтрационная подушка, которая стабилизирует давление. Модификацией техники считается имплантация под склеральный лоскут мини-шунта, то есть миниатюрного дренажа. Благодаря его конструкции обеспечивается стабильный отток жидкости.
После операции глаз закрывают повязкой на несколько дней. Терапия каплями обязательна. Поверхностные швы снимают через 7-10 дней. В период реабилитации рекомендуется ограничить потребление соли и маринованной пищи, а также алкоголя. Нельзя тереть глаза в течение 10 дней. Важно защищать прооперированную область от воды и пыли. Спать рекомендуется на боку, противоположном от глаза, в которое проводилось вмешательство. Во избежание травм лучше ограничить физическую активность.
Преимущества синустрабекулэктомии:
- пациент возвращается домой почти сразу после операции;
- процедура оперирования одного глаза занимается 20 минут;
- безболезненность;
- быстрая реабилитация (1-3 недели);
- отсутствие постельного режима;
- минимальные ограничения в период восстановления.
Положительный эффект после синустрабекулэктомии отмечается в 60-80%. У остальных пациентов возникает необходимость повторить операцию. После лечения проходить обследования нужно дважды в год, чтобы вовремя выявить осложнения и другие нарушения в работе зрительной системы.

Прогноз и профилактика
Несмотря на то, что даже современные методы лечения не позволяют избавиться от глаукомы навсегда, терапия помогает сохранить зрение и обеспечить комфортную жизнь пациенту. Даже если глаукома не сопровождается выраженными симптомами, нельзя отказываться от лечения, ведь патология постоянно прогрессирует и на позднем этапе развития приводит к необратимой слепоте.
Факторы риска:
- возраст от 40 лет;
- наличие глаукомы у родственников;
- рефракционные нарушения;
- сахарный диабет;
- наличие псевдоэксфолиаций;
- длительная терапия кортикостероидами (лечение бронхиальной астмы, аутоиммунных заболеваний);
- сбои в центральном кровообращении (гипертония или гипотония, инфаркт миокарда, вегетососудистая дистония, нарушения мозгового кровообращения);
- сбои в местном и региональном кровообращении (сосудистые спазмы, мигрень, сужение просвета сонной артерии);
- болезни щитовидной железы.
Наличие каждого из факторов риска повышается вероятность развития глаукомы. Если имеется сразу несколько тревожных сигналов, р

