Лазерная и микроинвазивная хирургия глаукомы
Stephenson M.
Микроинвазивная хирургия глаукомы (MIGS) обеспечивает снижение внутриглазного давления (ВГД) с меньшим повреждением тканей по сравнению с традиционной антиглаукомной хирургией. Эта процедура, по мнению экспертов, эффективна при начальной и умеренно развитой глаукоме.
John Berdahl, MD, Sioux Falls, South Dakota, США: Не так давно внезапно появилось множество разнообразных методик MIGS. Эти процедуры заполнили большой издавна существовавший пробел: когда гипотензивные капли уже недостаточно эффективны, а трабекулэктомия еще не показана. MIGS позволяет начать инвазивное лечение глаукомы на ранней стадии заболевания более безопасным образом.
В США одобрение FDA получили методики, работа которых осуществляется в разных сегментах глазного яблока: на уровне шлеммова канала, супрахориоидального пространства и субконъюнктивального пространства.
Richard Lewis, MD, Sacramento, США: По рекомендациям FDA вмешательства на шлеммовом канале и супрахориоидальном пространстве показаны при начальной и умеренно развитой глаукоме только в сочетании с хирургией катаракты. Сейчас некомбинированная процедура относится к разряду off-label. Однако я думаю, со временем мы оценим пользу этих вмешательств и для глаз с нативным хрусталиком, и для глаз при артифакии.
Вмешательства на шлеммовом канале
Dr. Lewis: Микроинвазивные вмешательства на шлеммовом канале проводятся только при открытом угле передней камеры (УПК). К этой группе относятся iStent (Glaukos, San Clemente, California, США), ABiC (ab interno canaloplasty, Ellex, Minneapolis, USA), TRAB 360 (Sight Science, Menlo Park, California, США), GATT (gonioscopy-assisted transluminal trabeculotomy) и Kahook Dual Blade (New World Medical, Rancho Cucamonga, California, США).
iStent – это имплантируемый через трабекулу микрошунт. Он стал первым устройством для хирургии глаукомы, одобренным FDA, и первым имплантатом для MIGS при начальной и умеренно развитой стадии глаукомы, улучшающим естественный отток внутриглазной жидкости (ВГЖ) через перманентное отверстие в трабекулярной сети (рис. 1). iStent можно имплантировать в процессе хирургии катаракты через роговичный разрез 1,5 мм. Его преимуществом стало сохранение важных тканей глаза, повреждаемых во время стандартных антиглаукомных операций.
Kahook Dual Blade имеет острый конец и два лезвия, которые разрезают и удаляют трабекулярную сеть. Это создает возможность для оттока ВГЖ из передней камеры сразу в шлеммов канал, минуя трабекулу, являющуюся местом наибольшего сопротивления оттоку.
Michael Greenwood, MD, Fargo, North Dakota, USA: Kahook Dual Blade размещается в шлеммовом канале без предварительного введения в переднюю камеру глаза. Процедура может быть выполнена любому пациенту независимо от того, происходит ли это одновременно с хирургией катаракты или нет. Кроме того, в отличие от iStent, который одобрен для лечения начальной и умеренно развитой глаукомы, Kahook Dual Blade получил одобрение для лечения более далеко зашедших стадий глаукомы.
Trabectome (NeoMedix, Tustin, California, США) – устройство, похожее на Kahook Dual Blade, но для абляции трабекулярной сети ему дополнительно требуется электрокоагулятор.
TRAB 360 представляет собой трабекулотом, при помощи которого можно выполнить разрез трабекулярной сети на 180 градусов. Для совершения разреза трабекулы на 360 градусов хирургу требуется выполнить два движения: по часовой стрелке и против часовой стрелки.
ABiC – это относительно новая методика, всесторонне улучшающая естественный отток ВГЖ. Она выполняется через самогерметизирующийся роговичный разрез и сохраняет все преимущества вискодилатации шлеммова канала на 360 градусов, как при традиционной каналопластике, однако отличается простотой и скоростью MIGS. Эта процедура может быть выполнена как в сочетании с хирургией катаракты, так и самостоятельно.
GATT выполняется через роговичный разрез шириной 1,0 мм. Процедура заключается в прохождении проводника через шлеммов канал на 360 градусов с последующим затягиванием шва, которое сопровождается разрушением трабекулы и открытием шлеммова канала. Эта методика позволяет получить доступ ко всей естественной дренажной системе, а не только к какому-либо ее фрагменту и эффективно снизить внутриглазное давление (ВГД). При использовании этой методики не происходит повреждения конъюнктивальной ткани.
Супрахориоидальные вмешательства
CyPass Micro-Stent (Alcon, Fort Worth, Texas, США) – это устройство, располагающееся супрацилиарно и создающее контролируемый отток ВГЖ в супрахориоидальное пространство (рис. 2). CyPass представляет собой трубку длиной 6,35 мм с наружным диаметром 0,51 мм. Его можно имплантировать через роговичный разрез шириной 1,5 мм. Для его установки используется специальный проводник, отсепаровывающий радужку от склеральной шпоры. В получившейся щели размещают CyPass Micro-Stent, а отверстия, расположенные по всей длине трубки, способствуют оттоку жидкости в супрацилиарное пространство. Устройство может стать хорошей альтернативой вмешательствам на трабекулярной сети, особенно для пациентов с повышенным давлением в эписклеральных венах.
Субконъюнктивальные вмешательства
XEN45 Gel Stent (Allergan, Dublin, Ирландия) выполнен из мягкого, полученного из коллагена, желатина. Это нить длиной 6 мм и толщиной, примерно как человеческий волос. Стент имплантируется через небольшой роговичный разрез, будучи предзагруженным в инжектор наподобие тех, что используются для имплантации ИОЛ. Он создает мягкий отток ВГЖ из передней камеры в субконъюнктивальное пространство.
XEN намного более безопасная процедура, чем хирургия с использованием шунтов. CyPass и XEN появились не так давно, но первые результаты их применения очень обнадеживают.
Dr. Berdahl: MIGS показана пациентам, которым требуется небольшое снижение ВГД. Здесь соблюдается баланс между эффективностью вмешательства и его риском. Большая степень снижения ВГД ассоциируется с большим риском осложнений.
Dr. Lewis: Действительно, MIGS намного более безопасная процедура, чем традиционная хирургия глаукомы. В то же время она позволяет существенно снизить ВГД. Я думаю, что устройства для MIGS будут применяться все чаще как в сочетании с хирургией катаракты, так и самостоятельно. Сейчас мы пытаемся определиться с выбором оптимальных кандидатов для каждого варианта процедуры.
Естественно, несмотря на все преимущества MIGS показания к традиционной хирургии глаукомы, в том числе с применением дренажей, все же в отдельных случаях имеются. Но с течением времени, определенно, мы будем выполнять трабекулэктомию все реже и реже.
Ключом к успеху при выполнении микроинвазивных антиглаукомных вмешательств является уверенное владение навыками гониоскопии. Удерживать гониопризму недоминантной рукой на максимальном увеличении микроскопа без чрезмерного давления на глаз может быть не совсем удобно. Однако получение хорошего изображения необходимо для эффективного проведения операции.
Dr. Greenwood: Перед тем как приступить к выполнению микроинвазивных антиглаукомных вмешательств, я советую хирургам почаще выполнять гониоскопию на консультативном приеме. Затем можно попрактиковаться в операционной во время стандартных операций по поводу катаракты. Попробуйте сделать это несколько раз в конце операционного дня, когда в запасе остается несколько дополнительных минут.
Reay Brown, MD, Atlanta: При выполнении процедур MIGS может быть полезным окрашивание трабекулярной сети трипановым синим (рис. 3). Этот прием аналогичен окрашиванию передней капсулы хрусталика при наличии бурой и белой катаракты. Он помогает визуализировать трабекулу и шлеммов канал, особенно при имплантации iStent. Окрашивание облегчает позиционирование стента и помогает Вам понять, что Вы на правильном пути.
Dr. Berdahl: У 20% пациентов, идущих на операцию по поводу катаракты, имеется сопутствующая глаукома. Полагаю, что пациентам нужно как минимум дать информацию о том, что существует возможность одновременного проведения щадящей процедуры для снижения ВГД. Возможно, при далеко зашедших стадиях глаукомы и высоком ВГД методики MIGS не будут очень эффективны. Но MIGS – это хороший вариант старта хирургического лечения. Если микроинвазивная процедура не приведет к достаточному снижению ВГД, то всегда остается возможность перехода к более агрессивной и более рискованной методике.
Dr. Greenwood: Со временем появляется все больше данных о результатах MIGS, и, вероятно, скоро мы поймем, какая из современных методик более эффективна, и определимся с показаниями к той или иной процедуре.
Stephenson M. Tips and techniques for optimizing approved MIGS // EyeWorld (Asia-Pacific. – 2017. – Vol. 13, № 3. – P. 22-24.
Источник
В отделе работают: 7 сотрудников, в том числе 5 кандидатов медицинских наук, 2 врача высшей категории.
Специализация отдела: ранняя диагностика различных форм глаукомы; динамическое наблюдение за состоянием зрительного нерва, зрительных функций, гидродинамики глаза, отражающих стабилизацию глаукоматозного процесса; разработка и усовершенствование лазерных и микроинвазивных хирургических технологий лечения глаукомы; исследование факторов риска прогрессирования глаукомы после проведенного лазерного и хирургического лечения глаукомы.
ОБ ОТДЕЛЕ
Отдел хирургии глаукомы был создан в 1983 г. из научного и клинического подразделений МНТК «Микрохирургия глаза». Первым руководителем отдела хирургии глаукомы был профессор В.И. Козлов, который в 1986г. совместно с академиком С.Н. Федоровым изобрел новую технологию операции при глаукоме — непроникающую глубокую склерэктомию, позволившую снизить травматичность хирургии глаукомы до минимума.
Модификация техники операции непроникающей глубокой склерэктомии, разработанная сотрудниками института, расширила показания для тяжелых случаев первичной и вторичной глаукомы.
Благодаря многоплановым экспериментальным и клиническим исследованиям сотрудниками отдела хирургии глаукомы совместно с лазерным отделом МНТК «Микрохирургия глаза» были разработаны и внедрены в практику операции с применением различных источников лазерной энергии, что в комбинации с хирургическими вмешательствами позволяет компенсировать внутриглазное давление.
К преимуществам разработанных операций можно отнести:
- малую инвазивность;
- возможность амбулаторного проведения операций;
- практически полное отсутствие осложнений;
- высокую эффективность.
В настоящее время в отделе хирургического лечения глаукомы применяются самые современные разработки мировой и отечественной офтальмологии, включающие в себя лазерное лечение глаукомы самостоятельно и комбинированное лазерное лечение в сочетании с хирургической операцией при начальных стадиях глаукомы.
Лазерные операции выполняются на новейшей лазерной установке Selecta Trio, позволяющей выполнять все виды лазерных операций на переднем и заднем отрезках глаза, а также комбинированные лазерные вмешательства, качество и результаты лечения контролируются с помощью новейшего компьютерного томографа SPECTRALIS.


В особо тяжелых случаях, при многократно оперированной глаукоме, а также при ранее проведенных вмешательствах у пациентов с коморбидной патологией в отделе проводятся высокотехнологичные хирургические вмешательства с использованием лучших дренажей и имплантов, применяемых в мире.
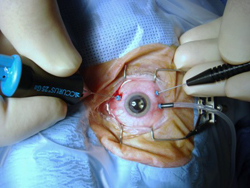
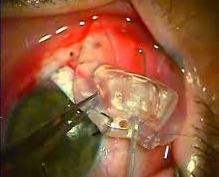
При далеко зашедшей стадии глаукомы и терминальной глаукоме выполняется микроимпульсная лазерная циклофотокоагуляция на новейшем аппарате Cyclo G6 Glaucoma laser system IRIDEX (США) по оригинальной методике, разработанной в отделе хирургического лечения глаукомы МНТК “Микрохирургия глаза” им. акад. С.Н. Федорова.
В отделе хирургического лечения глаукомы МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова ежегодно проводится более 6 000 микроинвазивных хирургических и лазерных операций при глаукоме, что превышает показатели европейских стран и США.
Офтальмохирурги владеют более чем 20-ю видами лазерных и хирургических вмешательств.
Стабильно минимальные осложнения после проведенных операций обеспечивают высокую эффективность лечения.
Отдел хирургии глаукомы является клинической базой для обучения врачей как в России, так и за рубежом.
Сотрудники отдела активно сотрудничают с коллегами в региональных медицинских центрах, проводя научно-клинические телеконференции, дистанционные консилиумы и консультации по сложным клиническим случаям в телемедицинском формате через портал Минздрава России.
СОТРУДНИКИ ОТДЕЛА
Источник
Фролов М.А., Фролов А.М., Казакова К.А., Роскокоха И.В., Гринько М.А.
По данным ВОЗ от 2010 года, глаукома является второй (12%) по значимости причиной слепоты во всем мире [1]. В РФ за 2016 год глаукома составляла 8,3% в структуре общей заболеваемости по классу глазных болезней среди взрослого населения [2]. Такие внушительные цифры задают одно из направлений в исследовательской работе для всего офтальмологического сообщества.
W. Mackenzie в 1830 году первым предложил метод хирургического лечения глаукомы, на тот момент это была склеростомия. В 1856 году Albreht von Greafe выполнил секторальную иридэктомию, однако нестойкий гипотензивный эффект способствовал поискам других методов хирургических вмешательств. Если говорить о дренажной хирургии глаукомы, то ее родоначальником считается Louisde Wecker, который в 1894 году имплантировал золотую проволоку в ткани глаза [3]. С тех пор дренажная хирургия претерпела много изменений и сейчас следует по направлению минимально инвазивной хирургии глаукомы (МИГХ).
Миниатюрный шунт Ex-PRESS (Alcon, США) произведен в 1998 году M. Belkin и Y. Glovinsky. Состоит из нержавеющей стали, не имеет клапана. Дренаж длиной 2,64 мм, внешний диаметр 0,4 мм, внутренний 0,05 мм. В шунте, вблизи среза имеется дополнительное отверстие. Для правильной фиксации трубки и предотвращения дислокации на ней имеется выступ. На месте имплантации происходит местная реакция, заключающаяся в образовании тонкой фиброзной капсулы, без воспаления [4].
E. Dahan и T.R. Carmichael в 2005 году опубликовали результаты 2-годичного исследования применения данного шунта у пациентов с первичной открытоугольной глаукомой (ПОУГ) [5]. Вмешательство произведено у 15 человек (30 глаз). На одном глазу производилась имплантация дренажа, на другом стандартная трабекулэктомия (ТЭ). На основе этих наблюдений выявлено, что большее снижение ВГД достигнуто при постановке микрошунта. В 2009 году E.M. Kanner et al. опубликовали 3-годичные результаты исследования [6], при котором на 231 глазу производилась установка только данного импланта, а на 114 глазах она выполнялась в сочетании с факоэмульсификацией катаракты (ФЭК). Снижение внутриглазного давления (ВГД) было достигнуто в 94,8% и 95% случаев соответственно. Из осложнений встречались: блокада микрошунта нитями фибрина и гипотония в раннем послеоперационном периоде. Необходимо указать, что в процессе эксплуатации дренажа выявились такие осложнения, как мелкая передняя камера, гифема, закупорка импланта и его дислокация, эндофтальмит [7].
Дренаж Hydrus microstent (Ivantis, Inc., Irvine, CA, США) выполнен в виде трубчатого каркаса из биосовместимого нитинола и имеет кривизну, сходную шлеммову каналу (ШК). Устройство имеет отверстия как по длине, так и на концах, имплантируется через роговичный разрез, составляющий 1 мм. Дренаж имеет две модификации с длиной 15 и 8 мм [8]. Под контролем гониоскопии стент устанавливают с помощью инжектора в ШК через трабекулярный аппарат. С помощью данного устройства ШК остается в раскрытом состоянии, что способствует беспрепятственному оттоку внутриглазной жидкости (ВГЖ).
I.K. Ahmed et al. в 2012 году представили первые долгосрочные (в течение 6 месяцев) результаты исследования 28 глаз с развитой и далекозашедшей стадиями ПОУГ после ФЭК и имплантации дренажа Hydrus. На момент последнего осмотра авторы отметили, что показатель истинного ВГД в среднем снизился с 29,9±5,8 мм рт. ст. до 15,3±2,3 мм рт. ст. Послеоперационные осложнения включали появление субконъюнктивального кровоизлияния у 1 пациента, гифемы – в 1 случае и формирование на 2 глазах периферических гониосинехий [9].
Дренаж iStent первого поколения. Он произведен компанией Glaukos (США). Имплант вводится в угол передней камеры ab interno [10]. Микростент iStent создан из медицинского титана с гепариновым покрытием и имеет вид трубки, изогнутой под 90 градусов, длиной 1 мм, с наружным диаметром 0,25 мм и внутренним – 0,12 мм. Имплантация этого дренажа производится через трабекулярную ткань в шлеммов канал с помощью инжектора. Его действие основано на том, что отток ВГЖ происходит в шлеммов канал, минуя трабекулярную сеть [10]. Первый опыт применения импланта был представлен D. Spiegel и K. Kobuch в 2002 году. Группу больных составили 5 человек (6 глаз) с ранее не оперированной ПОУГ. Результаты оценивались в течение 9 месяцев. Стойкий положительный эффект удалось достигнуть в 4 глазах. Получено снижение ВГД от исходного среднего значения в 23,4 мм рт. ст. до 16 мм рт. ст., причем без применения гипотензивных препаратов [11]. С 2003 года начались мультицентровые исследования, при которых, в частности, исследовали снижение ВГД при использовании дренажа совместно с ФЭК. Спустя год после вмешательства ВГД снизилось с 21,7 до 17,4 мм рт. ст. Из осложнений в ряде случаев наблюдались обструкция стента и его дислокация [12].
Золотой микрошунт (Gold Micro-Shunt) был изобретен в Израиле и изготовлен фирмой SOLX. Данный дренаж изготовлен из золота, он прямоугольной формы с длиной 5 и шириной 3 мм. Выпускается 2 вида шунта: GMS и GMS plus. Первый имеет массу 6,2 мг и толщину 60 мкм. В пластинке 9 каналов с шириной 25 мкм и высотой 44 мкм. GMS plus имеет массу 9,2 мг, а каналы этой модели шире – 68 мкм. Действие микрошунта основано на увеличении оттока ВГЖ из передней камеры в супрахориоидальное пространство, поэтому при имплантации данного дренажа угол передней камеры (УПК) должен быть свободен от гониосинехий.
С 2006 года начались мультицентровые исследования его в Испании и Израиле [13]. За 4 года наблюдений шунт показал достаточную эффективность. В частности, было отмечено, что ВГД у пациентов с глаукомой, которым был имплантирован дренаж, составило от 5 до 21 мм рт. ст. в 97% случаев. Также авторы выявили осложнения, которые возникали после имплантации золотого микрошунта. Это супрахориоидальные кровоизлияния, рубеоз радужки, эндофтальмит, отслойка сетчатки [14].
Углеродный дренаж состоит из активированного углеродного волокна гидратцеллюлозы длиной 25 мм. Полифиламентная углеродная нить имеет высокие дренажные функции [15]. В экспериментах in vivo установлено отсутствие побочных эффектов и достаточно эффективное снижение офтальмотонуса. Не наблюдалось случаев закрытия путей оттока фибринозной тканью и, следовательно, сохранялись пути оттока для ВГЖ [16]. Затем был разработан еще один дренаж из этого же материала, имеющий длину 25 мм и диаметр 150–600 мкм. Он представляет собой углеродную монофиламентную нить, произведенную из активированного углеродного волокна при температуре 1000° С. По результатам исследований (12 пациентов) ВГД было нормализовано и находилось на уровне 17,69±1,97 мм рт. ст. В 1 случае спустя 3 месяца после вмешательства был зафиксирован пролежень конъюнктивы. В остальных наблюдениях снижение уровня ВГД отмечалось на протяжении всего периода исследования (5-18 месяцев) [17].
Дренаж из ванадиевой стали, предложенный В. Кумаром и М.А. Фроловым, представляет собой прямоугольной формы фигуру из мягкой стальной проволоки толщиной 80 мкм, размеры ее 2,5х0,5 мм. Антиглаукомные вмешательства были выполнены у 41 пациента. Из осложнений в послеоперационном периоде наблюдали: у 8 пациентов – повышение ВГД, у 1 пациента – гифему и у 5 – мелкую переднюю камеру, из них в 3 случаях развилась цилиохориоидальная отслойка (ЦХО) [18].
i-Stent Inject – стент второго поколения (Glaukos). Данный стент меньший по размеру, чем первого поколения, в связи с чем имлантацию его в ШК провести гораздо легче. Причем возможно установить сразу два стента. Маленький размер данного импланта позволяет также избегать таких нежелательных моментов, как гипотония и рефлюкс крови из коллекторных каналов и ШК [10, 19].
Супрахориоидальный микростент CyPass (Transcend Medical, Menlo Park, CA, США) – R. Craven (2010 год). Представляет собой трубку с внутренним диаметром 0,3мм, наружным – 0,51 мм и длиной 6,35 мм. Действие его основано на активации супрахориоидального пути оттока ВГЖ. Имплантируется дренаж ab interno с помощью инжектора в сформированную щель УПК [20]. В исследованиях S. Lanchulev et al. данный дренаж имплантировали на 81 глазу в сочетании с ФЭК. Спустя полгода уровень ВГД снизился с 22,9 мм рт. ст. до 16 мм рт. ст. Из осложнений наблюдали мелкую переднюю камеру и транзиторную гифему. E.R. Carven et al. после имплантации микростента CyPass наблюдали такие осложнения, как окклюзия центральной вены сетчатки, обострение диабетического макулярного отека, персистирующее воспаление [21].
Дренаж из ядерной мембраны на основе лавсана (полиэтилентерефталата, полиэстера) – это отечественная разработка. Имплант имеет следующие показатели: толщина 10 мкм с диаметром пор 0,05-2,0 мкм [22]. С течением времени эффективность дренажа снижается, что связано с адсорбцией на его поверхности белков и элементов крови. Данную проблему авторы решили так – они преобразовали поверхность импланта, в результате чего она приобрела отрицательный заряд и стала шероховатой. Эксперименты и первые исследования показали весьма хорошие результаты, но нельзя забывать о возможном закрытии пор дренажа и связанным с этим снижением гипотензивного результата [22].
Stegman canal expander выпускается компанией Ophthalmos в Швейцарии и выполнен из полиамида. Дренаж вводится ab externo в ШК, имеет вид трубки с множественными отверстиями. Имплант устанавливается с наружной стороны глаза, поэтому за ним легко наблюдать в процессе установки. Экспандер поддерживает ШК в раскрытом состоянии и способствует свободному прохождению камерной влаги [23]. В исследованиях профессора Тетца опубликованы результаты 65 операций по установке экспандеров в основном пациентам с повышенным ВГД после трабекулэктомии. В группе из 10 человек отмечено снижение гипотензивного эффекта с 24,8 мм рт. ст. до 15 мм рт. ст., что является достаточно хорошим результатом у такой сложной категории пациентов [24].
Дренаж STAR flo (iSTAR Medical) в своем составе имеет силиконовый эластомер. Имеет следующие характеристики: ширина от 3 до 5 мм, длина – 8 мм, толщина – 0,275 мм. В основе действия лежит транспорт ВГЖ в супрахориоидальное пространство и под конъюнктиву [25]. В исследовании [25] среднее ВГД до операции составило 37,0 мм рт. ст., а через 12 месяцев – 14,3 мм рт. ст. Из ранних послеоперационных осложнений наблюдали хориоидальное кровоизлияние, гипотонию и макулопатию на фоне развившейся ЦХО.
Микрошунт Inn Focus состоит из полистирола, имеет вид трубки с длинной 8,5 мм и просветом 0,07 мм. Дистальный конец имплантируется ab externo одним концом в переднюю камеру, другим – в склеральный карман, который больше размера трубки не менее чем в 2 раза. Обследовали 14 пациентов, одним из них выполняли только дренажную операцию, а другим – в сочетании с удалением катаракты. Через 1, 2 и 3 года наблюдения квалифицированный показатель успеха (ВГД≤14 мм рт. ст. и снижение ВГД≥20%) составил 100%, 91% и 95% соответственно. Среднее ВГД с гипотензивными препаратами было снижено с 23,8±5,3 до 10,7±2,8; 11,9±3,7 и 10,7±3,5 мм рт. ст. соответственно. Наиболее частыми осложнениями являлись хориоидальный выпот и гипотония [26].
Дренаж iStent Supra (Glaukos Сorporation) Произведен из титана и полиэфирсульфона. Устанавливается ab interno, в основном, в сочетании с ФЭК. Процесс установки практически аналогичен CyPass [27].
Имплантат из сплава титана и никеля – нитинол. Предложил К.Б. Першин для увеличения и поддержания объема ШК. Дренаж представляет собой полую перфорированную трубку в виде незамкнутого кольца диаметром 11 мм, внутренний диаметр трубки составляет 150 мкм, внешний – 245мкм. При эксплуатации отметили некоторые трудности при введении дренажа, что связано с ригидностью нитинола, наличием септ внутри ШК. При дальнейшем наблюдении за имплантом не выявлено сквозных дефектов в трабекулярной сети и повреждений в десцеметовой мембране. Во всех наблюдениях дренаж находился в полости ШК, занимал правильное положение по всей протяженности канала [28].
Экспандеры шлеммова канала (ЭШК), предложенные Душиной Г.Н., изготовлены из тонкой нержавеющей ванадиевой стальной проволоки медицинского качества AISI 316L. Экспандер вводится безопасно, что обусловлено его кривизной, которая аналогична кривизне ШК. Экспандер держит форму, несмотря на давление со стороны стенок ШК, благодаря особому его строению: витки в головной и хвостовой частях прилежат друг к другу, в то время как в центральной части они отстают друг от друга на 0,1-0,2 мм. Численность витков – от 5 до 12. Существует несколько поколений экспандеров, длина которых составляет от 3 мм до 7 мм, а диаметр проволоки варьирует от 0,04 мм до 0,05 мм, внешний диаметр импланта – 0,2-0,3 мм [29]. Через 2 года наблюдений лучше всего себя зарекомендовал ЭШК-3, при котором полного успеха удалось достигнуть в 61,5% случаев, признанного успеха – в 30,8%, тогда как полная неудача была отмечена лишь у 7,7% пациентов [29].
Дренаж из сополимера лактида (L) и капролактона 70/30 188 кДа (диаметр волокна 5,7 мкм, размер пор 29 мкм) предложил М.Н. Коломейцев. Исследуемые материалы были изготовлены на базе НБИКС-центра НИЦ «Курчатовский институт». Материалы, из которых изготавливается дренаж, состоят из волокон диаметром 2-8 мкм, проходят вакуумную стерилизацию дозой 15 кГр. Перед оперативным вмешательством из фибриллярно структурированного материала изготовлялись дренажи, имеющие прямоугольную форму, размерами: длина – 3,0 мм, ширина – 2,0 мм, толщина– 0,2 мм [30]. В результате исследований выявлено, что данные дренажи создают благоприятные условия оттока ВГЖ, что обусловлено сохранением фибриллярной структуры импланта на протяжении не менее, чем полгода с момента вмешательства, и, который затем, замещается на пористую ткань. Разработанный дренаж улучшает результаты антиглаукомных операций, что верифицируется гипоэхогенностью интрасклеральной полости на фоне нормализации ВГД в течение по крайней мере года [30].
Заключение
Представленное многообразие дренажей свидетельствует о том, что до сих пор нет оптимального решения для лечения глаукомы. Несмотря на то что результаты операций с применением дренажной хирургии весьма обнадеживающие, однако нередко еще встречаются осложнения в виде обструкции дренажа, хориоидального кровоизлияния, гифемы, формирования гониосинехий, развития ЦХО, а в ряде случаев и недостаточного или непродолжительного гипотензивного эффекта. В связи с этим следует продолжать поиск более эффективных и безопасных микроинвазивных дренажей.
Источник


