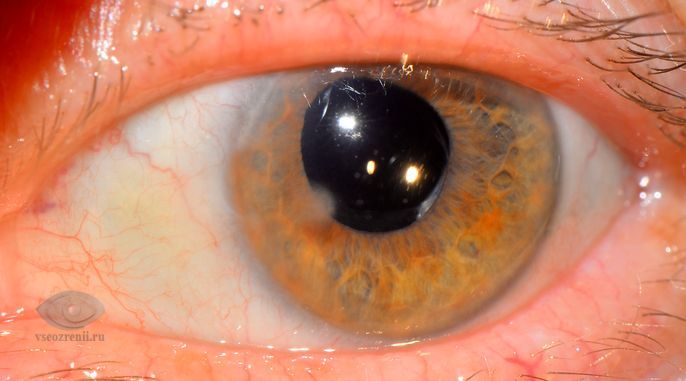
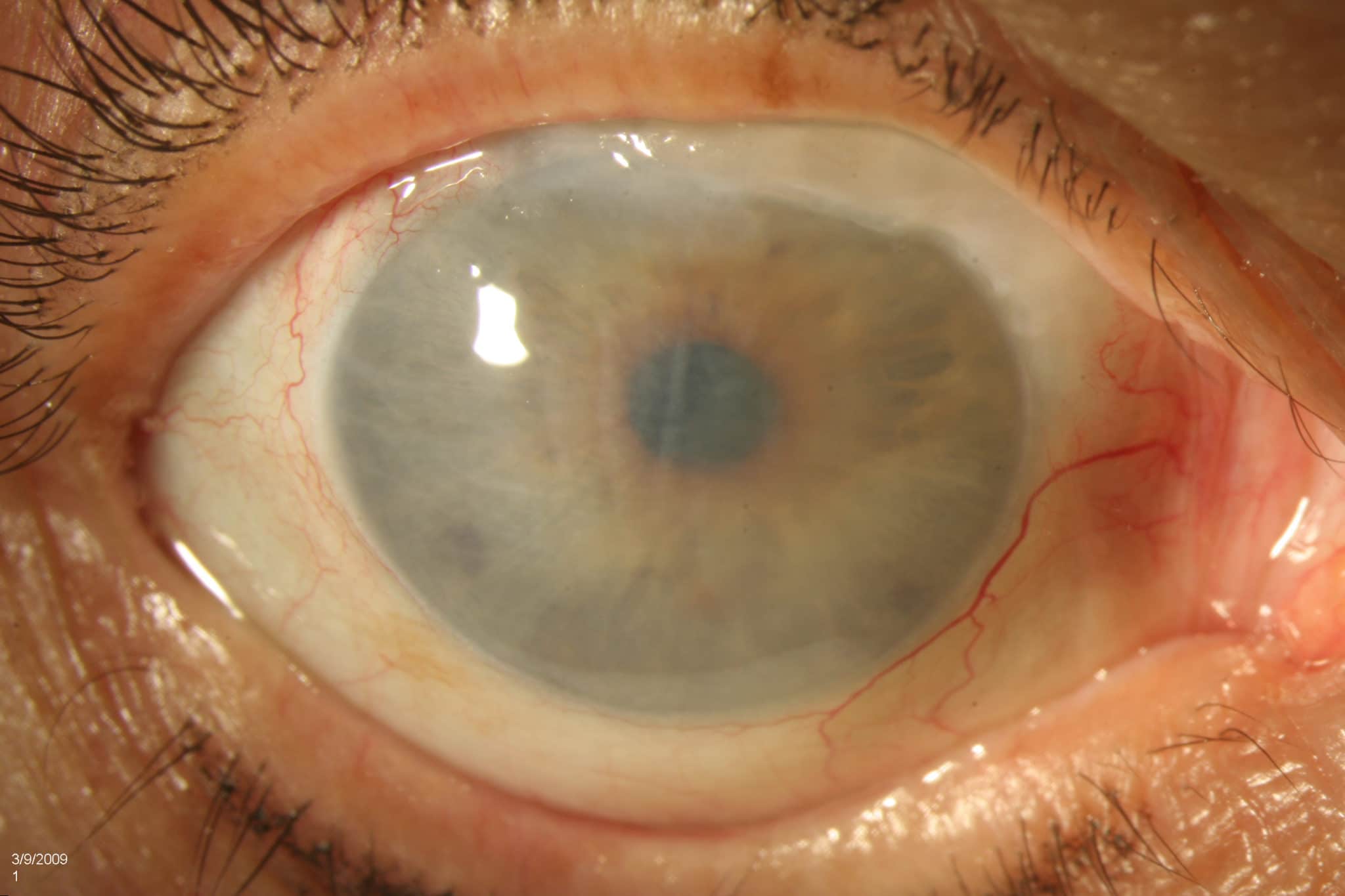
Консервированная или не консервированная роговица
Заболевания роговицы занимают одно из ведущих мест среди причин слабовидения и слепоты. При формировании перфораций или «расплавлении» роговицы различного генеза единственным эффективным методом вернуть прозрачность, а значит и зрение, в ряде случаев – сохранить глаз, как орган, является трансплантация роговицы. Так как применение нативной роговицы ограничено сроком жизни материала и ограниченной его доступностью, целесообразно применять запатентованные консервированные трансплантаты роговицы, особенно при необходимости неотложного хирургического вмешательства.
Проведен анализ 26 сквозных кератопластик, среди которых одну группу (22 глаза) составляли плановые операции, а вторую группу (4 глаза) – ургентные вмешательства. Срок наблюдения составил 24 месяца. Все пациенты обследовались по стандартной методике, дополнительно производился подсчет эндотелиальных клеток. Прозрачное приживление достигнуто на 18 глазах (81%) в первой группе пациентов и на 3 глазах (75%) во второй группе. Плотность эндотелиальных клеток составила 1500±200/мм2 (24 мес.).
Консервированная роговица является безопасным в отношении инфекций тканевым препаратом.
 Роговица выполняет защитную и опорную функции, что обеспечивается её прочностью, чувствительностью и способностью быстро восстанавливаться. Функции светопроведения и светопреломления обеспечиваются прозрачностью и сферичностью роговицы. Строма роговицы состоит из кератоцитов, которые активно синтезируют коллаген разных типов (I, V, VI) и кератансульфат. К моменту рождения число пролиферирующих кератоцитов падает практически до нуля, что знаменует их переход в G0фазу клеточного цикла[1]. В здоровой роговице запрограммированная клеточная смерть кератоцитов почти не наблюдается, однако сразу после повреждения наружнего её слоя (эпителия) наблюдается немедленный апоптоз кератоцитов, расположенных под зоной повреждения[2]. Кератоциты играют роль в патогенезе различных форм дистрофии роговицы. Так, при генетическом нарушении синтеза кератансульфата, выделяемого в толщу стромы, развивается пятнистая дистрофия роговицы[3]; кератоконус обусловлен избыточным апоптозом кератоцитов[4], а нарушение функции «заднего» эпителия приводит к дистрофии Фукса[5].
Роговица выполняет защитную и опорную функции, что обеспечивается её прочностью, чувствительностью и способностью быстро восстанавливаться. Функции светопроведения и светопреломления обеспечиваются прозрачностью и сферичностью роговицы. Строма роговицы состоит из кератоцитов, которые активно синтезируют коллаген разных типов (I, V, VI) и кератансульфат. К моменту рождения число пролиферирующих кератоцитов падает практически до нуля, что знаменует их переход в G0фазу клеточного цикла[1]. В здоровой роговице запрограммированная клеточная смерть кератоцитов почти не наблюдается, однако сразу после повреждения наружнего её слоя (эпителия) наблюдается немедленный апоптоз кератоцитов, расположенных под зоной повреждения[2]. Кератоциты играют роль в патогенезе различных форм дистрофии роговицы. Так, при генетическом нарушении синтеза кератансульфата, выделяемого в толщу стромы, развивается пятнистая дистрофия роговицы[3]; кератоконус обусловлен избыточным апоптозом кератоцитов[4], а нарушение функции «заднего» эпителия приводит к дистрофии Фукса[5].
Часто нарушение функции происходит в результате вторичной дистрофии роговицы, возникшей после хирургических вмешательств или травматических повреждений. Воспалительные процессы, приводящие к перфорации роговицы, нередко ведут к потере зрения[6].
По данным ВОЗ на сегодняшний день роговичная слепота занимает третье место среди причин слабовидения[7]. Около 8 млн человек в мире нуждаются в кератопластике, которая является основным и единственным методом лечения первичных дистрофий роговицы, а тем более, торпидных гнойных процессов.
В настоящее время, в качестве материала для трансплантации может быть использована только роговица человека. При сквозной кератопластике (СКП) трансплантат содержит все слои роговицы. Среди них имеется слой очень чувствительных клеток – это «задний» нейроглиальный эпителий роговицы («эндотелий»* роговицы). Известно, что плотность «эндотелиальных» клеток меняется на всем протяжении жизни, но с разной динамикой. При рождении плотность клеток составляет 3500–5000 кл./мм2.
 В первый год жизни плотность эндотелиальных клеток снижается преимущественно за счет роста роговицы, далее плотность клеток снижается за счет уменьшения их числа. Естественная потеря этих клеток в среднем составляет 0,6% (0,3–1,0%) в год до возраста 14 лет, после чего их потеря становится более интенсивной – 2,9% в год. К зрелому возрасту количество «эндотелиальных» клеток роговицы составляет 1400–2500 кл./мм2. Кроме возрастной потери, их количество снижается в результате травм, хирургических вмешательств, системных заболеваний (например, при сахарном диабете), поскольку при любом виде повреждения их регенерационный потенциал минимален[8].
В первый год жизни плотность эндотелиальных клеток снижается преимущественно за счет роста роговицы, далее плотность клеток снижается за счет уменьшения их числа. Естественная потеря этих клеток в среднем составляет 0,6% (0,3–1,0%) в год до возраста 14 лет, после чего их потеря становится более интенсивной – 2,9% в год. К зрелому возрасту количество «эндотелиальных» клеток роговицы составляет 1400–2500 кл./мм2. Кроме возрастной потери, их количество снижается в результате травм, хирургических вмешательств, системных заболеваний (например, при сахарном диабете), поскольку при любом виде повреждения их регенерационный потенциал минимален[8].
После сквозной кератопластики все структуры донорской роговицы постепенно замещаются тканями роговицы реципиента, кроме клеток «заднего» эпителия, которые продолжают жить, поддерживая жизнеспособность трансплантата. Этим объясняются высокие требования к качеству донорского материала для сквозной кератопластики и максимальная осторожность по отношению к задней поверхности роговицы при всех манипуляциях во время операции. Необходимо отметить, что роговица, в отличие от других структур, подлежащих трансплантации, не имеет сосудов и отделена от сосудистого тракта глаза внутриглазной жидкостью. Этим объясняется относительная иммунная обособленность роговицы, позволяющая успешно выполнять кератопластику без строгого подбора пары донор-реципиент.
 Использование нативной роговицы в качестве трансплантата ограничено сроком в 1 сут. после смерти донора. Поэтому большинство крупных офтальмологических клиник Европы, Азии и Америки пользуются услугами глазных банков. Функциями глазного банка являются забор, консервация и контроль за хранением донорского материала в соответствии с требованиями существующего законодательства. Донорский материал консервируется в специальных жидкостях, содержащих в своем составе антибиотики, буферные соединения и др. При консервировании в специальной среде снижаются иммунные свойства роговицы, стабилизируются клетки «эндотелия» роговицы. Плотность «эндотелиальных клеток» консервированной роговицы стандартно составляет не менее 2500/мм2, а срок хра- нения трансплантата – 14 сут.
Использование нативной роговицы в качестве трансплантата ограничено сроком в 1 сут. после смерти донора. Поэтому большинство крупных офтальмологических клиник Европы, Азии и Америки пользуются услугами глазных банков. Функциями глазного банка являются забор, консервация и контроль за хранением донорского материала в соответствии с требованиями существующего законодательства. Донорский материал консервируется в специальных жидкостях, содержащих в своем составе антибиотики, буферные соединения и др. При консервировании в специальной среде снижаются иммунные свойства роговицы, стабилизируются клетки «эндотелия» роговицы. Плотность «эндотелиальных клеток» консервированной роговицы стандартно составляет не менее 2500/мм2, а срок хра- нения трансплантата – 14 сут.
Материал и методы
В ГАУЗ «РКОБ МЗ РТ» за период 2012–2014 гг. произведено 26 сквозных кератопластик (СКП) с использованием консервированного в среде EUSOL-C трансплантата роговицы (ООО «Имрог», Москва). Выкраивание трансплантата производилось одноразовыми трепанами фирмы Baron диаметром от 6,5 до 9,0 мм. После обработки операционного поля раствором бетадина 5%, субтеноновой анестезии раствором лидокаина 2% и подшивания кольца Флиринга, одноразовым трепаном выкраивали сегмент роговицы диаметром на 0,5 мм меньше донорского сегмента. Трансплантат фиксировали 4 узловыми швами 8/0, затем ушивали непрерывным швом 10/0. Передняя камера восстановлена воздухом. В послеоперационном периоде использовались кортикостероиды мест- но, сроком до 1 года по убывающей схеме.
Одной группе пациентов выполнялась плановая СКП. В эту группу входило 22 человека (22 глаза) – 13 мужчин и 9 женщин в возрасте 27–84 лет. Нозологическая структура пациентов первой группы пред- ставлена в таблице 1.
У пяти пациентов основное заболевание было осложнено глаукомой – на 2 глазах внутриглазное давление компенсировано медикаментозно, на 3 глазах предварительно имплантирован клапан Аchmed. Также одномоментно с СКП в 3 случаях произведена экстракция катаракты по типу «открытое небо» с имплантацией интраокулярной линзы (ИОЛ) и на 2 глазах произведена замена переднекамерной ИОЛ на заднекамерную.
Послеоперационный период у пациентов этой группы протекал без особенностей, за исключением двух случаев, когда развилась картина увеита. Применением массивных доз глюкокортикостероидов явления воспаления были купированы.
Второй группе пациентов выполняли ургентную СКП. Эту группу составили 4 человека (4 глаза), все пациенты мужского пола в возрасте 23–64 года. Нозологическая структура пациентов представлена в таблице 2.

 Техника операции у двух пациентов отличалась несколько асимметричным высеканием трансплантата реципиента из-за локализации воспалительного процесса (рис. 4А, Б) и большим диаметром трансплантата. В послеоперационном периоде в двух случаях произошла ранняя кератомаляция, вследствие чего этим пациентам была произведена блефарорафия. Подсчет клеток «эндотелия» роговицы производился анализатором TomeyEM-3000. Технические возможности прибора позволяют осуществить захват «эндотелиальных» клеток роговицы глаза, анализ захваченного изображения и расчет клеточной плотности в автоматическом режиме. Измерения выполняются без непосредственного контакта с по- верхностью роговицы глаза пациента.
Техника операции у двух пациентов отличалась несколько асимметричным высеканием трансплантата реципиента из-за локализации воспалительного процесса (рис. 4А, Б) и большим диаметром трансплантата. В послеоперационном периоде в двух случаях произошла ранняя кератомаляция, вследствие чего этим пациентам была произведена блефарорафия. Подсчет клеток «эндотелия» роговицы производился анализатором TomeyEM-3000. Технические возможности прибора позволяют осуществить захват «эндотелиальных» клеток роговицы глаза, анализ захваченного изображения и расчет клеточной плотности в автоматическом режиме. Измерения выполняются без непосредственного контакта с по- верхностью роговицы глаза пациента.
Результаты
Анализ результатов лечения проводился по состоянию роговичного трансплантата (биологический результат) и остроте зрения (функциональный результат). Биологический результат кератопластики оценивали по состоянию пересаженного трансплантата: прозрачный, полупрозрачный и мутный. Функциональный исход операции зависит не только от степени прозрачности трансплантата, но и от со- хранности зрительно-нервного аппарата глаза.
В первой группе пациентов, которым была проведена плановая СКП, прозрачное (см. рис. 1) и полупрозрачное (см. рис. 2, 3) приживление наблюдалось на 18 глазах (81%). Максимальная острота зрения в этой группе составила от 0,04 до 0,4 (0,2±0,08) с коррекцией. Низкая острота зрения объясняется некорригируемым послеоперационным астигматизмом, а также глаукомой или изменениями в макуле, которые предшествовали трансплантации. Плотность «эндотелиальных» клеток после трансплантации составила 1500±200/мм2. ВГД на всех глазах, в т. ч. у пациентов с глаукомой компенсировано. Мутное приживление наблюдалось на 4 глазах (19%). Острота зрения у этих пациентов составляла от правильной светопроекции до движения руки у лица.

Во второй группе пациентов после ургентной СКП прозрачное и полупрозрачное приживление наблюдалось на 3 глазах (75%) (см. рис. 4Б, 5Б, 6Б), в том числе у одного из пациентов после ранней кератомаляции и блефарорафии. В этом случае через 6 мес. после блефарорафии наблюдали восстановление целостности роговицы. Максимальная острота зрения у этих пациентов не превышала 0,08±0,02 из-за асимметрично-расположенного лоскута и соответственно астигматизма высокой степени. На 1 глазу (25%) в течение всего срока наблюдения имеет место постоянная частичная блефарорафия из-за кератомаляции и развитию синдрома сухого глаза тяжелой степени.
Таким образом, консервированный трансплантат роговицы безопасен в отношении различных инфекций и имеет пригодную для сквозной кератопластики плотность «эндотелиальных» клеток.
Источник
Плотникова Ю.А.
Объективные сложности с наличием и/или забором свежих донорских роговиц для трансплантации, сложившиеся в последнее десятилетие в России, вынуждают офтальмохирургов прибегать к органосохранной хирургии консервированным материалом с заведомой потерей зрительных функций.
Цель. Оценить состояние органа зрения в отдалённом периоде после сквозной органосохранной пересадки роговичного трансплантата, консервированного высушиванием на силикагеле или длительной консервации в жидкой среде.
Материалы и методы. Произведено 27 операций с использованием консервированной роговицы, высушенной на силикагеле, и 13 – консервированной в жидкой среде. Во всех случаях показанием к вмешательству служила угроза потери глаза вследствие воспалительных процессов роговицы.
Сухую донорскую роговицу регидратировали за 2 часа до вмешательства. Консервированную в жидкой среде роговицу использовали сразу после вскрытия флакона с материалом. Выкраивали необходимый по диаметру и форме трансплантат непосредственно на операционном столе после оценки необходимого диаметра замещения дефекта.
Тотальная пересадка (диаметр – 10 мм) выполнена в 10 случаях, субтотальная (7-9 мм) – в 9 случаях. После предварительной отсепаровки конъюнктивы: с лимбом (11-12 мм) – 5 глаз, с ободком склеры – (13мм и более) – 4 глаза. Пересадка малого диаметра (4-6 мм) произведена 12 больным, из них 7 – грибовидной формы. Обязательно соблюдалось условие абсолютно полного иссечения поражённой ткани роговицы. Трансплантат адаптировали непрерывными или узловыми швами, в зависимости от диаметра и заинтересованности склеры.
Результаты и обсуждение. Основным критерием оценки в раннем периоде являлось стихание воспалительных явлений переднего отрезка глаза, сохранение герметичности раны и, как следствие, состояние камер глаза и внутриглазного давления. У 36 больных наблюдали ярко выраженный санирующий эффект вмешательства – значительное уменьшение инъекции, уменьшение субъективных признаков роговичного синдрома уже на 2 сутки после операции.
Герметизация раны и глубина передней камеры были адекватны во всех случаях. Нормотонию наблюдали у 32 больных, лёгкую гипотонию – у 3, внутриглазную гипертензию у 5 пациентов.
Из особенностей раннего послеоперационного периода нами отмечено следующее:
– активная эпителизация периферической зоны тотального и субтотального трансплантата в первые дни после операции;
– достаточно высокая прозрачность регидратированного трансплантата, позволяющая без труда визуализировать детали передней камеры и хрусталик, при этом у всех больных присутствовало предметное зрение с остротой от 0,02 до 0,1;
– наличие отёка роговичного трансплантата у всех больных после пересадки материала, консервированного в жидкой среде.
Ни в одном случае не наблюдали расплавления трансплантата. Отдалённые сроки наблюдения составили от 1 года до 14 лет. Критериями оценки являются, прежде всего, сохранность органа, состояние самого трансплантата, внутренних сред глаза и уровень ВГД.
Органосохранный эффект в указанном периоде наблюдения составил 100 %. В 4 случаях через 1,5 и 2 мес. после операции наблюдали локальное провисание непрерывного шва с формированием ступеньки между трансплантатом и краем раны, что потребовало наложения дополнительных узловых швов.
Практически у всех пациентов наблюдали замедление поверхностной эпителизации трансплантата с длительно существующими центральными эрозиями или патологической эпителизацией центральной или парацентральной зоны роговицы. Прозрачность трансплантата прогрессивно снижалась, начиная с 4-ой недели после вмешательства за счёт отёка стромы, а с 8 недели за счёт её помутнения. У 16 пациентов первоначально начала формироваться глубокая васкуляризация (по задней поверхности трансплантата), при этом строма и поверхностные слои достаточно долго оставались полупрозрачными и аваскулярными. У 14 больных с первых недель после вмешательства преобладала поверхностная васкуляризация трансплантата с более быстрым и интенсивным помутнением стромы и полной эпителизацией центральных участков роговицы.
Предметного зрения в отдалённом периоде у больных не наблюдали. У 4-х больных через 2 – 4 мес. после вмешательства развилась внутриглазная гипертензия с умеренной эктазией мутного трансплантата. У одного из пациентов с гипотонией в раннем послеоперационном периоде ВГД нормализовалось к концу второй недели после вмешательства, у второго – сохранялась весь последующий период наблюдения. В остальных случаях внутриглазное давление оставалось нормальным.
Выводы
1. Пересадка роговицы, консервированной высушиванием на силикагеле или в жидкой среде, позволяет сохранить глазное яблоко при угрожающих состояниях со стороны роговой оболочки.
2. Судьба сквозного трансплантата роговицы, консервированной высушиванием на силикагеле или в жидкой среде, заключается в формировании васкуляризированного бельма.
3. В большинстве случаев подобное вмешательство позволяет сохранить нормальные взаимоотношения внутренних структур глазного яблока и нормальный уровень ВГД, что не исключает шансов на последующую оптико-реконструктивную хирургию.
Источник