Конфокальная микроскопия роговицы показания
Описание

Конфокальная микроскопия — один из современных методов исследования; позволяет проводить прижизненный мониторинг состояния роговицы с визуализацией тканей на клеточном и микроструктурном уровне.
Данный метод в силу оригинальной конструкции микроскопа и его большой разрешающей способности позволяет визуализировать живые ткани роговицы, измерить толщину каждого из её слоён, а также оценить степень морфологических нарушений.
Охарактеризовать морфологические изменения роговицы, возникающие при различных воспалительных и дистрофических её заболеваниях, а также вследствие хирургических вмешательств и воздействия КЛ.
Данные морфологического исследования необходимы, чтобы оценить тяжесть патологического процесса, эффективность лечения и определить тактику ведения больного.
• Воспалительные заболевания роговицы (кератиты).
• Дистрофические заболевания роговицы (кератоконус, дистрофия Фукса и др.).
• Синдром «сухого глаза».
• Состояния после хирургических вмешательств на роговице(сквозной пересадки роговицы, кераторефракционных операций).
• Состояния, связанные с ношением КЛ.
Относительное противопоказание выраженное раздражение глаза на фоне острого воспалительного процесса.
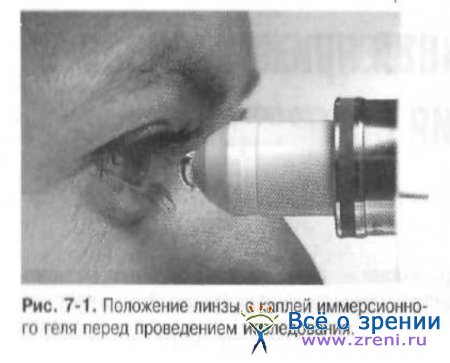
Проведение данного исследования возможно без применения анестетиков. На объектив линзы конфокального микроскопа помещают каплю иммерсионной жидкости. Это исключает непосредственный контакт линзы с роговицей и сводит к минимуму риск повреждения эпителия.
Исследование выполняют на конфокальном микроскопе ConfoScan 4 (Nider) с увеличением в 500 раз. Прибор позволяет осмотреть роговицу по всей её толщине.
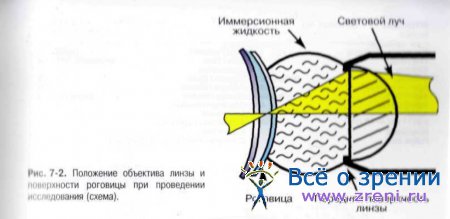
Размер исследуемой зоны составляет 440×330 мкм, толщина слоя сканирования — 5 мкм. Линзу с каплей геля подводят к роговице до касания и устанавливают так. чтобы толщина слоя иммерсионной жидкости составляла 2 мм. Конструкция прибора позволяет исследовать роговицу в центральной зоне и её парацентральных участках (рис. 7-1; рис. 7-2.).
Передний эпителий состоит из 5-6 слоев клеток. Средняя толщина всего эпителия — приблизительно 50 мкм. По морфологической структуре выделяют следующие слои (изнутри кнаружи): банальный, шиловидных клеток и поверхностный.
• Самый внутренний (базальный) слой представлен маленькими плотными цилиндрическими клетками без видимого ядра. Границы базальных клеток чёткие, яркие (рис. 7-3).

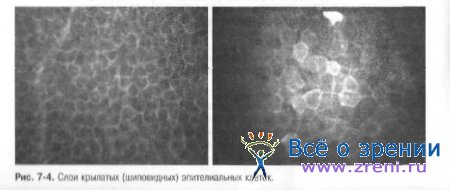
• Средний слой состоит из 2-3 пластов шиповидных (крылатых) клеток с глубокими инвагинациями, в которые встраиваются выросты соседних клеток. Микроскопически границы клеток довольно хорошо различимы, а ядра могут не определяться или быть нечёткими (рис. 7-4).
• Поверхностный слой эпителия представлен одним или двумя пластами полигональных клеток с чёткими границами и гомогенной плотностью. Ядра обычно ярче, чем цитоплазма, в которой также можно различить околоядерное тёмное кольцо (рис. 7-5).
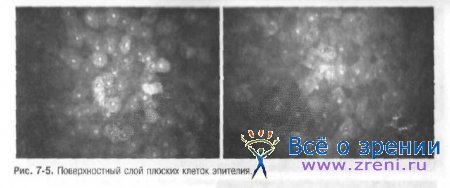
Среди клеток поверхностного слоя различают тёмные и светлые. Повышенная отражательная способность эпителиальных клеток свидетельствует о снижении в них уровня метаболизма и начинающейся их десквамации.
Боуменова мембрана прозрачная структура, не отражающая свет, поэтому в норме при конфокальной микроскопии её визуализация невозможна.
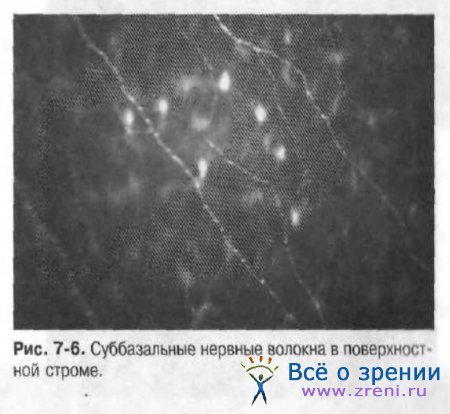
Суббазальное нервное сплетение находится под боуменовой мембраной. В норме нервные волокна выглядят как параллельно идущие на тёмном фоне яркие полосы, контактирующие между собой. Рефлективность (отражательная способность) может быть неравномерной по протяжению волокна (рис. 7-6).
Строма роговицы занимает от 80 до 90% толщины роговицы и состоит из клеточного и внеклеточного компонента. Основные клеточные элементы стромы— кератоциты; составляют примерно 5% объёма.
Типичная микроскопическая картина стромы включает несколько ярких неправильной овальной формы тел (ядер кератоцитов), которые лежат в толще прозрачного тёмно-серого или чёрного матрикса. В норме визуализация внеклеточных структур невозможна из-за их прозрачности. Строма может быть условно разделена на субслои: передний (расположен непосредственно под боуменовой мембраной и составляет 10% толщины стромы), переднесредний, средний и задний.
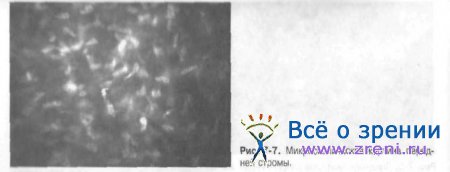
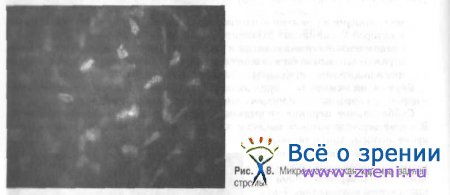
Средняя плотность кератоцитов выше в передней строме, постепенно их количество уменьшается по направлению к задним слоям. Плотность клеток передней стромы почти в два раза больше, чем клеток задней стромы (если плотность клеток передней стромы принять за 100%, то плотность клеток задней составит около 53,7%). В передней строме ядра кератоцитов имеют округлую бобовидную форму, а в задней овальную и более вытянутую (рис. 7-7.7-8).
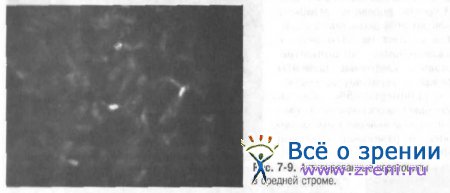
Ядра кератоцитов могут различаться по яркости. Различная способность отражать свет зависит от их метаболического состояния. Более яркие клетки принято считать активированными кератоцитами («стрессовыми» клетками), деятельность которых направлена на поддержание внутреннего гомеостаза роговицы. В норме и поле зрения встречаются единичные активированные клетки (рис. 7-9).
Нервные волокна в передней строме роговицы визуализируются в виде ярких гомогенных полос, нередко образующих бифуркации (рис. 7-10).

Десцеметова мембрана в норме прозрачна и не визуализируется при конфокальной микроскопии.
Задний эпителий представляет собой монослой гексагональных или полигональных плоских клеток с равномерно светлой поверхностью на фоне чётких тёмных межклеточных границ (рис. 7-11).

В приборе заложена возможность мануального или автоматического подсчёта плотности клеток, их площади и коэффициента вариабельности.
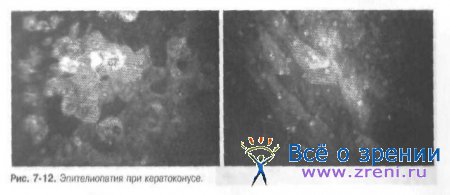
Кератоконус характеризуется значительными изменениями в переднем эпителии и строме роговицы.
Передний эпителий. Обнаруживают различные варианты эпителиопатии (рис. 7-12):
—
Статья из книги: Офтальмология. Национальное руководство | Аветисов С.Э.
Источник
Семенов А.Д., Мушкова И.А., Майчук Н.В., Кишкин Ю.И.
1НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава РФ
Передняя дозированная радиальная кератотомия (ПДРК) – метод хирургической коррекции миопии, разработанный в МНТК «Микрохирургия глаза» в 80-х годах XX века, стал революционной технологией и более десяти лет господствовал во многих странах. Более 200 тысяч человек были успешно прооперированы в России и в мире [2,4]. Однако ремоделирование роговицы в процессе послеоперационного рубцевания, регресс рефракционного эффекта различного генеза, технологические погрешности (слишком поверхностные насечки или сквозное прорезывание роговицы) и индивидуальные особенности коллагенообразования привели к актуализации проблемы докоррекции индуцированной аметропии после ПДРК [5,6,7]. Операцией выбора многими рефракционными хирургами признается лазерный интрастромальный кератомилез (ЛАЗИК). Зачастую выполнение ЛАЗИК для коррекции индуцированной аметропии после ПДРК сопровождается расхождением насечек при попытке поднять роговичный клапан и, как следствие, нарушением адаптации клапана, иррегулярным астигматизмом и врастанием эпителия под клапан через насечки в послеоперационном периоде. Второй серьезной проблемой является ограниченная информативность компьютерной кератотопографии роговицы у пациентов после ПДРК, не позволяющая выявить признаки дегенеративных заболеваний, таких как кератоконус, кератоглобус и др., что является крайне важным для прогнозирования развития послеоперационной кератэктазии на фоне снижения биомеханической резистентности роговицы после ЛАЗИК [8].
Единственным методом прижизненной визуализации гистоморфологии роговицы является конфокальная микроскопия, позволяющая проводить исследования биологических тканей на клеточном уровне в состоянии функциональной активности [1,3].
Цель
Целью данной работы было изучение гистоморфологии роговицы у пациентов после ПДРК с помощью конфокальной микроскопии, а также разработка показаний и противопоказаний к докоррекции индуцированной аметропии после ПДРК методом ЛАЗИК.
Материал и методы
Для изучения гистоморфологии роговицы пациентов in vivo применяли конфокальный микроскоп Confoscan 4 (Nidek, Japan) со следующими параметрами: линза для исследования через иммерсионный гель – 40х, NA 0,75, WD 1,98 мм, Zeiss; исследуемая зона роговицы- 460 х 345 ?m, получаемое изображение — 768 х 576 pixel, латеральное разрешение — 0,6 ?m/pixel, скорость сканирования – 25 снимков в секунду. При исследовании использовали автоматический режим сканирования всей толщины роговицы, мануальный режим для визуализации определенных корнеальных структур, функцию автоматического подсчета плотности эндотелиальных клеток с оценкой полиморфизма и размера клеток, а также функцию оптической пахиметрии (с помощью Z-ring).
Обследовано 38 пациентов (66 глаз) с индуцированной аметропией через 10-28 лет после ПДРК, в возрасте от 36 до 63 лет (средний возраст 44,2±6,8 лет), контролем являлись 34 пациента (62 глаза) с интактной роговицей, в возрасте от 29 до 48 лет (средний возраст 38,4±4,2 года). Критерием включения пациентов в исследование был I тип рубцевания после ПДРК при биомикроскопическом исследовании (тонкие, линейные рубцы без признаков расхождения, зажиты первичным натяжением).
Результаты и обсуждение
Степень сферического компонента рефракции варьировала в широких пределах от -3,5 до + 6,5 диоптрий, астигматического: от – 1,0 и до + 4,5 диоптрий. При проведении конфокальной микроскопии у пациентов после ПДРК в центральной зоне структура роговицы не имела специфических отличий от роговицы неоперированных глаз группы контроля. В проекции кератотомических насечек практически на всех обследованных глазах выявлены признаки очаговой псевдокератинизации эпителия, свидетельствующей о замедленном слущивании поверхностных эпителиальных клеток.
Несмотря на биомикроскопически отмеченный I тип рубцевания, при исследовании стромы роговицы в области насечек, КМ выявила 2 принципиально различных по биомеханическим свойствам вида заживления: в первом случае насечка представляет собой линейный рубец с плотной фиброзной тканью, во втором – единичные элементы фиброзной ткани по периферии насечки, в центре — эпителиальные вакуоли, содержащие оптически негативную субстанцию, возможно – интерстициальную жидкость.
На четырех глазах двух пациентов после ПДРК выявлены морфологические признаки первичного кератоконуса: «складчатость» в супраэндотелиальных слоях стромы и дистрофические изменения десцеметовой мембраны. При этом данные компьютерной кератотопографии и пахиметрии не позволяли заподозрить наличие кератоконуса.
На одном глазу выявлены признаки дистрофии роговицы, затрагивающие боуменову мембрану и базальный слой эпителия.
Данным пациентам были предложены нехирургические методы коррекции аметропии.
Всем остальным пациентам (35 человек, 61 глаз) была выполнена коррекция аметропии методом ЛАЗИК на эксимерлазерной установке «Микроскан-ЦПФ» (Россия). Клапан формировался с помощью микрокератома «Zyoptix», Bausch&Lomb (USA) с головкой 120 и расчетной толщиной клапана 100±20 мкм. У 27 пациентов с плотными рубцами клапан был сформирован без дефектов, и на протяжении всего периода послеоперационных наблюдений (12 месяцев), иррегулярного астигматизма и врастания эпителия не было. У 8 пациентов с малофиброзированными рубцами произошло частичное расхождение насечек, формирование иррегулярного астигматизма различной степени (6 глаз) и врастание эпителия под клапан через насечки (3 глаза). В одном случае потребовалось повторное вмешательство для удаления новообразованного эпителия.
Заключение
Морфологическими показаниями для коррекции индуцированной аметропии после ПДРК методом ЛАЗИК, являются: биомикроскопически I тип рубцевания, при конфокальной микроскопии — линейные, несквозные кератотомические насечки, состоящие из плотной фиброзной ткани, без признаков расхождения и вакуолей, а также отсутствие конфокальных признаков дегенеративных заболеваний роговицы.
Противопоказаниями — малофиброзированные корнеальные насечки с эпителиальными полостями, сквозные насечки с расхождением краев, признаки дегенеративных заболеваний роговицы, выявляемые с помощью конфокальной микроскопии.
Таким образом, конфокальная микроскопия роговицы позволяет оптимизировать отбор пациентов для кераторефракционной хирургии, что способствует снижению риска послеоперационных осложнений и повышению качества реабилитации пациентов.
Литература
1. Алио Х.Л., Хавалой Х., Негри Э.П. и соавт. Качество интерфейса роговичного лоскута после ЛАСИК. Исследование с помощью конфокального микроскопа // Офтальмология.- 2004.- том 1, № 3.-С.12-24
2. Ивашина А.И. Современные проблемы рефракционной офтальмохирургии / В сб. научн. статей 7 съезда офтальмологов, ч.: М. 2000.- С. 250.
3. Качалина Г.Ф., Майчук Н.В., Кишкин Ю.И., Майчук Д.Ю Использование конфокальной микроскопии – метода прижизненной визуализации ультраструктуры роговицы в кераторефракционной хирургии / В сб. научн. статей VII Международной научно-практической конференции «Современные технологии катарактальной и рефракционной хирургии – 2006»: М., 2006.- С. 82-89.
4. Коршунова Н.К., Мушкова И.А., Михальченко Н.Н, Тингаев В.В. 30–летний опыт радиальной кератотомии/ В сб. научных статей 7 съезда офтальмологов, ч.1: М. 2000.- С. 256.
5. Burnstein Y., Hersh P.S. Photorefractive keratectomy following radial keratotomy // Journal of Refractive Surgery.- 1996.- №1.- P.163–170.
6. Buratto L., Brint S. LASIK Surgical Techniques and Compilations // Hard Cover. – 2000. – 624 p.
7. Gimbel H.V., Sun R., Chin P.K., van–Westenbrugge J. Excimer laser photorefractive keratectomy for residual myopia after radial keratotomy // Canadian Journal of Ophthalmolology.- 1997.- №1.- P. 25–30.
8. Kachalina G.F., Maychuk N.V. Confocal Microscopy of the cornea and biochemical analysis of tears in the investigation of the keratectasia pathogenesis after photorefractive surgery/ Abstracts of XXV Congress of ESCRS: Stockholm – 2007.-P. 91-92.
Источник
S.Ae. Avetisov, G.B. Egorova
GU NII of Eye Diseases RAMN, Moscow
Purpose: to study possibilities and information value of confocal microscopy in normal subjects and in patients with some pathologic conditions of cornea.
Materials and methods: Confocal microscopy was performed in 40 subjects (75 eyes) : 6 participants were healthy volunteers with mild myopia, 24 – had keratoconus of I – IV stages,4 patients were after penetrating corneal transplantation, 4– after refractive corneal surgery , 1– after herpetic keratitis, 1– with Fuchs dystrophy. Confocal microscopy was made with «Confoscan – 4,» Nidek (magnification х 500).
Results and conclusion: Confocal microscopy is highly informative non–invasive method, which allows detecting subtle changes on cellular and micro structural levels, studing in details pathogenic mechanisms in various diseases and surgery.
Для успешного решения задач оптической и хирургической коррекции различных рефракционных нарушений большое значение имеет адекватная оценка функционального и морфологического состояния роговой оболочки. Изучение структурных изменений при различных заболеваниях роговицы необходимо также для оценки тяжести патологического процесса, эффективности лечения и определения тактики ведения больного.
В связи с этим целесообразность разработки неинвазивных методов исследования, позволяющих оценить степень морфологических изменений в роговице, является неоспоримой.
В течение последнего десятилетия все большее распространение получают офтальмологические методы диагностики, позволяющие получать информацию с визуализацией результатов исследования. Ультразвуковые методы, компьютерная видеокератография позволили значительно расширить и углубить знания и понятия о различных аспектах болезней роговицы и хирургических процедур.
Одним из наиболее современных методов исследования роговицы является прижизненная конфокальная микроскопия. Данный метод в силу оригинальной конструкции микроскопа и его большой разрешающей способности позволяет визуализировать живые ткани роговицы на клеточном уровне, измерить толщину каждого из ее слоев, оценить количество, форму, размер клеток эпителия, стромы, заднего эпителия роговицы, степень десквамации эпителиальных клеток при воздействии контактных линз и хирургических вмешательств [1 –7].
Цель данного исследования – изучение возможностей и информативности конфокальной микроскопии в норме и при некоторых патологических состояниях роговой оболочки глаза.
Материал и методы исследования
Конфокальная микроскопия роговицы была проведена у 40 пациентов (75 глаз): 6 пациентов (12 глаз) были здоровыми добровольцами или имели миопию слабой степени, 24 (48 глаз) –с кератоконусом 1–4 стадий, 4 пациента (4 глаза) –после сквозной пересадки роговицы, 4 (8 глаз) –после рефракционных операций на роговице, 1пациент (1 глаз) –после перенесенного герпетического кератита, 1 пациент (2 глаза ) –с дистрофией Фукса.
Исследование проводили с помощью конфокального микроскопа «Confoscan – 4», Nidek (увеличение х 500).
Данный прибор позволяет исследовать роговицу по всей ее толщине, размер исследуемой зоны составляет 440 х 330 мкм. Толщина слоя сканирования составляет 5 мкм. Исследование проводится с использованием иммерсионной жидкости, которая находится между роговицей и объективом линзы, в результате чего исключается непосредственный контакт линзы и роговицы и сводится к минимуму риск повреждения эпителия. Проведение данного исследования возможно без применения анестетиков. В качестве иммерсионной жидкости используется гель («Видисик»). Линза с каплей геля подводится к роговице до касания, толщина слоя иммерсионной жидкости должна быть равна 2 мм. Конструкция прибора позволяет исследовать роговицу в центральной зоне и ее парацентральных участках (рис.1, 2).
Результаты проведенных исследований
При обследовании здоровых добровольцев и пациентов с миопией слабой степени получены данные, характеризующие нормальную картину всех слоев роговой оболочки глаза.
Роговичный эпителий состоит из 5–6 слоев и трех разных видов клеток:
1– плоские поверхностные (2–3 слоя);
2 – шиповидные (крылатые) (2–3) слоя;
3 –цилиндрические базальные (1 слой).
Цилиндрические базальные клетки обладают митотической активностью. Средняя толщина всего эпителия приблизительно 50 мкм. С помощью конфокальной микроскопии можно определить особенности различных клеток.
Поверхностный слой эпителия представлен полигональными клетками, обычно с четким ядром, четкими границами и гомогенной плотностью. Ядра обычно ярче, чем окружающая их цитоплазма, также можно различить перинуклеарное темное кольцо (рис. 3).
Базальные клетки – маленькие полигональные, более плотные без четкого ядра и с очень четкими яркими границами (рис.4). Крылатые клетки обладают переходными характеристиками, ядра могут быть нечеткими или могут не определяться.
Боуменова и десцеметова мембраны в норме не визуализируются, т.к. прозрачны и не отражают свет.
Конфокальная микроскопия дает возможность визуализировать волокна нервных сплетений роговицы. Субэпителиальное нервное сплетение находится под боуменовой мембраной. Его нервные волокна, перфорируя боуменову мембрану на уровне базального эпителия, формируют суббазальное нервное сплетение, волокна которого идут поверхностно, обеспечивая иннервацию базального эпителиального слоя, и заканчиваются в области поверхностных эпителиальных слоев.
В качестве критериев оценки нервных волокон используют такие показатели, как плотность, ширина, извилистость, рефлективность, ориентация, ветвление. В норме можно увидеть длинные, параллельно идущие тяжи или пучки нервов [2,7]. Часто нервные волокна яркие, хорошо контрастирующие на фоне непрозрачного темного фона (рис. 5).
Строма роговицы занимает от 80 до 90% толщины роговицы и состоит из 3 основных компонентов: клеточного, бесклеточного и нейросенсорного.
Клеточный компонет в основном состоит из кератоцитов и составляет примерно 5% всего вещества. Бесклеточный –от 90 до 95 % стромы, включает правильные (регулярные) коллагеновые пластинчатые структуры и интерстициальную ткань. Нейросенсорный компонент представлен стромальным глубоким нервным сплетением.
Типичная конфокальная микроскопическая картина стромы включает несколько ярких неправильной овальной формы тел, которые являются ядрами кератоцитов и лежат в толще прозрачного (темно–серого или черного) бесклеточного матрикса. При отсутствии патологических изменений стромы визуализация внеклеточных структур невозможна из–за их прозрачности. Строма может быть условно разделена на субслои: передний (непосредственно под боуменовой мембраной), передне–средний, средний и задний. Средняя плотность кератоцитов выше в передней строме (10% толщины), их количество уменьшается по направлению к задним слоям. Плотность клеток прогрессивно уменьшается от передней (100%) к задней строме (53,7%).
В передней строме ядра кератоцитов имеют округлую бобовидную форму, в задней строме – овальную (рис. 6,7).
В ряде случаев кератоциты имеют различную яркость. Различие в рефлективности зависит от их метаболического возбуждения, поэтому их называют активированными кератоцитами (рис. 8). Их можно обнаружить и в здоровых роговицах – это «стрессовые» клетки, их деятельность направлена на поддержание внутреннего гомеостаза роговицы и они являются типичными для воспалительных и рубцовых процессов (например, при заживлении после эксимер–лазерных операций) [2].
В строме (особенно в передне–средней и средней) возможна визуализация нервных волокон из глубокого роговичного сплетения. Эти волокна визуализируются в виде тонких, ярких рефлектирующих полос, ориентированных либо вертикально, либо по косой параллельно друг другу, часто видна бифуркация в виде буквы Y (рис. 9).
Задний эпителий роговицы выглядит как яркий одноклеточный слой из гексогональных или полигональных плоских клеток. Ядра не определяются, а тело клетки гомогенно яркое, светлое. Края клеток визуализируются, как тонкие серые линии. Чем выше плотность клеток, тем меньше их размер. Возможен мануальный или автоматический подсчет количества клеток, расчет их плотности, площади, коэффициента вариабельности (рис. 10).
При кератоконусе морфологические изменения достаточно многообразны, особенно в области роговицы, вовлеченной в эктатический процесс.
В эпителиальном слое могут определяться различные варианты эпителиопатии. Поверхностные клетки становятся деформированными и вытянутыми в косом направлении, клеточные границы нечеткие. Участки с большей отражательной способностью свидетельствуют о нарушении прозрачности (рис. 11).
Цвет клеток характеризует состояние их жизнедеятельности. Светлые клетки – с более сглаженной поверхностью и большей отражательной способностью, что является следствием их атрофии. Большое количество светлых клеток свидетельствует об их повышенной десквамации (рис. 12).
Неравномерный рефлекс с боуменовой мембраны косвенно свидетельствует о нарушении ее структуры и прозрачности.
В базальном эпителии обнаруживается деформация и неправильность формы клеток и иногда возможно определить небольшие зоны, в которых базальный эпителий отсутствует (рис. 13).
Субэпителиальное нервное сплетение в общем хорошо визуализируется и может иметь нормальную морфологию (рис. 14).
Строма роговицы при кератоконусе всегда вовлечена в патологический процесс: повышенная отражательная способность передних отделов стромы и стрии Вогта в задних отделах стромы являются типичными находками. Основные изменения стромы представлены микростриями, которые выглядят, как разнородные тонкие линии со сниженной отражательной способностью (гипорефлекторные), контрастирующие с более светлой стромой и располагаются внеклеточно.
Эти проявления являются следствием дегенеративных процессов и могут быть микроскладками (как и стрии Вогта) или микротрещинами экстрацеллюлярного матрикса. Микрострии обнаруживаются во всех слоях роговичной стромы. Количество кератоцитов уменьшено, видны их значительные дегенеративные изменения (рис. 15).
Изменения в строме могут быть многообразными. В частности, примером может служить изменение формы и ориентации кератоцитов в средней строме при кератоконусе 3 стадии. Отмечаются наличие большого количества кератоцитов с повышенной отражательной способностью, выраженная тенденция к помутнению (рис. 16).
Необходимо отметить, что чем больше выражены клинические признаки кератоконуса и тяжелее патологический процесс, тем большие изменения выявляются при конфокальной микроскопии.
С помощью данного метода можно исследовать состояние трансплантата после операции сквозной пересадки роговицы. Изменения могут быть разнообразными и выраженными в различной степени. На рисунке 17 представлена картина передней стромы роговичного трансплантата: визуализируются кератоциты с нечеткими размытыми границами, выявляются участки стромы с пониженной прозрачностью, что может быть следствием дистрофического процесса с элементами отека. В различных слоях трансплантата могут определяться стромальные складки (рис.18).
На рисунке 19 представлен пример морфологической картины после операции кератомилеза. Можно отметить снижение прозрачности стромы роговицы, нарушение архитектоники волокнистых структур, очень малое количество кератоцитов, нечетко контурируемых. Яркие рефлектирующие точки являются включениями металлической пыли, которые образовались, по–видимому, в результате использования режущего инструмента низкого качества. При биомикроскопии в этом случае можно видеть световые блики. Кроме этого, можно выявить участки помутнения в области боуменовой мембраны, отек нервных волокон и другие изменения (рис. 20).
Герпетические поражения роговицы приводят к грубым структурным изменениям. На рисунке 21 представлены изменения роговицы после перенесенного герпетического кератита (при биомикроскопии выявляется облачковидное помутнение в эпителии и субэпителиальных слоях). Морфологические изменения характеризуются отсутствием различимых межклеточных границ, большим количеством рефлексирующих зон, что свидетельствует о появлении новых характеристик эпителиальной ткани, связанных с явлением кератинизации. Возможно, причиной является нейротрофический процесс, вызывающий понижение структурной и функциональной организации эпителия.
На рисунке 22 представлены изменения, характерные для тяжелого поражения эндотелия с формированием поверхности по типу шагреневой кожи при дистрофии Фукса.
Таким образом, можно утверждать, что конфокальная микроскопия является высокоинформативным неинвазивным методом исследования, позволяющим выявить тонкие изменения роговицы на клеточном и микроструктурном уровне, более полно изучить патогенетические механизмы при различных заболеваниях или хирургических вмешательствах.
Метод дает возможность детального изучения и визуализации всех роговичных структур. Дальнейшие исследования должны быть направлены на накопление материала и стандартизацию микроскопической картины роговицы в различных клинических ситуациях.
Источник


