Искусственная сетчатка глаза история
В 2018 году 39 миллионов человек остаются слепыми. Из-за наследственных заболеваний, старения тканей, инфекций или травм. Одна из главных причин — это болезни сетчатки. Но наука развивается так быстро, что фантастика переходит из книг в лаборатории и операционные, снимая барьер за барьером. Ниже мы рассмотрим, какое будущее ждет офтальмологию, как будут лечить (и уже лечат), возвращать зрение, диагностировать недуги и восстанавливать глаза после операций.
Киборгизация: бионические глаза
Главный тренд офтальмологии будущего — бионические глаза. В 2018 году уже существуют 4 успешных проекта, и искусственные глаза сейчас — далеко не картинка из футуристического фэнтези.
Самый интересный проект — это Argus II от Second Sight. Устройство состоит из импланта, очков, камеры, кабеля и видеопроцессора. Имплант, имеющий передатчик, вживляется в сетчатку. Носимая с очками камера фиксирует изображения, которые процессор обрабатывает, генерируя сигнал, передатчик импланта принимает его и стимулирует клетки сетчатки. Так реконструируется зрение. Разработка изначально предназначалась для больных макулодистрофией. Это возрастное заболевание, оно сопровождается слабым кровоснабжением центра сетчатки и приводит к слепоте.
В чем недостаток технологии? Устройство стоит баснословные 150 тысяч долларов и не возвращает зрение полностью, лишь позволяя различать силуэты фигур. По состоянию на 2017 год 250 человек носят Argus II, что, безусловно, ничтожно мало.
У Argus II есть аналоги. Например, Boston Retinal Implant. Он тоже создан специально для пациентов с макулодистрофией и пигментным ретинитом (разложением фоторецепторов сетчатки). Он работает по похожему принципу, направляя сигналы нервным клеткам и создавая схематичное изображение объекта. Стоит назвать и IRIS, созданный для пациентов на последних стадиях деградации сетчатки. IRIS состоит из видеокамеры, носимого процессора и стимулятора. От них отличается Retina Implant AG. Имплант улавливает фотоны и активирует зрительный нерв, при этом устройство обходится без внешней камеры.
Импланты в головном мозге
Как ни странно, лечить зрение можно, не касаясь глаз. Для этого достаточно вживить в мозг чип, который будет стимулировать короткими электрическими разрядами зрительную кору. В этом направлении работает упомянутый выше Second Sight. Компания разработала альтернативную версию Argus II, которая совсем не затрагивает глаза и работает с мозгом напрямую. Девайс будет стимулировать нервные клетки током, извещая мозг о потоке света.
Искусственная сетчатка
Мы сказали, что пигментный ретинит поражает фоторецепторы сетчатки, из-за чего человек перестает воспринимать свет и слепнет. Это заболевание кодируется генетически. Сетчатка состоит из миллионов рецепторов. Мутация лишь в одном из 240 генов запускает их гибель и портит зрение, даже если связанные с ней зрительные нейроны будут целы. Как быть в этом случае? Имплантировать новую сетчатку. Искусственный аналог состоит из электропроводящего полимера с шелковой подложкой, завернутого в полимерный полупроводник. Когда падает свет, полупроводник поглощает фотоны. Вырабатывается ток и электрические разряды касаются нейронов сетчатки. Эксперимент с мышами показал, что при освещенности в 4-5 лк (Люксов), как в начале сумерек, мыши с имплантами реагируют на свет так же, как и здоровые грызуны. Томография подтвердила, что зрительная кора мозга крыс была активна. Неясно, будет ли разработка полезной для людей. Итальянский технологический институт (IIT) обещает отчитаться о результатах опытов в 2018 году.
Ошибка в коде
Носимые, вшиваемые и встраиваемые устройства — не единственная надежда офтальмологии. Для того, чтобы вернуть зрение, можно переписать генетический код, из-за ошибки в котором человек начал слепнуть. Метод CRISPR, который базируется на инъекции раствора с вирусом, несущим правильный вариант ДНК, излечивает наследственные заболевания. Исправление кода позволяет бороться с возрастной дегенерацией сетчатки, а также с амаврозом Лебера — крайне редким недугом, убивающим светочувствительные клетки. В мире им страдает около 6 тысяч человек. Препарат Luxturna обещает покончить с ним. Он содержит раствор с правильной версией гена RPE65, шифрующим структуру необходимых белков. Это инъекционный препарат — его вводят в глаз микроскопической иглой.
Диагностика и восстановление после операции
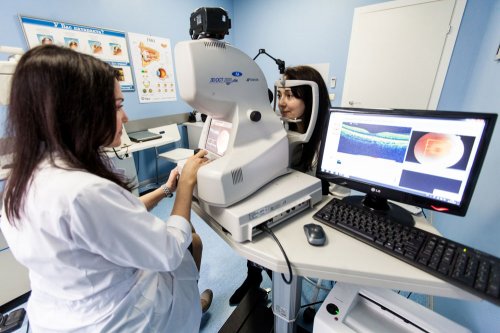
Сопровождающий нас повсюду смартфон — прекрасный инструмент для быстрой и точной диагностики. Например, синхронизированный со смартфоном офтальмоскоп Peek Vision позволяет делать снимки сетчатки где и когда угодно. А Google в 2016 году представил алгоритм анализа изображений, основанный на искусственном интеллекте, который позволяет выявлять признаки диабетической ретинопатии на снимках сетчатки. Алгоритм отыскивает мельчайшие аневризмы, указывающие на патологию. Диабетическая ретинопатия — это тяжелое поражение сосудов сетчатой оболочки глаза, ведущее к слепоте.
Будущее — за быстрым восстановлением после операций. Интересен препарат Cacicol, представленный турецкими исследователями в 2015 году. Их разработка снимает боль, повышенную чувствительность и жжение после операции на глазах. Препарат уже опробовали клинически: пациенты, которым сшивали роговицу (этот метод используется при лечении ее истончения — кератоконуса), отмечали снижение побочных эффектов.
Каким будет зрение будущего?
Уже сейчас офтальмология достигла поразительных успехов: прежде неизлечимую слепоту можно обратить, а наследственные заболевания побороть, переписав несколько участков генетического кода. В каком направлении будет идти развитие? Попробуем предположить:
Лучше предотвратить, чем лечить. Окулист в смартфоне и нейронная сеть, ставящая диагноз, обещают заметно сократить риск запущенных и едва излечимых болезней глаз. Дополненная реальность (AR) позволит распространять медицинские знания в игровой и необременительной форме. Уже сейчас есть приложения AR, моделирующие последствия катаракты и глаукомы. Знание, как известно, сила. Заменить, если нельзя вылечить. Киборгизация — это ключевой медицинский тренд. Нынешние разработки хороши, но они реконструируют зрение лишь отчасти, позволяя различать размытые контуры. В ближайшие 10 лет технология будет идти по пути повышения качества изображения и детализации. Важная задача — избавиться от носимых компонентов: камеры, очков, кабеля. Имплант должен стать мягче и, можно сказать, дружелюбнее для тканей человека, чтобы не ранить их. Вероятно, чипы без внешних вспомогательных элементов, вживляемые прямо в мозг — это самая перспективная ветка киборгизации зрения. Дешевле и доступнее: 150 тысяч долларов за устройство пока делают бионические глаза очень далекими от рынка и недосягаемыми для большинства больных. Следующий шаг — сделать их максимально доступными. Восстановление за часы: вживление чипов, коррекция сетчатки и даже исправление ДНК требуют хирургического вмешательства. Оно оставляет резь, жжение, фантомные боли и другие неприятные следствия. Препараты будущего будут регенерировать поврежденные ткани за часы. Фантастическое зрение для всех: мгновенный снимок с помощью глаза и сетчатка, подключенная к интернету, только сейчас выглядят как научная фантастика.
Источник
2002: создана искусственная сетчатка глаза.
Биологические сенсорные системы компактны и эффективно расходуют энергию. При попытке создания полупроводниковый аналог сетчатки, сталкиваются с большими трудностями: при толщине 0,5 мм она весит 0,5 г и потребляет 0,1 Вт.
Биологическая сетчатка. Клетки сетчатки связаны сложной сетью возбуждающих (односторонние стрелки), подавляющих (линии с кружками на конце) и двунаправленных (двусторонние стрелки) сигнальных связей. Такая схема вырабатывает селективные ответы четырех типов ганглионарных клеток (внизу), которые составляют 90% волокон зрительного нерва, передающих зрительную информацию в мозг. Ганглионарные клетки включения «Вкл.» (зеленые) и выключения «Выкл.» (красные) возбуждаются, когда локальная интенсивность света выше или ниже, чем на окружающем участке. Ганглионарные клетки возрастания «Инк.» (синие) и убывания «Дек.» (желтые) генерируют импульсы, когда интенсивность света увеличивается или уменьшается.
Кремниевая сетчатка. В электронных моделях сетчатки аксоны и дендриты каждой клетки (сигнальные связи) заменяются металлическими проводниками, а синапсы — транзисторами. Перестановки такой конфигурации создают возбуждающие и запрещающие взаимодействия, которые имитируют связи между нейронами. Транзисторы и соединяющие их проводники располагаются на кремниевых чипах, различные участки которых играют роль различных слоев клеток. Большие зеленые площадки — фототранзисторы, преобразующие свет в электрические сигналы.
На ранней стадии развития глаза ганглионарные клетки сетчатки направляют свои аксоны в тектум, сенсорный центр среднего мозга. Аксоны сетчатки направляются с помощью следов химических соединений, выделяемых соседними клетками тектума, которые активируются одновременно; в результате нейроны, возбуждающиеся одновременно, связываются. В итоге в среднем мозге формируется карта пространственного расположения сенсоров сетчатки.
Чтобы смоделировать этот процесс, используют программируемые проводники для создания самоорганизующихся связей между клетками в чипе сетчатки Visio1 (вверху) и чипе искусственного тектума Neurotrope1 (внизу). Электрические выходные импульсы направляются от искусственных ганглионарных клеток к клеткам тектума через микросхему памяти (ОЗУ) (в середине). Чип сетчатки выдает адрес возбужденного нейрона, а чип тектума воспроизводит импульс возбуждения в соответствующем месте. В нашем примере искусственный тектум дает команду ОЗУ поменять местами адреса 1 и 2. В результате окончание аксона ганглионарной клетки 2 перемещается к клетке тектума 1, вытесняя аксон ганглионарной клетки 3. Аксоны реагируют на градиент электрического заряда, освобожденного возбужденной клеткой и помогающего перенаправить соединения.
После многократного возбуждения блоков соседствующих нейронов искусственной сетчатки (выделенные треугольники вверху слева) конечные точки аксонов клеток тектума, которые вначале были разбросаны (выделенные треугольники внизу слева), сближаются и образуют более однородные полосы (внизу справа).
Искусственные сетчатки «Аргус» (Argus) были успешно вживлены шестерым слепым пациентам, позволив им вновь видеть свет и обнаруживать движение крупных ярких объектов.
Эта система объединяет крошечный электронный глазной имплантат с видеокамерой, установленной на тёмных очках. Решётка из 16 электродов в имплантате соединяется с сетчаткой, воздействуя на фоторецепторы. Сигнал, подаваемый на них, проходит длинный путь от камеры: через обрабатывающий процессор, затем — по радиоканалу к приёмнику, расположенному за ухом, и далее — по проводам, протянутым под кожей, к глазному имплантату. Система может работать только с пациентами, у которых ослаблены и повреждены фоторецепторы сетчатки, но здоров глазной нерв.
Предпринимаются попытки воспроизводить нейронные структуры и их функции. Это называют морфингом (отображением) нервных связей на кремниевые электронные цепи. Таким образом создаются нейроморфные микрочипы путем морфинга сетчатки — нервной ткани толщиной 0,5 мм, покрывающей заднюю стенку глаза. Сетчатка состоит из пяти специализированных слоев нервных клеток и выполняет предварительную обработку визуальных изображений (образов), извлекая полезную информацию, не обращаясь к мозгу и не расходуя его ресурсы.
Кремниевая сетчатка воспринимает движения головы человека. Четыре типа кремниевых ганглионарных клеток на чипе Visio1 имитируют реальные клетки сетчатки и выполняют предварительную обработку визуальной информации. Одни клетки реагируют на темные области (красные), другие — на светлые (зеленые). Третий и четвертый наборы клеток следят за передними (желтые) и задними (синие) границами объектов. Черно-белые изображения, получаемые при декодировании, демонстрируют то, что слепой человек мог бы видеть с помощью нейроморфного имплантата сетчатки.
2003: Сотрудник международной организации «Врачи без границ» Карло Урбани предупредил ВОЗ об угрозе вируса атипичной пневмонии. Это запустило самую грандиозную в истории систему мер по борьбе с эпидемией. Урбани сам умер от этой болезни менее чем через месяц.
Карло Урбани — итальянский врач, впервые выявивший тяжелый острый респираторный синдром (ТОРС) в качестве новой и опасной инфекционной болезни.
Его раннее предупреждение Всемирной организации здравоохранения (ВОЗ) вызвало массовую реакцию, что, вероятно, помогла спасти жизни миллионов людей во всем мире. Урбани сам умер от этой болезни менее чем через месяц.
В нескольких лабораториях мира приступили к изучению природы заболевания. Эта была беспрецедентная в мировой практике организованная работа вирусологов, молекулярных биологов, микробиологов, направленная на установление причины ТОРС. Под эгидой ВОЗ осуществлялась координация усилий ученых. Результаты не заставили себя долго ждать.
К первому относят человеческий, который маркирован, как HcoV–229E. Вторую группу составляют человеческий коронавирус – ОС43, а также вирус гепатита мышей, энцефаломиелита свиней, бычий; к третьей группе серотипа относят коронавирусы бронхита птиц, уток. Таким образом, из многочисленных видов коронавирусов у человека патогенетическую роль играют HcoV–229E и ОС43. С ними связывают вспышки острых вирусных заболеваний верхнего отдела дыхательных путей и остро возникающую диарею. Наиболее характерным проявлением острого вирусного заболевания является клиническая картина острого ринита.
Вирус имеет сферическую форму за счет шиповидных отростков, которые образуют подобие «солнечной короны»; это образное сравнение взято за основу названия – коронавирус (coronavirus).
Вирион, как это видно при электронной микроскопии, представляет сферическую форму, его размеры колеблются от 60 до 220 нм. Геном представлен однонитевой РНК. Морфологическая структура представлена шиповидными отростками («солнечная корона»), нуклеокапсидом, липидсодержащей оболочкой, белковой мембраной.
2005: Жан-Мишель Дюбернар произвел первую частичную трансплантацию лица.
Трансплантация — в медицине пересадка какого-либо органа или ткани, например, почки, сердца, печени, лёгкого, костного мозга, стволовых гемопоэтических клеток, волос.
Различают следующие виды трансплантации:
аутотрансплантация, или аутологичная
трансплантация — реципиент трансплантата является его донором для самого себя;
изогенная трансплантация — донором трансплантата является 100% генетически и иммунологически идентичный реципиенту однояйцевый близнец реципиента;
аллотрансплантация, или гомотрансплантация — донором трансплантата является генетически и иммунологически отличающийся человеческий организм;
ксенотрансплантация, или межвидовая трансплантация — трансплантация органов от животного другого биологического вида.
30 ноября 2005 года в прессе появились первые сообщения об уникальной операции по частичной пересадке лица, проведенной во французском городе Амьене командой врачей во главе с доктором Жаном-Мишелем Дюбернаром. Дюбернар заведует хирургическим отделением в больнице Эдуарда Эрио в Лионе, совмещая работу практикующего врача с исполнением обязанностей депутата французского парламента.
Ткани, необходимые для трансплантации, были взяты у мертвого донора. Операции подверглась 38-летняя француженка Изабель Динуар, которой откусила нижнюю часть лица собственная собака. По словам врачей, повреждения лица их пациентки были крайне тяжелыми: женщина утратила нос, губы и подбородок, и с трудом могла есть и разговаривать. Операция была завершена в 27 декабря и была проведена успешно.
В настоящее время Изабель Динуар говорит с явным усилием, ее нижняя часть лица остается малоподвижной, но в целом она теперь ничем не выделяется в уличной толпе.
2006: Получена первая вакцина против вируса папилломы человека.
Вирус папилломы человека широко распространен во всем мире. Существует множество типов этого вируса, одни из них безвредны, тогда как другие могут вызывать различные онкологические заболевания, прежде всего в генитальной области:
рак шейки матки (рак нижнего отдела матки) у женщин;
патологические и предраковые изменения шейки матки (т.е. такие изменения клеток шейки матки, при которых существует риск их трансформации в опухолевые);
рак влагалища и вульвы (рак наружных половых органов) у женщин;
генитальные бородавки (кондиломы) у женщин и мужчин.
Заболевание возникает в результате заражения женщины некоторыми типами вируса папилломы человека. Эти типы вируса могут способствовать изменению клеток поверхностного слоя шейки матки, вызывая трансформацию их из нормальных в предраковые. Если такие изменения не лечить, они могут перейти в рак.
Во всем мире рак шейки матки является вторым по частоте видом рака у женщин, от него ежегодно умирают более 650 женщин. Ежегодно в мире диагностируют более 490 000 новых случаев рака шейки матки.
Профилактика рака шейки матки и генитальных кондилом заключается в ограничении факторов риска, способствующих этому заболеванию, таких как:
-раннее начало половой жизни;
-частая смена половых партнеров;
-большое число половых партнеров;
-незащищенные половые контакты;
-неправильные гигиенические мероприятия.
В настоящее время появилась возможность защитить себя от вируса папилломы человека, и заболеваний которые он вызывает, с помощью вакцинации.
Первая и единственная профилактическая вакцина Гардасил (квадривалентная вакцина против вируса папилломы человека 6, 11, 16 и 18 типов, производства компании Merck Sharp & Dohme) была зарегистрирована в США в 2006 году, в России, также в 2006 году.
Вакцина неживая, инфекционностью не обладает и не может вызвать заболевание или спровоцировать обострение уже существующего.
Вакцина Гардасил относится к классу генно-инженерных вакцин и представляет собой смесь в определенных пропорциях вирусоподобных частиц типов 6, 11, 16 и 18.
Эти вирусоподобные частицы похожи на пустую оболочку натурального вируса, не содержащую его генетический материал, поэтому они не обладают никакими патогенными свойствами, зато обладают высокой иммуногенностью — вызывают формирование иммунитета значительно более сильного, чем при естественном инфицировании.
Вирусоподобные частицы воспринимаются иммунной системой организма человека как натуральные вирусы, и при контакте с клетками иммунной системы запускается комплекс формирования иммунного ответа. В результате вырабатываются специфические антитела, формируется особый пул клеток, длительно циркулирующих в организме. Организм становится защищенным. Длительность защиты по результатам проведенных исследований составляет на сегодня более 11 лет, и уже получены свидетельства наличия иммунологической памяти, что позволяет рассчитывать на длительность защиты на несколько десятилетий.
2006: разработана вторая вакцина против ротавирусной инфекции (первая была отменена).
Иногда детский организм может быть инфицирован ротавирусами. Сложность болезней, вызываемых этими микроорганизмами, состоит в том, что они часто сопровождаются серьёзным поражением желудочно-кишечного тракта (гастроэнтеритом) у новорожденных и маленьких детей. Каждый год эти микробы обуславливают до 25 миллионов визитов в клинику, до 2 миллионов случаев госпитализации детей и более 600.000 смертей во всём мире среди детей младше 5 лет .
Разработка безопасных и высоко эффективных вакцин (то есть препаратов, содержащих ослабленные вирусы или продукты их жизнедеятельности), способных активизировать иммунные механизмы, направленные против ротавирусной инфекции , является первоочередной задачей педиатрии, особенно в развивающихся странах, где распространённость инфекционных заболеваний продолжает оставаться крайне высокой, а уровень медицинского обеспечения населения явно недостаточным. Проблема усугубляется ещё и тем, что большинство уже разработанных противовирусных вакцин часто вызывают у детей многочисленные побочные эффекты и осложнения, а также нередко обладают невысокой эффективностью и непродолжительностью основного иммуностимулирующего действия. Вот почему, многим детям нужно через некоторое время вводить вакцину повторно, а иногда в третий, четвёртый и более раз. Некоторые виды вакцин могут вызвать глубокое внедрение вирусов в ткани организма ребёнка и спровоцировать серьёзные воспалительные процессы в кишечнике. Всё это крайне нежелательно, и может стать причиной вполне оправданного и вынужденного изъятия определённых вакцин из употребления.
Недавно были разработаны несколько новых вакцин , действие которых направлено на стимулирование иммунитета против ротавирусов. Эти вакцины изготовлены в виде жидких препаратов, принимаемых пациентами орально, то есть их дают ребёнку выпить. Эффективность данных вакцин полностью ещё не изучена, и не известны все нежелательные последствия и максимально активные дозы.
Группой исследователей под руководством Guillermo M. Ruiz-Palacios было обследовано более 63.000 здоровых детей в Финляндии и 11 странах Латинской Америки. Половине обследованных детей вводили HRV-вакцину RIX4414 (она содержит ослабленные ротавирусы G1P[8] ), а другая половина детей принимала инертные безвредные вещества (плацебо). Интересно, что вакцина давалась детям не однократно, а в виде двухразового введения с определённым интервалом времени (он колебался от двух до четырёх месяцев в зависимости от возраста ребёнка). После этого, дети обеих групп неоднократно обследовались педиатрами на протяжении нескольких лет , после чего сравнивались показатели их иммунитета, и анализировалось общее состояние здоровья.
В ходе проведенного исследования было установлено, что выбранная учёными схема введения вакцины даёт очень хорошие результаты. Во-первых, двухразовое введение новой вакцины предупреждает развитие ротавирусного гастроэнтерита в 90-100% случаев. Во-вторых, практически не наблюдалось побочных эффектов. В третьих, защитное действие вакцины проявляется на протяжении двух лет , что можно считать чрезвычайно успешным. Госпитализация по поводу ротавирусной инфекции снизилась на 85%. Далеко не всякая вакцина имеет столь высокие стимулирующие иммунитет показатели.
Таким образом, двукратное введение ослабленной живой вакцины RIX4414 против ротавируса G1P является высоко эффективным для защиты детей первых лет жизни от серьёзного вирусного гастроэнтерита и практически не имеет побочного действия.
2008 год: Лоран Лантьери произвел первую полную трансплантацию лица.
Коллектив врачей Государственного французского госпиталя имени Анри-Мондора успешно провели операцию по полной пересадке тканей лица. Операция была проведена 26 и 27 июня под руководством профессора Лорана Лантиери и продлилась более 6-ти часов.
Прооперированный 35-летний мужчина по имени Паскаль Колэ — страдал от тяжелого генетического заболевания Реклингхаузена, вследствие которого черты его лица были сильно искажены. По словам медиков, пациенту были пересажены все ткани лица, в том числе веки и слезные протоки.
В течение двух месяцев пересаженный участок оставался неподвижным, после чего началось восстановление чувствительности и двигательной функции.
Сейчас пациент отлично ест, говорит и даже может полностью закрыть рот, но, по признанию врачей, недостаточно хорошо улыбается, что связано с не совсем удачным перерасположением мышц.
Данилина О.С., Мялкина К.Н.
Источник