Ишемия мозга и глаукома
Филина Н.В., Мельников В.Я., Коноплёва Э.В.
Проблема глаукомы является одной из важнейших в современной офтальмологии. С каждым годом увеличивается количество больных с первичной открытоугольной глаукомой [35]. Связанно это и с определенными демографическими сдвигами. Население стареет – увеличивается распространенность данного заболевания [2].
Мировая статистика заболеваемости среди населения свидетельствует о росте частоты ПОУГ: по оценке ВОЗ, в 2010 г. численность больных глаукомой составляла около 60млн., а к 2010 г. она достигнет почти 80 млн. человек [35].
В Российской Федерации по данным статистики на 2012 г. более миллиона человек больны глаукомой и свыше 66 тысяч слепых вследствие глаукомного процесса [11].
До сих пор это заболевание является причиной необратимой слепоты и слабовидения, занимая одно из ведущих мест в перечне инвалидизирующих заболеваний органа зрения [7].
За последнее время в зарубежных публикациях можно встретить сравнение ПОУГ с болезнями Альцгеймера, Паркинсона и другими нейродегенеративными заболеваниями, поскольку у них имеется ряд схожих особенностей: рост заболеваемости с возрастом, избранное поражение одного вида нейронов, механизм гибели нервной клетки и т. д. Однако ранее офтальмологами в проводимых исследованиях изучались, в основном, сетчатка и зрительный нерв, и не уделялось внимание более высоким отделам зрительного анализатора. В связи с этим актуальным становится изучение структур зрительного пути при ПОУГ [1, 25, 33].
Роль митохондриальной патологии и других факторов в развитии глаукомы
Несмотря на многочисленные исследования этиологии и патогенеза первичной открытоугольной глаукомы, у большинства больных с длительным течением заболевания, происходит прогрессивное ухудшение зрительных функций с переходом заболевания в более тяжелую стадию. Причинами этого могут быть неизученные на сегодняшний день механизмы патогенеза и факторы прогрессирования глаукомы, в частности так называемая митохондриальная патология, на основе которой развиваются многие сочетанные заболевания, а некоторые из них протекают более тяжело [6].
Развитие нейродегенерации при глаукоме объединяет множество факторов и путей апоптоза ганглионарной клетки, но все они так или иначе связаны с митохондриями как основной единицей, ответственной за энергетические процессы в клетке и апоптоз [4, 8, 12, 20, 32].
В настоящее время доказанным считается тот факт, что наиболее ранние повреждения при глаукоме происходят в митохондриях аксонов ганглиозных клеток сетчатки (ГКС) [5]. Ведь именно митохондриям принадлежит особая роль в развитии нейродегенеративных заболеваний [2].
Предполагается, что целый ряд взаимодействующих факторов может вносить вклад в нейрональные повреждения при нейродегенеративных расстройствах, и одним из них является вторичная дисфункция митохондрий. Исходя из этого, прогрессирование глаукомы и появление глаукоматозной оптической нейропатии (ГОН), а затем и атрофии могут рассматриваться как митохондриальная патология [21].
Установлено также участие сульфгидрильных групп в процессах перекисного окисления липидных компонентов мембран, приводящих к развитию дегенеративных изменений тканей [16]. О нарушении окислительно-восстановительных процессов и тканевого дыхания может свидетельствовать также повышение уровня лактата в крови пациентов [16].
Значимым фактором прогрессирования нейродегенерации при данном заболевании считается наличие измененных протеинов: бета-амилоида и тау-белка [26, 34, 37, 40]. На культуре выделенных ганглионарных клеток сетчатки мышей было продемонстрировано нейротоксическое действие предшественника бета-амилоида в присутствии индуктора синтеза бета-амилоида. Дегенерация нейронов сетчатки была пропорциональна времени воздействия бета-амилоида и его концентрации. При добавлении в культуру клеток ингибитора синтеза бета-амилоида гибель клеток прекращалась [3, 31, 36].
По данным исследователей, тау-белок определяется и в сетчатке больных глаукомой, но в гораздо меньшем количестве. Однако при исследовании с моноклональными антителами AT8 выявления фосфорилированного тау-белка у больных глаукомой был выявлен гиперфосфорилированный тау-белок, который играет значимую роль в патогенезе болезни Альцгеймера [3, 29].
Глаукома как нейродегенеративное заболевание
Буквально до последнего времени первичную открытоугольную глаукому рассматривали как чисто глазное заболевание, основным проявлением которого является нарушение гидродинамики, приводящее к нарушениям микроциркуляции, ишемии с развитием глаукомной нейрооптикопатии. Однако со временем выяснилось, что распад зрительных функций все равно наступает, правда, существенно позже [7].
Первичная открытоугольная глаукома (ПОУГ) – заболевание, которое развивается с возрастом и характеризуется прогрессирующим течением даже на фоне нормализованного уровня офтальмотонуса [7, 35]. Как известно, механизм гибели клеток сетчатки и аксонов зрительного нерва при глаукоме, как и при всех нейродегенеративных расстройствах, – это физиологически запрограммированный апоптоз [1, 5, 10, 23, 35].
Глаукому можно отнести к заболеваниям нейродегенеративного генеза:
— эти заболевания имеют общий механизм гибели клетки; как известно гибель ганглионарных клеток сетчатки — это физиологически запрограммированная гибель клетки – апоптоз. Запуск апоптоза происходит при активации специфических протеаз – каспаз, которые, проникая в ядро клетки, разрушают ДНК. В свою очередь, активация каспаз напрямую связана с митохондриальной дисфункцией;
— отмечается гибель нейронов одного вида, нарушение межсинаптических связей, которые приводят к нарушению центральной функции; при глаукоме погибают волокна зрительного нерва и страдают зрительные функции, а при болезни Альцгеймера страдают лобные доли головного мозга и нарушаются когнитивные функции;
— нейродегенеративные заболевания развиваются с возрастом и имеют длительный хронический характер течения; также и распространенность глаукомы увеличивается в возрастной популяции, а прогрессирование заболевания происходит в течение нескольких лет [10].
Распространение дегенеративных изменений на структуры ЦНС при глаукомной оптической нейропатии (ГОН) можно объяснить с помощью процесса вторичной транссинаптической нейродегенерации, под которой понимают распро¬странение патологического процесса на здоровые нейроны, которые избежали первичного повреждения от повышенного ВГД, но прилежат к повреж¬денным нейронам, которые оказывают на них дегенеративное влияние [38, 39].
Нейродегенерация характеризуется повреждением клеток и межклеточного вещества, в результате чего происходит нарушение функции органа [3, 14]. Нейродегенеративные заболевания – это заболевания, которые возникают в результате прогрессирующей дегенерации и гибели нейронов, входящих в определенные структуры ЦНС, приводят к разрыву связей между отделами ЦНС и дисбалансу синтеза соответствующих нейромедиаторов и, как следствие, к нарушению памяти, координации движений и мыслительных способностей и т.д. [8, 20, 22, 24, 25, 27, 28].
Причиной отрицательной динамики глаукомного процесса, характеризующейся быстрым распадом зрительных функций, могут быть неизученные на сегодняшний день механизмы патогенеза и факторы прогрессирования данного заболевания, к которым относятся нарушения процессов тканевого дыхания, окислительно-восстановительных реакций и процесса перекисного окисления липидов, а также состояние митохондрий клеток сетчатки, зрительного нерва и других структур зрительного тракта. Установлено, что за процессы тканевого дыхания и трофическую регуляцию на микроциркуляторном уровне через свободные недоокисленные сульфгидрильные группы отвечают тиоловые соединения [16].
Изучение причин и механизмов развития и прогрессирования ПОУГ является необходимым условием для патогенетического обоснования лечения и профилактики прогрессирования ГОН. Развитие нейродегенерации при глаукоме может происходить вследствие множества причин, приводящих разными путями к апоптозу ганглионарной клетки. Но все они так или иначе связаны с митохондрией, основной единицей, ответственной за энергетические процессы в клетке и апоптоз. Гибель клетки в результате апоптоза происходит при всех нейродегенеративных заболеваниях [10].
Многие проведенные исследование позволили выявить грубые дегенеративные изменения на протяжении всех отделов проводящих путей зрительного анализатора, особенно на уровне наружных коленчатых тел и коркового отдела в области шпорной борозды. Данные изменения в центральной нервной системе, зарегистрированные у больных ПОУГ, имеют ряд схожих особенностей с другими нейродегенеративными заболеваниями [1].
С целью изучения патогенетического значения апоптоза при первичной открытоугольной глаукоме (ПОУГ) проведено исследование его маркеров у пациентов с глаукомой различных стадий и с подозрением на ее наличие в сыворотке крови и слезной жидкости. Выявлены характерные особенности в состоянии системы Fas/FasL, связанные со стадией глаукоматозного процесса и коррелирующие с некоторыми клинико-функциональными (периметрическими) показателями, что важно как для понимания патогенеза ПОУГ, так и для прогнозирования течения заболевания [19].
Новые методы диагностики глаукомы
Новое понимание процессов развития глаукоматозного процесса дает возможность искать новые средства диагностики данной патологии и прогноза ее развития. Так, важной становится оценка функций митохондрий. Для этого в настоящее время используют клинические, морфологические (гистохимическое изучение активности ферментов митохондрии и распределение в ней различных субстратов – липидов, гликогена, солей кальция – в биоптатах тканей), биохимические (оценка уровней лактата и пирувата, антиоксидантной активности, продуктов перекисного окисления липидов крови) и молекулярно-генетические методы (выявление мутаций митохондриальной ДНК и ядерных мутаций, приводящих к нарушению синтеза митохондриальных белков) [9, 21].
Предложен метод функциональной диагностики, основанный на анализе суммарной биоэлектрической активности головного мозга с помощью диагностического аппарата «Магнитоэнцефалограф индукционный МЭГИ-01». Этот метод позволяет подойти к выявлению заболевания на стадии доморфологических изменений. Таким образом, исследовав при помощи магнитоэнцефалографии суммарную биоэлектрическую активность головного мозга при глаукоме, они обнаружили отклонения, отражающие основные патогенетические звенья развития данного заболевания. Они заключались в усилении симпатических влияний на глаз вегетативной нервной системы, застое в венозной системе глаза, ослабление трофической функции парасимпатической нервной системы на глаз. У офтальмологически здоровых пациентов таких изменений зарегистрировано не было [17].
Изучены закономерности изменений суммарной биоэлектрической активности головного мозга при первичной открытоугольной глаукоме с помощью индукционной магнитной энцефалографии. Выявлены специфичные для первичной открытоугольной глаукомы изменения диффузной биоэлектрической активности головного мозга: нарушение работы адренорецепторных структур глаза, ослабление парасимпатического влияния на нервно-рецепторный аппарат, отличающийся богатством и разнообразием форм рецепторных элементов, сконцентрированных на границе цилиарного тела и дренажной зоны глаза [18].
Подводя итог, необходимо отметить, что глаукома действительно может рассматриваться как нейродегенеративный процесс, так как имеет много общего с такими заболеваниями, как болезнь Альцгеймера и болезнь Паркинсона [30]. Теперь становится ясным, что воздействовать надо не только на внутриглазное давление, но и на другие звенья патогенеза глаукомной нейропатии, такие как эксайтотоксичность, оксидативный стресс, митохондриальная дисфункция, аксонопатия и протеинопатия. Только в совокупности гипотензивного лечения с нейропротективным удастся достигнуть благоприятного результата и остановить прогрессирование дегене¬ративного процесса при глаукоме [13].
Источник
Глаукома получила такое название в связи с изменением цвета зрачка при патологии глаз. В период наивысшего развития патологического процесса зрачок становится зеленоватого или бирюзового оттенка, поэтому все заболевания с таким изменением получили название глаукома (в переводе с греческого «глаукома» переводится как бирюза, лазурь, а с немецкого — зеленая вода). На самом деле глаукома это не отдельное заболевание, а целая группа схожих патологических процессов, со схожими проявлениями.
Среди них наиболее характерными являются:
- Изменения внутриглазного давление, которое возникает периодически или присутствует на постоянной основе, процесс носит хронический прогрессирующий характер;
- Постепенные процессы атрофии зрительного нерва;
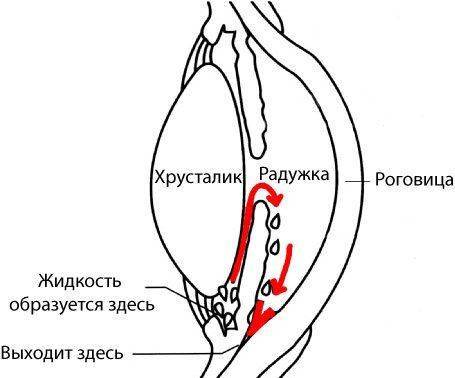
- Нарушение оттока внутриглазной жидкости;
- Нарушения зрительных функций по определенной схеме;
- Постепенное развитие углубления в области диска зрительного нерва.
Наиболее часто глаукома возникает в старшей возрастной группе, но это не означает, что она не может возникнуть и в молодом возрасте или даже младенчестве. Изредка регистрируются случаи врожденного заболевания. Но все же основную группу занимают люди старше 60 лет.
Причины посттравматической глаукомы
Видов глаукомы очень много, но одна из самых опасных форм этого заболевания — посттравматическая глаукома, в связи с тем, что она в большинстве случаев приводит к инвалидности и полной слепоте.
Очень частая причина этого вида глаукомы — любое механическое или химическое воздействие на глаз — ранение, удар, химический ожог, в результате которых возникают изменения в передней камере глаза и сосудисто-нервном пучке глазного яблока. В связи с повреждением внутренних структур глаза нарушается отток внутриглазной жидкости, возникают препятствия (сращения) в передней камере, которые не дают возможности свободно циркулировать внутриглазной влаге.
Кроме того, причиной может послужить смещение хрусталика глаза или изменение его формы, что ведет к блокировке оттока жидкости. Вследствие травмы может произойти выпячивание хрусталика в переднюю камеру, он набухает и затрудняет передвижение влаги. Глаукомы, вызванные травмой хрусталика, называют факогенными.
Иногда посттравматическая глаукома развивается при разрастании соединительной ткани в передней камере глаза, которая проросла по ходу раневого канала. При глубоком повреждении слоев глаза заживление происходит замещением грубой рубцовой тканью блокирующей радужно-роговичный угол. И еще одна причина, которая может привести к подобной патологии — металлические инородные тела, длительно пребывающие в глазе. В них происходят окислительные процессы, выделяются различные соединения металла, они оседают в перегородках передней камеры глаза и затрудняют отток жидкости.
Следует четко понимать, что именно состояние угла передней камеры играет основную роль в циркуляции влаги внутри глаза, и степень открытия угла оказывает влияние на формирование повышенного внутриглазного давления. Чем меньше открыт радужно-роговичный угол, тем сильнее повышается внутриглазное давление. Почти в 100% случаев именно этот механизм приводит к развитию глаукомы.
Виды посттравматической глаукомы
В настоящий момент имеется много разновидностей классификации заболевания, но по типу возникновения нарушений различают:
- Контузионную посттравматическую глаукому;
- Раневую;
- Ожоговую.
В любом случае, какая бы причина у заболевания ни была, существуют наиболее характерные симптомы:
- Различной степени интенсивности помутнение в роговице;
- Атрофические процессы в радужной оболочке и разной степени деформация зрачка;
- Полное или частичное смещение хрусталика глаза;
- Снижение остроты зрения, которое возникает в различные сроки с момента начала заболевания;
- Застойные явления и изъязвления глазного яблока.
В качестве осложнений могут возникать сопутствующие заболевания — афакия, отслоение сетчатки глаза, кровоизлияния в глазное яблоко.
Контузионной посттравматической глаукоме присуща блокада угла передней камеры, она запирается стекловидным телом или рубцовой тканью (гониосинехии, шварты). Также механическая закупорка может произойти хрусталиком глаза, остатками свернувшейся крови. В этом случае затрудняется отток и повышается внутриглазное давление из-за грыжевого выпячивания стекловидного тела и деформации угла передней камеры.
 При механической травме или проникающем ранении может произойти кровоизлияние в переднюю камеру глаза (гифема) или стекловидное тело (гемофтальм). Однако гифема образуется в первые же часы после получения травмы, а гемофтальм, как правило, формируется постепенно, через значительный промежуток времени (через несколько дней и даже недель) после травмы.
При механической травме или проникающем ранении может произойти кровоизлияние в переднюю камеру глаза (гифема) или стекловидное тело (гемофтальм). Однако гифема образуется в первые же часы после получения травмы, а гемофтальм, как правило, формируется постепенно, через значительный промежуток времени (через несколько дней и даже недель) после травмы.
В случае вывиха хрусталика при травме, вторичная посттравматическая глаукома развивается через несколько лет после получения травмы, когда разрушенные массы хрусталика блокируют отток жидкости из глаза.
После проникающих ранений глаза, следствием которых может быть вытекание водянистой влаги из передней камеры или ранение хрусталика, также происходят изменения внутриглазного давления. Однако в случае вытекания внутриглазной жидкости, давление резко снижается, а вот при ранении хрусталика наблюдается его отек, набухание, что приводит к резкому повышению давления в передней камере и развивается закрытоугольная глаукома.
Если же травма глаза не была вызвана проникающим ранением, но при этом в глазное яблоко попало значительное количество инородных тел, глаукома может развиваться по типу острого глаукоматозного приступа, при котором требуется немедленная офтальмологическая помощь. В противном же случае пострадавший может полностью лишиться зрения.
При химических ожогах наиболее часто возникают временные глаукоматозные состояния. Повышение внутриглазного давления при этом вызвано повреждением сосудов эписклеры (слой соединительной ткани между конъюнктивой и склерой, очень богат кровеносными сосудами), в результате происходит выброс простагландинов, повышающих внутриглазное давление.
И еще одна особенность посттравматической глаукомы — она имеет обратный суточный ритм колебаний внутриглазного давления. Максимальное давление в глазу при этом заболевании наблюдается в вечерние и ночные часы, в то время как в норме максимальное давление в глазу в утреннее время и днем, а по вечерам и ночам оно минимально.
Лечение посттравматической глаукомы
При увеличении внутриглазного давления обязательно требуется проведение гипотензивной терапии, направленной на нормализацию давления и циркуляции влаги. На ранних этапах посттравматической глаукомы рекомендованы тимолол, диакарб и клофелин. В поздние сроки применяют миотические препараты — пилокарпин в виде глазных капель, фосфакол, тосмилен. Фосфакол можно чередовать с пилокарпином или ацеклидином.
 Однако консервативная терапия при посттравматической глаукоме не всегда оказывает положительный эффект и тогда возникает необходимость в хирургической коррекции оттока жидкости. К наименее травматичным операциям относятся криохирургия, лазерная иридэктомия или трабекулопластика.
Однако консервативная терапия при посттравматической глаукоме не всегда оказывает положительный эффект и тогда возникает необходимость в хирургической коррекции оттока жидкости. К наименее травматичным операциям относятся криохирургия, лазерная иридэктомия или трабекулопластика.
Кроме того, могут применяться методы витрэктомии или циклокриокоагуляции. Суть витрэктомии состоит в удалении стекловидного тела, что облегчает движение внутриглазной жидкости. Витрэктомия применяется при отслоении сетчатки глаза, если кровоизлияние в глаз не рассосалось самостоятельно. Также она показана в тех случаях, когда произошел вывих или подвывих хрусталика в стекловидное тело, в этом случае не только производят витрэктомию, но и удаление хрусталика.
Операций, при посттравматической глаукоме, разработано достаточно много, но офтальмолог выбирает наиболее приемлемый метод в каждом случае отдельно. А для профилактики развития этого заболевания рекомендуется своевременно обрабатывать рану в глазу, применять рациональную терапию при контузиях, которая должна быть направлена на снижение болевых ощущений, отечности в области раны и устранение кровоизлияния.
Loading …
Источник