Группа скрининга при глаукоме
Следует ли вообще лечить глаукому, ведь многие полагают, что это заболевание может пройти самостоятельно? Любая глаукома, лечение её — это уровень не домашней медицины, а профессиональной.
Да! Это просто необходимо! Свыше полутора миллионов жителей США страдает от проявлений глаукомы. В списке заболеваний, вызывающих слепоту, глаукома занимает устойчивое второе место.
Самое большее распространение (примерно 90% всех случаев) получила открыто-угольная форма глаукомы (ОУГ), отличающаяся постепенным прогрессом вплоть до наступления полной слепоты. Прочие разновидности глаукомы — врожденная, закрытоугольная и вторичная также опасны, но менее коварны.
Разумеется, статистика всегда условна, поэтому, упоминая больных с открытоугольной глаукомой и с плохим зрением, источники утверждают: слепота прогрессирует у 65% лиц на протяжении 20 лет.
Помимо ухудшения остроты зрения ОУГ может провоцировать появление других сопутствующих заболеваний. Частный случай — нарушение периферического зрения.
Глаукома соотносится с преклонным возрастом и расовыми критериями. Так лица европейского происхождения после 50 лет сталкиваются с глаукомой сравнительно редко. Люди пожилые жалуются на нее гораздо чаще, а в преклонном возрасте от нее страдает более 3% от числа всех пациентов офтальмологических клиник. Негры считаются особой группой риска по заболеванию глаукомой, а большинство случаев слепоты у негроидов вызывается именно этим заболеванием.
Помимо возрастных данных и особенностей рассового происхождения, для развития глаукомы имеют особую важность
- близорукость;
- сахарный диабет;
- наследственность, когда кто-то в семье уже имеет глаукому;
Существует много тестов для определения глаукомы, но чаще всего на практике используются тонометрия, офтальмоскопия и периметрия.
Выбор тонометрии как как тестового метода на глаукому целиком возлагается на врача. В ряде случаев лицам, входящим в группу риска (в возрасте под 70) клинически целесообразно обследоваться на глаукому у врача-окулиста.
Для измерения уровня внутриглазного давления применяются различные типы тонометров — аппланационные и импрессионные. При использовании любого тонометра принято считать по определению, что глаза пациентов имеют сходную ригидность, толщину роговицы и одинаковый кровоток. Результаты тонометрии зависят от выбор модели устройства, тяжести заболевания и квалификации врача-офтальмолога.
Проблемы использования тонометрии связаны с свойствами глазного давления. Под этим подразумевается уровень внутриглазного давления, превышающий 21 мм рт. ст. Несмотря на то, что гипотензивность глаз зачастую предваряет сокращение поля зрения вследствие глаукомы и рассматривается как дополнительный фактором риска (глаукома отмечается в 5—6 раз чаще нормального при ВГД, превосходящем 21 мм рт. ст.), небольшая гипотензивность глаз встречается у пациентов, не страдающих глаукомой.
При этом число лиц, страдающих от глаукомы, составляет примерно 1% от общей численности всего населения, что гораздо меньше, нежели чем число больных, имеющих гипотензивность глаз (порядка 15%). Гипотензивность есть у четверти всех лиц пожилого возраста. Гипотензивность не взаимосвязана с глаукомой. Примерно у 80% больных с ГГ глаукома никогда не диагоностировалась и не прогрессировала.
Высокий уровень внутриглазного давления наоборот имеет важное значение для рисков появления глаукомы. Исходное значение в 35 мм рт. ст. гораздо менее чувствительно при прогнозировании глаукомы. Открытоугольная глаукома может прогрессировать у пациентов, имеющих обычный показатель внутриглазного давления.
Офтальмоскопия — второй вид скрининга на открытоугольную глаукому. Офтальмоскопия обязательно присутствует в стандартном осмотре врача-офтальмолога, будучи одним из важнейших компонентов диагностики глазных заболеваний. В ходе этой процедуры при помощи офтальмоскопа возможно осмотреть глазное дно, оценить состояние сосудов глазного дна, диска зрительного нерва и сетчатки.
Также офтальмоскопия дает возможность обнаружить затронутые атрофией участки, способные вызвать образование новых очагов заболевания, найти
места разрывов сетчатки и узнать их количество. Исследования могут делаться в прямом и обратном виде, широким и узким зрачком.
Наряду с заболеваниями глаз офтальмоскопия используется в диагностике других патологий, как то: сахарный диабет, артериальная гипертония и пр.
Третий метод обследования на ОУГ — периметрия, процедура, позволяющая определить границы полей зрения. Периметрия характеризуется большей точностью, нежели тонометрия или офтальмоскопия. Объём поля зрения дает возможность определить остроту периферического зрения, оказывающего влияние на состояние жизнедеятельности пациента.
Периметрия рекомендована при наличии таких патологических состояний, как
- глаукома;
- дистрофия сетчатки;
- отслойка сетчатки;
- гипертония;
- ожоги глаза;
- онкологические заболевания глаза;
- излияние крови в сетчатку;
- травма, ишемия зрительного нерва.
Вверх
Источник
Раннее выявление глаукомы. Скрининг населения на глаукому.Рекомендации: Не существует достаточных оснований для того, чтобы рекомендовать общее применение тонометрии в качестве эффективного теста на глаукому. Однако клинически выгодно советовать пациентам высокого риска, таким, как лица старше 65 лет, периодически проходить обследование на глаукому у окулиста. Глаукома — вторая по распространенности причина слепоты в США — проявляется у 1,4 миллиона американцев и вызывает более 3 миллионов визитов к офтальмологам в год. Из различных форм глаукомы (врожденная, открытоугольная, закрытоугольная, вторичная) открыто-угольная глаукома (ОУГ) является наиболее распространенной (90% случаев) и постепенно развивающейся формой болезни-до того, как проявятся необратимые признаки потери зрения. Количество лиц с ОУГ, у которых развивается слепота, точно не определено, но исследования предполагают, что в течение 20 лет слепота развивается у 70% лиц с тяжелым заболеванием. Кроме слепоты (снижение остроты зрения), могут наблюдаться сопутствующие болезни, такие, как снижение периферического зрения. Глаукома возникает менее, чем у 1% лиц моложе 70 лет, у пожилых она распространена чаще, после 75-летнего возраста она возникает у 2—4% людей. У негров, являющихся по глаукоме группой риска, эта болезнь является основной причиной слепоты. В дополнение к возрасту и расе другими факторами риска по глаукоме являются диабет, близорукость и наличие в семье случаев глаукомы.
Эффективность скрининговых тестов на глаукому.Тремя наиболее распространенными тестами на глаукому являются — тонометрия, офтальмоскопия и периметрия. Тонометры, включающие тонометры Шютца, аппланационные и бесконтактные тонометры, используются для измерения внутриглазного давления. Точность и надежность тонометрии связаны с выбором прибора, подготовкой врача и особенностями заболевания. Наиболее важной проблемой, связанной с этим тестом, является ограниченная специфичность глазной гипертензивности (ГГ), которая обычно определяется, как внутриглазное давление (ВГД), превышающее 21 мм рт. ст. Хотя ГГ часто предшествует сокращение поля зрения из-за глаукомы и является дополнительным фактором риска (глаукома встречается в 5—6 раз чаще обычного при ВГД, превышающем 21 мм рт. ст.), небольшая ГГ часто проявляется у лиц, глаукомой не страдающих. Число людей, больных глаукомой, составляющее 1 % от общего числа населения, много ниже, чем число лиц с ГГ (от 5 до 13% по разным оценкам); ГГ присутствует у 25% лиц старше 65 лет. Так, хотя ГГ может предшествовать глаукоме, у 70—97% лиц с ГГ глаукома не развивается. Риск возникновения глаукомы увеличивается вместе с высокими уровнями ВГД, поэтому порог в 35 мм рт. ст. более специфичен, но менее чувствителен при предсказаниях глаукомы. Кроме того, ОУГ часто развивается у лиц с нормальным ВГД даже у лиц с точно определенной глаукомой только у 50% отмечается ГГ. Ограниченная специфичность тонометрии дополняется низкой распространенностью ОУГ и уровнем предсказания, составляющим всего 5%, для бессимптомных лиц, таких, например, как участники программ на обследование на глаукому. Вторым скрининговым тестом на ОУГ является офтальмоскопия. Она может определить аномалии вызванные глаукомой, черепного зрительного нерва (бледность диска зрительного нерва, кровоизлияние, образование чашеобразных углублений), которые часто предшествуют необратимому сокращению полей зрения. Хотя офтальмоскопия редко применяется для специального выявления глаукомы, она часто является несовершенной по разным причинам. Во-первых, офтальмоскопия имеет низкую чувствительность. Даже в доказанных случаях глаукомы образование чашеобразных углублений и другие аномалии обнаруживаются только в 50—60% случаев. Во-вторых, она имеет ограниченную специфичность при определении текущего глаукоматозного снижения зрения; в таких случаях специфичность составляет примерно 15%. В-третьих, эта информация должна проверяться офтальмологами часто с последующим специальным обследованием на глаукому. Врачи на местах получают существенно меньшую точность при определении результатов. В-четвертых, интерпретация полученных данных сильно зависит от исследователя, даже при применении специальных стандартов. Наконец, применение специальной техники, например, измерение отношения диаметра экскавации к диаметру зрительного нерва и стереоскопическое фотографирование зрительного нерва слишком сложны для использования при первичном общем обследовании. Третий метод обследования на ОУГ — периметрия, измерение полей зрения. Эта процедура отличается большей точностью, чем тонометрия или офтальмоскопия. Проблемы, возникавшие в предыдущие годы при ручном определении полей зрения, сняты в последние годы применением специальных приборов. Последние работы, использующие эти приборы, показывают чувствительность, превышающую 90%, и специфичность 70—88%. Несмотря на достоинства, которые проявляет эта технология в руках эксперта, автоматическая периметрия слишком дорога для общего обследования. Кроме того, исследование полей зрения не эффективно для раннего обнаружения глаукомы. Учебное видео определения полей зрения — периметрии
— Также рекомендуем «Эффективность раннего обнаружения глаукомы.» Оглавление темы «Профилактика заболеваний.»: |
Источник
В статье представлены результаты оригинального исследования, посвященного оценке эффективности скрининга глаукомы в Российской Федерации, выявлению неэффективные зоны и возможных решений.
Введение
Первичная открытоугольная глаукома (ПОУГ) представляет собой прогрессирующую оптическую нейропатию, характеризующуюся потерей ганглиозных клеток с развитием специфических изменений диска зрительного нерва (ДЗН) и слоя нервных волокон сетчатки, что при отсутствии своевременного лечения неуклонно ведет к слепоте [1–3].
Чем раньше выявляется ПОУГ, тем больше возможности у офтальмолога помочь больному сохранить зрительные функции и стабилизировать течение глаукомного процесса. Однако бессимптомное течение глаукомы на начальных стадиях обусловливает сложность раннего выявления ПОУГ. По данным литературы, в среднем от момента манифестации до появления первых клинических признаков проходит 5–7 лет, в связи с чем даже в городах с развитой медицинской помощью ПОУГ часто выявляется на запущенных стадиях, что значительно снижает эффективность лечения [2]. В настоящее время доказано, что даже при начальных клинических проявлениях ПОУГ происходит значительное повреждение заинтересованных структур: трабекулярной сети угла передней камеры, ганглиозных клеток сетчатки, волокон зрительного нерва, сосудистого тракта глаза. У больных с начальной стадией ПОУГ имеется нарушение жизнеспособности 20–50% нервных волокон. Но при этом часть из них способна к функциональной состоятельности при устранении условий, нарушающих жизнедеятельность, при назначении адекватного лечения [4]. Из вышеизложенного очевидно, что необходимо принимать активные меры по целенаправленному выявлению ПОУГ на ранней стадии. Но важно понимать, что профилактические мероприятия должны быть эффективными, чтобы в условиях ограниченного финансирования не только оправдывать средства, необходимые для их проведения, но и являться экономическими инвестициями, снижающими необходимость в более дорогостоящем лечении. Следовательно, немаловажное значение в лечебно-диагностическом процессе имеет и организационная составляющая [5, 6]. На стыке этих направлений в настоящее время в развитых странах активно разрабатываются и продолжают совершенствоваться программы скрининга глаукомы [7].
Цель исследования: оценить эффективность скрининга глаукомы в Российской Федерации, выявить неэффективные зоны и предложить возможные решения.
Материал и методы
С учетом цели исследования нами была разработана анкета для врачей-офтальмологов, включающая 35 вопросов. Анкета состояла из вводной части, а именно обращения к респонденту с кратким разъяснением темы исследования; блока вопросов для получения информации о респондентах и основного блока с вопросами смыслового характера. Блок вопросов для получения информации о респондентах (местонахождение, стаж работы) также включал вопросы, позволявшие отсеять неподходящих респондентов (критерии включения: работа в первичном амбулаторно-
поликлиническом звене и участие в диспансеризации взрослого населения). Анкета содержала открытые, закрытые и полузакрытые вопросы. Вопросы основного блока были сгруппированы по схожему содержанию, каждый вопрос включал четкое пояснение относительно оформления ответа. Общее количество врачей-респондентов составило 126 человек (основную долю (72 врача, 57,0%) составляли врачи-офтальмологи из г. Москвы), проходившие курсы повышения квалификации на базе кафедры офтальмологии ФГБОУ ДПО РМАНПО Минздрава России. Средний стаж работы врачом-офтальмологом составил 20 лет (от 5 до 54 лет).
Проведение данного исследования одобрено этическим комитетом ФГБОУ ДПО РМАНПО Минздрава России.
Результаты исследования
На вопрос «Считаете ли Вы действующую модель раннего выявления глаукомы в рамках диспансеризации взрослого населения эффективной?»:
29 врачей (23%) ответили: да, с момента начала проведения диспансеризации увеличился процент выявления глаукомы на ранней стадии;
33 врача (26%) придерживаются мнения, что глаукома стала выявляться чаще, но на поздних стадиях;
64 врача (51%) считают, что диспансеризация остается формальной системой и не работает на практике в принципе.
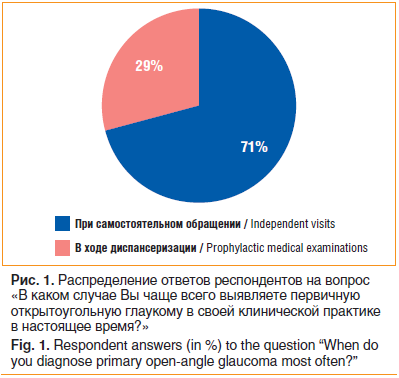
Таким образом, более половины респондентов считают действующую модель раннего выявления глаукомы в рамках диспансеризации взрослого населения формальной и неэффективной. Косвенно об этом также свидетельствует тот факт, что абсолютное большинство врачей-респондентов (89 врачей, 71%) указали, что чаще выявляют глаукому при самостоятельном обращении пациентов по поводу снижения зрения или при подборе очков, а, как известно, задачей диспансеризации является активное выявление заболевания (рис. 1)./
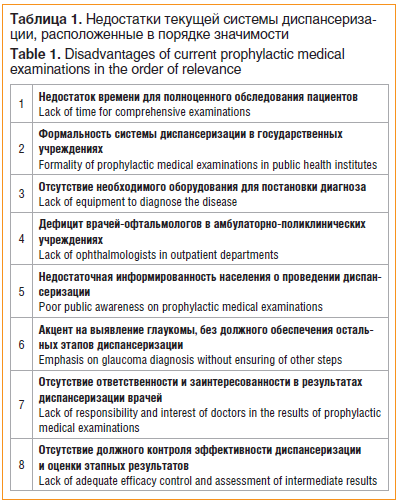
В связи с вышесказанным показательными оказались ответы респондентов на вопрос относительно недостатков текущей системы диспансеризации. Врачам-офтальмологам первичного звена было предложено расположить в порядке значимости недостатки системы диспансеризации больных глаукомой от 1 до 8 (1-е место — самый значимый, 8-е место — наименее значимый). Результаты опроса представлены в таблице 1.
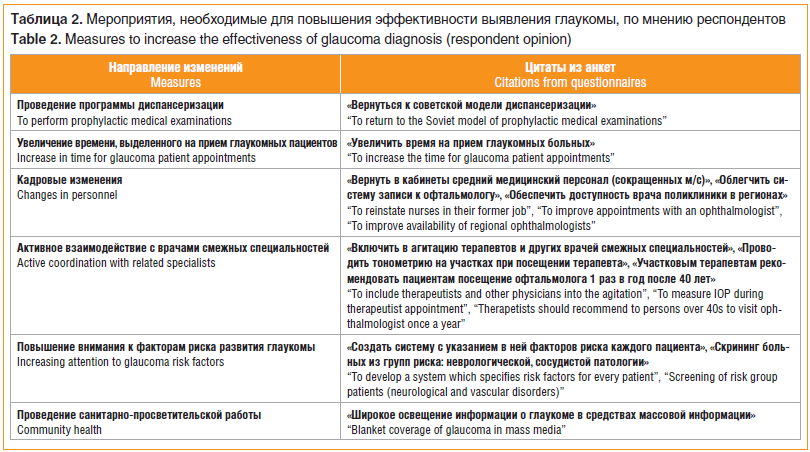
Мы также включили в анкету открытый вопрос касательно путей повышения эффективности выявления глаукомы на ранней стадии на уровне первичного амбулаторно-поликлинического учреждения, на который врачи должны были сами вписать ответ без предложенных нами вариантов. В таблице 2 указаны основные мероприятия по повышению эффективности диспансеризации, предложенные респондентами.
В представленном выше блоке вопросов были рассмотрены аспекты системы диспансеризации в общем виде, далее мы оценивали каждый этап диспансеризации с детализацией недостатков и отношения врачей-респондентов к возможным изменениям в системе диспансеризации.
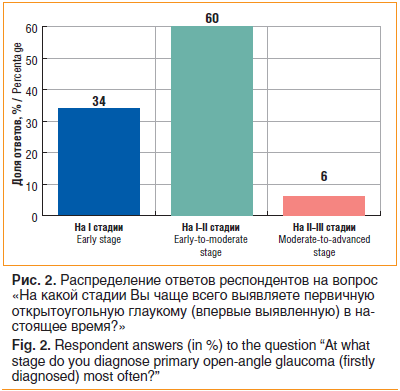
Распределение ответов на вопрос «На какой стадии Вы чаще всего выявляете первичную открытоугольную глаукому (впервые выявленную) в настоящее время?» представлено на рисунке 2.
На вопрос «Считаете ли Вы, что необходимо проводить скрининг глаукомы у всего населения старше 39 лет?»:
92 врача (73%) выбрали из предложенных ответов вариант «да»;
34 врача (27%) отметили вариант «нет», эффективнее проводить скрининг в группах повышенного риска развития глаукомы (наличие родственников с глаукомой, СД и т. д.).
Целевой скрининг позволяет использовать дополнительные исследования при скрининге глаукомы у пациентов с факторами риска развития заболевания, что было отмечено и самими врачами-респондентами в предложениях по совершенствованию системы диспансеризации, но, как видно из представленных ответов, на данный момент врачи придерживаются консервативной позиции относительно охвата скрининга. Массовый скрининг при этом не позволяет использовать расширенный комплекс методов исследований, отношение же врачей-офтальмологов к тонометрии при этом отражено в ответе на следующий вопрос.
Распределение ответов на вопрос «Считаете ли Вы, что введение тонометрии в рамках диспансеризации взрослого населения позволило увеличить выявление глаукомы на ранней стадиив Вашей клинической практике?» приведено на рисунке 3. Менее половины врачей-респондентов считают тонометрию эффективным методом при выявлении глаукомы на ранней стадии.

Обсуждение
Целью данной работы являлся анализ эффективности скрининга глаукомы с поиском неэффективных зон и возможных решений по данным зонам. Но прежде чем перейти к оценке эффективности скрининга глаукомы, необходимо ответить на вопрос: необходим ли скрининг глаукомы? Эффективность и целесообразность использования скрининга определяются критериями Wilson — Junger, сформулированными в 1968 г. и не потерявшими свою актуальность в настоящее время [6]. Подробный анализ вопроса целесообразности скрининга глаукомы был проведен в работе С.А. Рыкова и О.П. Витовской, в которой было доказано, что на современном этапе развития медицины существуют все предпосылки, которые отвечают критериям Wіlson — Junger, для разработки и внедрения программ скрининга глаукомы [8]. Вместе с тем глаукома на данный момент остается тяжелым заболеванием глаза с неясной этиологией и сложными, все еще недостаточно изученными звеньями патогенеза, что обусловливает сложности диагностики заболевания на ранней стадии. Таким образом, с одной стороны, программа скрининга глаукомы необходима, с другой — представляет собой сложную задачу в плане организации [9]. Следует сразу отметить, что в литературе на данный момент нет примера успешно реализованной программы скрининга глаукомы, но есть примеры отдельных решений, доказавших свою эффективность, и именно на этих решениях и возможностях внедрения их в практику мы акцентировали внимание при оценке полученных данных.
Ключевым моментом, определяющим эффективность скрининга, является выбор диагностического теста. Скрининг глаукомы осуществляется с помощью тонометрии — метода измерения уровня внутриглазного давления (ВГД) [2, 5]. В целом хороший скрининговый тест должен обладать следующими качествами: быть дешевым, легким в управлении, надежным, быстрым и точно разграничивающим норму и патологию [6]. Рассмотрим с этих позиций метод скрининга глаукомы: тонометрия является дешевым, легким в управлении и быстрым методом исследования — прибор для пневмотонометрии доступен, исследование неинвазивно и выполняется средним медицинским персоналом, время исследования занимает не более нескольких минут, что позволяет использовать данный метод в рамках массового скрининга. Вместе с тем тонометрия обладает низким процентом воспроизведения и этого метода недостаточно, чтобы отличить норму от патологии. Это связано с тем, что, хотя большинство пациентов с глаукомой и имеют ВГД выше 21 мм рт. ст. (верхняя граница нормы), от 25 до 50% имеют нормальное ВГД, и это состояние называется глаукомой нормального давления, в то же время не все пациенты с уровнем ВГД выше 21 мм рт. ст. имеют глаукому [1–3]. Таким образом, данный метод исследования характеризуется вероятностью как ложноположительных, так и ложноотрицательных ошибок, что говорит о низкой эффективности тонометрии в качестве скринингового метода при выявлении глаукомы. Неэффективность скрининга с использованием тонометрии в качестве единственного или главного скринингового теста при выявлении глаукомы обоснована в многочисленных современных исследованиях [10–13], в т. ч. в обзоре Американской рабочей группы по профилактическим мероприятиям (USPSTF, 2013), в котором были проанализированы данные научных исследований и клинических испытаний наиболее масштабных популяционных исследований [7]. За последнее десятилетие произошло накопление новых данных по патогенезу глаукомы, внедрены современные методы ранней диагностики и мониторинга глаукомы, но в России модель скрининга глаукомы не менялась с 1976 г., когда был издан приказ MЗ СССР № 925 (от 22 сентября) «О мерах по раннему выявлению и активному наблюдению больных глаукомой», в соответствии с которым впервые в истории советского здравоохранения было начато проведение обязательного систематического измерения уровня ВГД всему населению страны в возрасте 39 лет и старше 1 раз в 3 года [2]. Возвращаясь к данным анкетирования врачей-офтальмологов первичного звена, отметим, что меньше половины респондентов (37%) считают действующую модель раннего выявления глаукомы в рамках диспансеризации взрослого населения эффективной. Таким образом, действующая в России модель скрининга глаукомы крайне устарела и требует внедрения современных подходов к повышению эффективности.
По заключению USPSTF, диагностика глаукомы должна проводиться с использованием нескольких тестов, которые при комбинации дают оценку уровня ВГД в сочетании с оценкой структуры и функций зрительного нерва [7]. Но возможна ли реализация подобной модели скрининга глаукомы в рамках массового скрининга? Учитывая ограниченность ресурсов здравоохранения, можно с уверенностью сказать, что нет. Однако это не означат, что от этой модели стоит в принципе отказаться. Как альтернатива во многих развитых странах принята концепция скрининга групп населения с высоким риском развития заболевания (целевой скрининг), что объясняется относительно низкой распространенностью глаукомы в популяции (0,5% среди общего населения) и необходимостью специальных дорогостоящих ресурсов (оборудование и медицинский персонал) [9]. Эффективность целевого скрининга была подтверждена и в обзоре USPSTF [7].
Основой для целевого скрининга являются установленные факторы риска развития заболевания. Для глаукомы основными факторами являются следующие: наследственность (распространение глаукомы среди кровных родственников больных глаукомой в 5–6 раз выше, чем в общей популяции); возраст (глаукома редко возникает в возрасте до 40 лет, а уровень заболеваемости возрастает в старших возрастных группах); артериальная гипертензия; сахарный диабет; органические (атеросклероз) ифункциональные (периферические сосудистые спазмы, мигрень, болезнь Рейно, ночная гипотония, «немая» ишемия) нарушения кровообращения в сосудах головного мозга и в глазничной артерии [1–3]. Возвращаясь к современной модели диспансеризации взрослого населения с хроническими неинфекционными заболеваниями, обратим внимание на то, что одним из нововведений диспансеризации явилось деление на 2 этапа. Первый этап диспансеризации начинается с заполнения анкеты, и задача этого этапа — выявление у граждан признаков хронических заболеваний и факторов риска их развития, среди которых: повышенный уровень артериального давления, дислипидемия, повышенный уровень глюкозы в крови, функциональные нарушения кровообращения в сосудах головного мозга [5]. Если мы вновь обратимся к факторам риска развития глаукомы, то в данном перечне недостает лишь информации о наследственной отягощенности по глаукоме. С нашей точки зрения, включение в анкету вопроса о наличии кровных родственников, страдающих глаукомой, в совокупности с данными по возрасту, наличию сопутствующей сосудистой патологии и сахарного диабета, позволит без значительного усложнения существующей системы сформировать группу риска развития глаукомы, которая на втором этапе будет углубленно осмотрена врачом-офтальмологом. С одной стороны, включение дополнительного вопроса в анкету и формирование целевой группы не требует значительных финансовых затрат при реализации, с другой — пожилой возраст, наличие сопутствующей сосудистой патологии и сахарного диабета являются факторами риска развития не только глаукомы, но и возрастной макулодистрофии и диабетической ретинопатии — основных причин необратимого снижения остроты зрения и слепоты в развитых странах мира, и именно эти пациенты нуждаются в углубленном обследовании у офтальмолога 1 раз в 3 года.
Заключение
Полученные результаты имеют, на наш взгляд, важное значение, т. к. показывают, что в настоящее время глаукома хотя и диагностируется чаще на ранней стадии, но продолжает выявляться преимущественно при самостоятельном обращении пациентов, что указывает либо на недостаточный охват населения диспансеризацией, либо на низкое качество ее проведения. Учитывая лидирующую позицию глаукомы среди причин необратимого снижения зрения и инвалидности, отметим, что механизма пассивного выявления недостаточно, и включение глаукомы в состав приоритетных направлений диспансеризации взрослого населения является оправданным и обоснованным. Однако сама программа диспансеризации больных глаукомой нуждается в кардинальном пересмотре и разработке новых принципов и подходов в решении важнейших задач на этапе скрининга глаукомы. Одним из необходимых базовых решений является переход с модели массового скрининга на модель целевого скрининга. Формирование целевой группы возможно с использованием анкеты первого этапа диспансеризации взрослого населения, при условии включения дополнительного вопроса о наследственной отягощенности по глаукоме. По данным масштабных эпидемиологических исследований, применение расширенного комплекса диагностических методик в группе пациентов с высоким риском развития глаукомы — эффективная альтернатива массовому скринингу, основанному на применении теста с высоким риском ложноотрицательных и ложноположительных ошибок.
Сведения об авторах:
1,2Казанфарова Марина Ажифендиевна — аспирант кафедры офтальмологии, руководитель проектов Фонда международного медицинского кластера, ORCID iD 0000-0001-7401-9538;
1Алексеев Игорь Борисович — д.м.н., профессор, ORCID iD 0000-0002-4506-4986;
3Линденбратен Александр Леонидович — д.м.н., профессор, ORCID iD 0000-0003-3335-7893;
1Кочергин Сергей Александрович — д.м.н, профессор, ORCID iD 0000-0002-8913-822X.
1ФГБОУ ДПО РМАНПО Минздрава России. 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.
2Фонд международного медицинского кластера. 119048, Россия, г. Москва, ул. Усачева, д. 35, стр. 1.
3ФГБНУ «Национальный НИИ общественного здоровья им. Н.А. Семашко». 105064, Россия, г. Москва, ул. Воронцово Поле, д. 12, стр. 1.
Контактная информация: Казанфарова Марина Ажифендиевна, e-mail: a.m.aliverdieva@gmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 15.04.2019.
About the authors:
1,2Marina A. Kazanfarova — MD, postgraduate student, Project Manager of the International Medical Cluster Foundation, ORCID iD 0000-0001-7401-9538;
1Igor B. Alekseev — MD, PhD, Professor, ORCID iD 0000-0002-4506-4986;
3Aleksandr L. Lindenbraten — MD, PhD, Professor, ORCID iD 0000-0003-3335-7893;
1Sergey A. Kochergin — MD, PhD, Professor, ORCID iD 0000-0002-8913-822X.
1Russian Medical Academy of Continuous Professional Education. 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation.
2 The International Medical Cluster Foundation. 35–1, Usachev str., Moscow, 119048, Russian Federation.
3N.A. Semashko National Research Institute of Public Health. 12–1, Vorontsovo Pole str., Moscow, 105064, Russian Federation.
Contact information: Marina A. Kazanfarova, e-mail: a.m.aliverdieva@gmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 15.04.2019.
Источник