Глаукома операция фильтрационная подушка
Глаукома: симптомы болезни
К сожалению, больные замечают у себя наличие глаукомы лишь после того, как часть зрительного нерва уже необратимо поражена. Указанием на наличие глаукомы могут послужить слепые пятна по краям поля зрения, со временем всё больше и больше увеличивающиеся.
Но и их часто замечают очень поздно, потому что второй глаз и мозг вначале компенсируют данную потерю функции. При отсутствии лечебных мер глаукома может привести к слепоте.
Заболевание часто диагностируют слишком поздно ещё и потому, что оно, как правило, проходит безболезненно. Только при одной редкой форме закрытоугольной глаукомы сильные боли в глазу, головные боли и покраснение глаза могут послужить указаниями на то, что орган зрения не здоров и необходимо обратиться к хирургу-офтальмологу.
Глаукома: диагностика
Для установления и подтверждения диагноза «глаукома» необходимо провести несколько взаимодополняющих мер.
Измерение внутриглазного давления
При подозрении на глаукому врач-офтальмолог вначале измеряет внутриглазное давление, поскольку оно является одним из решающих факторов для развития глаукомы. Однако одной этой меры не достаточно, поскольку многие виды этого заболевания могут остаться невыявленными: глаукома часто сопровождается нарушением оттока водянистой влаги с последующим повышением внутриглазного давления, однако не всегда.
Если ограничиваться лишь одним методом обследования – измерением внутриглазного давления, то почти половина заболеваний глаукомой выявлено не будет.
Обследование щелевой лампой
Помимо измерения внутриглазного давления глаз исследуют при помощи так называемой щелевой лампы. При этом глаз осматривают через щелевую лампу, действующую, как микроскоп.
Возможно, что врач (хирург-офтальмолог) перед этим закапает в глаз медикамент, чтобы вызвать расширение зрачка. Специальный ход лучей света щелевой лампы позволяет провести через глаз оптический разрез.
Таким образом можно сделать точную оценку местоположения и обширности изменений различных структур глаза. Для установления наличия глаукомы особенное внимание уделяют участку, в котором зрительный нерв выходит за пределы глаза (диск зрительного нерва).
На основании осмотра с щелевой лампой врач может установить, повреждён ли зрительный нерв. Если пациентам были закапаны капли для расширения зрачка, им после окончания обследования несколько часов нельзя водить машину.
Измерение поля зрения (периметрия)
Ещё один метод подтверждения диагностики глаукомы – измерение поля зрения, так называемая периметрия. Этот метод позволяет распознать типичные для глаукомы нарушения поля зрения.
Ещё небольшие нарушения по краям поля зрения, которые пациенты ещё не замечают, с помощью данного обследования уже могут быть выявлены. Однако следует помнить, что нарушения в поле зрения часто наступают по прошествии нескольких лет после повреждения зрительного нерва, поэтому описанный выше осмотр с щелевой лампой необходим.
Дополнительные обследования
К ним относятся измерение толщины роговицы, трёхмерное измерение диска зрительного нерва при помощи так называемой ретинотомографии (трёхмерное изображение диска зрительного нерва) и так называемая когерентная томография глаза. Ретинотомография и когерентная томография глаза важны и для последующего врачебного наблюдения глаукомы.
Глаукома: лечение без операции
Многим пациентам с глаукомой можно помочь с помощью глазных капель (антиглаукоматозные средства). В прошлом применялись прежде всего бета-блокаторы, которых, правда, заменили более новые и специфические медикаменты.
Среди новых антиглаукоматозных средств это, как правило, так называемые простагландины и альфа-антагонисты. Обе названные группы веществ очень эффективно понижают внутриглазное давление.
Ещё одна используемая группа веществ – так называемые локально действующие ингибиторы карбоангидразы, которые, помимо снижения давления, улучшают нарушенное кровоснабжение заднего отдела глазного яблока.
Даже если закрытоугольная глаукома представляет собой неотложный случай, вначале предпринимается попытка понизить внутриглазное давление с помощью лекарственных препаратов. Лишь когда это не приносит результатов, назначается операция по удалению глаукомы.
Только при врождённой глаукоме операцию назначают сразу же. При вторичной глаукоме всегда должно проводиться параллельное лечение основного заболевания.
Операция по удалению глаукомы
Если одно медикаментозное лечение глаукомы не приводит к достаточному снижению внутриглазного давления, для лечения глаукомы обращаются к офтальмологической хирургии.
Операция при глаукоме: метод
Если при глаукоме внутриглазное давление не может быть в достаточной мере понижено медикаментозным способом, при помощи операционного вмешательства на радужной оболочке создаётся компенсация давления между передней и задней камерами глаза.
Кроме того, операция при глаукоме препятствует повторной блокаде при оттоке водянистой влаги: создаётся искусственный сток для водянистой влаги, чтобы после операции внутриглазное давление не могло снова повыситься.
Как правило, операция при глаукоме осуществляется под местным наркозом и может быть проведена абмулантно.
В арсенале офтальмологической хирургии имеются специальные методы с использованием лазера, снижающие внутриглазное давление при глаукоме. Однако их действие часто незначительно и непродолжительно.
Операция при глаукоме: послеоперационное лечение
На прооперированный глаз накладывают мазевую повязку. Важно прооперированный глаз ни в коем случае не тереть и не оказывать на него механического давления. Кроме того, в первые дни после операции нельзя перенапрягать прооперированный глаз длительным чтением или смотрением телевизора. Также в первое время после операции катаракты следует избегать физических нагрузок и не посещать сауну.
Операция при глаукоме: осложнения
Операция по удалению глаукомы предполагает предварительное обследование пациента, анализы, осмотр ротовой полости. На подготовительном этапе крайне важно выявить очаги инфекции (острые респираторные заболевания, больные зубы), чтобы устранить их до начала оперативного вмешательства.
Хирургическая операция глаукомы проводится под местным наркозом с применением лидокаина и адреналина для усиления обезболивающего действия и уменьшения потери крови.
В медицинской практике применяют различные методы хирургического вмешательства при глаукоме. выбор конкретного способа зависит от:
- формы заболевания глаукомы;
- показтелей здоровья пациента;
- показателя внутриглазного давления;
- легкости оттока влаги.
Операция глаукомы лазером отличается высокой эффективностью, что подтверждается многочисленными случаями успешного лечения. Проводят лазерную терапию в случаях, когда заболевание находится на начальной стадии и дистрофические изменения зрительного нерва не сильно выражены.
Чтобы глаукома после операции перестала проявляться и процесс восстановления прошел в максимально сжатые сроки, необходимо соблюдать рекомендации врача.
При глаукоме операция последствия дает, в основном, положительного характера, если соблюдать все рекомендации лечащего врача. Вскоре после оперативного вмешательства основные признаки заболевания исчезают, роговица глаз заживает.
Чтобы избежать негативных последствий следует избегать физического и зрительного перенапряжения, соблюдать диету, щадящий режим и принимать назначенные врачом лекарственные препараты.
Негативные последствия после операции глаукомы наблюдаются примерно в 20,0% случаев и связаны они, в основном, с упущениями во время операции, несоблюдением режима во время реабилитационного периода, а также вследствие наличия у пациента противопоказаний, на которые предварительно не обратили внимание.
хирургическая иридэктомия — процедура, во время которой удаляется часть радужки;лазерная иридотомия — пробивание в радужке с помощью лазерного луча отверстия, через которое жидкость свободно перемещается между камерами.
Такие процедуры применяют на обоих глазах в следующих случаях:
- при острых приступах глаукомы;
- при обнаружении узкого угла фильтрации с угрожающей возможностью его закрытия;
- во всех случаях, когда грозит закрытие угла фильтрации.
При открытоугольной глаукоме операция проводится в тех случаях, когда консервативная терапия не принесла ожидаемых результатов. По сравнению с закрытоугольной, такой вид глаукомы поддается лечению, в том числе, и хирургическим путем, гораздо легче.
Основная задача, которую преследуют при хирургическом вмешательстве состоит в формировании новых каналов оттока водянистой жидкости. При некоторых видах оперативного лечения открывают старые протоки для движения внутриглазной жидкости.
У пожилых людей с набором хронических заболеваний существует риск того, что дистрофические процессы продолжаться, вследствие чего понадобиться повторная операция.
Самые сложные офтальмологические операции путем обычной или лазерной микрохирургии выполняют специалисты медицинского центра имени С. Федорова в Москве. К услугам пациентов комфортные условия, отсутствие очередей, современные медицинские технологии и доступные цены.
Глаукома: профилактика
В принципе, каждый человек может заболеть глаукомой, вовремя этого не заметив. Поэтому защитить от развития этого заболевания могут только профилактические обследования у офтальмолога.
К сожалению, это делается всё ещё слишком редко, потому что общественность недостаточно проинформирована об опасностях развития глаукомы. Профилактические обследования приобретают ещё больший вес, если помнить, что вызванные глаукомой повреждения даже после проведённой операции останутся необратимыми.
Целью операции при глаукоме может быть только сохранение ещё имеющейся зрительной способности и предотвращение наступления слепоты. Профилактические обследования включают все обследования, которые проводятся и для диагностики болезни, и описаны ниже, в соответствующем отрывке. К сожалению, больничные кассы ещё не оплачивают стоимость данных обследований. Она составляат около 20 евро.
Кому особенно важно проходить профилактические обследования?
Профилактические обследования особенно важны для людей с наличием факторов риска развития глаукомы. К ним относятся люди старше 40 лет, в семье которых уже были случаи заболевания этой болезнью, люди с близорукостью (с диоптриями выше, чем -5), больные сахарным диабетом со значительными изменениями глазного дна и люди с нарушением кровообращения.
К последним относятся также те, у кого значительно понижено кровяное давление.
Как часто следует проходить профилактические обследования?
Если первое обследование не выявило симптомов глаукомы, следующее обследование можно проводить через 3 года, если Ваш возраст не превышает 65 лет. Пожилым людям старше этого возраста следует проверяться каждые 1-2 года, даже если первое обследование не выявило отклонений от нормы.
Источник
Резюме
Цель: охарактеризовать виды фильтрационных подушек (ФП), оценить корреляцию уровня внутриглазного давления (ВГД) и дисфункции ФП в различные периоды послеоперационного наблюдения, разработать схему лечебно-реабилитационных мероприятий, направленных на адекватное формирование путей оттока внутриглазной жидкости (ВГЖ) после фистулизирующих антиглаукомных вмешательств (ФАВ).
Цель: охарактеризовать виды фильтрационных подушек (ФП), оценить корреляцию уровня внутриглазного давления (ВГД) и дисфункции ФП в различные периоды послеоперационного наблюдения, разработать схему лечебно-реабилитационных мероприятий, направленных на адекватное формирование путей оттока внутриглазной жидкости (ВГЖ) после фистулизирующих антиглаукомных вмешательств (ФАВ).
Методы: проспективное исследование с участием пациентов после ФАВ. Проведены ультразвуковая биомикроскопия путей оттока ВГЖ, биомикроскопическая оценка ФП, определение уровня офтальмотонуса через 5 сут, 1, 3, 6, 12 и 24 мес. после операции.
Результаты: охарактеризованы типы ФП у 450 пациентов после ФАВ. Проанализированы экстремы декомпенсации ВГД и состояние путей оттока ВГЖ по данным ультрабиомикроскопического (УБМ) мониторинга и биомикроскопии в сроки до 6 и более мес. послеоперационного периода. Систематизирована схема лечебно-реабилитационных мероприятий, направленных на адекватное формирование путей оттока ВГЖ, в зависимости от сроков послеоперационного периода и причин дисфункции ФП с учетом фаз процесса заживления операционной раны.
Выводы: процесс формирования путей оттока ВГЖ после антиглаукомных операций носит длительный и многоэтапный характер. Основополагающим в определении тактики ведения пациентов после ФАВ наряду с уровнем офтальмотонуса должна быть оценка состояния ФП и всех зон путей оттока по данным УБМ. Своевременные, патогенетически обоснованные лечебно-реабилитационные мероприятия позволяют повысить эффективность антиглаукомных операций и избежать повторного назначения гипотензивной терапии или проведения повторных хирургических антиглаукомных вмешательств.
Ключевые слова: антиглаукомные фистулизирующие операции, дисфункция фильтрационной подушки, пути оттока внутриглазной жидкости, ультрабиомикроскопический мониторинг, заживление, алгоритм лечебных мероприятий.
Abstract
Dysfunction of filtering bleb.
Diagnostics, strategy of treatment
Volkova N.V.*, Yureva T.N. **, Malysheva Yu.V.
Irkutsk Branch of Eye Microsurgery Federal State Institution named after S.N. Fyodorov,
*Irkutsk State Medical University,
**Irkutsk State Medical Academy of Postdiploma Education
Purpose: to characterize the types of filtering blebs, to evaluate the correlation of level of IOP and dysfunction of filtering blebs at the different periods of follow-up, to develop the schema of treatment and rehabilitation, directed to adequate formation of intraocular fluid outflow pathways after fistulizing antiglaucomatous surgery (FAS).
Methods: patients after fistulizing antiglaucomatous surgery were enrolled into the prospective study. UBM of intraocular fluid outflow pathways, biomicroscopy of filtering blebs, definition of IOP level in 5 days, 1, 3, 6, 12 and 24 months after surgery were performed.
Results: the types of filtering blebs were defined in 450 patients after the FAS . The peaks of IOP levels and condition of intraocular fluid outflow pathways according to UBM and biomicroscopic data were analyzed during 6 months and longer in postoperative period. The scheme of treatment and rehabilitation activities aimed at the adequate formation of intraocular fluid outflow pathways, depending on the duration of postoperative period and causes of dysfunction of filtering blebs considering phases of the process of the surgical wound healing was created.
Conclusion: the process of intraocular fluid outflow pathways formation after antiglaucomatous surgery is characterised as a long and multi-stage one. UBM definition of filtering bleb condition and of all zones of outflow pathways should be fundamental factor in determination in assessment of tactics of patient’s treatment after fistulazing antiglaucomatous surgery. On-time and pathogenically proved treatment and rehabilitation measures allow improving the efficiency of antiglaucomatous surgery and avoiding a restart of the antihypertensive therapy or repeated glaucoma surgery.
Key words: antiglaucomatous fistulizing surgery, dysfunction of filtering bleb, intraocular fluid outflow pathways, UBM monitoring, healing, algorithm of therapeutic measures.
Актуальность
Среди методов лечения глаукомы ФАВ составляют, по данным разных авторов, от 19,28 до 37,35% в зависимости от стадии процесса [3]. Однако к 1 году послеоперационного периода их эффективность снижается до 90%, а в сроки 5-летнего наблюдения составляет лишь 60–65% [2, 4].
Залог длительного функционирования хирургически сформированных путей оттока ВГЖ – это адекватно сформированные внутренняя фистула (ВФ), интрасклеральный канал (ИСК) и ФП. При прочих равных условиях аваскулярная, разлитая и реагирующая на транспальпебральный массаж ФП является обязательным условием длительного функционирования путей оттока ВГЖ. Однако несмотря на простоту и доступность осмотра, оценка состоятельности ФП, особенно в ранние послеоперационные сроки, представляет большие трудности. Это обусловлено отсутствием в раннем послеоперационном периоде прямой корреляции между уровнем ВГД и «дисфункцией» ФП, большой вариабельностью видов ФП и отсутствием единой, принятой к использованию классификации.
Цели исследования:
1) охарактеризовать наиболее часто встречающиеся виды ФП по данным биомикроскопии и УБМ мониторинга;
2) оценить корреляцию между «дисфункцией» ФП и уровнем ВГД;
3) на основании полученных результатов систематизировать стратегию реабилитационных мероприятий при «дисфункции» ФП.
Методы
Под наблюдением находились 450 пациентов после ФАВ. Помимо стандартного офтальмологического обследования при каждом визите всем пациентам проводились биомикроскопия с фоторегистрацией переднего сегмента глазного яблока и ФП, гониоскопия, тонометрия по Маклакову (Рt), а также УБМ-мониторинг состояния путей оттока ВГЖ в сроки наблюдения 3–5 сут, 1, 3 и 6 мес. послеоперационного периода. Исследование проводилось на аппарате UBM Hi-scan Opticon по разработанной в Иркутском филиале МНТК «Микрохирургия глаза» оригинальной УБМ-классификации [1].
Результаты и обсуждение
В основу характеристики ФП заложены эхогенная плотность ткани на УБМ-сканограмме и соответствие этого показателя биомикроскопической картине. Варианты эхогенности определены по акустической плотности содержимого ФП относительно плотности склеры (как ткани, имеющей максимальную плотность на ультразвуковых сканах глаза) [1, 6]. Динамический мониторинг определил варианты патологических и адекватно сформированных ФП. При этом оценка ФП не исключала характеристику ИСК и ВФ.
Выделены патологические ФП:
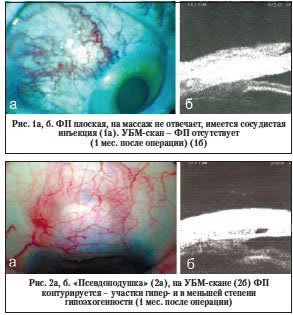
1-й тип – отсутствует. Биомикроскопически в области вмешательства ФП не контурируется, возможно наличие сосудистой инъекции в области операционного доступа. На УБМ-сканограмме ФП не определяется (рис. 1).
2-й тип – «псевдоподушка». Биомикроскопически определяются плоская, локальная ФП, отек и инъекция конъюнктивы вокруг склерального лоскута, на транспальпебральный массаж ФП не отвечает (рис. 2а). При проведении УБМ дифференцируется плотное гиперэхогенное содержимое в проекции ФП (рис. 2б).
3-й тип – плоская ФП (рис. 3а, б) биомикроскопически схожа со 2-м типом ФП, но отвечает на транспальпебральный массаж, на сканограммах имеет гипо- и в меньшей степени гиперэхогенную структуру.
4-й тип – крупнокистозные (солитарные) ФП (рис. 4). Эти ФП биомикроскопически имеют вид однокамерного образования истонченной конъюнктивы, ограниченного подковообразным рубцом, при транспальпебральном массаже увеличиваются по высоте, но не разливаются по площади. В раннем послеоперационном периоде возможна выраженная сосудистая инъекция конъюнктивы.
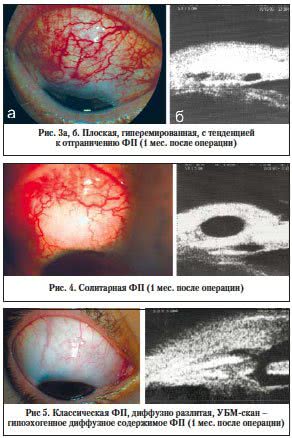
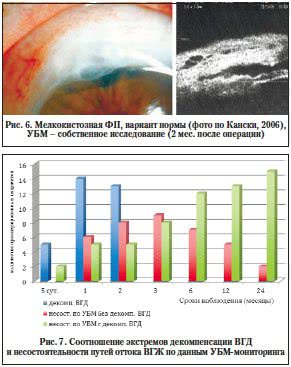
Среди адекватно сформированных ФП выделены два типа: 5-й – мелкокистозная и 6-й – классическая (рис. 5, 6).
Эти ФП имеют схожую картину при биомикроскопическом исследовании, характеризуются пологими краями, отсутствием четкой границы с окружающей бульбарной конъюнктивой, равномерно разливаются на транспальпебральный массаж. На УБМ-сканограммах содержимое аэхогенное или диффузное гипоэхогенное.
В отличие от классических (6-й тип) мелкокистозные (5-й тип) ФП имеют вид многокамерных образований и также равномерно разливаются в ответ на массаж. На УБМ-сканах визуализируются тонкостенные кисты с а- и гипоэхогенным содержимым. Однако этот тип ФП, несмотря на отнесение его к варианту нормы, имеет потенциальную возможность развития наружной фильтрации и инфицирования, что требует динамического наблюдения за пациентами даже в отдаленном послеоперационном периоде.
Необходимо отметить, что УБМ-мониторинг наряду с биомикроскопической характеристикой ФП позволяет определить клинические признаки неадекватного течения отдельных фаз процесса послеоперационного заживления [9, 10]. На УБМ-сканограммах наличие гипо- и гиперэхогенных включений в период со 2-х по 25 сут процесса заживления, на наш взгляд, свидетельствует об активности компенсаторного ангиогенеза и избыточной генерации грануляционной ткани. Клинически это проявляется формированием одного из типов «патологических» ФП, что требует проведения активных реабилитационных мероприятий. В отдаленном периоде (от 2-х и более мес. с момента операции) затяжное течение фазы ремодуляции рубца, сопровождающееся ангиогенезом, гипертрофией и возможным последующим гиперрубцеванием, также является признаком неадекватного морфогенеза вновь образованных путей оттока ВГЖ, приводящего к облитерации зон, что требует дальнейшей реабилитации и динамического наблюдения в течение 6 и более мес. после операции [5].
При анализе экстремов декомпенсации ВГД и состоятельности путей оттока по данным УБМ получены следующие данные (рис. 7).
В 32 случаях (7,1%) в разные сроки после операции выявлена декомпенсация офтальмотонуса. У 5 пациентов декомпенсация ВГД на 5-е сут послеоперационного периода возникла в результате механической блокады ВФ (геморрагический сгусток, блокада корнем радужки) и была ликвидирована адекватной терапией, включающей противовоспалительное, рассасывающее лечение и лазерную локальную иридопластику. Лишь в 2-х случаях в этот период выявлена несостоятельность путей оттока ВГЖ, связанная с неадекватным течением воспалительного процесса и рефрактерным характером глаукомы, что подтверждалось данными УБМ и формированием 1-го типа ФП. В сроки 1 мес. после операции офтальмогипертензия наблюдалась у 14 пациентов (3,1%), а в сроки 2 мес. – еще у 13 (2,9%). В этих случаях декомпенсация офтальмотонуса также явилась следствием затяжного течения фазы воспаления. Клинически данное состояние проявлялось гиперемией, отеком ткани ФП, общей ирритацией и клеточной реакцией во влаге передней камеры в виде феномена Тиндаля 1–2 степени. Возможными причинами этого являются избыточная генерация медиаторов воспаления и факторов роста в фазе альтерации [7, 8, 11], а также нарушение проницаемости гематоофтальмического барьера, что требует дальнейшего изучения. Однако подобная клиническая картина не сопровождалась патологической УБМ-симптоматикой, и ВГД удавалось нормализовать на фоне противовоспалительной терапии.
Наибольшие трудности в определении тактики послеоперационного ведения вызвала группа пациентов (40 человек, 8,9%) с еще нормальным уровнем ВГД, но уже с признаками несостоятельности путей оттока ВГЖ по данным УБМ и «дисфункции» ФП. УБМ-сканограммы данной группы характеризуются прогрессирующей облитерацией ИСК, уплощением ФП и формированием гиперэхогенного содержимого в этих структурах. При этом «дисфункция» ФП еще не сопровождается декомпенсацией офтальмотонуса в течение продолжительного времени (до 2–3 и даже 6 мес.).
Наиболее понятной и не вызывающей трудностей в диагностике причин «дисфункции» ФП явилась группа пациентов (60 человек, 13,3%), у которой активный фибропластический процесс в ИСК и ФП подтверждался данными УБМ-мониторинга и сопровождался декомпенсацией офтальмотонуса.
Таким образом, результаты исследования позволили выявить клинические особенности течения послеоперационного заживления, подтвердили длительность и многоэтапность формирования путей оттока ВГЖ [1, 6, 12].
В целом определение тактики ведения пациентов после ФАВ должно основываться на комплексной оценке послеоперационного уровня ВГД, биомикроскопической характеристике ФП, а также данных УБМ-мониторинга путей оттока ВГЖ.
Результаты исследования позволили систематизировать схему лечебно-реабилитационных мероприятий с целью управления фазами процесса заживления операционной раны в случае нарушения последовательности и длительности их течения. Кроме того, современная офтальмохирургия требует назначения современных фторхинолонов за 1 сут и в течение 10–14 дней после операции даже в случае стандартного течения послеоперационного периода. Одним из таких препаратов является фторхинолон широкого спектра действия с минимальным токсическим эффектом – левофлоксацин 0,5% (глазные капли Офтаквикс). Назначение противовоспалительных агентов зависит прежде всего от клинической картины в зоне формирования путей оттока. Так, в фазе воспаления, сопровождаемой в т. ч. транзиторной офтальмогипертензией, патогенетически обоснованным является назначение ингибиторов каскада воспалительных реакций: глюкокортикоидов (ГК), нестероидных противовоспалительных препаратов (НПВС), антигистаминных агентов [7]. При первых признаках активного ангиогенеза и фиброплазии при формировании патологической ФП, помимо вышеперечисленных лечебных мероприятий, целесообразно выполнение нидлинга ФП с глюкокортикоидами, ингибиторами ангиогенеза [8, 11], субконъюнктивальных инъекций антиметаболитов, проведение лазерного сутуролизиса или механической сутуротомии, а также назначение физиопроцедур и транспальпебрального массажа глазного яблока. В фазе ремодуляции рубца дополнительно к вышеперечисленным лечебным мероприятиям выполняется неоднократный нидлинг ФП, назначаются ферментотерапия, физиолечение и транспальпебральный массаж.
Клинический пример № 1
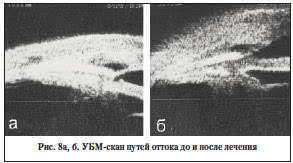
Пациент В., 51 год, 1 мес. после непроникающей глубокой склерэктомии (НГСЭ), уровень ВГД – 19 мм рт. ст. По данным УБМ ФП плоская, содержимое гиперэхогенно, ИСК слабо сообщается с ее полостью (рис. 8а). По данным биомикроскопии – 3-й тип ФП (рис. 3). Несостоятельность путей оттока и «дисфункция» ФП не сопровождаются декомпенсацией офтальмотонуса. Непроникающее вмешательство явилось показанием к выполнению лазерной десцеметогониопунктуры (ДГП). Гиперемия, отек тканей и гиперэхогенный характер содержимого ФП по УБМ явились показаниями к нидлингу ФП и назначению транспальпебрального массажа. При этом пациент постоянно в течение 2 мес. получал инстилляции ГК, НПВС, антигистаминных препаратов. Через 2 мес. после лечения сформировалась классическая ФП, Рt=17 мм рт. ст., а на УБМ-сканограмме визуализировался ИСК, сообщающийся с полостью ФП, содержимое обеих структур гипоэхогенно (рис. 8б). Рекомендовано продолжить транспальпебральный массаж 2 р./день, контроль в динамике через 3 мес.
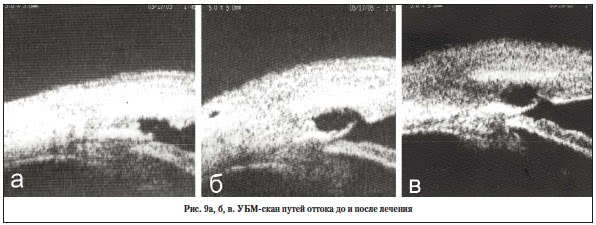
Клинический пример № 2
Больной Е., 60 лет, 2 мес. после НГСЭ и лазерной ДГП в сроки 1 мес. после операции, уровень ВГД – 27 мм рт. ст. Биомикроскопически – «псевдоподушка», на УБМ-скане ИСК не сообщается с ФП, содержимое полостей гиперэхогенно (рис. 9а). Учитывая декомпенсацию ВГД и дисфункцию ФП, показано проведение комплекса реабилитационных мероприятий. Выполнен неоднократный нидлинг ФП, назначен массаж, дополнительно – рассасывающее лечение. На этом фоне ВГД снизилось до 16 мм рт. ст., динамика УБМ-скана демонстрировала изменение высоты и характера содержимого полостей ИСК и ФП (рис. 9б, в), что биомикроскопически соответствовало формированию классической ФП.
Таким образом, предлагаемая к практическому использованию оценка путей оттока и ФП после ФАВ, включающая данные биомикроскопии и морфогенеза по результатам УБМ-сканирования, позволяет диагностировать их неадекватное формирование даже при референтных значениях офтальмотонуса. В нашем исследовании неадекватное формирование путей оттока (в т. ч. с/без декомпенсации ВГД) констатировано в 129 случаях (28,7%). Однако правильная оценка морфогенеза с учетом сроков и фаз процесса заживления в процессе мониторинга, а также своевременное и патогенетически обоснованное лечение позволили повысить эффективность хирургического лечения глаукомы. В сроки наблюдения до 3-х лет необратимые рубцовые трансформации возникли лишь в 35 случаях (7,8%), еще в 3 случаях (0,7%) понадобилось дополнительное гипотензивное лечение в более ранние сроки.
Следовательно, предлагаемая к использованию в клинической практике комплексная оценка состояния путей оттока ВГЖ и «дисфункции» ФП позволяет своевременно диагностировать их неадекватное формирование, провести комплекс лечебных мероприятий и пролонгировать гипотензивный эффект фистулизирующих вмешательств при глаукоме.
Литература
1. Волкова Н.В., Юрьева Т.Н., Щуко А.Г. и др. Классификация путей оттока внутриглазной жидкости после фистулизирующих антиглаукоматозных операций // Глаукома. 2008. №3. С. 16–20.
2. Волкова Н.В., Щуко А.Г., Малышев В.В. Ретроспективный анализ факторов риска развития рубцовых изменений путей оттока внутриглазной жидкости после фистулизирующих антиглаукоматозных операций // Глаукома. 2010. № 3. С. 35–40.
3. Егоров Е.А., Куроедов А.В. Отдельные клинико-эпидемиологические характеристики глаукомы в странах СНГ и Грузии. Результаты многоцентрового открытого ретроспективного исследования // Клиническая офтальмология. 2012. № 1. С. 21.
4. Курышева Н.И., Марных С.А., Борзинок С.А. Применение физиологических регуляторов репарации в хирургии глаукомы (клинико-иммунологическое исследование) // Вестник офтальмологии. 2005. № 6. С. 21–25.
5. Юрьева Т.Н., Волкова Н.В. Алгоритм реабилитационных мероприятий на этапах формирования путей оттока после непроникающей глубокой склерэктомии // Офтальмохирургия. 2007. № 4. С. 67–71.
6. Kreiger A.E. Ultrasound biomicroscopy of sclerotomy sites // Ophthalmology. 2001. Vol. 108, No. 7. P. 1175–1176.
7. Chang L., Crowston J.G., Cordeiro M.F. et al. The role of the immune system in conjunctival wound healing after glaucoma surgery // Surv. Ophthtalmol. 2000. Vol. 45. P. 49–68.
8. Choi J.Y., Choi J., Kim Y.D. Subconjunctival bevacizumab as an adjunct to trabeculectomy in eyes with refractory glaucoma: a case series // Korean J. Ophthalmol. 2010. Vol. 24. No. 1. P. 47–52.
9. Seibold L.K., Sherwood M.B., Kahook M.Y. Wound Modulation after filtration surgery // Survey of ophthalmology. 2012. Vol.57, N 6. P. 530–550.
10. Shaaramy T.M., Sherwood M.B., Hitchings R.A. et al. Glaucoma. Philadelphia: Saunders Elsevier, 2009. 540 p.
11. Siriwardena D., Knaw P.T., King A.J. et al. Human antitransforming growth beta monoclonal antibody — a new modulator of wound healing in trabeculectomy: a randomized placebo controlled clinical study // Ophthalmology. 2002. Vol. 109. P. 427–431.
12. Palmberg P. The failing filtering bleb // Ophthalmology clinics of North America. 2000. Vol. 13. N 3. P. 517–529.
Источник


