Глаукома дистрофия зрительного нерва
Я хочу обратиться к доктору Я.В. Пронину. Я сделала операцию 16.12.2008 г. по поводу катаракты, и начались мои мучения. Перед операцией я получила журнал, где вы описали, что такое катаракта, в чем заключается операция по ее удалению, и дали советы, что делать после операции. Я сделала мед, изюм, орех. А как помочь сетчатке, чтобы она заработала? Какие нужны травы? На сегодняшний день я правым глазом ничего не вижу. Закапывала лекарства, которые были прописаны, а с 5 марта доктор их отменил.
Четвертого февраля я лежала еще в больнице (мне лазером прибили сетчатку), и мне сообщили, что трагически погиб муж. Как все переношу — не описать. Мне 57 лет.
С Галина Александровна,
г. Томск
Уважаемые читательницы, к сожалению, вынужден повторить то, о чем писал. Методов полноценного восстановления нейроэпителия сетчатки и пораженного зрительного нерва в мировой медицине пока нет. Все методики официальной и народной медицины направлены на сдерживание дистрофических процессов. Иногда удается добиться
достаточно длительной ремиссии. Поэтому вам, Людмила Васильевна, рекомендую регулярно принимать сборы лекарственных трав с целью сохранения зрения. Очень полезен следующий сбор:
берем равные части цветков пижмы, хвощ полевой, спорыш, лист березы, подорожника. Все смешать, измельчить. 2 ст. ложки сбора поместить в термос, залить 3 стаканами кипятка, настаивать 6 часов. Процедить, принимать по 150 мл за 20 минут до еды три раза в день. Курс — две недели, перерыв не менее месяца. По поводу очков Панкова в специальной офтальмологической литературе никаких данных не нашел.
Вопрос Галины Александровны гораздо более сложный и тяжелый. Судя по выписке, состояние правого глаза крайне проблематичное. Здесь необходимы терпение и надежда. Все решится после удаления силикона, что проводится через 5-6 месяцев после операции. Крайне важно сохранение зрения левым глазом, а так как у вас диагностирована глаукома левого глаза (ОУГ 1а), необходимы постоянный контроль ВГД и регулярные закапывания антитлаукоматозных средств под наблюдением окулиста.
Лечение дистрофии сетчатки и зрительного нерва
Лечение ВМД (возрастная макулярная дегенерация) крайне сложно, основным принципом должно быть регулярность и постоянство, и проводиться оно должно врачом-офтальмологом. Что же может добавить народная медицина в помощь официальной?
В питании — увеличение доли растительной пищи, ежедневно салаты из свежих овощей с растительным маслом, по возможности ежедневно овощные соки (удачный пример — сок «Тонус — овощная смесь»). Можно приготовить самим. По 1 стакану соков моркови, красной свеклы, яблочного и апельсинового, добавить 1 стакан меда (диабетикам не надо). Хранить в прохладном, темном месте. Принимать по полстакана 2 раза в день до еды 14 дней, перерыв 2 недели, и курс можно повторить. Вариантов много, подберите для себя по возможности и по вкусу.
Для профилактики и лечения склероза сосудов сетчатки:
по 100 г пустырника, цветков боярышника и омелы. Тщательно измельчить, смешать. 2 ст. ложки сбора залить 2 стаканами кипятка, настаивать 4 часа, процедить. Принимать по 100 г 4 раза в день до еды 3 недели, отдых не менее 1 недели и курс повторить. Хороший эффект дает применение местно в виде глазных капель:
рыбий жир, раствор витамина А и Е, облепиховое масло {что-то одно) по 1-2 капли 2 раза в день в оба глаза. 1 месяц капать, 1 месяц отдых.
Или (главное, чтобы не было аллергий на компоненты):
в равных частях смешать сок алоэ, мед, воду для инъекций. Хранить в темном, прохладном месте. Закапывать по 1 капле 2 раза в день в оба глаза. 1 месяц капать, 1 месяц отдыхать.
Или в 10 мл раствора йодистого калия 3% (готовится в аптеке) добавить 5 мл отвара ромашки лекарственной и 1 мл меда. Смешать, хранить в темном и прохладном месте. Закапывать по 1 капле в каждый глаз 3 раза в день. 1 месяц капать, 1 месяц отдых.
Доступные средства профилактики и борьбы с глаукомой
Полноценное здоровое питание с резким ограничением соли, жирной и острой пищи. Ежедневно салаты из свежих овощей — простейший рецепт:
белокочанная капуста, мелко нашинкованная, морковь натереть на терке, взять того и другого в равных пропорциях, небольшой пучок укропа мелко порубить (летом — свежий, зимой можно заменить сушеным или семенами укропа) и чуть-чуть растительного масла. Очень вкусно и полезно.
Конечно, гимнастика для глаз. Методик — огромное множество, все восходят корнями к древнеиндийскому трактату «йога для глаз». Главное — регулярность и постоянство, минимум 3 раза в день по 10-15 минут.
К более специфическим средствам относятся следующие рекомендации:
— избегать воздействия прямых солнечных лучей; ношение очков с зеленым стеклом, так как зеленый цвет способствует нормализации ВГД. В настоящее время выпускаются специальные спектральные линзы (для работы с компьютером, «антифарные» для водителей), в том числе и специальные линзы для больных глаукомой;
— ограничение приема жидкостей на ночь;
— прием следующих травяных сборов при компенсированной глаукоме с нормальным ВГД:
буквица — 100 г, омела — 100 г, эфедра — 75 г. 1 ст. ложку мелко измельченного сбора с вечера положить в термос и залить 400 мл кипятка. Утром процедить. Принимать по 100 г 4 раза в день перед едой. Месяц принимать. Месяц отдыхать.
При приступах глаукомы:
адонис — 75 г, буквица — 100 г. 1 ст. ложку сбора с вечера положить в термос, залить 200 мл кипятка. Утром процедить. Принимать по 50 мл за 30 минут до еды 4 раза в день в течение 10-14 дней до нормализации ГД.
Добавление в отвар 1-2 ч. ложек меда усиливает эффект лечения.
Яков ПРОНИН,
доктор
Источник
Комментариев:
Рейтинг: 63
Под дистрофией глазного нерва скрывается отмирание волокон. Данное состояние диагностируется довольно часто. В большинстве случаев, дистрофия зрительного нерва встречается у молодых и активных людей. При отсутствии правильных действий по устранению этого состояния, возможна полная потеря зрения, без восстановления. Вернуть способность видеть можно, если нервные волокна не успели полностью атрофироваться.

Основные причины данного явления
Зачастую данное заболевание развивается на фоне предшествующих состояний. Однако дистрофия глазных нервов может быть и наследственной болезнью. На сегодняшний день, выделяют несколько основных причин, способствующих развитию болезни:
- Наследственная предрасположенность.
- Полная интоксикацию организма (передозировка лекарственными препаратами и наркотиками).
- Наличие серьезных патологий со зрением врожденного характера.
- Вирусные инфекции с осложнениями на глаза.
- Алкогольное отравление тяжелой степени.
- Глазные заболевания. В частности, глаукома, профузные кровотечения или поражения зрительного нерва.
- Гипертоническая болезнь.
- Атеросклероз.
- Патологические состояния центральной нервной системы: опухоли, менингиты и травмы черепа.
Клиническая картина дистрофии
 На сегодняшний день выделяют несколько основных типов дистрофии:
На сегодняшний день выделяют несколько основных типов дистрофии:
- первичную;
- вторичную;
- частичную;
- полную;
- законченную;
- прогрессирующую;
- одностороннюю;
- двустороннюю.
Главный симптом данного состояния — резкое снижение зрения. Причем корректировать его никак не удается. Данный признак зависит от разновидности дистрофии и может проявляться по-разному. Прогрессирующее состояние имеет свои симптомы. Так, резкое снижение зрения может привести к сильной дистрофии и полной потере зрения. Этот процесс способен длиться несколько суток или месяцев. Все зависит от первопричины его развития.
Все вышеописанное указывает на то, что развиться дистрофия глазных нервов может у любого человека. Наследственность в данном случае играет минимальную роль. Предотвратить развитие процесса практически невозможно. Все, что в силах человека — не допускать осложнений после простудных заболеваний. Однако своевременные профилактические осмотры у офтальмолога позволят заметить патологию уже на ранней стадии и прибегнуть к качественному лечению.

Частичная дистрофия характеризуется ухудшением зрения, однако на определенном этапе этот процесс может остановиться. Если он продолжился, развивается прогрессирующее состояние.
Нарушение зрения может быть частичным или полным. Человека донимают зрительные расстройства и невозможность различать цвета. Поле зрения может стать «тоннельным». Этот процесс полностью зависит от развития патологии. Появление темных пятен перед глазами указывает на поражение центральных нервных волокон. Сужение поля зрения — нарушение в периферической части глазного нерва. Эти изменения могут наблюдаться как на одном глазу, так и на обоих. При появлении первой симптоматики важно вовремя обратиться к врачу. Это позволит отслеживать прогрессирование процесса и, по возможности, остановить его.
Диагностика и методы устранения дистрофии
При подозрении на наличие патологического процесса необходимо пройти комплексное офтальмологическое обследование.
Кроме того, следует обратиться за помощью к неврологу. Стандартное обследование у офтальмолога включает в себя следующие этапы:

- качественный осмотр глазного дна с использованием специального зрачка и расширяющих капель;
- проверку на остроту зрения;
- сферопериметрию;
- оценку восприятия цветов и оттенков;
- компьютерную периметрию — этот процесс позволяет определить пораженный участок нерва;
- видеоофтальмографию — это метод позволит оценить тяжесть поражения;
- рентген черепа;
- компьютерную томографию;
- лазерную допплерографию.
На сегодняшний день, не существует особых методик, позволяющих избавиться от дистрофии. Лечение заключается в оживлении нервных волокон. Этот процесс возможен при правильной и активной стимуляции зрительного нерва. Осуществляется это путем применения магнитных полей, лазера и электротока. Необходимо понимать, что качество лечения и результат зависят от стадии, на которой человек обратился за помощью. Чем раньше была обнаружена дистрофия, тем больше шансов на положительный исход.
Процесс магнитостимуляции позволяет оказывать особое влияние на нервные волокна. В результате кровообращение улучшается и обменные процессы работают с новой силой. Если патологическое поражение несет легкий характер, спустя 15 процедур оно полностью исчезнет. В основе метода электростимуляции лежат электрические импульсы. Один электрод посредством специальной иглы вводится в глазное яблоко, второй — остается на коже. Электростимуляция проводится в течение двух недель. Процедуру в обязательном порядке нужно повторять каждые 3 месяца.
Вышеописанные методы прекрасно сочетаются с традиционными способами лечения. Человеку рекомендуют применять сосудорасширяющие препараты и витамины В. Нередко используют хирургическое вмешательство. Его основной целью является доставка лекарственного средства непосредственно в нервную ткань. Лечение осуществляется опытным врачом после проведения подробной диагностики.

- Глазные капли V.Rohto Dry Eye это безопасный заменитель слезы;
- Применяется для устранения симптомов и лечения синдрома сухого глаза;
- Препарат увлажняет слизистую, способствует заживлению микротравм, повышению резкости зрения

Источник
Возникает атрофия зрительного нерва при глаукоме вследствие повышения внутриглазного давления и изменения кровоснабжения органов зрения из-за пережатия сосудистого сплетения. При этом у человека возникает сильная боль в глазу, что распространяется на голову, появляется светобоязнь и слезотечение. При отсутствии необходимого лечения такой недуг вызывает полную или частичную потерю зрения на оба глаза.
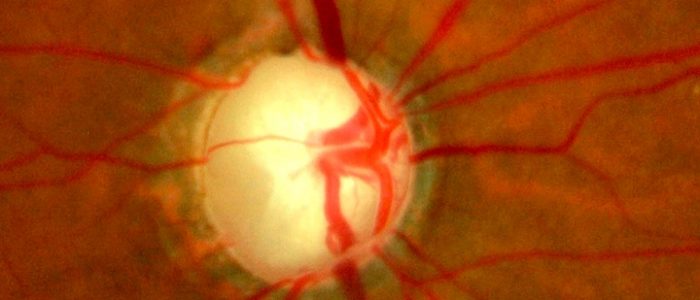
Терапия патологии заключается в нормализации давления внутри глазного яблока.
Причины патологического состояния
При глаукоме атрофия зрительного нерва образуется вследствие воздействия на организм человека таких факторов и патологических состояний:
- травмы и порезы глаза;
- инфицирование бактериальной, вирусной или грибковой природы;
- попадание токсических или ядовитых веществ;
- аутоиммунные процессы;
- недостаточное поступление витаминов;
- патологии головного мозга;
- колебание внутричерепного давления;
- нарушение кровоснабжения глаза;
- атеросклероз сосудов, питающих орган зрения;
- повышение давления;
- новообразование;
- сахарный диабет;
- эндокринологические нарушения;
- изменение функционирования глазного яблока;
- отягощенная наследственность;
- врожденные аномалии строения.
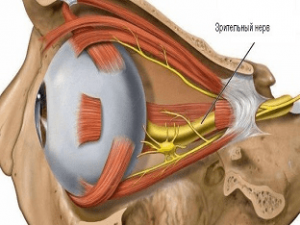 Зрительный нерв служит «мостиком» между глазом и головным мозгом.
Зрительный нерв служит «мостиком» между глазом и головным мозгом.
Нерв глаза соединяет орган зрения с головным мозгом. Это дает возможность передачи информации от анализаторов и осмысливать происходящее вокруг человека. Отмирание нейронов в этом нервном стволе приводит к нарушению связей и потере больным зрения. Этот процесс может быть частичным, при этом у человека сохраняется надежда на восстановление зрительных функций за счет регенерации нейронов или полной, когда слепота является необратимой. Если атрофия нерва произошла с одной стороны, то аутоиммунный процесс, который запустило отмирание клеток провоцирует нарушение зрения и второго глаза.
Вернуться к оглавлению
Как проявляется?
При атрофии зрительного нерва, сочетанной с глаукомой, у пациента появляются такие характерные симптомы:
- снижение остроты зрения;
- нарушение четкости видения предметов как вблизи, так и вдали;
- выпадение ресниц;
- давящая боль в глазных яблоках;
- туннельное зрение с отсутствием визуализации по сторонам;
- покраснение склеры;
- слезотечение;
- светобоязнь;
- головная боль;
- тошнота и рвота;
- головокружение.
 При остром приступе заболевания наряду с резким повышением ВГД и ВЧД наблюдаются тошнота и рвота.
При остром приступе заболевания наряду с резким повышением ВГД и ВЧД наблюдаются тошнота и рвота.
Глаукома характеризуется стабильным увеличением внутриглазного давления. Из-за этого происходит нарушение кровообращения и всех трофических процессов в глазном яблоке с отмиранием нейронов, образующих зрительный нерв. Острый приступ глаукомы характеризуется сильным повышением внутриглазного и внутричерепного давления с тошнотой и рвотой в результате раздражения рвотного центра продолговатого мозга, выраженной светобоязнью и слезотечением. После приступа пациент может отметить резкое ухудшение зрения, обусловленное возможными кровоизлияниями в зрительный нерв.
Вернуться к оглавлению
Особенности диагностики
Заподозрить атрофию зрительного нерва вследствие глаукомы можно по характерной клинической картине и жалобах, что предъявляет пациент. Для подтверждения диагноза и определения остроты зрения измеряют внутриглазное давление и проводят прямую офтальмоскопию. Также важно определить границы доступной для глаза видимой площади. Обнаружить очаги ишемии глазного яблока поможет флюоресцентная ангиография, которая выполняется при помощи введения в сосуд контрастного вещества. В дополнение к этому выполняется компьютерная и магнитно-резонансная томография головного мозга и глаза.
Следует сдать общий и биохимический анализ крови.
Вернуться к оглавлению
Как лечить?
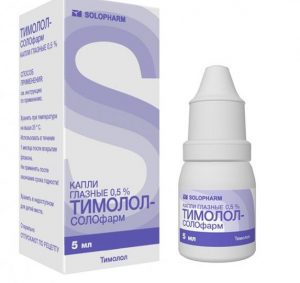 «Тимолол» применяют при медикаментозной терапии для нормализации выработки вещества глаза.
«Тимолол» применяют при медикаментозной терапии для нормализации выработки вещества глаза.
Терапия атрофии зрительного нерва из-за глаукомы заключается в уменьшении внутриглазного давления. С этой целью показано медикаментозное лечение при помощи средств, улучшающих отток внутриглазной жидкости. К ним относят симпатомиметики, простагландины и биомиметики. Также применяют препараты, уменьшающие выработку вещества глаза. Это бета-адреноблокаторы «Бетаксолол», «Бетоптик» и «Тимолол». Еще используют средства, что сочетают эти 2 эффекта. При неэффективности медикаментозного воздействия показано оперативное вмешательство с восстановлением оттока жидкости глаза и нормализацией давления внутри его. В комплексной терапии применяют препараты для ликвидации отеков и воспаления нервных тканей и улучшения обменных процессов внутри глаза. Также применяют витаминно-минеральные комплексы Это помогает частично или полностью восстановить зрение и ускорить регенерацию нейронов зрительного нерва.
Вернуться к оглавлению
Осложнения
Основная опасность глаукомы и атрофии зрительного нерва заключается в потере зрения. Этот процесс является необратимым. Некроз нервных тканей одного глаза провоцирует развитие такого же процесса и на втором глазу. Также возможны кровоизлияния в сетчатку, нерв и другие патологические образования, вызванные высоким давлением. Восстановить утерянное зрение при полной атрофии зрительного нерва невозможно.
Вернуться к оглавлению
Методы профилактики
 Хорошей профилактикой заболеванию будет отказ от вредных привычек.
Хорошей профилактикой заболеванию будет отказ от вредных привычек.
Предотвратить нарушение зрения и глаукому можно, если вести здоровый образ жизни с отсутствием вредных привычек. Также важно правильно питаться с достаточным количеством в рационе витаминов и минералов, избегать стрессов и чрезмерного физического переутомления. При появлении признаков нарушения зрения нужно немедленно пройти все необходимые исследования для постановки диагноза и провести полноценное лечение до достижения положительного результата.
Вернуться к оглавлению
Прогнозы при сочетании патологий
В результате атрофии зрительного нерва и глаукоме может частично или полностью исчезнуть зрение, что значительно влияет на качество жизни человека. При своевременном и действенном лечении от этих заболеваний можно избавиться. Но если терапия оказалась неэффективной, то потеря зрения приводит к инвалидизации человека и неблагоприятным прогнозам для жизни и трудовой деятельности.
Источник
За последние десятилетия офтальмология достигла значительных успехов в лечении глаукомы, тем не менее данное заболевание продолжает оставаться второй после катаракты причиной слабовидения и слепоты среди населения. По оценке Всемирной организации здравоохранения, в 2010 году численность больных глаукомой в мире составляла около 60 млн человек. По данным Quigley H.A., к 2020 году прогнозируется увеличение данного числа до 80 млн человек.
Согласно современным представлениям, глаукома рассматривается как мультифакторное нейродегенеративное заболевание, характеризующееся развитием и прогрессированием глаукомной атрофии зрительного нерва (ЗН) с потерей зрительных функций, независимо от уровня внутриглазного давления (ВГД). Глаукома характеризуется проградиентным течением и нарастанием структурных и функциональных изменений зрительной системы, с преимущественным поражением нейроретинального комплекса.
Механизмы развития глаукомной оптической нейропатии (ГОН) во многом сходны с таковыми при заболеваниях центральной нервной системы, например, болезни Альцгеймера. Однако патогенез глаукомного поражения изучен далеко не полностью. Существующие на сегодняшний день теории многообразны и нередко противоречивы. Особый интерес представляют три основные концепции: сосудистая, метаболическая и биомеханическая.
- Сторонники сосудистой концепции ГОН полагают, что повышение ВГД сопровождается нарушением циркуляции кровотока в тканях глазного яблока с развитием ишемии зрительного нерва и гибелью ганглионарных клеток сетчатки и их аксонов.
- В метаболической концепции в качестве ведущих факторов развития и прогрессирования глаукомной атрофии ЗН рассматривается повреждающее действие глутамата и продуктов свободно-радикального окисления. Метаболические нарушения, тесно связанные с ишемией нервной ткани, индуцируют апоптоз и некроз ганглионарных клеток сетчатки.
- Согласно биомеханической концепции, основным фактором развития и прогрессирования ГОН является компрессия аксональных пучков нервных волокон деформированной решетчатой мембраной склеры с нарушением в них аксоноплазматического тока, что ведет к дефициту нейротрофических факторов и в конечном итоге к гибели нейронов.
На сегодняшний день малоизученным остается вопрос о роли внутренней пограничной мембраны сетчатки в формировании глаукомной атрофии диска зрительного нерва (ДЗН). Однако считается, что именно механическое воздействие пограничной мембраны на преламинарный отдел ДЗН является одним из факторов развития и прогрессирования ГОН. В условиях повышенного офтальмотонуса возникает аномально высокий градиент давления по обе стороны пограничной мембраны, вследствие чего она куполообразно продавливается в сторону решетчатой пластинки. Это приводит к сдавлению аксонов ганглионарных клеток сетчатки с последующей блокадой в них аксоноплазматического тока. Это «эффект плоскостного давления».
Также установлено, что изменения при ПОУГ происходят не только в сетчатке и диске зрительного нерва, но и на протяжении всего зрительного пути. При морфологических исследованиях головного мозга животных с экспериментальной глаукомой установлена выраженная атрофия латеральных коленчатых тел, причем степень выраженности атрофии напрямую зависит от длительности офтальмогипертензии и соответствует клиническим изменениям в диске зрительного нерва.
Роль оксида азота
Рядом с общепринятыми механическими и сосудистыми факторами патогенеза ГОН значительная роль отводится метаболическим нарушениям, среди которых ведущее место занимает дисрегуляция метаболизма оксида азота (NO). Как оказалось, этот короткоживущий газ вырабатывается в организме ферментативным путем из аминокислоты L-аргинина и участвует в регуляции практически всех функций организма.
В тканях глаза выявлены все изоформы NO-синтазы (NOS) — фермента, под воздействием которого синтезируется оксид азота: эндотелиальная (еNOS), нейрональная (nNOS), макрофагальная, или индуцибельная (іNOS).
- Эндотелиальная NOS присутствует в эндотелии сосудов хориоидеи и сетчатки, в стенках коротких и задних цилиарных артерий, преламинарной области диска зрительного нерва.
- Нейрональная NOS выявлена в периваскулярных зонах нервных волокон зрительного нерва.
- В местах дезорганизации решетчатой пластины отмечено накопление макрофагальной NOS, появление которой характерно преимущественно для патологических состояний.
Экспериментальные исследования показали, что NO играет важную роль в регуляции кровообращения микроциркуляторного русла внутренних оболочек глаза и диска зрительного нерва, координации транспорта водянистой влаги через дренажную систему, влиянии на механизм нейронального апоптоза. Все это дало основание предполагать, что NO может принимать участие в развитии ГОН.
При глаукоме потеря зрения отражает гибель ретинальных ганглиозных клеток. При этом низкие дозы NO способны играть защитную роль для фоторецепторов. При выработке в больших количествах NO опосредует гибель нервных и фоторецепторных клеток в результате воздействия на них нейротоксического и высокореакционного соединения — пероксинитрита (ООNO–), образовавшегося в результате реакции NO со свободным радикалом супероксиданноном (О2–). Таким образом, NO может оказывать как положительное, так и отрицательное влияние на развитие и течение первичной открытоугольной глаукомы (ПОУГ). Во многом это зависит от уровня NO.
Конкретная физиологическая и патофизиологическая роль NO в генезе глаукомы до конца не изучена. Отсутствие точного понимания детальных механизмов участия NO в патогенезе глаукомы связано как с многогранностью этого заболевания, так и с трудностью изучения содержания NO в тканях глаза в силу его физико-химических особенностей. Использовать прямые количественные методы изучения NO іn vіvo, а в некоторых случаях и іn vіtro технически очень сложно. Поэтому в настоящее время наиболее распространено косвенное исследование содержания NO по уровню стабильных продуктов его метаболизма — нитрит (NO2 –)- и нитрат (NO3 –)-анионов. В единичных работах был изучен уровень NO в слезной, внутриглазной жидкости и плазме крови на разных стадиях ПОУГ. Но нет сведений о том, существует ли корреляционная связь между показателями NO в водянистой влаге, сыворотке крови и слезной жидкости на разных стадиях этой болезни у пациентов разного пола, отсутствуют и данные о медикаментозной коррекции нарушенных уровней NO.
Стадии поражения зрительного нерва
У пациентов первой стадии произошло незначительное нарастание объема глобальной потери (GLV %) ганглиозного комплекса сетчатки, достоверно не отличающегося от показателей пациентов латентной стадии заболевания. Компенсация ВГД приводит к кардинальному перераспределению показателей, характеризующих функциональное состояние сетчатки. Снижение ВГД сопровождается нормализацией показателей центральной периметрии, ПЭРГ, что свидетельствует об их функциональной преходящей депрессии на фоне повышенного ВГД. В то же время у пациентов на этой стадии выявляется нарастающее статистически достоверное снижение индексов SWAP-периметрии, что может быть обусловлено угнетением функциональной активности S-ганглиоцитов, отличающихся широкими рецептивными полями.
Вторая стадия глаукомы характеризуется нарастанием морфологических изменений ДЗН, включением в уравнение канонической величины всех показателей, характеризующих состояние комплекса ганглиозных клеток, значимым снижением толщины СНВ, а также увеличением размеров глаукомной экскавации. У пациентов этой группы наблюдалось снижение индексов всех видов компьютерной периметрии. В то же время объективные исследования функционального состояния ганглиозного комплекса сетчатки с помощью ПЭРГ значимых изменений не проявляют. Превышение толерантного уровня ВГД в первую очередь сопровождается уменьшением объема ганглиозного комплекса сетчатки. Обратимая функциональная депрессия фоторецепторов и ганглиоцитов, расположенных преимущественно в центральной – аваскулярной – зоне сетчатки, отсутствие изменений в толщине СНВ, представленных в основном аксонами ганглиозных клеток, позволяют предположить, что формирование глаукомной нейропатии начинается с деформации дендритов ГК, основным критерием изменения которых является увеличение объема глобальной потери ганглиозного комплекса сетчатки (GLV %).
На следующем этапе в патологический процесс включаются аксоны ганглиоцитов, как правило, в первую очередь именно тех клеток, которые имеют большие рецептивные поля (разветвленные дендриты), т.е. S-клеток, преимущественно расположенных в проекции зоны Бьеррума. Сокращение дендритных полей может задолго предшествовать гибели ганглиозных клеток и нервных волокон и определять изменение толщины всего комплекса ганглиозных клеток сетчатки . Эта теория получила название теории дендритных полей. Таким образом, можно сказать, что модель глаукомной дегенерации у человека также начинается с изменения дендритов, на следующем этапе сопровождается повреждением аксонов с последующим включением в патологический процесс непосредственно ганглиоцитов, что подтверждается их абсолютным функциональным дефицитом на развитых стадиях глаукомы.
Лечение
Современные методы лечения глаукомы направлены, преимущественно, на снижение ВГД, что является непременным условием стабилизации глаукомного процесса. Однако ухудшение зрительных функций даже при эффективном снижении офтальмотонуса позволяет предположить, что развивающиеся структурные нарушения в ЗН связаны не только с повышением ВГД. Следовательно, лечебные мероприятия, направленные только на нормализацию ВГД, вряд ли следует считать единственно результативными. Терапия глаукомы должна быть комплексной, направленной на устранение, по возможности, основных причин (механических, дисциркуляторных, метаболических) развития атрофии ЗН. Предотвращение гибели нейрональных клеток является столь же важной задачей лечения ГОН, как и нормализация ВГД. Одним из направлений, обеспечивающих решение данной задачи, является декомпрессионная хирургия глаукомы.
Нейропротекторная терапия
Центральные нейродегенеративные изменения зрительного пути вносят свой существенный вклад в патофизиологические механизмы глаукоматозного прогресса, а методы лечения, сочетающие гипотензивную и нейропротекторную терапию, направлены на защиту периферических и центральных зрительных нейронов и сохранение зрительных функций.
Нейротрофические факторы (НТФ) – семейство крупных полипептидов, которые регулируют выживание, развитие и функцию нейронов. Секретируемые нейрональными структурами (нейронами, глией), они выполняют сигнальную миссию в большом спектре физиологических процессов. НТФ осуществляют структурную и функциональную организацию как отдельных клеток мозга, так и нейрональной сети в целом, являясь регуляторами нейрональной пластичности.
Одна из основных функций НТФ связана со способностью противостоять окислительному стрессу и апоптозу. В современной офтальмологической практике наибольшее распространение получили цитомедины или пептидные биорегуляторы, являющиеся индукторами эндогенных пептидов. Для лечения ГОН широко используются такие препараты данной фармакологической группы, как кортексин и ретиналамин. Обладая низкой молекулярной массой (не более 10 кДА), они проникают через гематоэнцефалический и гематоофтальмический барьеры и поступают непосредственно к нейронам.
- Кортексин – комплекс полипептидов, полученный методом уксуснокислой экстракции из коры головного мозга крупного рогатого скота и свиней. Препарат обладает тканеспецифическим действием на серое вещество головного мозга, а также регулирует процессы метаболизма в нейронах сетчатки и ЗН.
- Ретиналамин – комплекс водорастворимых пептидных фракций, полученный методом уксуснокислой экстракции из сетчатки глаз крупного рогатого скота. Лекарственное средство обладает тканеспецифическим действием на сетчатку, регулирует процессы метаболизма, улучшает функциональную активность клеточных элементов ретинальной ткани, стимулирует репаративные процессы в сетчатке, а также нормализует проницаемость сосудов глазного яблока.
Немаловажным в нейропротекции при ГОН является и способ доставки лекарственного вещества.
Кортексин рекомендуется вводить внутримышечно в дозе 10 мг в течение 10 дней, а ретиналамин – внутримышечно и парабульбарно в дозе 5 мг в течение 10 дней. Однако подобные способы введения не обеспечивают оптимальную концентрацию лекарственного вещества в области ДЗН, что связано с анатомическими особенностями глазного яблока. При парабульбарном введении препарата до ретинальной ткани доходит лишь 9,3% от введенной дозы. Кроме того, при этом возможны такие осложнения, как перфорация глазного яблока, парабульбарные гематомы.
В последнее время большое распространение получили методики введения лекарственных средств при помощи физиотерапевтических процедур. Так, широко применяется метод эндоназального электрофореза ретиналамина и кортексина, основанный на использовании постоянного тока. Раствор ретиналамина 0,25% вводится с активного положительного электрода, установленного в средних носовых ходах (сила тока 0,5–1 мА). Продолжительность процедуры – от 3 до 15 минут. Курс лечения – 10 процедур. Эндоназальный электрофорез 0,25% раствором кортексина проводится аналогичным способом. Несомненными преимуществами данного неинвазивного метода лечения являются отсутствие болевых ощущений и риска развития осложнений, связанных с инъекционным введением препаратов.
Для ретиналамина разработано большое количество альтернативных путей введения: субконъюнктивально, в субтеноново пространство, ретробульбарно, под кожу виска и др. Проведены исследования по применению данного препарата путем субконъюнктивальных инъекций (ретиналамин растворяли в 2 мл 2% лидокаина, под конъюнктиву вводили 1 мл полученного раствора; курс лечения – 10 инъекций). Одновременно пациенты получали 1,0 мл раствора ретиналамина в/м и стандартную сосудистую терапию (эмоксипин, АТФ, милдронат). Клинически значимые результаты в виде улучшения зрительных функций и стабилизации глаукомного процесса были получены через 3, 6 и 12 месяцев.
Эффективным оказалось применение ретиналамина при ретробульбарном и субтеноновом введении. Пациентам с компенсированным ВГД данный препарат вводился ретробульбарно в дозе 5 мг ежедневно в течение 10 дней. Пациентам с декомпенсированным офтальмотонусом ретиналамин вводился под тенонову капсулу однократно в сочетании с антиглаукомной операцией. По результатам исследования выявлена положительная динамика клинических показателей с повышением амплитуды зрительных вызванных потенциалов.
Хирургия
Известен способ лечения ГОН, заключающийся в проведении трансвитреальной декомпрессии склерального канала ЗН путем дисцизии склерального кольца ножом Сато на глубину до 1 мм со стороны ДЗН в меридианах 11 (1) или 5 (7) часов через сквозные разрезы склеры. Однако он имеет существенные недостатки: высокую вероятность повреждения ЗН, риск развития гемофтальма, эндофтальмита.
Другой хирургический способ лечения ГОН заключается в проведении субтотальной витрэктомии с последующим введением в витреальную полост?

