Гистерезис роговицы что это
in the evaluation of ophthalmotonus
E.A. Egorov, M.V. Vasina
Department of Ophthalmology of Medical Faculty
GOU VPO Russian State Medical University of Roszdrav
Ophthalmological Center “Doctor Visus”, Moscow
Purpose: to analyze results of complex study with the Ocular Response Analyzer (ORA, Reichert Inc, USA.
Materials and methods:
135 patients (240 eyes) at the age of 19 — 80 years old (60 males and 75 females) were examined. First group included patients without history of IOP increase, without family history of glaucoma, with refraction abnormalities not more then 3.0 D. Second group – patients with keratoconus of various stages, third – patients with POAG of different stages.
All patients underwent visometry, computer perimetry, tonometry, pahimetry, gonioscopy, biomicroscopy and ophthalmoscopy on ORA
Results and conclusion:
There was correlation between increase of corneal hysteresis and central corneal thickness in the first and third groups.
There is inversely proportional dependence between ophthalmotonus and corneal hysteresis.
Resistance corneal factor is lower then indices of corneal hysteresis in patients with keratoconus, this may be forecasting sign in diseases of cornea.
Измерение внутриглазного давления занимает важное место при обследовании пациента в практике врача–офтальмолога. Все практические методы тонометрии базируются на принципах применения силы к глазному яблоку и измерению образующейся деформации. Деформация может быть достигнута уплощением роговицы при аппланационной тонометрии или вдавлением глазного яблока при импрессионной тонометрии.
Альтернативный метод аппланационной тонометрии измеряет требуемую силу для уплощения определенной зоны роговицы, а не ее размер, как при использовании то-нометра Маклакова. Именно на этом принципе основан тонометр Г. Гольдмана (1954–1961 года), который до настоящего времени является «золотым стандартом» в измерении ВГД.
Анализатор биомеханических свойств глаза Ocular Response Analyzer (ORA, Reichert Inc., США) является бесконтактным тонометром, работающим по принципу динамической двунаправленной аппланации роговицы [1–7]. Измерения, произведенные на ORA, позволяют оценить:
– ВГД по Гольдману (ВГДг);
– ВГД роговично–компенсированное (ВГДрк);
– корнеальный гистерезис (КГ);
– фактор резистентности роговицы (ФРР);
– центральную толщину роговицы (ЦТР).
ВГД роговично–компенсированное расчитывается с помощью специального алгоритма на основании полученных данных клинических измерений.
Корнеальный гистерезис – разница между двумя регистрируемыми ORA значениями давления во время аппланации роговицы, возникающими в результате затухания воздушного импульса в вязко–эластичной роговичной ткани.
Фактор резистентности роговицы – дополнительный параметр, который рассчитывается с помощью специального алгоритма.
В этой работе мы ставили целью проанализировать результаты, полученные на данном аппарате.
Материалы и методы
Было обследовано 135 человек (240 глаз) в возрасте от 19 до 80 лет, из них 60 мужчин и 75 женщин. Все пациенты были разделены на три группы. Первая группа – условно здоровые, не имеющие в анамнезе повышения ВГД, не отягощенные наследственностью по глаукоме, с аномалиями рефракции не более 3,0D. Вторая – пациенты с кератоконусом различной степени. Третья группа – лица, страдающие ПОУГ с различной стадией глаукомного процесса.
Всем пациентам проводились визометрия, компьютерная периметрия, тонометрия, пахиметрия, гониоскопия, биомикроскопическое и офтальмоскопическое исследование, исследование на ORA (анализаторе биомеханических свойств роговицы).
Результаты
В группе здоровой популяции было обследовано 41 человек (79 глаз), из них 18 мужчин и 23 женщины в возрасте от 23 до 79 лет (46,8±17,81).
В группе здоровых пациентов мы выделили три подгруппы, различающиеся по толщине роговицы (<520 мкм, от 521 до 580 мкм, >581 мкм) и проанализировали все показатели, получаемые на анализаторе биомеханических свойств роговицы (рис. 1–3, табл. 1).
Во второй группе обследовано 17 пациентов (32 глаза) с кератоконусом, из них 10 мужчин и 7 женщин в возрасте от 19 до 45 лет (26,4±9,9).
Были получены следующие результаты:
ВГД рк=13,3±2,35
ВГД г=8,9±2,66
ФРР=6,1±1,31
КГ=7,7±1,41
ЦТР=445,2±14,21
В данной группе не только снижены все показатели, но и на корнеограмме два сигнала (пика) снижены по сравнению с группой здоровых пациентов. Исследование пациентов с кератоконусом показало: ФРР у них всегда значительно ниже, чем КГ (рис. 4).
В третью группу вошло 77 пациентов (129 глаз) с ПОУГ в возрасте от 42 до 80 лет (64,8±8,21).
Внутри данной группы были выделены три подгруппы, различающиеся по толщине роговицы: 1) <520 мкм; 2) 521–580 мкм; 3) >581мкм.
В группе с тонкой роговицей обследовано 27 пациентов (49 глаз) из них 12 мужчин и 15 женщин в возрасте от 43 до 77 лет (66,7±7,9). Распределение по стадиям глаукомы: I – 9 глаз (18%); II – 14 глаз (29%); III – 21 глаз (43%); IV – 5 глаз (10%).
Группу с ЦТР от 521 до 580 мкм составили 33 человека (52 глаза), возраст которых составлял 65,2±6,95 лет (от 52 до 76), из них 12 мужчин и 21 женщина. Соотношение по стадиям глаукомного процесса выглядело следующим образом: I – 23 глаза (44%); II – 11 глаз (21%); III – 16 глаз (31%); IV – 2 глаза (4%).
В группе с толстой роговицей (>581 мкм) обследовано 17 пациентов (28 глаз) – 8 мужчин и 9 женщин. Возраст в этой группе составлял в среднем 61,2±8,93 лет (от 42 до 80 лет). Стадии глаукомы распределились так: I – 13 глаз (46%); II – 8 глаз (29%); III – 6 глаз (21%); IV – 1 глаз (4%).
На рис. 5 приводится корнеограмма пациенки Г., 68 лет с диагнозом OS о/у IIа глаукома. ВГД рк=16,3 ВГД г=11,0 ФРР=5,8 КГ=6,6 ЦТР=478.
Данные, полученные на ORA, у пациента Г., 61 года с диагнозом OD о/у IIIа глаукома, представлены на рис. 6. ВГД рк=13,3 ВГД г=11,5 ФРР=8,6 КГ=8,6 ЦТР=610.
КГ снижается при повышении ВГД как по Гольдману, так и по роговично–компенсированному, а при снижении офтальмотонуса происходит повышение КГ.
На рис. 7 и 8 приводятся кератограммы пациента Г., 67 лет с диагнозом OS о/у II глаукома с повышенным офтальмотонусом и после его снижения на фоне приема гипотензивной терапии.
При наличии ПОУГ на одном глазу показатели КГ ниже показателей КГ на другом глазу без глаукомы у одного и того же пациента.
В глазах после антиглаукоматозных операций КГ выше, чем на другом, не оперированном глазу при гипотензивной медикаментозной терапии. Полученные результаты требуют дополнительного анализа, что может служить косвенным признаком степени компенсации ВГД.
Выводы
1. Значения КГ повышаются с увеличением ЦТР как в группе здоровых пациентов, так и в группе глаукомных пациентов.
2. При повышении ВГД происходит снижение КГ, при снижении офтальмотонуса КГ повышается, то есть имеется обратно пропорциональная зависимость.
3. ФРР ниже показателей КГ у пациентов с кератоконусом, что может быть прогностическим признаком при заболеваниях роговицы.
4. У глаукомных больных КГ, как правило, ниже ФРР.
5. Низкий КГ не может считаться предрасполагающим фактором в возникновении глаукомы, так как связан с толщиной роговицы, показатели которой должны соизмеряться с ВГД.
6. Исследование на ORA требует определенных навыков и знаний в правильной трактовке получаемых результатов.
Источник


- Описание
Описание
Автоматический прибор, в котором реализован принципиально новый подход к измерению офтальмотонуса. Анализатор биомеханических свойств глаза позволяет оценивать вязко-эластические свойства роговицы и ее толщину.
Анализатор биомеханических свойств глаза ORA Reichert широко востребован в эксимер-лазерных клиниках, так как позволяет прогнозировать успех операции и точно измерять ВГД у пациентов после рефракционной хирургии.
Единственный прибор в мире, который выдает значения сопротивления роговицы и истинного внутриглазного давления за одно простое быстрое измерение.
В ORA применяется динамический двунаправленный процесс аппланации (сплющивания роговицы) для определения биомеханического сопротивления роговицы. Возможность измерения этого эффекта, известного как гистерезис роговицы, дает ключ для понимания влияния сопротивления роговицы на измерения внутриглазного давления, следовательно, для получения лучшего показателя истинного внутриглазного давления!
Кроме того, ORA представляет систему измерения, основанную на определении нового параметра – превышение глазного давления EOP.
EOP – отклонение от линии, отображающей распределение ВГД у людей с нормальным зрением. Используя параметр EOP можно охарактеризовать любой глаз при помощи расположения его относительно данной линии.
Особенности:
- Использование новых параметров (гистерезиса роговицы и EOP) при диагностике глаукомы;
- Бесконтактный способ измерения;
- Использование мягкого воздушного импульса и современной аппланационной системы обнаружения;
- Возможность оценить эффективность назначенного лечения
- Избавление от традиционной Гольдмановской тонометрии;
- Простое кнопочное управление и полная автоматическая регулировка;
современная конструкция и дизайн.
ORA незаменим в предсказании исхода рефракционной хирургии. Всегда есть небольшой процент пациентов после рефракционной хирургии, у которых развивается эктазия из-за недостаточной коррекции или наоборот слишком сильной коррекции, и которым нужна добавочная операция. И возможность измерения биомеханических характеристик роговицы при помощи ORA обеспечит” недостающее звено” для понимания осложнений после операции.
Одно измерение – четыре параметра:
- IOPg – Goldmann Correlated IOP (ВГД по Гольдману, ВГДг);
- CH – Corneal Hysteresis (Корнеальный гистерезис, КГ);
- IOPcc – Corneal Compensated IOP (Роговично-компенсированное ВГД, ВГДрк);
- CRF – Corneal Resistance Factor (Фактор резистентности роговицы, ФРР).
Корнеальный гистерезис (КГ)
Это условная величина, характеризующая вязко-эластические свойства роговицы, его значение постоянно и генетически детерминировано для каждого конкретного индивида.
Роговично-компенсированное давление (ВГДрк)
Это условная величина, характеризующая ВГД, которое имел бы глаз, если бы вязко-эластические свойства роговицы были учтены при измерении. ВГДрк позволяет сравнивать офтальмотонус на глазах, обладающих различными биомеханическими свойствами, с разными роговицами и склерами.
Фактор резистентности роговицы (ФРР)
Это условная величина, характеризующая сопротивление собственно роговичной ткани, которое существовало бы при нулевом офтальмтонусе.
Технические характеристики:
| Вариант исполнения: | С прямым датчиком, с угловым датчиком |
| Диапазон измерения: | 0 ~ 60 мм рт.ст. |
| Диапазон измерений данных пахиметрии: | 200 ~ 900 мкм |
| Частота зонда: | 20 МГц |
| Точность: | ± 5 мкм |
| Разрешение: | 1 мкм |
| Интерфейс передачи данных: | RS232 |
| Вес: | 13.6 кг (без упаковки) |
| Длина: | 24 см |
| Глубина: | 34 см |
| Высота: | 43 см |
| Питание: | 100 – 240 В, 50/60 Гц |
Источник
В статье представлены результаты исследования, подтверждающего важную роль корнеального гистерезиса как предиктора прогрессирования глаукомной оптиконейропатии при проведении сравнительного анализа морфофункциональных показателей.
Введение
На протяжении десятилетий повышенное внутриглазное давление (ВГД) признавалось ведущим фактором риска развития и прогрессирования глаукомной оптиконейропатии (ГОН) [1–3]. Однако в литературе имеется немало подтверждений тому, что заболевание может прогрессировать и при нормальном ВГД [4]. Среди прочих факторов риска прогрессирования ГОН упоминаются возраст [5, 6], пол [7, 8], сопутствующие соматические заболева-
ния [9, 10], близорукость [11], раса [8, 12], применение бета-блокаторов в качестве местного гипотензивного лечения [13], биомеханические свойства роговицы [14, 15]. Следует, однако, подчеркнуть, что относительно влияния последнего фактора на течение ГОН существуют разные точки зрения. Так, если до недавнего времени большое внимание уделялось связи центральной толщины роговицы (ЦТР) с прогрессированием заболевания [16], то в настоящее время на первый план выходит такой параметр, как корнеальный гистерезис (КГ), отражающий вязкоэластичные свойства роговицы [1]. В литературе мы не встретили ни одной работы, в которой бы роль КГ в прогрессировании ГОН оценивалась в сравнении с другими морфофункциональными
показателями.
Цель: определить роль КГ как предиктора прогрессирования ГОН при проведении сравнительного анализа морфофункциональных показателей.
Материал и методы
Данное исследование носит характер ретроспективного когортного. С целью проведения данной работы из 2 тыс. наблюдаемых в Центре офтальмологии ФМБА больных с первичной глаукомой для данного исследования произвольно было отобрано 128 пациентов (173 глаза): 78 больных (108 глаз) со стабильным течением ГОН (группа 1) и 50 пациентов (65 глаз) с прогрессированием заболевания (группа 2).
Критериями включения в исследование являлись: ПОУГ, ПЗУГ после периферической лазерной иридотомии (ПЛИТ) начальной, умеренной стадий, cфероэквивалент <6,0 дптр., астигматизм <2,0, открытый угол передней
камеры (УПК) — не менее 30°, отсутствие сопутствующей патологии органа зрения.
Критериями исключения являлись: глаукома нормального давления, пигментная глаукома, недостаточно прозрачные оптические среды глаза, отсутствие устойчивой фиксации, медикаментозный миоз, cфероэквивалент
>6,0 дптр., астигматизм >2,0 дптр., низкое качество снимка диска зрительного нерва (ДЗН), менее 5 протоколов периметрии в анамнезе, антиглаукомные операции в анамнезе, хронические системные аутоиммунные заболевания, сахарный диабет, болезнь Паркинсона, болезнь Альцгеймера, деменция.
Средний возраст больных составил 68 лет (44–88). Больные с впервые выявленными ПОУГ и ПЗУГ и псевдоэксфолиативной глаукомой (ПЭГ) находились под наблюдением в течение 7 лет.
Диагноз глаукомы был поставлен на основании характерных изменений ДЗН, выявляемых при офтальмоскопии (патологическое отклонение от нормы пропорций неврального ободка, глаукомная экскавация ДЗН, перипапиллярная атрофия, клиновидные дефекты в слое нервных волокон сетчатки, примыкающие к краю ДЗН, геморрагии по краю ДЗН), повышенного офтальмотонуса, выходящих за пределы нормы результатов стандартной автоматизированной периметрии (САП).
Во время данного исследования не проводились измерение флуктуации ВГД, а также определение пиков ВГД в течение суток.
Исследование проведено в соответствии с этическими принципами, заложенными Хельсинкской декларацией и отраженными в правилах качественной клинической практики (GCP) и нормативных требованиях. Протокол исследования утвержден этическим комитетом ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России.
Объем обследования включал в себя измерение
роговично-компенсированного внутриглазного давления, КГ и фактора резистентности роговицы на анализаторе биохимических свойств роговицы ORA (USA). Также всем пациентам выполнялись авторефрактометрия, визометрия, гониоскопия, оптическая когерентная томография (ОКТ — протокол GCC, ONH), включая ОКТ переднего отрезка глаза c определением размеров УПК и исследование ганглиозного слоя сетчатки с определением толщины ганглиозного комплекса (GCC) и его характеристик: объема глобальных (GLV) и фокальных его потерь (FLV) на приборе Optovue, СA, пахиметрия (SP-100, Германия), биометрия (Lenstar LS 900, Haag-Streit Diagnostics, Швейцария). Проводили также стандартную автоматизированную периметрию по программе 24-2 SITA Standard (Humphrey Field Analyzer), исследование ДЗН с его фотографированием (Visucam 500, Германия).
Большое внимание уделялось качеству исследуемых протоколов. Так, исключали протоколы с потерей фиксации более 30%, ложнонегативными ошибками, а также более 15% ложноположительных результатов. Прогрессирование ГОН оценивалось по данным периметрии, а именно по изменению индекса поля зрения (VFI, Visual Field Index), который отражает потенциал поля зрения в процентном выражении [17, 18]. Скорость прогрессирования (ROP, дБ/год) оценивалась по данным GPA (Glaucoma Progression Analysis) методом САП [19], при этом снижение светочувствительности определялось как «возможное» (possible progression) и как «вероятное прогрессирование» (likely progression), а регрессионный анализ осуществлялся на основании имеющихся как минимум двух базовых тестов. В дальнейшем повторные обследования проводились каждые полгода. В общей сложности за весь период наблюдения было выполнено не менее 14 периметрий у каждого пациента.
С целью открытия угла передней камеры пациентам с ПЗУГ первым этапом проводилась ПЛИТ.
Всем пациентам с гипотензивной целью назначались местные препараты (рис. 1) и/или выполнялась селективная лазерная трабекулопластика. Для оценки влияния вида местной гипотензивной терапии на характер течения ГОН учитывали те группы препаратов, которые назначались в период основного срока наблюдения (более половины) в каждом конкретном случае, в т. ч. в течение последних 3 лет.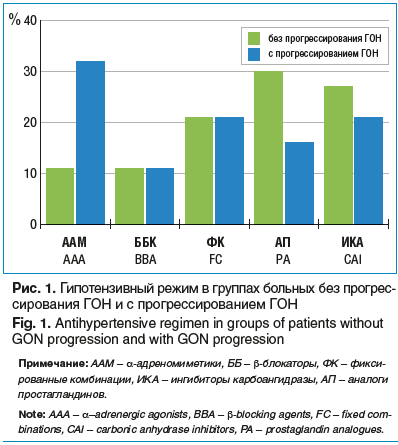
Статистическая обработка данных. Для сравнения групп больных не по независимым выборкам, а по полным данным применялись методы, учитывающие корреляцию наблюдений для парных глаз. Применяли обобщение Rosner — Glynn — Lee и критерий ранговых сумм Mann — Whitney — Wilcoxon в случаях кластеризованных наблюдений; обобщение Obuchowski оценки AUC (оценка площади под характеристической ROC-кривой) на случай кластеризованных наблюдений. Для вычисления использовались пакеты clusrank, Exact языка R и программа funcs clustered ROC.R. Cutoff score рассчитывался на основе Youden’s index (MedCalc, версия 11.5.1). Числовые данные представлены как среднее ± SD. Статистическая обработка полученных результатов проводилась с использованием стандартного пакета программ статистического анализа SPSS 15.0 for Windows. Значения p<0,05 считались статистически значимыми.
Результаты исследования
Клиническая характеристика пациентов, принимавших участие в исследовании, представлена в таблице 1.
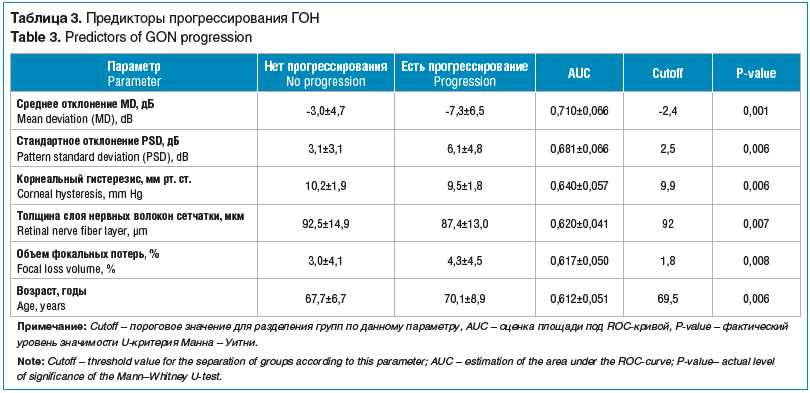
Результаты показали, что из трех форм глаукомы у наблюдаемых пациентов в группе с прогрессированием ГОН преобладали больные с ПЭГ. Прогрессирование ПЗУГ в 2 раза превосходило таковое при ПОУГ (табл. 2). Анализ также показал, что периметрические индексы (MD, PSD), толщина слоя нервных волокон (RNFL), объем фокальных потерь (FLV), КГ и возраст пациента имеют статистически достоверное влияние на развитие ГОН (табл. 3). Из рисун-ка 2 видно, что КГ в группе с прогрессированием ГОН существенно отличался от такового в группе без прогрессирования, и это отличие было более выраженным, чем для основных морфофункциональных показателей.
Обсуждение
Результаты настоящей работы впервые показали, что КГ имеет столь же существенное значение в качестве предиктора прогрессирования ГОН, как и исходная степень глаукомного поражения, в частности выражаемая данными периметрии. Однако если учесть существование «препериметрической» глаукомы, то становится очевидной диагностическая важность параметров, позволяющих прогнозировать течение глаукомного процесса в условиях отсутствия глаукомных дефектов полей зрения. Такими параметрами традиционно считаются морфометрические показатели, изменения которых опережают появление функциональных дефектов [20–22]. Результаты настоящего исследования показали, что прогностическая значимость КГ на момент выявления заболевания не уступает таковой для наиболее важных морфометрических показателей: толщины слоя нервных волокон сетчатки или характеристики ее ганглиозного слоя (см. табл. 2).
Вопросам влияния биомеханических свойств роговицы на течение ГОН уделяется большое внимание в литературе. В частности, было выявлено значительное снижение КГ в группе больных глаукомой по сравнению с таковым у здоровых обследуемых [23] и лиц с офтальмогипертензией [24]. Как было показано в предыдущих наших исследованиях, КГ является маркером препериметрической стадии глаукомы [20].
Примечательно, что в настоящем исследовании толщина роговицы в ее центральной части не вошла в число достоверно значимых предикторов прогрессирования ГОН. Это совпадает с результатами, полученными другими авторами. Так, в одном из таких исследований, похожих по дизайну на нашу работу (срок наблюдения за больными — 5 лет, 230 глаз), было показано, что ведущую роль в прогрессировании ГОН играет отнюдь не ЦТР, а именно низкий КГ [25]. F. Medeiros et al. [26] также отмечают, что КГ играет важную роль в прогрессировании глаукомы. В ходе однофакторного анализа ими было установлено, что каждому миллиметру рт. ст. КГ соответствовало ухудшение индекса полей зрения на 0,25%/год (p<0,001). В многофакторном анализе было установлено, что роль ВГД в прогрессировании ГОН опосредована через КГ. Риск прогрессирования был более высоким в глазах с повышенным уровнем ВГД и низким КГ. К аналогичному выводу пришли и другие авторы [27]. В то же время в ряде исследований было показано, что ЦТР связана с тяжестью глаукомы и является фактором риска прогрессирования ГОН [21, 28, 29]. Однако если говорить о значимости показателей КГ и ЦТР в развитии ГОН в сравнительном аспекте, то большее «предпочтение» авторы отдают именно КГ. Так, по данным De Moraes et al., в 17,4% случаев скорость прогрессирования ГОН была ассоциирована с исходно низкими показателями КГ, в то время как с ЦТР — лишь в 5,2% [27]. Следует отметить, что при проведении данного исследования статистически достоверного влияния ЦТР на прогрессирование ГОН выявлено не было. Ретроспективный анализ серий снимков ДЗН в динамике, проведенный Chee et al. [30], показал прямую связь между КГ (но не ЦТР или ВГД) и прогрессированием ГОН.
Также следует упомянуть, что КГ, по данным литературы, может играть важную роль в повышении восприимчивости зрительного нерва к глаукоматозному повреждению. Так как фиброзная капсула глаза (роговица и склера) является структурой, играющей ведущую роль в поддержании механической целостности глаза, то логично предположить, что при изменении ее жесткости изменяется и степень ее деформации при определенном уровне ВГД [32]. Следовательно, механические свойства фиброзной капсулы глаза оказывают влияние и на биомеханику ДЗН [32, 33]. Эластичные свойства склеры могут служить в качестве буферирующего механизма для микрообъемных изменений в глазу, что защищает его от флуктуаций ВГД [32].
Результаты настоящей работы показали, что исходно низкое значение толщины слоя нервных волокон (RNFL) и объем потерь ганглиозного слоя сетчатки также ассоциировались с прогрессированием заболевания (см. табл. 2, рис. 2), что совпадает с данными литературы [33].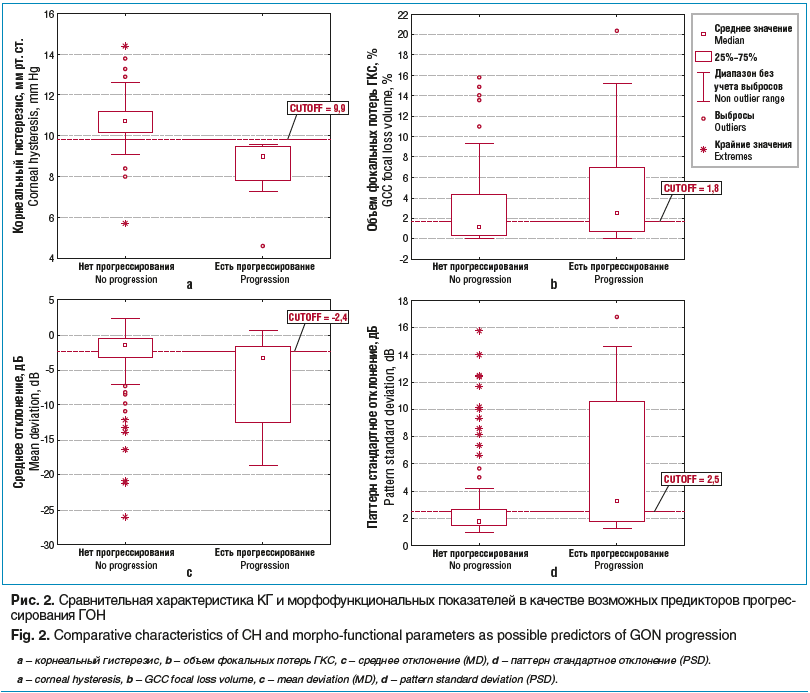
Исходный уровень ВГД в настоящем исследовании не вошел в число достоверно значимых предикторов прогрессирования ГОН, это мы объясняем тем фактом, что всем больным сразу было назначено гипотензивное лечение. В то же время было замечено, что в группе больных с отсутствием прогрессирования ГОН число пациентов, находящихся на лечении аналогами простагландинов (АП), в 2 раза превышало таковое в группе больных с прогрессированием ГОН.
АП относятся к препаратам первого выбора в лечении глаукомы. Однако данных об их влиянии на прогрессирование заболевания в литературе пока немного. Впервые это было показано в недавнем исследовании UKGTS, где авторы продемонстрировали, что риск развития глаукомы на фоне лечения латанопростом был ниже, чем в группе плацебо [34]. Следует подчеркнуть, что это отличие было достоверным только на втором году наблюдения. Таким образом, наше исследование является первым, в котором пусть и косвенно, но указывается на значимость лечения АП с целью предупреждения прогрессирования ГОН, причем эти результаты получены при наблюдении, в 3 раза превосходящем по длительности UKGTS.
Результаты настоящего исследования показали более частое применение α2-адреномиметиков в группе больных с прогрессированием ГОН, несмотря на известный факт нейропротекторной активности бримонидина [35]. Однако это мы объясняем возможным нарушением режима закапывания препарата вследствие его побочных эффектов [36].
Выводы
Исходно низкий уровень КГ (но не исходное ВГД)
ассоциируется с прогрессированием ГОН.
Другие значимые факторы — возраст больных и степень глаукомного поражения, характеризуемая периметрическими индексами и толщиной слоя нервных волокон сетчатки, а также объемом фокальных потерь ее ганглиозного слоя.
Сведения об авторах:1Курышева Наталия Ивановна — д.м.н., профессор, руководитель консультативно-диагностического отдела; 2Шаталова Екатерина Олеговна — врач-офтальмолог; 1Лепешкина Людмила Вячеславовна — врач-офтальмолог. 1ФГБУ ГНЦ РФ ФМБЦ им. А.И. Бурназяна ФМБА России. 123098, Россия, г. Москва, ул. Гамалеи, д. 15. 2ООО «Клиника Доктора Шаталова». 1426113, Россия, Московская обл., г. Орехово-Зуево, ул. Набережная, д. 10а. Контактная информация: Курышева Наталия Ивановна, e-mail: e-natalia@list.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 16.09.2018.
About the authors:1Natalia I. Kurysheva — MD, PhD, Professor, Head of the Clinical Diagnostic Department; 2Ekaterina O. Shatalova — ophthalmologist; 1Ludmila V. Lepeshkina — ophthalmologist. 1Burnazyan Federal Medical Biophysical Center of Federal Medical Biological Agency. 15, Gamalei str., Moscow, 123098, Russian Federation. 2LLC “Doctor Shatalov Clinic”. 10A, Naberezhnaja str., Orekhovo-Zuyevo, Moscow region, 1426113, Russian Federation. Contact information: Natalia I. Kurysheva, e-mail: e-natalia@list.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 16.09.2018.
Источник