Гипотензивный режим при глаукоме
В статье представлены результаты оригинального исследования, посвященного изучению эффективности различных режимов терапии первичной открытоугольной глаукомы, а также алгоритмов выбора и смены компонентов этого лечения офтальмологами в условиях реальной клинической практики.

Актуальность
Глаукома является ведущей причиной необратимой слепоты во всем мире. У большого числа пациентов с глаукомой отмечается потеря или выраженное сужение полей зрения на обоих глазах [1–3]. По данным Всемирной организации здравоохранения (ВОЗ), ежегодно регистрируется около 600 тыс. новых случаев слепоты в результате заболевания глаукомой, а общее количество больных в мире уже превысило 100 млн человек. Практически во всех регионах России глаукома занимает 1-е место среди причин инвалидности вследствие офтальмопатологии [4–6]. Ранее было неоднократно установлено, что именно интолерантный уровень офтальмотонуса является наиболее доказанным фактором риска прогрессирования и развития глаукомной оптической нейропатии (ГОН) [7–9]. Предполагается, что понижение уровня внутриглазного давления (ВГД) является единственным подтвержденным способом стабилизации глаукомного процесса и требует длительного и, вероятнее всего, пожизненного местного гипотензивного лечения [10–13].
Таким образом, ключевым моментом лечения глаукомы является достижение «давления цели» [14, 15]. Чем больший ущерб нанесен состоянию зрительного нерва и чем более выражены изменения полей зрения, тем меньше должен быть уровень ВГД [16, 17]. Согласно рекомендациям Российского глаукомного общества (РГО), рекомендуемый верхний порог тонометрического уровня ВГД (измеренного по Маклакову, грузом 10 г) при начальной стадии глаукомы должен находиться в пределах 22–24 мм рт. ст., при развитой — в диапазоне 19–21 мм рт. ст., а при далеко зашедшей стадии — от 16 до 18 мм рт. ст. [18]. Достижение целевых уровней ВГД возможно путем назначения местной гипотензивной медикаментозной терапии, лазерного или хирургического лечения [19]. При этом режим терапии определяет непосредственно офтальмолог, исходя из личного опыта, финансовых возможностей пациента, данных объективных методов исследования и, лишь отчасти, ориентируясь на доступные клинические рекомендации [20]. Большую роль играет и приверженность пациентов лечению. Так, согласно данным исследовательской группы по изучению лечения офтальмогипертензии (OHTS) и других многоцентровых исследований, проведенных за последние годы, большинство пациентов через 5 лет получают лечение двумя и более препаратами, а по данным отечественных авторов — тремя и более препаратами, что снижает их приверженность лечению, эффективность гипотензивного лечения и, как следствие, приводит к назначению дополнительных инстилляций или инвазивных манипуляций [21–29].
В связи с этим целью настоящего исследования явилось изучение эффективности различных режимов терапии, а также алгоритмов выбора и смены компонентов этого лечения офтальмологами в условиях реальной клинической практики.
Материал и методы
Данное исследование стало продолжением опубликованной ранее работы, посвященной изучению основных характеристик синдрома «сухого глаза» (ССГ) у пациентов с первичной открытоугольной глаукомой (ПОУГ) [22]. В базу данных комбинированного аналитического многоцентрового когортного исследования, проведенного в период с января по май 2016 г. на 31 научно-клинической базе 4 стран (Беларусь, Казахстан, Россия, Узбекистан), были включены результаты обследования 398 человек (641 глаз; 242 женщины, 60,8%; 156 мужчин, 39,2%). В исследование включены пациенты с ПОУГ, диагностированной не менее чем 6 мес. назад. Участие пациентов в исследовании было подтверждено их письменным согласием. Ретроспективный компонент исследования включал изучение анамнеза заболевания от момента установления диагноза. Во всех случаях диагноз был установлен и подтвержден специальными методами исследования. Стадия глаукомы на момент первичного диагностирования заболевания устанавливалась по данным медицинской документации. На момент включения в исследование проводилась дополнительная документальная верификация стадии заболевания, согласно действующей классификации глаукомы, с измерением тонометрического уровня ВГД (по Маклакову), исследованием морфометрических и функциональных показателей. Все клинические исследования, подразумевающие измерение офтальмотонуса, на момент включения в исследование производились в интервале от 9:00 до 12:00.
Критериями включения в основную группу стали:
европеоидная раса пациентов с начальной, развитой или далеко зашедшей стадиями ПОУГ с длительностью заболевания не менее 6 мес. на момент финального осмотра; возраст от 40 до 89 лет; клиническая рефракция ±6,0 диоптрий и астигматизм степенью до ±3,0 диоптрий. На момент финального обследования пациенты могли получать любую медикаментозную гипотензивную терапию или не получать ее по причине удачно выполненной антиглаукомной операции.
Критериями исключения были: выраженные помутнения оптических сред, затрудняющие использование морфометрических или периметрических методов исследования либо приводящие к неправильной трактовке их результатов; возрастная макулодистрофия; постокклюзионная и диабетическая ретинопатия; травмы и заболевания органа зрения в анамнезе, затрудняющие проведение тонометрии; интракапсулярная экстракция катаракты, «классическая» экстракапсулярная экстракция катаракты или факоэмульсификация, прошедшие с осложнениями (например, с частичной потерей стекловидного тела); отслойка сетчатки; системные заболевания, требующие гормональной терапии.
Методы статистического анализа
Обработка полученных данных проводилась с использованием программы Statistica (версии 8.0, StatSoft Inc., США). Все исследуемые параметры представлены в формате Мe (Q25%; Q75%), где Мe — медиана, а Q25% и Q75% — квартили. Для попарного сравнения двух независимых выборок использовался U-критерий Манна — Уитни, для внутригрупповых сравнений — T-критерий Вилкоксона. Для проверки равенства медиан нескольких независимых выборок применяли H-критерий Краскела — Уоллеса. Критический уровень значимости при проверке статистических гипотез принимался <0,05.
Результаты
Стадии глаукомы и уровень ВГД
Было установлено, что средний уровень ВГД (все стадии заболевания) на момент диагностики глаукомы составил 28,00 (26,00; 30,00) мм рт. ст. Далее нами был проведен анализ показателей офтальмотонуса на момент диагностики заболевания в зависимости от стадии ПОУГ к моменту финального обследования (табл. 1). Обнаружено, что те пациенты, у которых была констатирована далеко зашедшая стадия болезни, на момент диагностики имели уровень ВГД значимо выше, чем у пациентов со 2-й и 1-й стадиями заболевания. Таким образом, уровень ВГД на момент диагностики ПОУГ может определять стадию болезни и служить прогностическим признаком течения заболевания. Так, при уровне ВГД 30 мм рт. ст. и более на момент диагностики заболевания существует больший риск прогрессирования глаукомы до продвинутых стадий в сравнении с более низкими уровнями офтальмотонуса (27,00 (25,00; 29,00) и 28,00 (26,00; 30,00)) мм рт. ст.
Также были проанализированы изменения уровня ВГД на фоне лечения при различных стадиях глаукомы. У пациентов с начальной стадией уровень офтальмотонуса был выше, чем у пациентов с развитой и далеко зашедшей стадиями болезни (p=0,030 и p=0,031 соответственно), при этом значимых различий между развитой и далеко зашедшей стадиями не было выявлено (p=0,921). У всех пациентов наблюдалось значимое снижение ВГД на фоне лечения, однако целевые цифры ВГД, согласно рекомендациям РГО (2015), были достигнуты лишь при 1-й и 2-й стадиях глаукомы (табл. 2). Это объясняется значительной сложностью в достижении более низких уровней ВГД при далеко зашедшей глаукоме, с одной стороны, и исчерпанием механизмов компенсации величины офтальмотонуса (баланс «образование камерной влаги — отток») — с другой. Кроме того, при 3-й стадии у клиницистов существует психологический барьер в отношении назначения более агрессивных методов лечения в связи с рисками осложнений и отсутствием веры пациента в успех тех или иных манипуляций [17].
Также из таблицы 2 следует, что количество пациентов (глаз) с компенсацией уровня ВГД значимо отличалось между всеми стадиями (использовался критерий χ2 с поправкой Йетса). Таким образом, следует принять во внимание, что количество пациентов с компенсацией офтальмотонуса обратно пропорционально стадии заболевания.
Режимы и уровень ВГД
На момент финального исследования у всех пациентов с глаукомой (641 глаз) использовались 44 различных режима (терапия, лазеры, хирургия), которые состояли из одного или нескольких компонентов: бета-адреноблокаторы (ББ), аналоги простагландинов (ПГ), местные ингибиторы карбоангидразы (ИКА), альфа-адреномиметики (АМ), холиномиметики (ХМ), лазерная трабекулопластика (ЛТП), непроникающая глубокая склерэктомия (НГСЭ) и синустрабекулэктомия (СТЭ). Стоит отметить, что некоторые режимы отличались малым количеством случаев, поэтому для упрощения представления информации (данных анализа) были отобраны 11 наиболее популярных, охватывающих 81,9% случаев (525 глаз). Эти данные приведены в таблице 3. По нашему мнению, такое многообразие режимов обусловлено попыткой офтальмологов подобрать индивидуальное лечение сугубо эмпирически. При этом, по мнению авторов статьи, стратегия назначений должна быть достаточно строгой и включать только наиболее часто назначаемые (т. е. эффективные) схемы лечения и комбинации лекарственных средств (монотерапия ПГ, фиксированная комбинация ББ и ПГ изолированно или в сочетании с ИКА/АМ в качестве максимально переносимой медикаментозной терапии), а также проведение лазерного лечения или выполнение традиционных хирургических пособий.
Из таблицы 3 следует, что 301 случай связан с применением всего 3 режимов (ПГ; ПГ, ББ; ПГ, ББ, ИКА), количество случаев использования других медикаментозных режимов — значительно меньше.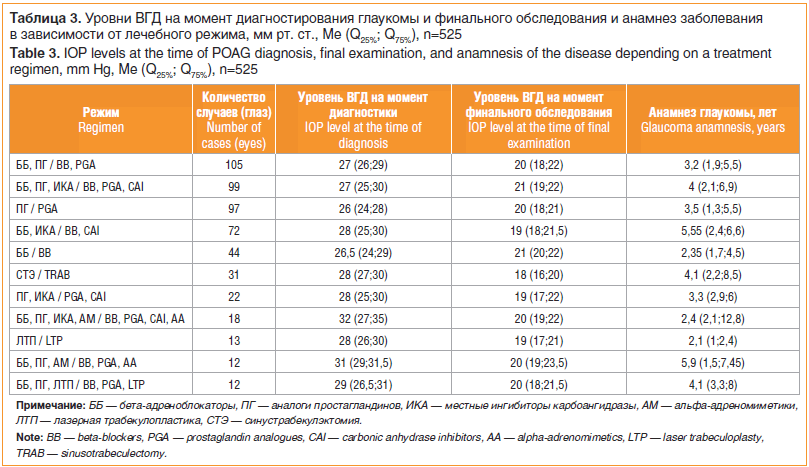
Из таблицы 3 следует также, что первым шагом в лечении недавно диагностированных случаев с умеренно повышенным ВГД чаще является монотерапия с использованием ББ. Значительно менее популярна на старте лечения монотерапия с применением ЛТП (в целом занимая 2-е место по частоте назначения при малом сроке анамнеза). Стоит отметить, что число пациентов, получающих монотерапию ББ и ЛТП и достигших ВГД 20–21 мм рт. ст., со временем уменьшается (что, несомненно, обусловлено снижением гипотензивного эффекта), уступая место более «долгоиграющим» режимам (второй шаг в лечении). Так, при большей продолжительности заболевания выделяются 2 пика «популярности» — монотерапия с назначением аналогов ПГ и комбинация ББ и ПГ. При этом, позволяя достигнуть более низких значений офтальмотонуса, оба режима обеспечивают и большую продолжительность эффективного гипотензивного воздействия в сравнении с монотерапией ББ (3,5 (1,3; 5,5) года; 3,2 (1,9; 5,5) года и 2,35 (1,7; 4,5) года соответственно). Следующим шагом при увеличении продолжительности анамнеза является усиление режима до применения тройной комбинации (ББ, ИКА, ПГ) либо проведение традиционной хирургии (СТЭ).
Интересным наблюдением, следующим из таблицы 3, стал тот факт, что у пациентов с анамнезом около 5,5 года в большинстве случаев используется режим ББ в комбинации с местными ИКА. Такой выбор может быть связан как с недавним переводом на этот режим после отмены предыдущего, включающего ПГ, вследствие развития побочных явлений (прогрессирование ССГ, гиперемия конъюнктивы, усиление роста ресниц, особенно при односторонней глаукоме), так и длительным применением комбинации ББ и местных ИКА при непрогрессирующем характере течения начальной стадии ПОУГ.
При анализе зависимости содержания режима терапии от анамнеза при различных стадиях глаукомы было установлено, что после диагностирования ПОУГ на начальной стадии с увеличением срока наблюдения наиболее популярными используемыми режимами являются (в порядке убывания): ББ, ББ+ПГ, ПГ, ББ+ПГ+ИКА, ББ+ИКА (рис. 1).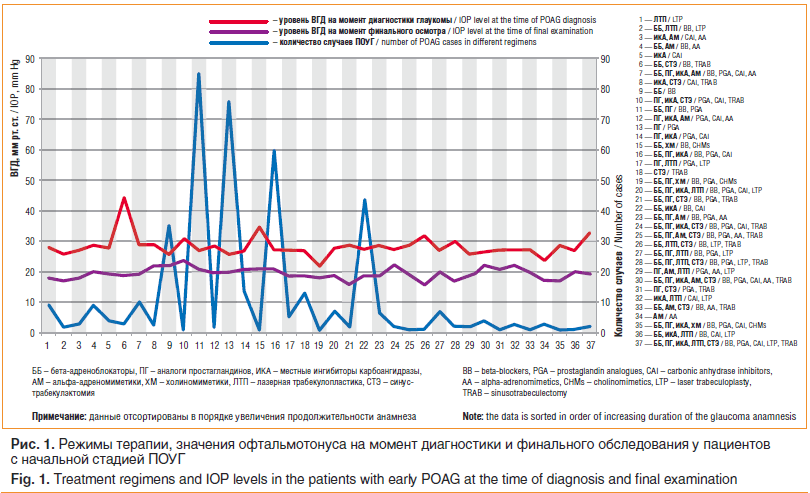
У пациентов с развитой стадией заболевания с увеличением анамнеза глаукомы наиболее предпочтительными режимами являлись: ПГ, ББ+ПГ, ББ+ИКА, ББ+ПГ+
ИКА (рис. 2).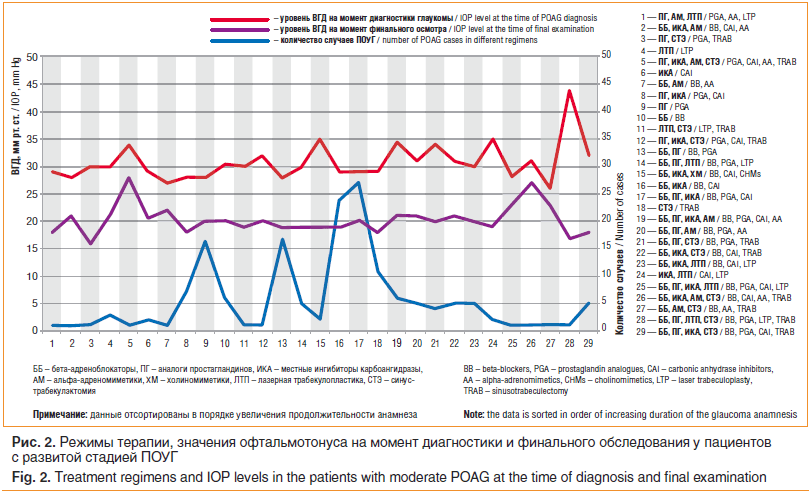
У пациентов с далеко зашедшей стадией болезни были выявлены следующие закономерности: следуя необходимости быстрого и выраженного снижения уровня офтальмотонуса, предпочтение отдавали старту с максимального медикаментозного режима (ББ+ПГ+ИКА), в дальнейшем переходя к СТЭ. Стоит также отметить, что при развитой и, особенно, далеко зашедшей стадиях глаукомы подавляющее большинство медикаментозных режимов были многокомпонентными, что связано с отсутствием уверенности врачей-офтальмологов в возможности достижения целевого уровня ВГД на фоне монотерапии (рис. 3).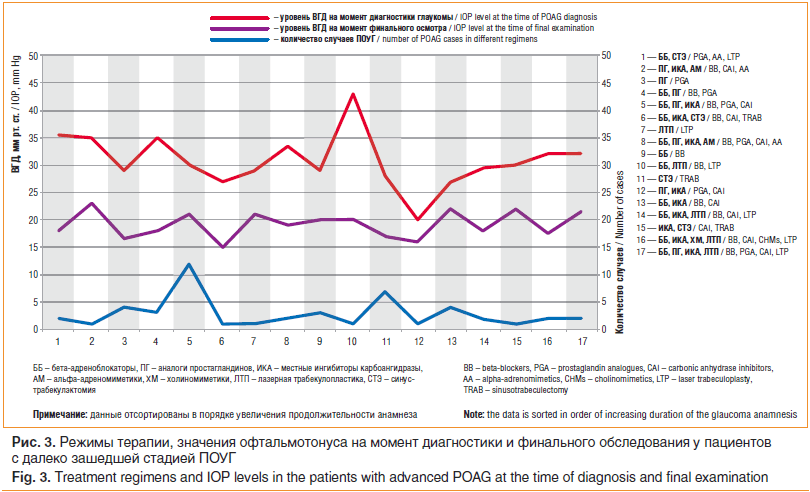
Таким образом, большинство клиницистов первой линией терапии у пациентов с начальной ПОУГ выбирают ББ. Вместе с тем при продвинутых стадиях болезни, вследствие необходимости достижения более выраженного гипотензивного эффекта, аналоги ПГ в виде монотерапии или комбинации с ББ оказываются более востребованными. При далеко зашедшей глаукоме, учитывая важность сохранения зрительных функций и достижения уровня ВГД ниже 18 мм рт. ст., лечение начинают сразу с максимально переносимого медикаментозного режима, переходя к оперативному лечению.
Ограничения исследования
В исследование включены неоднородные массивы подгрупп пациентов с разными стадиями глаукомы. Так, на момент диагностирования заболевания 1-я стадия была установлена на 428 глазах, 2-я — на 164 глазах, 3-я стадия — на 49 глазах. В то же время при финальном обследовании таких глаз было 314, 174 и 153 соответственно. Таким образом, глаз с далеко зашедшей стадией глаукомы было в 2 раза меньше, чем с начальной стадией заболевания, что соответствует естественной убыли населения. Стоит отметить, что при анализе режима лечения не учитывали, какой ПГ или местный ИКА использовали пациенты. Это видится нам важным, с учетом имеющихся данных о различной гипотензивной эффективности различных препаратов одной фармакологической группы.
Также не было сделано различий при учете гипотензивной эффективности фиксированных комбинаций и аналогичных раздельных антиглаукомных режимов, что, в свою очередь, могло влиять на приверженность пациентов терапии из-за значительной разницы в количестве инстилляций в сутки и существенно отразиться на эффективности лечения.
Кроме того, не регистрировали продолжительность каждого режима, который пациент получал на протяжении всего лечения, а лишь констатировали общую продолжительность наблюдения и содержание актуального гипотензивного режима. Также необходимо учитывать, что зачастую причиной смены режимов могла быть не только недостаточная гипотензивная эффективность, но и побочные эффекты применения лекарственных средств определенных групп (ПГ), поэтому некоторые лекарственные сочетания, особенно при длительном анамнезе или при односторонней глаукоме, могли быть назначены исключительно из соображений влияния на качество жизни пациента.
Заключение
Установлено, что уровни ВГД на момент диагностики являются прогностическим критерием течения заболевания (чем выше ВГД, тем выше риск развития продвинутых стадий глаукомы). По-прежнему сохраняется тенденция к выбору в качестве стартового режима при начальной глаукоме монотерапии с применением ББ, что, согласно данным группы исследователей «Научный Авангард» (руководитель — д.м.н. А.В. Куроедов, 2011–2017), приводит к прогрессированию заболевания, при этом аналоги ПГ назначаются в качестве единственного препарата или в комбинации с ББ при продолжительности глаукомы более 3,5
(1,3; 5,5) года. При продвинутых стадиях заболевания с целью достижения более выраженного гипотензивного эффекта более предпочтительными оказываются монотерапия ПГ, ПГ+ББ, ПГ+ИКА, ББ + проникающая антиглаукомная хирургия. В большинстве случаев удается добиться целевых цифр ВГД (согласно рекомендациям РГО, 2015) при начальной стадии глаукомы (95,86% случаев), при развитой — в 3/4 случаев (74,14%), в то время как при далеко зашедшей — лишь у 1/3 пациентов (35,95%), даже на фоне выполненной ранее СТЭ и максимальной медикаментозной терапии.
Необходимо отметить, что в условиях реальной клинической практики отмечается большое разнообразие режимов (комбинаций лекарственных препаратов), обусловленное желанием офтальмологов индивидуализировать подход к ведению пациента. По мнению авторов статьи, также необходимо соблюдать определенную последовательность, продолжительность (в случае отсутствия целевых значений показателей офтальмотонуса) и состав режимов терапии для обеспечения максимального гипотензивного воздействия и снижения риска прогрессирования глаукомы (безусловно, принимая во внимание качество жизни пациента).
Сведения об авторах:1Нагорнова Зоя Михайловна — ассистент кафедры
оториноларингологии и офтальмологии; 1Селезнев Алексей Владимирович — к.м.н, доцент кафедры оториноларингологии и офтальмологии; 2Завадский Павел Чеславовоич — к.м.н., врач-офтальмолог; 3,4Куроедов Александр Владимирович — д.м.н., профессор кафедры офтальмологии, начальник офтальмологического отделения. 1ФГБОУ ВО ИвГМА Минздрава России. 153012, Российская Федерация, г. Иваново, Шереметевский проспект, д. 8. 2ИМФУП «Медицинский центр «Новое зрение». 220070, Республика Беларусь, г. Минск, ул. Клумова,
д. 5а. 3ФКУ «ЦВКГ им. П.В. Мандрыка» Минобороны России. 107014, Российская Федерация, г. Москва, ул. Б. Оленья, д. 8а. 4ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Российская Федерация, г. Москва, ул. Островитянова, д. 1. Контактная информация: Куроедов Александр Владимирович, e-mail: akuroyedov@hotmail.com. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 06.11.2017.
About the authors:1Zoya M. Nagornova — assistant of the Department of Otorhinolaryngology and Ophthalmology; 1Alexey V. Seleznev — Associate Professor, PhD in medical sciences, MD, Associate Professor of the Department of Otorhinolaryngology and Ophthalmology; 2Pavel Ch. Zavadsky — PhD in medical sciences, MD, ophthalmologist; 3,4Alexander V. Kuroyedov — Professor, Senior Doctorate in medical sciences, MD, Head of ophthalmology Department. 1Ivanovo State Medical Academy. 8, Sheremetevsky Ave., Ivanovo, 153012, Russian Federation. 2High-tech Cataract Treatment Center «New Vision». 5a, Klumova str., Minsk, 220070, Republic of Belarus. 3Central Military Clinical Hospital named after P.V. Mandryka. 8A, B. Olenya str., Moscow, 107014, Russian Federation. 4Pirogov Russian National Research Medical University. 1, Ostrovityanova str., Moscow, 117997, Russian Federation. Contact information: Alexander V. Kuroyedov, e-mail: akuroyedov@hotmail.com. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 06.11.2017.
Источник
Петухов В.М., Сеннова Л.Г.
ГОУ ВПО «Самарский государственный медицинский университет» Минздравсоцразвития России, кафедра глазных болезней ИПО, г. Самара
Проблема лечения больных первичной открытоугольной глаукомой не утратила своей актуальности, несмотря на все достижения последних десятилетий в вопросах медикаментозного, лазерного и микрохирургического лечения, поскольку до настоящего времени эта патология органа зрения является наиболее частой причиной слепоты и инвалидности.
Основополагающим фактором стабилизации глаукоматозного процесса и соответственно сохранения зрительных функций является нормализация внутриглазного давления и восстановление до физиологических значений показателей гидро- и гемодинамики. Однако, в пресбиопическом возрасте, когда нарушается функция аккомодации, создаются предпосылки для развития целого ряда заболеваний дистрофического характера, одним из которых является первичная открытоугольная глаукома.
Одним из основных факторов риска возникновения глаукоматозной оптической нейропатии, на который ориентированы врачи поликлинического звена, является повышенное внутриглазное давления (ВГД). Непосредственной причиной его повышения является ухудшение оттока внутриглазной жидкости, в основе которого лежат изменения дренажной системы глаза [2]. Подбор местной гипотензивной терапии — первый этап в лечении больных глаукомой и он индивидуален для каждого больного [1]. В распоряжении врача — офтальмолога большой арсенал гипотензивных препаратов, однако, при выборе того или иного препарата необходимо учитывать уровень ВГД, характер изменений угла передней камеры (УПК), стадию глаукоматозного процесса, возраст, сопутствующую сосудистую патологию.
Цель — разработка дифференцированного подхода к назначению местной гипотензивной терапии больным первичной открытоугольной глаукомой в зависимости от уровня ВГД и данных гониоскопии.
Материал и методы. Исследованы три группы больных — 328 пациентов с разным режимом миотиков. Всем проводилось стандартное обследование, включающее визометрию, статическую и кинетическую периметрию, прямую офтальмоскопию, гониоскопию, тонографию, тонометрию по Маклакову.
Результаты и обсуждение. Первую группу составили 117 больных (190 глаз), получающих монотерапию — ксалатан или траватан на ночь в течение нескольких месяцев — двух лет. Средний возраст пациентов — 62±2,5 года. Общая сопутствующая патология отмечена у 42 больных (гипертоническая болезнь, ИБС). В основном, это были больные с начальной стадией глаукомы — 89 глаз (46,8 %) и развитой — 101 глаз (53,2 %). Исходное ВГД составило 29,7±0,5 мм рт. ст. При гониоскопии отмечено, что угол передней камеры открыт, широкий, с неравномерной, слабовыраженной эндогенной пигментацией и очаговой атрофией корня радужной оболочки. В результате местной гипотензивной терапии ВГД снизилось до 20,0±0,9 мм рт. ст.
Во вторую группу вошли 129 больных (197 глаз), которым были назначены ?-адреноблокаторы (бетоптик или арутимол) 2 раза в день, а на ночь ксалатан или траватан, от нескольких месяцев до двух лет. Средний возраст соответствовал 65±2,1 лет. В этой группе больных чаще отмечалась общая сосудистая патология; гипертоническая болезнь (62), ИБС (7), сахарный диабет (8). Начальная стадия глаукомы установлена на 42 глазах (21,3 %), развитая — на 93 (47,2 %), далекозашедшая — на 62 глазах (31,5 %). Исходное ВГД было выше, чем в первой группе больных и составило 30,5±0,5 мм рт. ст. Гониоскопическая картина УПК была аналогична таковой в первой группе больных, однако, эндогенная пигментация была более выраженной и равномерной. В результате лечения ВГД снизилось до 22,5±0,4 мм рт. ст.
В третью группу вошли 82 больных (135 глаз), получающих максимальный режим миотиков: фотил два раза в день и ксалатан или траватан на ночь в течение нескольких месяцев. Средний возраст больных — 69,0±2,3 лет, чаще отмечалась общая сосудистая патология: гипертоническая болезнь, ИБС — у 57 больных, сахарный диабет — у 6 больных, гинерализованный атеросклероз — у 6 больных. Что касается стадии глаукомы, то в данной группе преобладали развитая стадия на 81 глазах (60 %), далекозашедшая — на 54 глазах (40 %). До лечения среднее ВГД составило 34,6±0,5 мм рт. ст. При гониоскопии отмечено, что УПК клювовидного профиля, узкий, при гониокомпрессии открывался до склеральной шпоры, выраженная эндогенная пигментация. После местной гипотензивной терапии ВГД снизилось до 24,3±0,6 мм рт. ст.
Выводы. Монотерапия препаратами ксалатан или траватан эффективна при открытом УПК и слабо выраженной пигментации элементов дренажной зоны глаза, при исходном уровне ВГД не более 31 мм рт. ст., в основном при начальной и развитой стадиях заболевания.
При исходном уровне ВГД 32–35 мм рт. ст. и выраженной эндогенной пигментации трабекулы наиболее эффективно сочетание ?-адреноблокаторов с ксалатаном или траватаном.
При исходном ВГД более 35 мм рт. ст. и клювовидном профиле УПК показано назначение комбинированных препаратов: фотил и ксалатан.
Источник