Генетический фактор в развитии глаукомы
Медицинский эксперт статьи

х
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Если суммировать причинные факторы развития глаукомы, можно составить следующую картину: дисфункция гипоталамуса приводит к эндокринным и обменным нарушениям, которые в свою очередь обусловливают местные нарушения. Наследственная глаукома связана с дисфункцией гипоталамуса, эндокринными и обменными нарушениями. Наследственные факторы обусловливают анатомическую предрасположенность, нарушения гидростатики и гидродинамики, что вызывает повышение внутриглазного давления.
Теории развития глаукомы
Первый период (конец XIX — начало XX вв.) — теория ретенции, т. е. задержки оттока внутриглазной жидкости из глаза. Повышение внутриглазного давления объяснялось развитием гониосинехий, пигментаций угла передней камеры. Сведения были получены при изучении энуклиированных глаз (слепых с абсолютной глаукомой). Другие факторы (нервный, сосудистый, эндокринный) игнорировались. Но оказалось, что пигментация гониосинехий не всегда приводит к глаукоме.
Второй период (1920-1950-е гг.) — нейрогуморальный, характеризующийся изучением различных сторон жизнедеятельности больных глаукомой, т. е. состояния нервной и эндокринной систем. Игнорировались местные, механические и сосудистые факторы.
Третий период (с 1950-х гг.) — синтетический подход, учитывающий общие и местные механизмы повышения внутриглазного давления, базирующийся на новых данных: роли наследственности в передаче глаукомы, феномене стероидной глаукомы, непосредственных причинах повышения внутриглазного давлении (гистологических, гистохимических, тонографических и т. д.), патогенезе глаукомной атрофии зрительного нерва.
- Наследственность. Генная предрасположенность к первичной глаукоме существует (по крайней мере обнаружены два гена, способствующие развитию этого заболевания). Установлено, что ответственным за развитие глаукомы является не единственный ген. Существует несколько генов, которые при наличии в них патологических изменений приводят к заболеванию. Заболевание, кроме того, проявляется лишь при других внешних факторах, воздействующих на организм, или если мутации присутствуют в нескольких генах одновременно. В случаях когда в семье заболеваемость глаукомой наблюдается достаточно часто, наследственность должна рассматриваться как важный фактор риска. Имеет значение также то обстоятельство, что члены семьи, живя вместе, подвергаются одинаковым факторам влияния окружающей среды. И это параду с генетической предрасположенностью играет существенную роль в развитии глаукомы. «Стероидный тест» — повышение внутриглазного давления на введение стероидов — дополняет генетическую предрасположенность. Предрасположенность к глаукоме передается по доминантному типу. У изомерных племен глаукомы нет, в Нормандии, Швеции, Дании глаукома встречается у 2-3% жителей.
- Нейрогенная теория — нарушение взаимодействия тормозных процессов коры и подкорки, баланса возбудимости симпатической и парасимпатической систем.
- Нарушение гемодинамики глаза — переднего и заднего отрезков, С возрастом понижается пульсовое давление крови, уменьшается периферический объем циркулирующей крови, что приводит к понижению объема крови, текущей по увеальному тракту, переднему отделу глазу. Это вызывает дистрофические явления в трабекуле, цилиарном теле, что приводит к изменению внутриглазного давления и понижению зрительной функции.
С. Н. Федоров, развивая гемодинамическую теорию, предложил считать, что глаукома является ишемической болезнью глаза и имеет три стадии, такие как:
- ишемия переднего отрезка глаза;
- повышение внутриглазного давления;
- ишемия зрительного нерва при повышении внутриглазного давления.
Н. В. Волков высказал предположение о соотношении внутричерепного, внутриглазного и артериального давлении как ведущем факторе в генезе глаукомы. Нарушается нормальное соотношение внутриглазного и внутричерепного давления. В норме это соотношение; если происходит увеличение 3 : 1, то это приводит к развитию глаукомной атрофии зрительного нерва.
Патогенез первичной глаукомы по А. П. Нестерову
- Возрастные дистрофические и функциональные нарушения в анатомически предрасположенном глазу.
- Гидростатические сдвиги — изменение нормального соотношения внутриглазного давления в различных замкнутых и полузамкнутых системах глаза (1/4-1/3 внутриглазной жидкости отекает по заднему пути).
- Функциональный блок дренажной системы глаза.
- Нарушение гидродинамики глаза.
- Повышение внутриглазного давления, вторичные сосудистые дегенеративные изменения в переднем и заднем отрезках глаза.
- Органический блок дренажной системы глаза с атрофией зрительного нерва и потерей зрительных функций.
Вторичные изменения в глазу приводят к повышению внутриглазного давления, которое в свою очередь вызывает вторичные изменения.
У больных сахарным диабетом в три раза чаше бывает глаукома. У 35% больных глаукомой отмечаются нарушение белкового обмена и гиперхолестеринемия.
Дистрофические изменения. Дегенерация соединительной ткани приводит к фрагментированному распаду соединительнотканных веществ в сосудах, трабекулах. Дистрофия эндотелия при водит к его пролиферации и склерозу трабекулы, в результате чего происходит облитерация коллекторов. Распад коллагеновых волокон приводит к тому, что трабекулы теряют тонус и вдавливаются в зону шлеммового канала, коэффициент легкости оттока жидкости С уменьшается почти в 2 раза, затем отток почти прекращается, вторично нарушается секреция.
В начальных стадиях глаукомы коэффициент С уменьшается до 0,13, в развившейся стадии глаукомы — до 0,07, в терминальной стадии — до 0,04 и меньше.
Блоки гидростатической и гидродинамической системы по А. П. Нестерову и их причины
- Поверхностный склеральный блок. Причина: сдавление и заращение эписклеральных венозных сосудов.
- Блок выпускников шлеммова канала. Причина: внутренние стенки шлеммова каната закрывают устья коллекторных каналов.
- Блокада шлеммова канала. Причина: внутренняя стенка шлеммова капала смещается и блокирует его просвет, происходит коллапс шлеммова канала.
- Блок трабекулярной сети. Причина: сдавление трабекулярных щелей, отхождение эксфолиативных пигментов крови. воспалительные и дистрофические изменения,
- Блок угла передней камеры. Причина: смещение кпереди корня роговицы, развитие гониосинехий при врожденной глаукоме — дефекты эмбрионального развития.
- Хрусталиковый блок. Причина: смещение хрусталика в сторону передней камеры, цилиарное тело касается хрусталика, направляя в полость стекловидного тела.
- Задний витреальный блок. Причина: внутриглазная жидкость скапливается в стекловидном теле, и оно отодвигается кпереди.
- Зрачковый блок бывает относительным и абсолютным. Причина: плотное прилегание и приращение роговицы к передней капсуле хрустатика — окклюзия зрачка.
Факторы риска развития глаукомы
Возраст, особенно при первичной глаукоме, играет важную роль. К возрастной группе чаще всего относятся пациенты старше 40 лет. С возрастом повышение внутриглазного давления отмечается даже в здоровых глазах, так как процесс старения происходит в трабекулярной сети. В этот период также снижается продукция водянистой влаги, поэтому внутриглазное давление умеренно повышается. Внутриглазное давление у большинства больных с глаукомой начинает повышаться между 40 и 50 годами, иногда и в более позднем периоде.
Пол. Женщины чаще страдают закрытоугольной глаукомой, а мужчины — пигментной глаукомой. У женщин чаще определяется глаукома с нормальным давлением, хотя диск зрительного нерва у них более чувствителен к внутриглазному давлению.
Расовая принадлежность. Пациенты африканского происхождения часто имеют более высокое внутри глазное давление. Повышенное внутриглазное давление у них отмечается в более раннем возрасте. Пигментная глаукома наиболее распространена у людей со светлой кожей. Закрытоугольная глаукома характерна для Азии, у японцев глаукома часто бывает с нормальным давлением. Развитию псевдоэксфолиативной глаукомы наиболее подвержены выходцы с Кавказа, проживающие в странах Северной Европы.
Наследственность. Факт наследственной предрасположенности к глаукоме известен давно. Однако это не означает, что у ребенка, родители которого страдают глаукомой, обязательно разовьется это заболевание. Глаукома может появиться спонтанно и без семейной предрасположенности к этому заболеванию. Врожденная, детская и ювенильная глаукома чаще имеет наследственный характер, но наблюдаются и спонтанные случаи заболевания глаукомой у этой категории пациентов. Но все же генетическая предрасположенность к развитию высокого внутриглазного давления и риск развития глаукомы иногда даже при нормальном внутриглазном давлении не отрицаются и имеют большое значение.
Атеросклероз — одна из главных проблем здоровья в современном обществе. Кровеносные сосуды глаза также, как и любые другие сосуды, могут страдать от атеросклероза. При атеросклерозе более часто и в более раннем возрасте развиваются катаракта и макулодистрофия (возрастные изменения центральной зоны сетчатки). Исследования показывают, что атеросклероз не повышает риска развития глаукомы, и тем не менее имеется слабая зависимость между атеросклерозом и повышением внутриглазного давления. Люди, страдающие атеросклерозом, с большей вероятностью будут иметь повышенное внутриглазное давление по сравнению со здоровыми людьми того же возраста.
Близорукость и дальнозоркость. Здоровые дальнозоркие и близорукие глаза имеют такое же среднее внутриглазное давление. Однако при дальнозоркости риск развития закрытоугольной глаукомы выше, в то время как при близорукости чаще наблюдается пигментная глаукома. Такие глаза более чувствительны к последствиям повышенного внутриглазного давления.
Нарушения глазного кровообращения. Тот факт, что уменьшение глазного кровотока обычно наблюдается раньше, чем глаукоматозные поражения, а пациенты с глаукомой часто имеют нарушения кровообращения и в других органах, указывает на то, что некоторые из этих нарушений носят причинный характер,
У некоторых глаукомных пациентов отмечается изменение кровообращения даже в покое, но особенно после физических нагрузок, эмоционального стресса или холода. Имеются различные признаки, которые, скорее всего, обусловлены сосудистой дисрегуляцией, а не атеросклеротическими нарушениями кровообращения. Доказано, что пациенты с глаукомой гораздо чаще страдают различными нарушениями кровообращения, чем здоровые люди того же возраста. При низком внутриглазном давлении, при котором развивается глаукоматозное поражение, есть вероятность того, что в патологическом процессе участвует также и нарушение кровообращения. В наиболее серьезных случаях недостаточное кровообращение (т. е. питание зрительного нерва) может привести к структурному повреждению, причем иногда даже при достаточно низких уровнях внутриглазного давления. Наиболее частая причина снижения кровоснабжения — это атеросклероз. Он может вести к сужению кровеносных сосудов, тромбозу и эмболии. Главная причина ухудшения глазного кровотока при глаукоме — это дизрегуляторные нарушения в кровеносных сосудах, включая и сосуды глаза. У больных, которые страдают сосудистой дизрегуляцией, наблюдается тенденция к пониженному артериальному давлению (гипотонии), особенно по ночам, и развитию вазоспазма.
Кровяное давление. Повышенное кровяное давление — гипертония — представляет известный риск для здоровья. Постоянного кровяного давления не существует. Оно может меняться в течение дня в зависимости от физической нагрузки, положения человека (горизонтального или вертикального), приема пищи и использования лекарственных средств.
Глаукома часто сочетается с нормальным кровяным давлением в течение дня, но ночью оно может или понижаться, или повышаться, чего не бывает у здоровых людей.
Для больных глаукомой значительное ортостатическое падение давления (при изменении положения тела от горизонтального к вертикальному) может быть достаточно опасным.
Повышенное кровяное давление при глаукоме не имеет столь серьезного значения, но хроническое повышение кровяного давления ведет к прогрессированию атеросклероза, имеющего следствием развитие офтальмопатологии, в том числе и глаукомы.
Временные падения кровяного давления распространены среди больных, страдающих вазоспастическим синдромом, так как глазное кровообращение у них очень чувствительно к снижению уровня кровяного давления.
Кровеносные сосуды глаза обеспечивают питание различных частей глазного яблока. Активная регуляция глазного кровотока осуществляется следующим образом. Когда свет попадает в глаз здорового человека, кровоснабжение сетчатки и зрительного нерва немедленно увеличивается. Это приводит к снижению кровяного давления в сосудах на входе в сетчатку и вызывает дефицит кровоснабжения. Чтобы компенсирован, этот дефицит, сосуды расширяются. Таким образом и осуществляется регуляция глазного кровотока.
Сахарный диабет. При диабете могут возникнуть необратимые поражения глаз, особенно при развитии глаукомы. При диабете возможно значительное повышение внутриглазного давления, что рассматривается как осложнение глаукомы. Появились данные о том, что при диабете глаукома встречается реже.
Таким образом, первичными факторами риска повышения внутриглазного давления и как следствие развитие глаукомы, являются возраст, наследственность, расовая принадлежность, атеросклероз и близорукость. Первичные факторы риска для развития глаукоматозного поражения — повышенное внутриглазное давление, сосудистая дисрегуляция с системной гипотензией и вазоспазм, женский пол и расовая принадлежность.
Дополнительные факторы (анатомическая предрасположенность к развитию глаукомы)
- Близорукость и дальнозоркость. Здоровые гиперметропические и миопические глаза имеют среднее внутриглазное давление. Однако при дальнозоркости риск развития закрытоугольной глаукомы выше, а при близорукости чаше наблюдается пигментная глаукома. Такие глаза более чувствительны к последствиям повышенного внутриглазного давления.
- Малая перед не задняя ось глаза.
- Задняя локализация шлеммова канала.
- Мелкая передняя камера.
- Большой хрусталик.
- Малая кривизна роговицы приводит к мелкой передней камере.
- Атопия цилиарного тела, ослабление мышцы Брюкке, которая натягивает склеральную шпору, что приводит к спадению выпускников.
 [1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Важно знать!
Доказано, что лазерная трабекулопластика эффективно снижает внутриглазное давление при неконтролируемой открытоугольной глаукоме, как первичной, так и вторичной. Читать далее…
!
Обнаружили ошибку? Выделите ее и нажмите Ctrl+Enter.
Источник
Статья посвящена возможностям генетического исследования при первичной открытоугольной глаукоме
Особенностью течения ПОУГ является практически бессимптомное начало заболевания. В связи с этим важное значение имеют новые методы диагностики, в т. ч. молекулярно-генетические и параклинические методы обследования.
Данное положение определяет вопрос о необходимости поиска и исследования новейших действенных методов ранней диагностики глаукомы и введения их в практику [1].
Данные многочисленных исследований говорят о том, что значительная доля заболевания ПОУГ генетически обусловлена (от 21 до 50%), а риск развития данного заболевания у потомков больных глаукомой в 10 раз больше, нежели среднепопуляционный [2, 3]. В последние годы ведется активное изучение ПОУГ-генов и генов, вовлеченных в развитие глаукомы. К настоящему времени найдено около 25 генов, вызывающих заболевание или связанных с ним (табл. 1) [4, 5].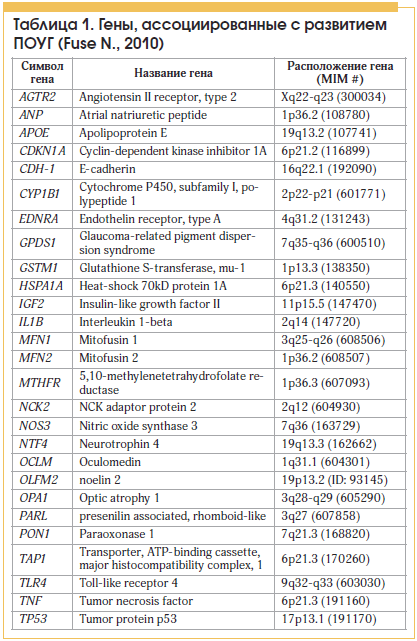
С 3 генами, такими как myocilin (MYOC), optineurin (OPTN) и WD repeat domain 36 (WDR36), связано не менее 10% всех случаев ПОУГ [5–13].
Глаукома, связанная с мутациями в генах OPTN (10р14-р15) и MYOC (Iq24.3-q25.2), принадлежит к группе моногенных болезней и наследуется по аутосомно-доминантному типу. Носители мутаций в этих генах рискуют заболеть ПОУГ в течение жизни с вероятностью от 60 до 100% [2]. Проведенные S. Monemi et al. исследования подтверждают, что сочетание мутаций в гетерозиготном состоянии в двух генах СYP1B1 и MYOC приводит к возникновению глаукомы с более злокачественным течением и ранним манифестированием [7].
При изменении последовательности аминокислот в результате мутации в гене MYOC миоцилин откладывается в зоне трабекулы и создает механическое препятствие для циркуляции внутриглазной жидкости. Мутантные формы миоцилина, в норме являющегося секреторным белком, не секретируются из клеток и уменьшают выделение нормальных форм миоцилина в том случае, когда обе формы коэкспрессируют в клетке. В мировой базе среди описанных мутаций миоцилина основную массу занимают миссенс- (83%) и нонсенс-мутации (6,4%). Около 6% составляют малые делеции, вставки и их комбинации. Основная масса полиморфизмов (а это несколько сотен) проанализирована в базе myocilin.com/variants.php. Наиболее тяжелые клинические проявления отмечаются в случае обрыва цепи миоцилина (rs139804296, rs74315329, rs143413116, rs74315337), а также в случае изменения структуры считываемого белка [14]. Известными являются мутации Gly252Arg (замещение глицина с аргинином в кодоне 252), Q368 мутация, iNOS, микросателлиты (ССТТТ)14, Туr347Туr в экзоне 3 и Arg76Lys в экзоне 1 [15].
Белок оптиневрин (ген OPTN) является частью белкового комплекса, регулирующего транспорт и экзоцитоз, и играет определенную роль в механизме апоптоза, выступая в качестве компонента опосредованного TNF-α сигнального пути. Среди его полиморфизмов известны Thr34Thr, Glul63Glu и 553-5С [16].
J.W. Cheng et al. провели метаанализ 32 опубликованных исследований связи между ПОУГ и R46X, R76K, Y347Y, T353I и Q368X полиморфизмов гена myocilin. Два полиморфизма Q368X и T353I были связаны с высоким риском глаукомы, при этом мутация Q368X характерна для европейской популяции, а мутация T353I – для азиатской [17].
В работе V. Mendoza-Renoso et al. проанализированы мутации гена миоцилина у 205 больных ПОУГ и 209 здоровых пациентов в Перу. Выявлены одиночные миссенс-мутации Gly326Ser и Trp286Arg у больных ПОУГ. Полиморфизмы Thr325Thr и Tyr347Tyr и Met476Arg выявлены и в группе контроля [18].
В.В. Рахманов у больных ПОУГ в Санкт-Петербурге идентифицировал мутацию Q368X в гене миоцилина, частота встречаемости которой составила 1,8%, что сравнимо с частотой ее встречаемости у больных ПОУГ в других популяциях за рубежом. Также было выявлено, что мутация Е50К в 4-м экзоне гена ОPTN, обнаруженная в США и Англии, не характерна для больных ПОУГ в Санкт-Петербурге, а аллель А полиморфизма М98К (с. 603 Т>А) гена оптиневрин может рассматриваться в качестве генетического фактора риска заболевания. Для других исследуемых полиморфизмов в генах миоцилина (Т285Т, Т325Т, Y347Y, K398R) и оптиневрина (L41L) ассоциации с глаукомой выявлено не было. Также проведено исследование мутации E50K (c. 458G>A) в гене OPTN, которая была обнаружена Т. Rezaie et al. в 2002 г. у 13,5% больных глаукомой, из которых 81,6% страдали глаукомой нормального давления. Автор не обнаружил этой мутации в российской популяции. Вариант L41L в гене OPTN был найден у 5 (2,9%) пробандов с ПОУГ [19, 20].
Проблеме исследования мутаций и полиморфизмов в генах миоцилина и цитохрома Р4501В1 у больных глаукомой в популяции Санкт-Петербурга посвящена работа А.Е. Мотущук [21]. Установлено, что полиморфизм L432V гена CYP1B1 у больных ПОУГ является нейтральным вариантом последовательности, не связанным с развитием заболевания.
В исследовании F. Lopez-Martinez et al. не выявлено ассоциаций с ПОУГ генетических вариантов MYOC (-1000C> G, -387C> T, -306G> А, -224T> С, -126T> С и -83G> А) в испанской популяции. Авторы также обнаружили у 3 (2,7%) пациентов с ПОУГ патогенные мутации в гене миоцилина. Две из этих мутаций (Gln368Stop и Ala445Val) были описаны ранее, в то время как третья (Tyr479His) была обнаружена впервые [22].
R. Rose et al. у 100 пациентов с ПОУГ из региона Каньякумари (Индия) выявили следующие мутации: Ser331Thr, Pro370Leu,Tyr347Tyr, Thr325Thr, Ser331Thrв в гене MYOC. Частота этих мутаций – 2%, что хорошо согласуется с другими сообщениями из Индии и иных стран [23].
S. Mookherjee et al. изучали связь полиморфных маркеров гена WDR36 с развитием ПОУГ у пациентов из Восточной Индии. Были отобраны 10 одиночных нуклеотидных полиморфизмов (rs1971050, rs1993465, rs13153937, rs10038177, rs11241095, rs10043631, rs10038058, rs10491424, rs17553936 и rs13186912), охватывающих практически весь ген WDR36. Исследовали 323 пациента с ПОУГ и 303 индивидуума из группы контроля. Установлена связь между данными полиморфизмами и ПОУГ с высоким ВГД [24].
L.Y. Jia et al. исследовали полиморфизмы генов myocilin (MYOC), optineurin (OPTN), WDR36 и аполипопротеина Е (АpoЕ) у 176 пациентов с ПОУГ и 200 человек из группы контроля из северной китайской популяции. Выявлены полиморфные локусы, ассоциированные с ПОУГ: MYOC IVS2 + 35A> G, OPTN Met98Lys, OPTN IVS5 + 38 т> G, OPTN IVS8-53T> С, WDR36 IVS5 + 30С> Т и АРОЕ -491A> T [25].
Y. Ikeda et al. проанализировали одиночные нуклеотидные полиморфизмы, которые позиционируются в качестве ПОУГ-ассоциированных у японского населения. Всего было исследовано 521 больной ПОУГ и 519 здоровых людей. В общей сложности было исследовано 154 полиморфизма из разных генов. Связанными с ПОУГ оказались следующие полиморфизмы: — rs11258194 в гене OPTN, 4 полиморфизма в гене WDR36 (rs1993465, rs13153937, rs6859041 и rs2034896), полиморфизм гена рецептора β2, ADRB2 (rs1042720) и 1 гена MTHFR (rs11559040) [11, 26].
А. Kumar et al. исследовали генетические полиморфизмы у пациентов с ПОУГ в популяции Индии. Частота генетических вариантов Pro193Leu, Glu229Lys, Arg368His и Met292Lys гена CYP1B1, Gln48His гена MYOC, Met98Lys гена OPTN в группе больных не отличалась от таковой в группе контроля [11].
Изучению вовлеченности генов системы детоксикации ксенобиотиков (CYP1B1, глутатион-S-трансфераза) в формирование ПОУГ посвящен ряд статей [2, 11, 27–30].
М. Űnal et al. исследовали генетические полиморфизмы глутатион S-трансферазы (GSTM1, GSTT1) у турецкого населения и выявили, что риск развития глаукомы значительно увеличивался у пациентов с комбинацией этих полиморфизмов [27].
W. Huang et al. провели метаанализ генетических полиморфизмов глутатион S-трансферазы при ПОУГ и получили следующие результаты. Авторы рассмотрели 11 исследований по GSTM1 (нулевой генотип) (1339 пациентов и 1412 лиц из группы контроля) и 7 исследований по GSTT1 (двойной генотип) (958 случаев, 1003 лица из группы контроля) и показали, что нулевой генотип GSTM1 повышает риск развития ПОУГ у азиатов, а генотип GSTM1 / GSTT1 связан с повышенным риском развития ПОУГ в европейской популяции [29].
Ряд исследований посвящен анализу ассоциаций генов системы апоптоза с развитием ПОУГ [5, 31, 32].
C.L. Daugherty et al. изучили роль полиморфизмов гена, кодирующего белок p53: rs1042522 (Arg72Pro), rs17878362 (16 п.н. Ins/Del) и rs1800371 (Pro47Ser), в подверженности к ПОУГ у пациентов в США. Проводилось исследование 191 пациента с ПОУГ и 167 пациентов группы контроля. Результаты исследования свидетельствуют о том, что генетический вариант rs1042522 связан с повышенным риском развития ПОУГ [31].
А.И. Белоусова обнаружила, что проапоптотические аллельные варианты генов p53(C72G), р21(С31А) и фактора некроза опухоли TNFa(G308A) оказывают значимое влияние на формирование ПОУГ, скорость прогрессирования и тяжесть течения заболевания в русской и бурятской этнических группах. Выявлено, что генетические полиморфизмы p53(C72G), р21(С31А) и TNFa(G308A) увеличивают риск развития ПОУГ среди лиц русской национальности в большей степени, чем у индивидуумов бурятской национальности [3].
Y. Guo et al. провели метаанализ нескольких баз данных для оценки ассоциаций между 2 полиморфизмами TP53 (в 4 экзоне в 3 интроне) и ПОУГ. По первому полиморфизму было рассмотрено 1930 пациентов и 1463 лица группы контроля из 9 независимых исследований, по второму полиморфизму – 858 пациентов с ПОУГ и 683 лица группы контроля в 4 исследованиях. Анализ показал значимую связь полиморфизма P53Arg72Pro с риском развития ПОУГ. В анализе подгрупп по этническому признаку (европейская и азиатская популяция) была обнаружена связь между этим полиморфизмом и риском ПОУГ в азиатской популяции (OR-1,36). В европейской популяции значимых ассоциаций выявлено не было. Сделан вывод о том, что полиморфизм P53Arg72Pro гена TP53 может влиять на индивидуальную восприимчивость к ПОУГ [32].
Одно из центральных звеньев в нарушении процессов апоптоза – факторы некроза опухолей и их рецепторы, имеющие широкий спектр биологического действия. В последнее время проведен ряд исследований по изучению ассоциаций полиморфизмов генов факторов некроза опухолей и их рецепторов с развитием ПОУГ в различных популяциях. Наибольший интерес исследователей вызывает полиморфизм 308G/A, расположенный в промоторной части гена TNFα [33, 34]. Исследованию вовлеченности в развитие ПОУГ генов фактора некроза опухолей посвящена работа Е.В. Тикуновой [35]. Автором выявлено, что фактором риска развития ПОУГ является аллель -308G TNFα (OR=1,78), а протективным фактором по данной патологии – генетический маркер -308АA TNFα (OR=0,01) и комбинации генетических вариантов: +1663АА TNFR2 с +250G Ltα (OR=0,34); -308AA TNFα с +250G Ltα (OR=0,09) и -308AA TNFα с +36А TNFR1 (OR=0,09). Генотипы -308GG TNFα, +250AA Ltα, +36GG TNFR1 и +36AG TNFR1 связаны с ранней манифестацией ПОУГ.
Важное патогенетическое значение при формировании ПОУГ имеют факторы роста. М.Ю. Кириленко (2014) выявлено, что генетические варианты сосудисто-эндотелиального (VEGF-A с.- 958C>T, rs 833061), инсулиноподобного (IGF-1 c.-1410T>C, rs 35767), трансформирующего (TGFβ-1 c.-1347T>C, rs 1800469), рецептора инсулиноподобного (IGFR-1 g.99181663C>T, rs 4965425) факторов роста и их комбинации ассоциированы с развитием и клиническим течением ПОУГ, а именно генетический вариант TIGFR-1 (OR=1,55) и комбинации аллелей С VEGF-A с Т IGFR-1 (ОR=3,17), С VEGF-A, Т IGF-1, Т TGFβ-1 (ОR=2,72), Т VEGF-A, Т IGF-1, С TGFβ-1 (ОR=2,13) являются факторами риска для ПОУГ [36].
Ряд публикаций посвящен исследованию ассоциаций между генами Toll-подобных рецепторов и развитием ПОУГ [4, 37, 38].
Е. Shibuya et al. выявили связь ряда полиморфизмов в гене TLR4 с риском развития НТГ в популяции Японии. Toll-подобный рецептор 4 (TLR4) принимает участие в запуске иммунного ответа и представляет собой трансмемб-ранный рецептор, который опосредует иммунные реакции на экзогенные и эндогенные лиганды и взаимодействует с белками теплового шока, которые вовлечены в патогенез нормотензивной глаукомы (НТГ). Было исследовано 250 пациентов с НТГ и 318 индивидуумов контрольной группы. Оценивали 8 одиночных нуклеотидных полиморфизмов в гене TLR4. Установлено, что минорные аллели 3 полиморфизмов (rs10759930, rs1927914 и rs7037117) значительно увеличивают риск НТГ. Было выявлено, что наличие 6 полиморфизмов -rs10759930, rs1927914, rs1927911, rs12377632, rs2149356 и rs7037117, rs7037117, расположенных в 3′-нетранслируемой области TLR4, увеличивает риск возникновения НТГ. Сделан вывод о том, что лиганды и/или цитокины, участвующие в сигнальной сети TLR4, могут быть факторами риска НТГ [4].
Y. Takano et al. в ходе многоцентрового исследования изучали связь полиморфизмов Toll-подобного рецептора (Toll-like receptor 4 (TLR4) gene) с ПОУГ, НТГ и псевдоэксфолиативной глаукомой у 760 пациентов в Японии. Аллельный вариант rs2149356 гена TLR4 чаще всего встречался при ПОУГ (р=0,015). Полиморфные варианты других локусов: rs10759930, rs1927914, rs1927911 и rs2149356 не были ассоциированы с ПОУГ (р=0,14) [37].
В работе W. Suh et al. не было выявлено статистически значимых различий в частотах гаплотипа гена TLR4 (рассматривались полиморфизмы rs10759930, rs1927914, rs1927911, rs12377632, rs2149356, rs11536889, rs7037117 и rs7045953) у 147 пациентов с НТГ и 380 здоровых индивидуумов в Южной Корее [38].
Значительное количество работ посвящено анализу вовлеченности в подверженность ПОУГ других генов-кандидатов (не представленных в таблице).
Ряд работ посвящен исследованию ассоциаций с ПОУГ рибосомальных генов. Ю.А. Кириленко и др. выявили, что патогенетически значимые показатели больных ПОУГ характеризуются различной по степени выраженности и направленности статистически значимой сопряженностью с функциональной активностью рибосомных генов [39].
Е.В. Кохтенко не выявила различий в частотах аллелей и генотипов генов, регулирующих транскрипцию рибосомальных генов (ТР53 (R72P), DNMT3B (C149T), POLR1B (S295L), TAF1B (A6S) у пациентов с ПОУГ и здоровых жителей Курской области. Анализ частот аллелей и полиморфизмов генов, регулирующих транскрипцию РГ, в группах больных глаукомой и здоровых людей не выявил ассоциации этих генов с предрасположенностью к ПОУГ [40].
Генетические исследования при эксфолиативной глаукоме, проведенные в Исландии и Швеции, выявили у 99% обследованных лиц 2 мутации в хромосоме 15 в гене lysyl ocedase-like LOXL1. Следует отметить, что эти мутации отсутствуют при других формах ПОУГ. Продукт гена LOXL1 является катализатором реакции, которая приводит к образованию зрелых волокон эластина [14].
N. Fuse et al. провели исследование лизил-оксидаза-подобного гена 1 (lysyl oxidase-like 1 (LOXL1) gene) в японской популяции у пациентов с эксфолиативной глаукомой и псевдоэксфолиативным синдромом. Изучались 3 одиночных нуклеотидных полиморфизма rs1048661, rs3825942, p.Arg141Leu; Gly153Asp и rs2165241. Два полиморфизма в экзоне 1 LOXL1, rs1048661 и rs3825942 были тесно связаны с ПЭС, включая и эксфолиативную глаукому [41].
К. Murakami et al. установили, что полиморфные варианты гена GLC1F могут быть связаны с развитием НТГ. Проводилось исследование 242 пациентов из Японии, в т. ч. 141 больного НТГ и 101 здорового индивидуума. Лица, несущие аллель 163 D7S1277i, имели статистически значимое увеличение риска развития НТГ в 2,47 раза (OR = 2,47) [42].
W. Liu et al. изучали связь 2 генов-кандидатов с формированием ПОУГ – аквапорина 1 (AQP1) и переносчика растворенных веществ SLC4A10. Среди 382 пациентов с ПОУГ и 363 индивидуумов контрольной группы ни один из 11 одиночных нуклеотидных полиморфизмов не показал статистически значимой связи с ПОУГ [43].
Таким образом, изучению генетических основ ПОУГ посвящено значительное количество работ. Однако следует отметить, что большинство исследований по выявлению генов предрасположенности к ПОУГ проведены за рубежом [9, 41, 44]. Единичные работы, выполненные в России, фрагментарны и посвящены оценке вовлеченности лишь некоторых генов в формирование ПОУГ: миоцилина (MYOC), оптиневрина (OPTN), цитохрома Р450 (CYP1B1), факторов некроза опухолей и их рецепторов (TNFα, TNFβ, TNFR1, TNFR2), факторов роста (VEGF-А, IGF-1 и др.), рибосомальных белков [3, 14, 19–21, 36, 39, 45–47], что крайне недостаточно и диктует необходимость проведения дальнейших генетических исследований ПОУГ в различных популяциях в России.
Источник


