Генетические аспекты первичная открытоугольная глаукомы
Статья посвящена возможностям генетического исследования при первичной открытоугольной глаукоме
Особенностью течения ПОУГ является практически бессимптомное начало заболевания. В связи с этим важное значение имеют новые методы диагностики, в т. ч. молекулярно-генетические и параклинические методы обследования.
Данное положение определяет вопрос о необходимости поиска и исследования новейших действенных методов ранней диагностики глаукомы и введения их в практику [1].
Данные многочисленных исследований говорят о том, что значительная доля заболевания ПОУГ генетически обусловлена (от 21 до 50%), а риск развития данного заболевания у потомков больных глаукомой в 10 раз больше, нежели среднепопуляционный [2, 3]. В последние годы ведется активное изучение ПОУГ-генов и генов, вовлеченных в развитие глаукомы. К настоящему времени найдено около 25 генов, вызывающих заболевание или связанных с ним (табл. 1) [4, 5].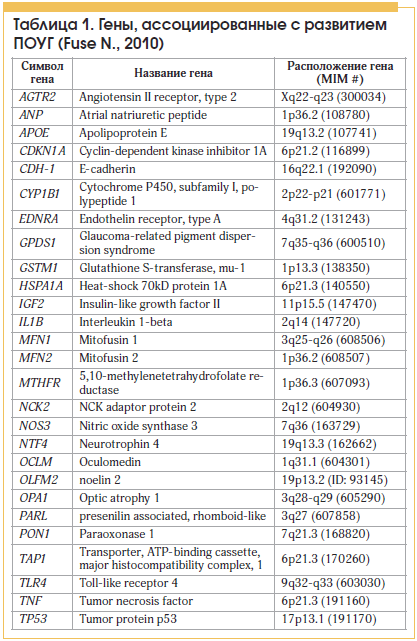
С 3 генами, такими как myocilin (MYOC), optineurin (OPTN) и WD repeat domain 36 (WDR36), связано не менее 10% всех случаев ПОУГ [5–13].
Глаукома, связанная с мутациями в генах OPTN (10р14-р15) и MYOC (Iq24.3-q25.2), принадлежит к группе моногенных болезней и наследуется по аутосомно-доминантному типу. Носители мутаций в этих генах рискуют заболеть ПОУГ в течение жизни с вероятностью от 60 до 100% [2]. Проведенные S. Monemi et al. исследования подтверждают, что сочетание мутаций в гетерозиготном состоянии в двух генах СYP1B1 и MYOC приводит к возникновению глаукомы с более злокачественным течением и ранним манифестированием [7].
При изменении последовательности аминокислот в результате мутации в гене MYOC миоцилин откладывается в зоне трабекулы и создает механическое препятствие для циркуляции внутриглазной жидкости. Мутантные формы миоцилина, в норме являющегося секреторным белком, не секретируются из клеток и уменьшают выделение нормальных форм миоцилина в том случае, когда обе формы коэкспрессируют в клетке. В мировой базе среди описанных мутаций миоцилина основную массу занимают миссенс- (83%) и нонсенс-мутации (6,4%). Около 6% составляют малые делеции, вставки и их комбинации. Основная масса полиморфизмов (а это несколько сотен) проанализирована в базе myocilin.com/variants.php. Наиболее тяжелые клинические проявления отмечаются в случае обрыва цепи миоцилина (rs139804296, rs74315329, rs143413116, rs74315337), а также в случае изменения структуры считываемого белка [14]. Известными являются мутации Gly252Arg (замещение глицина с аргинином в кодоне 252), Q368 мутация, iNOS, микросателлиты (ССТТТ)14, Туr347Туr в экзоне 3 и Arg76Lys в экзоне 1 [15].
Белок оптиневрин (ген OPTN) является частью белкового комплекса, регулирующего транспорт и экзоцитоз, и играет определенную роль в механизме апоптоза, выступая в качестве компонента опосредованного TNF-α сигнального пути. Среди его полиморфизмов известны Thr34Thr, Glul63Glu и 553-5С [16].
J.W. Cheng et al. провели метаанализ 32 опубликованных исследований связи между ПОУГ и R46X, R76K, Y347Y, T353I и Q368X полиморфизмов гена myocilin. Два полиморфизма Q368X и T353I были связаны с высоким риском глаукомы, при этом мутация Q368X характерна для европейской популяции, а мутация T353I – для азиатской [17].
В работе V. Mendoza-Renoso et al. проанализированы мутации гена миоцилина у 205 больных ПОУГ и 209 здоровых пациентов в Перу. Выявлены одиночные миссенс-мутации Gly326Ser и Trp286Arg у больных ПОУГ. Полиморфизмы Thr325Thr и Tyr347Tyr и Met476Arg выявлены и в группе контроля [18].
В.В. Рахманов у больных ПОУГ в Санкт-Петербурге идентифицировал мутацию Q368X в гене миоцилина, частота встречаемости которой составила 1,8%, что сравнимо с частотой ее встречаемости у больных ПОУГ в других популяциях за рубежом. Также было выявлено, что мутация Е50К в 4-м экзоне гена ОPTN, обнаруженная в США и Англии, не характерна для больных ПОУГ в Санкт-Петербурге, а аллель А полиморфизма М98К (с. 603 Т>А) гена оптиневрин может рассматриваться в качестве генетического фактора риска заболевания. Для других исследуемых полиморфизмов в генах миоцилина (Т285Т, Т325Т, Y347Y, K398R) и оптиневрина (L41L) ассоциации с глаукомой выявлено не было. Также проведено исследование мутации E50K (c. 458G>A) в гене OPTN, которая была обнаружена Т. Rezaie et al. в 2002 г. у 13,5% больных глаукомой, из которых 81,6% страдали глаукомой нормального давления. Автор не обнаружил этой мутации в российской популяции. Вариант L41L в гене OPTN был найден у 5 (2,9%) пробандов с ПОУГ [19, 20].
Проблеме исследования мутаций и полиморфизмов в генах миоцилина и цитохрома Р4501В1 у больных глаукомой в популяции Санкт-Петербурга посвящена работа А.Е. Мотущук [21]. Установлено, что полиморфизм L432V гена CYP1B1 у больных ПОУГ является нейтральным вариантом последовательности, не связанным с развитием заболевания.
В исследовании F. Lopez-Martinez et al. не выявлено ассоциаций с ПОУГ генетических вариантов MYOC (-1000C> G, -387C> T, -306G> А, -224T> С, -126T> С и -83G> А) в испанской популяции. Авторы также обнаружили у 3 (2,7%) пациентов с ПОУГ патогенные мутации в гене миоцилина. Две из этих мутаций (Gln368Stop и Ala445Val) были описаны ранее, в то время как третья (Tyr479His) была обнаружена впервые [22].
R. Rose et al. у 100 пациентов с ПОУГ из региона Каньякумари (Индия) выявили следующие мутации: Ser331Thr, Pro370Leu,Tyr347Tyr, Thr325Thr, Ser331Thrв в гене MYOC. Частота этих мутаций – 2%, что хорошо согласуется с другими сообщениями из Индии и иных стран [23].
S. Mookherjee et al. изучали связь полиморфных маркеров гена WDR36 с развитием ПОУГ у пациентов из Восточной Индии. Были отобраны 10 одиночных нуклеотидных полиморфизмов (rs1971050, rs1993465, rs13153937, rs10038177, rs11241095, rs10043631, rs10038058, rs10491424, rs17553936 и rs13186912), охватывающих практически весь ген WDR36. Исследовали 323 пациента с ПОУГ и 303 индивидуума из группы контроля. Установлена связь между данными полиморфизмами и ПОУГ с высоким ВГД [24].
L.Y. Jia et al. исследовали полиморфизмы генов myocilin (MYOC), optineurin (OPTN), WDR36 и аполипопротеина Е (АpoЕ) у 176 пациентов с ПОУГ и 200 человек из группы контроля из северной китайской популяции. Выявлены полиморфные локусы, ассоциированные с ПОУГ: MYOC IVS2 + 35A> G, OPTN Met98Lys, OPTN IVS5 + 38 т> G, OPTN IVS8-53T> С, WDR36 IVS5 + 30С> Т и АРОЕ -491A> T [25].
Y. Ikeda et al. проанализировали одиночные нуклеотидные полиморфизмы, которые позиционируются в качестве ПОУГ-ассоциированных у японского населения. Всего было исследовано 521 больной ПОУГ и 519 здоровых людей. В общей сложности было исследовано 154 полиморфизма из разных генов. Связанными с ПОУГ оказались следующие полиморфизмы: — rs11258194 в гене OPTN, 4 полиморфизма в гене WDR36 (rs1993465, rs13153937, rs6859041 и rs2034896), полиморфизм гена рецептора β2, ADRB2 (rs1042720) и 1 гена MTHFR (rs11559040) [11, 26].
А. Kumar et al. исследовали генетические полиморфизмы у пациентов с ПОУГ в популяции Индии. Частота генетических вариантов Pro193Leu, Glu229Lys, Arg368His и Met292Lys гена CYP1B1, Gln48His гена MYOC, Met98Lys гена OPTN в группе больных не отличалась от таковой в группе контроля [11].
Изучению вовлеченности генов системы детоксикации ксенобиотиков (CYP1B1, глутатион-S-трансфераза) в формирование ПОУГ посвящен ряд статей [2, 11, 27–30].
М. Űnal et al. исследовали генетические полиморфизмы глутатион S-трансферазы (GSTM1, GSTT1) у турецкого населения и выявили, что риск развития глаукомы значительно увеличивался у пациентов с комбинацией этих полиморфизмов [27].
W. Huang et al. провели метаанализ генетических полиморфизмов глутатион S-трансферазы при ПОУГ и получили следующие результаты. Авторы рассмотрели 11 исследований по GSTM1 (нулевой генотип) (1339 пациентов и 1412 лиц из группы контроля) и 7 исследований по GSTT1 (двойной генотип) (958 случаев, 1003 лица из группы контроля) и показали, что нулевой генотип GSTM1 повышает риск развития ПОУГ у азиатов, а генотип GSTM1 / GSTT1 связан с повышенным риском развития ПОУГ в европейской популяции [29].
Ряд исследований посвящен анализу ассоциаций генов системы апоптоза с развитием ПОУГ [5, 31, 32].
C.L. Daugherty et al. изучили роль полиморфизмов гена, кодирующего белок p53: rs1042522 (Arg72Pro), rs17878362 (16 п.н. Ins/Del) и rs1800371 (Pro47Ser), в подверженности к ПОУГ у пациентов в США. Проводилось исследование 191 пациента с ПОУГ и 167 пациентов группы контроля. Результаты исследования свидетельствуют о том, что генетический вариант rs1042522 связан с повышенным риском развития ПОУГ [31].
А.И. Белоусова обнаружила, что проапоптотические аллельные варианты генов p53(C72G), р21(С31А) и фактора некроза опухоли TNFa(G308A) оказывают значимое влияние на формирование ПОУГ, скорость прогрессирования и тяжесть течения заболевания в русской и бурятской этнических группах. Выявлено, что генетические полиморфизмы p53(C72G), р21(С31А) и TNFa(G308A) увеличивают риск развития ПОУГ среди лиц русской национальности в большей степени, чем у индивидуумов бурятской национальности [3].
Y. Guo et al. провели метаанализ нескольких баз данных для оценки ассоциаций между 2 полиморфизмами TP53 (в 4 экзоне в 3 интроне) и ПОУГ. По первому полиморфизму было рассмотрено 1930 пациентов и 1463 лица группы контроля из 9 независимых исследований, по второму полиморфизму – 858 пациентов с ПОУГ и 683 лица группы контроля в 4 исследованиях. Анализ показал значимую связь полиморфизма P53Arg72Pro с риском развития ПОУГ. В анализе подгрупп по этническому признаку (европейская и азиатская популяция) была обнаружена связь между этим полиморфизмом и риском ПОУГ в азиатской популяции (OR-1,36). В европейской популяции значимых ассоциаций выявлено не было. Сделан вывод о том, что полиморфизм P53Arg72Pro гена TP53 может влиять на индивидуальную восприимчивость к ПОУГ [32].
Одно из центральных звеньев в нарушении процессов апоптоза – факторы некроза опухолей и их рецепторы, имеющие широкий спектр биологического действия. В последнее время проведен ряд исследований по изучению ассоциаций полиморфизмов генов факторов некроза опухолей и их рецепторов с развитием ПОУГ в различных популяциях. Наибольший интерес исследователей вызывает полиморфизм 308G/A, расположенный в промоторной части гена TNFα [33, 34]. Исследованию вовлеченности в развитие ПОУГ генов фактора некроза опухолей посвящена работа Е.В. Тикуновой [35]. Автором выявлено, что фактором риска развития ПОУГ является аллель -308G TNFα (OR=1,78), а протективным фактором по данной патологии – генетический маркер -308АA TNFα (OR=0,01) и комбинации генетических вариантов: +1663АА TNFR2 с +250G Ltα (OR=0,34); -308AA TNFα с +250G Ltα (OR=0,09) и -308AA TNFα с +36А TNFR1 (OR=0,09). Генотипы -308GG TNFα, +250AA Ltα, +36GG TNFR1 и +36AG TNFR1 связаны с ранней манифестацией ПОУГ.
Важное патогенетическое значение при формировании ПОУГ имеют факторы роста. М.Ю. Кириленко (2014) выявлено, что генетические варианты сосудисто-эндотелиального (VEGF-A с.- 958C>T, rs 833061), инсулиноподобного (IGF-1 c.-1410T>C, rs 35767), трансформирующего (TGFβ-1 c.-1347T>C, rs 1800469), рецептора инсулиноподобного (IGFR-1 g.99181663C>T, rs 4965425) факторов роста и их комбинации ассоциированы с развитием и клиническим течением ПОУГ, а именно генетический вариант TIGFR-1 (OR=1,55) и комбинации аллелей С VEGF-A с Т IGFR-1 (ОR=3,17), С VEGF-A, Т IGF-1, Т TGFβ-1 (ОR=2,72), Т VEGF-A, Т IGF-1, С TGFβ-1 (ОR=2,13) являются факторами риска для ПОУГ [36].
Ряд публикаций посвящен исследованию ассоциаций между генами Toll-подобных рецепторов и развитием ПОУГ [4, 37, 38].
Е. Shibuya et al. выявили связь ряда полиморфизмов в гене TLR4 с риском развития НТГ в популяции Японии. Toll-подобный рецептор 4 (TLR4) принимает участие в запуске иммунного ответа и представляет собой трансмемб-ранный рецептор, который опосредует иммунные реакции на экзогенные и эндогенные лиганды и взаимодействует с белками теплового шока, которые вовлечены в патогенез нормотензивной глаукомы (НТГ). Было исследовано 250 пациентов с НТГ и 318 индивидуумов контрольной группы. Оценивали 8 одиночных нуклеотидных полиморфизмов в гене TLR4. Установлено, что минорные аллели 3 полиморфизмов (rs10759930, rs1927914 и rs7037117) значительно увеличивают риск НТГ. Было выявлено, что наличие 6 полиморфизмов -rs10759930, rs1927914, rs1927911, rs12377632, rs2149356 и rs7037117, rs7037117, расположенных в 3′-нетранслируемой области TLR4, увеличивает риск возникновения НТГ. Сделан вывод о том, что лиганды и/или цитокины, участвующие в сигнальной сети TLR4, могут быть факторами риска НТГ [4].
Y. Takano et al. в ходе многоцентрового исследования изучали связь полиморфизмов Toll-подобного рецептора (Toll-like receptor 4 (TLR4) gene) с ПОУГ, НТГ и псевдоэксфолиативной глаукомой у 760 пациентов в Японии. Аллельный вариант rs2149356 гена TLR4 чаще всего встречался при ПОУГ (р=0,015). Полиморфные варианты других локусов: rs10759930, rs1927914, rs1927911 и rs2149356 не были ассоциированы с ПОУГ (р=0,14) [37].
В работе W. Suh et al. не было выявлено статистически значимых различий в частотах гаплотипа гена TLR4 (рассматривались полиморфизмы rs10759930, rs1927914, rs1927911, rs12377632, rs2149356, rs11536889, rs7037117 и rs7045953) у 147 пациентов с НТГ и 380 здоровых индивидуумов в Южной Корее [38].
Значительное количество работ посвящено анализу вовлеченности в подверженность ПОУГ других генов-кандидатов (не представленных в таблице).
Ряд работ посвящен исследованию ассоциаций с ПОУГ рибосомальных генов. Ю.А. Кириленко и др. выявили, что патогенетически значимые показатели больных ПОУГ характеризуются различной по степени выраженности и направленности статистически значимой сопряженностью с функциональной активностью рибосомных генов [39].
Е.В. Кохтенко не выявила различий в частотах аллелей и генотипов генов, регулирующих транскрипцию рибосомальных генов (ТР53 (R72P), DNMT3B (C149T), POLR1B (S295L), TAF1B (A6S) у пациентов с ПОУГ и здоровых жителей Курской области. Анализ частот аллелей и полиморфизмов генов, регулирующих транскрипцию РГ, в группах больных глаукомой и здоровых людей не выявил ассоциации этих генов с предрасположенностью к ПОУГ [40].
Генетические исследования при эксфолиативной глаукоме, проведенные в Исландии и Швеции, выявили у 99% обследованных лиц 2 мутации в хромосоме 15 в гене lysyl ocedase-like LOXL1. Следует отметить, что эти мутации отсутствуют при других формах ПОУГ. Продукт гена LOXL1 является катализатором реакции, которая приводит к образованию зрелых волокон эластина [14].
N. Fuse et al. провели исследование лизил-оксидаза-подобного гена 1 (lysyl oxidase-like 1 (LOXL1) gene) в японской популяции у пациентов с эксфолиативной глаукомой и псевдоэксфолиативным синдромом. Изучались 3 одиночных нуклеотидных полиморфизма rs1048661, rs3825942, p.Arg141Leu; Gly153Asp и rs2165241. Два полиморфизма в экзоне 1 LOXL1, rs1048661 и rs3825942 были тесно связаны с ПЭС, включая и эксфолиативную глаукому [41].
К. Murakami et al. установили, что полиморфные варианты гена GLC1F могут быть связаны с развитием НТГ. Проводилось исследование 242 пациентов из Японии, в т. ч. 141 больного НТГ и 101 здорового индивидуума. Лица, несущие аллель 163 D7S1277i, имели статистически значимое увеличение риска развития НТГ в 2,47 раза (OR = 2,47) [42].
W. Liu et al. изучали связь 2 генов-кандидатов с формированием ПОУГ – аквапорина 1 (AQP1) и переносчика растворенных веществ SLC4A10. Среди 382 пациентов с ПОУГ и 363 индивидуумов контрольной группы ни один из 11 одиночных нуклеотидных полиморфизмов не показал статистически значимой связи с ПОУГ [43].
Таким образом, изучению генетических основ ПОУГ посвящено значительное количество работ. Однако следует отметить, что большинство исследований по выявлению генов предрасположенности к ПОУГ проведены за рубежом [9, 41, 44]. Единичные работы, выполненные в России, фрагментарны и посвящены оценке вовлеченности лишь некоторых генов в формирование ПОУГ: миоцилина (MYOC), оптиневрина (OPTN), цитохрома Р450 (CYP1B1), факторов некроза опухолей и их рецепторов (TNFα, TNFβ, TNFR1, TNFR2), факторов роста (VEGF-А, IGF-1 и др.), рибосомальных белков [3, 14, 19–21, 36, 39, 45–47], что крайне недостаточно и диктует необходимость проведения дальнейших генетических исследований ПОУГ в различных популяциях в России.
Источник
Для цитирования: Нестеров А.П. Первичная открытоугольная глаукома: патогенез и принципы лечения. РМЖ. Клиническая офтальмология. 2000;1:4.
Первичная открытоугольная глаукома (ПОУГ) – одна из главных причин слабовидения и слепоты среди населения. Ее распространенность увеличивается с возрастом. Так, в 40–45 лет ПОУГ страдает 0,1% населения, в 50–60 лет – 1,5-2%, в 75 лет и старше – около 10%. Это указывает на важную роль инволюционных процессов в возникновении и развитии заболевания.
Патогенез
Глаукомный процесс можно разделить на следующие патогенетические этапы:
• нарушение оттока водянистой влаги (ВВ) из глаза;
• повышение внутриглазного давления (ВГД) выше толерантного уровня;
• диффузная или фокальная ишемия головки зрительного нерва (ГЗН);
• глаукомная оптическая нейропатия;
• атрофия (апоптоз) ганглиозных клеток сетчатки.
Каждый из предыдущих этапов принимает прямое участие в возникновении последующих.
Причины нарушения оттока ВВ из глаза
Непосредственными причинами ухудшения оттока ВВ служат трабекулопатия, обусловливающая ухудшение фильтрующей функции трабекулярной диафрагмы, и частичная блокада склерального синуса. Блокада возникает в результате повышения разности давлений в передней камере глаза и в синусе.
Трабекулопатия
Трабекулопатии присущи следующие особенности:
• уменьшение количества и снижение функциональной активности клеток в трабекулярном фильтре;
• утолщение трабекулярных пластин и, особенно, пористой ткани;
• сужение и частичный коллапс межтрабекулярных щелей;
• деструкция волокнистых структур;
• отложение в трабекулярных структурах гранул пигмента, эксфолиаций, гликозаминогликанов.
Причины развития трабекулопатии следующие:
• более раннее, чем обычно, начало и большая выраженность возрастных инволюционных процессов в трабекулярных структурах;
• пресбиопия, ведущая к снижению активности цилиарной мышцы, которая анатомически связана с трабекулярным фильтром;
• ухудшение кровоснабжения и гипоксия (в частности, из-за пресбиопии) переднего сегмента глаза;
• уменьшение активности антиоксидантной системы и усиление свободнорадикальных деструктивных процессов;
• механическая деформация и сдавливание трабекулярного фильтра из-за коллапса склерального синуса.
В последнее время было высказано предположение о существовании сократительных элементов в трабекулярном фильтре, обеспечивающих ауторегуляцию оттока ВВ. Так же, как и при сосудистой ауторегуляции, оксид азота оказывает положительное, а эндотелин-1 – отрицательное влияние на движение жидкости через трабекулярный фильтр. При глаукоме ауторегуляция оттока ВВ нарушается. В настоящее время эту концепцию можно рассматривать только как гипотезу.
Причины и последствия коллапса склерального синуса
Ухудшение оттока ВВ через трабекулярную диафрагму приводит к прогрессирующему увеличению разности давлений по обе ее стороны. Сначала синус суживается, а затем в отдельных зонах полностью закрывается. Это приводит к уменьшению фильтрующей площади трабекулярной диафрагмы. Отсутствие противодавления в зонах коллапса приводит к компрессии трабекулярных структур, а прекращение фильтрации в них ВВ – к метаболическим нарушениям.
Особенности глаукомной оптической нейропатии (ГОН)
ГОН присущи несколько характерных особенностей, отличающих ее от других поражений зрительного нерва:
• Медленный, длительный процесс атрофии нервных волокон нередко продолжается в течение многих лет. При этом атрофия выборочно захватывает сначала только отдельные пучки волокон.
• Решетчатая пластинка склеры смещается кзади. Атрофия нервных волокон в зрительном нерве начинается на этом уровне.
• Прогрессирующее расширение центральной экскавации, сопровождается неравномерным сужением неврального кольца вплоть до полного его исчезновения в терминальной стадии болезни.
• Атрофический процесс распространяется на сетчатку, в которой обнаруживаются характерные для глаукомы дефекты в слоях нервных волокон и ганглиозных клеток.
• Нередко на диске зрительного нерва или около него появляются расслаивающие геморрагии в результате тромбирования микрососудов.
• ГОН часто сочетается с атрофическими изменениями в перипапиллярной хориоидее.
Патогенез ГОН
Основные факторы патогенеза ГОН:
• деформация опорных структур (особенно решетчатой пластинки склеры), вызванная повышением офтальмотонуса или снижением ликворного давления в ретробульбарном отделе зрительного нерва;
• ущемление пучков нервных волокон в деформированных канальцах решетчатой пластинки склеры;
• ослабление ауторегуляции кровообращения в ГЗН;
• диффузная и очаговая гипоксия ГЗН;
• нарушение аксоплазматического транспорта в аксонах ганглиозных клеток сетчатки;
• деструкция нервных волокон в ГЗН;
• действие нейротоксических факторов в сетчатке и ГЗН.
Патогенетические механизмы ГОН изучены далеко не полностью. Полагают, что главными пусковыми факторами ГОН служат деформация решетчатой пластинки склеры с ущемлением в ее канальцах пучков нервных волокон и/или гипоксия ГЗН. Каждый из этих факторов (или оба вместе) приводит к остановке аксоплазматического транспорта, связывающего тело ганглиозной клетки сетчатки с ее терминалами. Продолжительная блокада аксоплазматического транспорта активирует механизм апоитоз. Поврежденные клетки высвобождают цитотоксические факторы, которые повреждают соседние клетки, расширяя, таким образом, сферу поражения. К таким факторам относят глутамат, продукты перекисного окисления липидов, избыточное поступление в клетки ионов кальция.
Факторы риска
Факторы риска, влияющие на возникновение и прогрессирование глаукомы, делят на общие и местные. К первым относятся возраст старше 60–65 лет, неблагополучная наследственность, сахарный диабет, артериальная гипотония, гипотиреоз, диэнцефальная патология. Местные факторы риска включают изменения в глазу, вызванные миопией, дистрофией радужки, псевдоэксфолиативным синдромом, синдромом пигментной дисперсии. К факторам риска относят также большую величину отношения диаметра экскавации к диаметру диска зрительного нерва (Э/Д > 0,5), перипапиллярную b-зону. b-Зона – неравномерное, чаще неполное кольцо, образовавшееся вследствие ретракции пигментного эпителия и атрофии перипапиллярной хориоидеи. Выявление факторов риска имеет значение как для диагностики глаукомы, так и для назначения адекватного лечения в каждом конкретном случае.
Принципы лечения
Лечение ПОУГ носит патогенетическую направленность. Основные направления лечебных мероприятий:
• снижение ВГД до толерантного уровня;
• устранение или уменьшение гипоксии глаза (особенно диска зрительного нерва);
• коррекция нарушенного метаболизма;
• использование цито- и нейропротекторов для сохранения клеток как в переднем сегменте глаза, так и особенно в сетчатке;
• лечение тех сопутствующих заболеваний, которые оказывают неблагоприятное влияние на течение глаукоматозного процесса (сахарный диабет, гипотиреоз, сердечно-сосудистая недостаточность, сосудистая гипотония).
Только диспансерное наблюдение за больным позволяет выбрать оптимальный вариант лечения и своевременно вносить в него коррективы.
Больной должен быть активным и сознательным участником лечебного процесса. Необходимо информировать больного о сущности его заболевания, возможных вариантах лечения и прогнозе. Следует обучить больного правилам и нормам диспансеризации, методике инстилляции капель и приема других лекарственных средств, методам самоконтроля, оптимальному режиму труда и жизни. Хорошая информированность пациента существенно снижает опасность неаккуратного выполнения им назначений врача и облегчает своевременное выявление декомпенсации глаукомного процесса.
При назначении лечения необходимо учитывать материальные возможности больного и влияние лечебных мер не только на течение глаукомы, но и на качество жизни пациента. Снижение качества жизни зависит от нескольких факторов. Диагноз глаукомы вызывает у больного беспокойство, чувство напряжения и страха, а необходимость постоянного приема лекарств – раздражение. На оценке больным качества жизни сказываются ограничения в привычном образе жизни, побочное действие лекарственных средств, ухудшение зрительных функций.
Ведущая роль в лечении глаукомы принадлежит снижению ВГД до толерантного уровня. Поскольку определение толерантного давления связано с определенными трудностями, то используют более простое понятие – “давление цели”. В начальной стадии глаукомы верхний уровень истинного ВГД не должен превышать 18 мм рт.ст, в далеко зашедшей стадии – 15–16 мм рт.ст.
Лечение начинают с назначения одного гипотензивного лекарственного средства. Более двух препаратов одновременно используют временно до операции или постоянно в тех случаях, когда выполнение операции связано с большим риском, а также при отказе больного от оперативного вмешательства.
Безусловными показаниями к хирургическому лечению служат недостаточная эффективность лекарственной терапии, невозможность для больного систематически посещать врача-офтальмолога, неаккуратность пациента в выполнении назначений врача. Вместе с тем хирургическое вмешательство может быть произведено в любой стадии глаукомы в соответствии с выбором лечащего врача и информированным согласием больного.
Для коррекции метаболических нарушений целесообразно рекомендовать постоянный прием поливитаминов и дополнительно a-токоферола и/или b-каротина.
При нестабилизированной глаукоме назначают курс терапии, корригирующий гемодинамические и метаболические отклонения, с использованием препаратов и физиотерапевтических процедур цитопротекторного действия. Особое внимание следует уделять лечению сопутствующих заболеваний, влияющих на прогноз при глаукоме.
В заключение следует отметить, что в последние годы наметился существенный пересмотр традиционных представлений о глаукоме и методах ее лечения. Избежать ошибок можно только, используя методы исследования в соответствии с требованиями доказательной медицины.
Поделитесь статьей в социальных сетях
Источник