Флюоресцеин для окрашивания роговицы
Флюоресцентный краситель широко применяется в ветеринарной офтальмологии. Он позволяет диагностировать многие патологии, будь то болезни/повреждения роговицы, патологии носослёзной системы, ухудшение качества слезы.
Тест с флюоресцеином собаке и кошке.
Тест с флюоресцеином для собак и кошек предназначен для выявления повреждений на роговице. Таких как эрозия роговицы, язва роговицы, кератит, травмы роговицы. Флюоресцеин не имеет противопоказаний при использовании у любых видов животных. В ходе теста стерильная тест-полоска прикладывается к глазному яблоку. Этот особый краситель “оседает” только на поврежденных участках роговицы. Благодаря этому тесту участки роговицы,, лишенные эпителиального слоя окрасятся в зелёный цвет, что позволит специалисту определить степень и характер повреждения, а также его точное расположение. Иногда дефект на роговице виден сразу, а иногда – нет. Вот, как, например, в этом случае. Обратите внимание, собаке патологическая ресница трёт глаз. Там, где трение самое сильное, повреждён эпителиальный слой, и мы видим прокрашивание роговицы. Вот, что такое тест с флюоресцеином.
Проба Зейделя у собак и кошек.
Если у ветеринарного офтальмолога возникает сомнение относительно герметичности роговицы (например, при травме глаза), проводится модифицированный тест с флюоресцеином – Проба Зейделя. Эта проба предназначена для диагностики сквозных повреждений роговицы. Пациенту на роговицу наносят каплю раствора флюоресцеина и наблюдают глаз в кобальтовом свете. При наличии перфорации вытекающая внутриглазная жидкость окрасится в цвет красителя и будет видна в виде “разводов”. На фотографии ниже вы можете видеть язву роговицы и зелёные разводы на поверхности. Флюоресцеин окрашивает внутриглазную жидкость.

Положительная проба Зейделя у собаки
Тест Джонс-1 (тест на проходимость носослёзных каналов).
Этот тест применяется кошкам и собакам для проверки проходимости носослезных каналов. В норме слеза по носослёзному каналу попадает из конъюнктивального мешка в нос. Таким образом большое количество слезы естественным образом утилизируется, унося с собой микробов, мелкие частицы, остатки глазных капель и тд. При нормальной проходимости каналов флюоресцеин пройдет по всему тракту от слезной точки до носа, окрасив носовое зеркальце.
Когда нужно проводить тест Джонса-1 ?
- Слезотечение (“плачут” глаза, “текут” глаза)
- Наличие слезных дорожек
- Закупорка носослезных каналов
Если проходимость затруднена, то в зависимости от степени назначается терапевтическое лечение. При полной непроходимости рекомендуется дренирование носослезных каналов. Дренирование носослёзных каналов, или промывание носослёзных каналов – это простая и безболезненная процедура. С помощью специальной канюли мы пропускаем по носослёзному каналу небольшое количество жидкости. Которая вымывает содержимое канала и восстанавливает его пропускную способность.
Тест Rose Bengal (окрашивание роговицы бенгальским розовым)
Бенгальский розовый – это краситель насыщенного розового цвета. Он окрашивает мертвые и дегенерированные клетки и применяется для диагностики ряда болезней. Основные среди них – это герпесвирусный кератит кошек (FHV-1), пигментный кератит у мопсов, пекинесов, и других пород. В ходе этого теста мы точно также капаем каплю красителя и через несколько секунд оцениваем результат с помощью осветительного прибора.
Тест Lissamine Green (Тест с лиссаминовым зелёным)
Лиссаминовый зеленый – это краситель насыщенного зелёного цвета. Он применяется для выявления аномалий роговицы, бульбарной конъюнктивы и конъюнктивы у свободных краев век.
Используется в комплексной диагностике Синдрома сухого глаза, кератитов, кератоконъюнктивитов, эрозий роговицы.
Идеальное средство для прокрашивания эпителиальных повреждений на «красном» глазу.
Источник
Современные возможности применения красителей для диагностики повреждений эпителия роговицы и конъюнктивы глаз.
Авторы статьи: Мягков А.В., Соголовская Е.Г.
Важное значение для исследования целостности эпителия роговицы и конъюнктивы имеет применение красителей. Метод прокрашивания представляет собой один из наиболее простых, эффективных, бесконтактных и очень информативных методов исследования эпителия на клеточном уровне. Несмотря на то, что сегодня красители в основном применяются для диагностики повреждения роговицы и синдрома сухого глаза, подбора жестких и мягких контактных линз, а также их используют и для определения множества других состояний поверхности глаза на клетках роговицы и конъюнктивы.
В России офтальмологи для исследования роговичных повреждений традиционно используют в основном 2% водный раствор низкомолекулярного флюоресцеина. Впервые флюоресцеин для прокрашивания роговицы стали использовать в конце XIX века [1]. Растворенные в воде молекулы флюоресцеина проникают во внутриклеточное пространство между живыми клетками. Повреждение клеточной мембраны в результате дегенерации или гибели клеток делает внутриклеточное пространство более доступным для проникновения флюоресцеина. Эта особенность флюоресцеина делает его более удобным для исследования проницаемости в эпителиальных и эндотелиальных клетках роговицы [10].
Флюоресцеин используется также и для прокрашивания повреждений конъюнктивы глазного яблока, но в этом случае могут возникнуть диагностические трудности из-за наличия красителя, как в клетках, так и во внутриклеточном пространстве. Feenstra R. и Tseng S. в своих исследованиях показали, что водный раствор низкомолекулярного флюоресцеина имеет способность окрашивать некоторые виды здоровых клеток in vitro [5].
Способность флюоресцеина окрашивать роговицу и конъюнктиву позволило офтальмологам использовать его с диагностической целью при выявлении признаков сухости глаза[2]. Но в тоже время, надо учитывать, что наличие флюоресцеина в слезной пленке может препятствовать исследованию состояния окрашенного эпителия и конъюнктивы глазного яблока, маскирую их дефектные участки.
В мировой офтальмологии жидкий флюоресцеин в основном используют в качестве контрастного вещества для исследования сосудистой системы сетчатой оболочки глаза – флюоресцентной ангиографии. Для диагностики повреждений переднего отрезка глаза в основном используют сухие стерильные диагностические полоски BioGlo. Полоски BioGlo очень просты и удобны в применении. Флюоресцеиновую полоску увлажняют с помощью стерильного физиологического раствора и осторожно стряхивают несвязанные излишки. Исследуемого просят смотреть некоторое время вниз, приподнимая верхнее веко, и влажную полоску осторожно помещают на конъюнктиву выше верхнего лимба. После 1 или 2 морганий флюоресцеин распространяется по поверхности роговицы, окрашивая поврежденные участки эпителия в ярко-зеленый цвет.
В контактной коррекции зрения низкомолекулярный флюоресцеин используется для оценки посадки жестких газопроницаемых и газонепроницаемых контактных линз, в том числе ортокератологических. Для подбора мягких контактных линз используется высокомолекулярный флюоресцеин – SoftGlo, более крупные и тяжелые молекулы которого не внедряются в структуру полимера мягкой контактной линзы и не окрашивают её. Осмотр производится с помощью щелевой лампы с использованием синего фильтра. При нормальном положении линзы на глазу флюоресцеин равномерно распределяется по всему подлинзовому пространству. Заполнение красителем подлинзового пространства преимущественно по периферии свидетельствует о «плоской» посадке линзы, в центре – о «крутой»[4].
Кроме флюоресцеина, в качестве красителей для диагностики повреждения роговицы и конъюнктивы, в том числе и при синдроме сухого глаза, используется ещё два красителя: бенгальский разовый и лиссаминовый зеленый, которые, к сожалению практически не используются в практике отечественных офтальмологов [2].
Бенгальский розовый является производным флюоресцеина. Оба красителя относятся к группе гидроксиксантинов, но отличаются по молекулярной структуре. По данным литературы впервые закапывание бенгальского розового в качестве красителя упоминалось 1914 г., но наиболее широкое применение этого красителя в практике офтальмолога стало возможным благодаря шведскому врачу Генриху Сьёгрену, который при диагностике сухого керато-конъюнктивита заметил выделяющийся окрашенный участок слезной пленки после закапывания в поврежденные глаза пациента бенгальского розового [13]. С тех пор бенгальский розовый используется для диагностики множества другой глазной патологии, включая герпетические эпителиальные повреждения роговицы, поверхностный точечный кератит, дисфункцию мейбомиевых желез, синдром сухого глаза и т.п.
Бенгальский розовый, так же как и флюоресцеин, окрашивает не только мертвые или погибающие клетки, но и нормальные, здоровые, живые клетки и межклеточное пространство [5]. Исследование бенгальского розового показало, что он не окрашивает поверхность глаза при наличие физиологической слезной пленки или искусственной слезы. Компоненты слезной пленки, такие как муцин (олигосахарид), защищают поверхность здорового глаза, выполняя роль барьера для бенгальского розового, который окрасил бы эти клетки, если бы они не были эффективно защищены от молекул красителя. Таким образом, на участках с поврежденной целостностью слезной пленки или с дисфункцией выработки компонентов слезной пленки, бенгальский розовый может проникать через поверхность глаза , окрашивая главным образом ядра клеток и, в меньшей степени, другие структуры [5,7].
Бенгальский розовый также как и флюоресцеин обладает цитотоксичностью по отношению к эпителиальным клеткам [5,6]. К недостаткам бенгальского розового можно отнести также и субъективные ощущения пациента (жжение и чуство инородного тела при закапывании в конъюнктивальную полость). Цитотоксичность и неприятные субъективные ощущения являются основными причинами отказа офтальмологов от применения бенгальского розового в своей практике.
В отличие от известных флюоресцеина и бенгальского розового менее известный лиссаминовый зеленый не относится к группе ксантиновых красителей. Он является синтетическим производным, содержащим две аминофениловые группы. Лиссаминовый зеленый широко используется в качестве красителя в косметической, пищевой и фармацевтической промышленности [12]. В офтальмологической практике лиссаминовый зеленый применяется для прокрашивания эпителия роговицы в виде отдельно упакованных стерильных сухих полосок Lissamine Green.
Важной диагностической особенностью лиссаминового зеленого является то, что он окрашивает главным образом клетки с поврежденной мембраной и/или безжизненные клетки, как бенгальский розовый, заполняя их ядра. Другой особенностью окрашивания лиссаминовым зеленым является то, что его можно применять для диагностики эпителия при наличие покраснения глаза. Окрашивание лиссаминовым зеленым видно с большим контрастом на красном фоне, в то время как розовато-красный оттенок бенгальского розового или желтоватый оттенок флюоресцеина могут быть неразличимы на фоне красного глаза [10,12].
Лиссаминовый зеленый является единственным из перечисленных в данной статье красителей, не окрашивающим здоровые эпителиальные клетки. Результаты исследования окрашивания лиссаминовым зеленым эпителиальных клеток роговицы кролика в эксперименте и человека in vitro показали, что он не окрашивает здоровые, размножающиеся, растущие клетки и оказывает минимальное влияние на их жизнеспособность клеток [9].
Лиссаминовый зеленый не имеет канцерогенных или токсичных свойств [3,6,11]. При применении лиссаминового зеленого отсутствует жжение и другие неприятные ощущения [2]. Безопасность и удобство применения лиссаминового зеленого делают его красителем первого выбора.
Диагностическую эффективность лиссаминового зеленого в своих исследованиях подтвердил профессор M.S.Norn. Сравнивая на пациентах три вышеперечисленных красителя при различной патологии переднего отрезка глаза, он пришел к выводу, что лиссаминовый зеленый позволяет более четко дифференцировать поврежденные участки эпителия от здоровых тканей глаза [12]. Исследования Khurana А. и соавт. показали, что лиссаминовый зеленый и бенгальский розовый имеют сходную способность к быстрому реагированию при возникновении признаков сухости глаза. В исследовании, проведенного на 100 пациентах с синдромом сухого глаза, бенгальский розовый показал достоверную диагностическую эффективность в 89% случаев, а лиссаминовый зеленый в 87%. Оба красителя не вызывали окрашивания в контрольной группе [8].
Таким образом, лиссаминовый зеленый является наиболее информативным диагностическим красителем. Он позволяет более четко дифференцировать поврежденные и здоровые эпителиальные клетки, что очень важно у пользователей контактных линз. Контактная линза оказывает на эпителий роговицы и конъюнктивы не только механическое воздействие, но и способствует развитию явлений гипоксии, гиперкапнии и нарушению осмолярных эффектов [14]. Поэтому своевременная диагностика незначительных нарушений эпителия позволит предотвратить развитие более серьёзных и тяжелых осложнений.
Литература:
1. Axenfeld Theodor. Lehrbuch der Augenheilkunde. 1909, p. 32-38
2. Бржевский В.В., Сомов Е.Е. Роговично-конъюнктивальный ксероз (диагностика, клиника, лечение), 2003.
3. Clode SA: Teratogenicity and empryotoxicity study of Green S in rats. Food Chem Toxicol 1987, V.25, p.995-997.
4. Киваев А.А., Шапиро Е.И. Контактная коррекция зрения. Москва, 2000., С.104-106
5. Feenstra RPG, Tseng SCG. Comparison of fluorescein and Rose Bengal staining. Ophthalmology, 1992, V.99, N 4, p.605-617.
6. Feenstra RPG, Tseng SCG. What is actually stained by rose bengal. Acta Ophthalmologica, 1992, V.110, N 7, p.984-93.
7. Khan-Lim D, Berry M. Still confused about Rose Bengal? Current Eye Research, 2004, V.29, N4-5, p.31-317.
8. Khurana AK, Chaudhary R, Ahluwalia BK, Gupta S. Tear film profile in dry eye. Acta Ophthalmol (Copenh), 1991, N691, p.79-86.
9. Kim J. The use of vital dyes in corneal disease. Current Opinion in Ophthalmology, 2000, N 11, p.241-247.
10. Kim J, Foulks GN. Evaluation of the effect of lissamine green and rose Bengal on human corneal epithelial cells. Cornea, 1999, V.18, N 3, p.328-332.
11. Moorhouse SR, Creasy DM, Gaunt IF. Three generation toxicity study of rats ingesting Green S in the diet. Food Chem Toxicol 1987, N 25, p. 985-993.
12. Norn MS. Lissamine Green: vital staining of cornea and conjunctiva. ACTA Ophthalmologica, 1973, N 51, p. 483-491.
13. Sjogren H. Zur kenntnis der keratoconjunctivitis sicca. Acta Ophthalmol Suppl 1933, N2.
14. Tseng SCG. The ocular surface and contact lens wear. Refractive Eyecare for Ophthalmologists, 2002, N 6, p.16-19
© «ИнтелМед»
Источник
Эрозия роговицы. Диагностика
Травма роговицы является очень частой причиной обращений за экстренной офтальмологической помощью. В наиболее типичных случаях под воздействием инородного тела эпителий роговицы повреждается и отрывается от подлежащей стромы. Наиболее распространенными причинами возникновения травматических эрозий роговицы являются потирание глаза, травма ногтем, попадание мусора с потоком воздуха, химические повреждения, а также контузии (в том числе травма подушками безопасности, случаи насилия).
Диагностика эрозии роговицы
Обычно пациенты предъявляют жалобы на резкую боль, светобоязнь и покраснение глаза. Важно тщательно расспросить о механизме травмы, что позволит определить риск инфицирования или попадания инородного тела.
Диагностика эрозии роговицы при осмотре на щелевой лампе бывает затруднена, когда эпителий не полностью отрывается от подлежащей стромы. Окрашивание роговицы флюоресцеином является основой для правильной постановки диагноза. Когда эпителиальный дефект окрашен, пораженная область четко визуализируется и может быть легко измерена.
Область роговицы, лишенная эпителия, накапливает флюоресцеин и при обследовании на щелевой лампе с использованием кобальтового светофильтра приобретает зеленое свечение. Документирование вертикального и горизонтального размеров эпителиального дефекта роговицы позволяет в последующем следить за особенностями выздоровления пациента.
При осмотре дополнительно могут быть выявлены: субконъюнктивальные кровоизлияния, раны и ссадины конъюнктивы, отек стромы роговицы, складки десцеметовой мембраны, а также клеточные элементы и взвесь во влаге передней камеры. При очень тяжелых травмах эрозия роговицы может сочетаться с гифемой, сотрясением сетчатки или проникающим ранением.
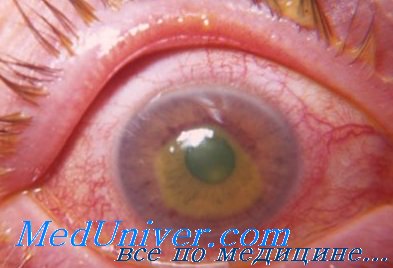
Дальнейшее обследование крайне важно для диагностики сопутствующей патологии, которая часто сочетается с эрозиями роговицы. Необходимо тщательно осмотреть непострадавший роговичный эпителий, так как может быть выявлена сопутствующая дистрофия передней базальной мембраны, так называемая map-dot-fingerprint дистрофия.
При данной патологии нарушается нормальное прикрепление эпителия к подлежащей базальной мембране, в результате чего имеется предрасположенность к возникновению эрозий при малейшей травме. Кроме того, необходимо исключить наличие кератита, а в случае, если он обнаружен, показано взять мазок на посев для последующего бактериологического исследования. Особую настороженность в отношении возможного развития кератита следует проявить при обнаружении эрозии роговицы у лиц, пользующихся контактной коррекцией зрения, либо при наличии сведений о травме органическими материалами (например, веткой дерева).
Линейные эрозии роговицы, в особенности вертикально ориентированные, указывают на необходимость тщательного обследования конъюнктивы верхнего века на предмет наличия инородных тел. В такой ситуации необходимо вывернуть верхнее веко и очистить конъюнктиву века и верхний конъюнктивальный свод при помощи ватного тампона.
Заживление эпителиальных дефектов происходит неравномерно, они приобретают неправильную или древовидную конфигурацию, что может быть ошибочно расценено как герпетический кератит. Анамнез и продолжительность заболевания в данной ситуации будут ключевыми факторами для дифференциального диагноза. Эрозии роговицы, в особенности небольших размеров, заживают в течение нескольких часов.
Если есть сомнения в правильности диагноза, следует назначить лечение как при обычной эрозии (см. ниже) и осмотреть пациента повторно на следующий день. Если древовидная форма патологического очага не изменилась, либо произошло ухудшение состояния, необходимо установить предварительный диагноз герпетического поражения и назначить соответствующее лечение.
— Также рекомендуем «Лечение эрозии роговицы. Принципы»
Оглавление темы «Обследование травм глаз»:
- Обследование травм глаз пожилых. Особенности
- Рентгенография, КТ при травме глаз. Показания, возможности
- МРТ, УЗИ при травме глаз. Показания, возможности
- Определение травмы глаза. Терминология
- Классификация травм глаза. Прогноз
- Повреждения поверхности глаза. Обследование
- Травматическое субконъюнктивальное кровоизлияние. Диагностика, лечение
- Эрозия роговицы. Диагностика
- Лечение эрозии роговицы. Принципы
- Осложнения эрозии роговицы. Прогноз
Источник


