Факоэмульсификация на эндотелий роговицы
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 30 июля 2015;
проверки требуют 14 правок.
Факоэмульсификация — микрохирургический метод удаления катаракты, в основе которого лежит фрагментация вещества хрусталика ультразвуком и его удаление из полости глазного яблока ирригационно-аспирационным методом.[1]
История[править | править код]
Первое описание характерного помутнения хрусталика можно обнаружить в медицинском сочинении «Папирус Эберса» (1525 г. до н. э). Согласно его содержанию, древние египтяне лечили катаракту глазными мазями и заклинаниями. В древности ученые пытались запечатлеть заболевания не только в рукописных трудах, но и в различных видах искусства, таких как скульптура и живопись. Так, в Египетском музее (Каир) находится статуя, представляющая собой мужчину, левый глаз которого, вероятно, поражен катарактой. Данное произведение искусства считается самым древним зарегистрированным случаем катаракты (2457-2467 гг. до н. э.).
В Фивах найдена настенная роспись (около 1200г. до н.э.), которая изображает офтальмолога, рассматривающего глаз ремесленника. Длина инструмента в его руках позволяет предположить, что он использовался для выполнения операции по удалению катаракты.
В 2001 году, недалеко от пирамидного комплекса Саккара (построенного около 2630 г. до н.э.), примерно в 30 км к югу от Каира, археологи обнаружили гробницу хирурга фараона. На стенах гробницы был изображен врач, использовавший ланцет для удаления катаракты. Подобный метод использовался офтальмологами вплоть до 1748 года, когда французский врач Дэвиль провел первое хирургическое вмешательство по удалению помутневшего хрусталика.[2]
Современный метод удаления катаркты – факоэмульсификация, впервые был предложен американским офтальмологом Чарльзом Кельманом.[2]
В 1967 году в медицинском журнале American Journal of Ophthalmology Чарльз Кельман опубликовал сообщение о новой технике удаления катаракты с применением низкочастотного ультразвука на глазах животных.[3]
Первая модель факоэмульсификатора CavitronKelman была запатентована в 1971 году. Конструкция состояла их электронного блока-генератора ультразвуковой энергии (частота 40 кГц) и никелевого пьезопреобразователя со сменными иглами с каналами для ирригации и аспирации.
В 1973 году Кельман опубликовал результаты 500 факоэмульсификаций, выполненных в клинике. Согласно полученным данным, острота зрения 0,5 и выше была достигнута почти в 90 % случаев, при этом осложнения после операции развивались значительно реже, чем после интракапсулярной экстракции катаракты.[4]
Несмотря на положительные результаты, процедура не сразу получила широкое распространение. Данная операция, по сути, являлась микрохирургическим вмешательством, выполняемым под микроскопом, что создавало дополнительные технические трудности для ее проведения.[5]
Современная модель факоэмульсификатора состоит из электромагнитного генератора с подключенной к нему рукояткой с титановой иглой, которая колеблется в продольном или поперечном направлении на ультразвуковых частотах.[6]
Подготовка к операции[править | править код]
При подготовке к факоэмульсификации, офтальмохирург должен оценить плотность ядра хрусталика и уровень сохранности его связочного аппарата, с целью оценки безопасности выбранного метода.
С целью снижения риска развития инфекционных осложнений и отека в раннем послеоперационном периоде пациенту нередко назначают нестероидные противовоспалительные препараты и антибактериальные средства в виде глазных капель.[1]
Перед операцией не рекомендуется заниматься тяжелыми физическими нагрузками. Категорически запрещается употреблять алкоголь. Прием пищи и жидкости накануне следует ограничить. За 5 дней до операции необходимо прекратить прием антикоагулянтов.[7]
Факоэмульсификация проводится под местной анестезией, для которой применяют инстилляции капель. Проводниковую анестезию – перибульбарные инъекции анестетика и блокаду лицевого нерва – выполняют по показаниям для обеспечения более глубокой анальгезии и акинезии глазного яблока.[1]
Принцип операции[править | править код]
Существует два способа проведения такой операции – торсионная факоэмульсификация и продольная. В настоящее время торсионная факоэмульсификация является более предпочтительным способом, так как торсионный ультразвук позволяет провести операцию наиболее эффективно, безопасно и персонализированно. Торсионная рукоятка дает возможность получать специальные осцилляторные колебания ультразвуковой иглы, позволяющие уменьшить тепловыделение и отталкивание фрагментов хрусталика.[8] Для обеспечения доступа к ядру хрусталика выполняются два или три небольших разреза в области лимба (основной разрез шириной 2,2 мм, дополнительный разрез (разрезы) шириной 1,2 мм). Проводится удаление передней капсулы хрусталика. Наконечник факоэмульсификатора, представляющий собой небольшую иглу, вводится в полость глаза и разделяет ядро хрусталика на отдельные фрагменты. Система обмена жидкости, связанная с насосом инструмента, позволяет одновременно с механическим разрушением ядра хрусталика проводить аспирацию хрусталиковых масс и стабилизировать внутриглазное давление поступающим стерильным изотоническим раствором. Через другие разрезы проводятся манипуляции, позволяющие разделять ядро на отдельные фрагменты и в дальнейшем удалять менее плотные фрагменты кортикальных слоев хрусталика с помощью аспирации (без механического разрушения). Операция завершается имплантацией интраокулярной линзы в капсульный мешок. Интраокулярная линза имплантируется в сложенном виде через основной разрез с помощью инжектора. Как правило, разрез имеет самогерметизирующийся профиль, поэтому в подавляющем большинстве случаев хирург не прибегает к наложению швов на роговицу.[1]
Преимущества[править | править код]
По сравнению с ранее использовавшимся методом экстракапсулярной экстракции катаракты, ультразвуковая факоэмульсификация позволяет разрушить ядро хрусталика и провести его аспирацию через небольшой разрез (2,2 мм). Достоинствами метода является меньшее число осложнений, отсутствие необходимости наложения швов, сокращение сроков реабилитации пациентов, уменьшение хирургически индуцированного астигматизма.[1] Для проведения процедуры необходим микрохирургический инструментарий и прибор — факоэмульсификатор.[5]
Возможные осложнения[править | править код]
Осложнения при факоэмульсификации встречаются реже, чем при удалении катаракты через большие разрезы. Специфические осложнения факоэмульсификации относятся к повреждающему действию факонаконечника на эндотелий роговицы глаза, что может приводить к отёку роговицы в раннем послеоперационном периоде (особенно при факоэмульсификации плотных катаракт). Предметом дискуссий остается влияние высокой частоты колебаний факонаконечника на состояние центральных отделов сетчатки глаза и стекловидного тела.[9][10][11]
Восстановление после операции[править | править код]
После факоэмульсификации пациент может покинуть клинику в день проведения операции. Чувствительность возвращается к глазу в течение нескольких часов, для восстановления зрения может потребоваться несколько дней. В течение нескольких недель после факоэмульсификации может потребоваться использование глазных капель. Читать или смотреть телевизор можно практически сразу после операции. После операции следует избегать физических нагрузок и любых воздействий на прооперированный глаз (касания, попадание мыла, шампуня, макияж и тд.). Большинство людей может вернуться к работе через несколько дней после факоэмульсификации, однако это зависит от условий рабочего процесса.[12]
Примечания[править | править код]
Ссылки[править | править код]
- Safety and efficacy of phacoemulsification compared with manual small-incision cataract surgery by a randomized controlled clinical trial: six-week results. // Ophthalmology. 2005 May;112(5):869-74. (англ.)
Источник
Малюгин Б.Э., Антонова О.П., Малютина Е.А.
Актуальность
В хирургии переднего отрезка глаза наличие первичной эндотелиальной патологии роговицы играет роль одного из наиболее значимых факторов риска развития послеоперационного отека роговицы. В наименее благоприятном варианте течения данного осложнения возможен его исход в помутнение роговицы, сопровождающееся стойким нарушением зрительных функций.
Известен факт, что возраст манифестации (5 декада жизни) самой распространенной формы первичной эндотелиальной дистрофии роговицы – дистрофии Фукса (ДФ) – совпадает с началом развития у пациентов возрастной катаракты [4, 15, 30, 31]. В случаях сочетанной патологии нередко возникает вопрос о выборе наиболее оптимальной тактики лечения таких пациентов.
На сегодняшний день не сформировано окончательного мнения о том, следует ли хирургу сначала удалять катаракту с последующей кератопластикой в случае развития декомпенсации роговицы либо придерживаться одномоментной тактики лечения. Напротив, это является предметом активной дискуссии среди офтальмохирургов. Ряд из них склоняется к проведению так называемой «тройной процедуры», т.е. выполнению эндотелиальной кератопластики одномоментно с удалением катаракты и имплантацией интраокулярной линзы, объясняя свой подход однократностью вмешательства, что обеспечивает ускоренное наступление зрительной реабилитации пациента, а также не требует дополнительных финансовых затрат, связанных с многократными госпитализациями [28]. В то же время существует альтернативное мнение, заключающееся в рекомендации по проведению последовательной хирургии. При этом этап эндотелиальной кератопластики может быть выполнен в различные сроки после экстракции катаракты либо, напротив, предшествовать таковой [5, 14, 22].
Исходные параметры состояния роговицы пациентов с катарактой и ДФ, включающие её толщину в центре (ЦТР), превышающую 640 мкм, а также плотность эндотелиальных клеток (ПЭК) ниже 500 кл/мм², свидетельствуют о пограничном состоянии роговицы [12, 27]. В таких случаях выбор хирургической тактики должен быть сделан в пользу комбинированного вмешательства. Тем не менее, хорошо известен факт, что даже у пациентов с пограничными показателями декомпенсация роговицы происходит далеко не всегда. Таким образом, существует категория больных, которым по ряду объективных причин выбор хирурга будет осуществлен в пользу исключительно удаления катаракты с имплантацией ИОЛ. В особенности это касается пациентов с катарактой, идущих на факоэмульсификацию (ФЭК) на фоне начальной стадии ДФ, характеризующейся наличием симптома капельной роговицы (сornea guttata), без явлений отека стромы роговицы, и снижением ПЭК, а в ряде случаев – с невозможностью подсчета количества эндотелиальных клеток на фоне отсутствия увеличения центральной толщины роговицы. Результативность оперативного лечения катаракты у данной категории пациентов и является предметом данного исследования.
Цель
Изучить клинико-функциональные результаты лечения пациентов с катарактой и начальной стадией первичной эндотелиальной дистрофии роговицы Фукса методом ультразвуковой факоэмульсификации с имплантацией эластичной интраокулярной линзы (ИОЛ).
Материал и методы
Исследуемая группа включала 23 пациентов с катарактой и ДФ: 6 мужчин (26,1%) и 17 женщин (73,9%), средний возраст которых составил 71,2±17,9 года (от 54 до 88 лет). Сроки развития ДФ к моменту первичного обращения известны лишь у 5-ти пациентов, они базировались на данных первичной диагностики по месту жительства и составили от 6-ти мес. до 4-х лет. Средняя исходная некорригированная острота зрения (НКОЗ) составила 0,13±0,07, корригированная острота зрения (КОЗ) равнялась 0,27±0,13.
Эндотелиальная микроскопия выявила снижение количества эндотелиальных клеток в сочетании с явлениями полимегетизма и полиморфизма, а также дефекты задней поверхности роговицы в виде гутт, представляющих собой локальные выпячивания десцеметовой мембраны в сторону передней камеры. Среднее исходное значение ПЭК составило 993±251 кл/мм². Толщина роговицы в центральной зоне до операции была в пределах нормы, среднее значение составило 568±52 мкм. Отек стромы роговицы и её эпителия по данным биомикроскопии у данной категории пациентов отсутствовал.
На всех глазах имелась катаракта различной степени твердости: на 7-ти глазах (30,4%) с ядром 2-й ст. (по Buratto L., 1999), на 12 глазах (52,17%), 3-й ст. и на 4 глазах 4-й ст. (17,4%).
Уровень внутриглазного давления (ВГД) перед операцией составил в среднем 15,0±4,5 мм рт.ст. На 5-ти глазах (21,7%) до проведения хирургического лечения диагностировали первичную открытоугольную глаукому различных стадий (от 1 до 3). У всех больных до операции была достигнута компенсация уровня ВГД инстилляциями гипотензивных препаратов либо посредством ранее выполненной антиглаукоматозной операции непроникающего типа (сроки п/о от 3-х мес. до 4-х лет). На 8-ми глазах (34,8%) по данным эхобиометрии выявлена осевая миопия, на 4-х глазах (17,4%) – осевая гиперметропия. На 3-х глазах (13%) имела место непролиферативная стадия диабетической ангиоретинопатии.
Учитывая отсутствие убедительных показаний к проведению эндотелиальной кератопластики, пациентам была рекомендована и проведена факоэмульсификация с имплантацией ИОЛ. Данное вмешательство выполняли на системе Stellaris (Baush&Lomb, США). При этом особое внимание уделяли выбору щадящих параметров факоэмульсификации. Настройки факоэмульсификатора были следующие: высота ёмкости с ирригационным раствором – 85 см, максимальная мощность УЗ – 30%, гиперпульсовой режим (80 имп/сек), двойной линейный контроль УЗ от ножной педали, максимальный вакуум в режиме УЗ – 500 мм рт.ст., в режиме ирригации-аспирации – 600 мм рт.ст.
Стоит подчеркнуть, что особое внимание в ходе операции обращали на протекцию монослоя эндотелиальных клеток роговицы, что включало в себя как минимум двукратное введение в переднюю камеру на этапе ультразвукового дробления и ирригации-аспирации хрусталика адгезивного вискоэластика Вискоат (Алкон, США), а также применение техники «phaco-chop» (факораскол) при дроблении ядра хрусталика, минимизирующей время использования активного ультразвука [8].
После завершения этапа ФЭК всем пациентам имплантировали заднекамерную гидрофобную ИОЛ в капсульный мешок. Имплантацию ИОЛ на завершающих этапах операции выполняли после заполнения капсульного мешка и передней камеры 1% раствором гиалуроната натрия – Провиск (Алкон, США). Выбор материала был сделан на основе исследований, по результатам которых доказана высокая вероятность кальцификации гидрофильной ИОЛ при её контакте с воздухом или пузырьком газа, введенным в переднюю камеру глаза при эндотелиальной кератопластике [17, 20].
Результаты
Распределение параметров ультразвуковой энергии в ходе факоэмульсификации в соответствии со степенью плотности катаракты (СПК) представлено в табл. 1.
Интраоперационных осложнений не наблюдали ни в одном случае. Наиболее частой послеоперационной находкой являлся отек роговицы с образованием складок десцеметовой оболочки, определяемый при биомикроскопии в 4-х случаях (17,4%). Во всех случаях отек купировали медикаментозно в течение первых 5-7 суток после операции.
Течение послеоперационного периода не сопровождалось инфекционными осложнениями. Пациенты получали стандартные назначения, включающие инстилляции капель антибиотика (в течение недели), стероидного и нестероидного противовоспалительных препаратов (в течение месяца), а также слезозаместителей или кератопротекторов в гелевой форме (в течение 1-2 мес.).
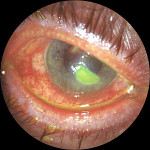
В 2-х случаях (8,7%), несмотря на первоначально полное восстановление прозрачности роговицы, спустя 3-6 мес. после операции отмечали развитие стойкого отёка роговицы и снижение остроты зрения до 0,2 (рис.). В связи с неэффективностью медикаментозного лечения этим пациентам провели трансплантацию десцеметовой мембраны. Оперативное вмешательство прошло без особенностей, и к 4 мес. послеоперационного периода достигнутая острота зрения составила 0,7 и 0,8 соответственно. Функциональные результаты этих пациентов исключены из представленных таблиц.
Оценка клинико-функциональных показателей проведенного лечения пациентов включала в себя анализ динамики остроты зрения, показателей толщины роговицы в центре по данным оптической когерентной томографии переднего отрезка глаза (Visante OCT, Carl Zeiss Meditec, Германия) и эндотелиальной микроскопии (Confoscan-4, Nidek, Япония).
У всех исследуемых пациентов после проведения стандартной методики ФЭК с имплантацией ИОЛ отмечали высокую корригированную остроту зрения на всех сроках наблюдения, которая варьировала от 0,7 до 1,0 (в среднем 0,8±0,11). Данные остроты зрения в динамике послеоперационного периода представлены в табл. 2.
При анализе кератопахиметрии (КПМ) отмечали незначительную динамику увеличения центральной толщины роговицы, средние значения которой составили 582±32 мкм к 6-му мес. послеоперационного периода (табл. 3).
Стоит отметить, что увеличение значений КПМ не коррелировало со степенью плотности катаракты и параметрами использованного ультразвука при факоэмульсификации. Объем используемой ирригационной жидкости при факоэмульсификации варьировал в диапазоне 78,2-80,4 мл.
В послеоперационном периоде выявили также снижение ПЭК. Потеря эндотелиальных клеток через 1 мес. после хирургического лечения составила 19%, к 6-ти месяцам после операции – 22,4%, к 12-ти – 22,9%, к 24-м – 24,9% (табл. 4). В последующие сроки наблюдения – от одного года после операции и далее – потеря ЭК составила 2,0%, что превышало стандартную физиологическую потерю клеток по данным литературы [1, 2, 13]. Несмотря на это, ПЭК ко 2-му году наблюдения составила 745±162 кл/мм² и не достигала критического уровня, равного 500 кл/мм².
Обсуждение
При оперативном лечении пациентов с катарактой, осложненной ЭДРФ, возможны три основных варианта хирургических вмешательств. К таковым относятся исключительно оперативное лечение катаракты, одномоментная операция – экстракция катаракты плюс эндотелиальная кератопластика, а также экстракция катаракты с центральным десцеметорексисом без эндотелиальной кератопластики [6, 19]. Как правило, экстракцию катаракты применяют у пациентов с ранними стадиями ЭДРФ либо с развитыми, при которых ещё не отмечается функциональная декомпенсация эндотелия роговицы, приводящая к её стромальному отеку. В последнем случае целесообразно ориентироваться даже не на плотность ЭК, а на центральную толщину роговицы как на индикатор функциональной активности её эндотелиального монослоя [26]. Результаты ФЭК у пациентов с ЭДРФ отличаются существенным разбросом ключевых параметров, что объективно связано как с разноплановостью исходных параметров глаза, таких, в частности, как стадия дистрофии роговицы, также как и с твердостью катаракты, выбором методики операции, наличием или отсутствием сопутствующей патологии. Процент выполненных кератопластик по причине стойкого отека у пациентов с артифакией и дистрофией роговицы Фукса по разным источникам варьирует от 3,7 до 39% [34].
В нашем исследовании получены функциональные результаты, которые следует считать высокими для данного контингента пациентов как по достигнутой остроте зрения, так и по количеству операционных и послеоперационных осложнений. В немаловажной степени это может быть объяснено тщательной протекцией эндотелия во время самой операции, в частности в процессе УЗ-фрагментации ядра хрусталика и последующей ирригации-аспирации хрусталиковых масс. Основными провокаторами декомпенсации эндотелия являются манипуляции в передней камере, объем используемой ирригационной жидкости и развитие асептического воспаления при наличии в капсульном мешке остатков кортикальных масс [11]. Повышение уровня секреции простагландинов и ряда других провоспалительных агентов, по мнению ряда авторов, может также негативно влиять на функциональную активность эндотелиоцитов [23, 25].
Среди интраоперационных факторов в аспекте наиболее щадящего воздействия на эндотелий изучались различные режимы ультразвука, в частности, торсионного и продольного. При этом отмечено более щадящее воздействие при торсионном движении ультразвуковой иглы [16, 24].
Известно, что одним из вариантов снижения УЗ-травмы эндотелия является применение фемтосекундного лазера для префрагментации ядра хрусталика. Так, Gavris M. с соавт. (2015) при применении данного метода у пациентов с ЭДРФ получили максимально высокие зрительные результаты, равные 1,0 в 100% случаев [9]. Следует отметить, что все пациенты имели катаракту 3-4 степени плотности, а среднее эффективное время УЗ (EPT) составило 4,58 сек. Это сравнимо с полученными нами результатами, при которых показатель ЕРТ составил 4,75 и 6,12 сек для дробления хрусталика 3-й и 4-й степеней твердости соответственно.
Следует подчеркнуть, что Gavris M. с соавт. не наблюдали ни одного случая декомпенсации роговицы в то время, как в нашем исследовании в 8,7% случаев (2 пациента) к сроку наблюдения 6 мес. имелась стойкая декомпенсация роговицы, потребовавшая проведения эндотелиальной кератопластики [9]. По данным Manning S. и соавт. при обследовании гораздо большей выборки пациентов, насчитывающей 2814 глаз, отек роговицы после фемтоассистированной факоэмульсификации встречался в большем проценте случаев, чем в группе стандартной методики [18]. В то же время Abell R. с соавт. отметили, что ЦТР на первые сутки была значимо выше после стандартной УЗ-факоэмульсификации по сравнению с фемтоассистированной факоэмульсификацией. Последняя также характеризовалась меньшим процентом потери эндотелиоцитов [3].
В исследовании Seitzman G. (2005) при проведении УЗ-факоэмульсификации катаракты у пациентов с ЭДРФ в 90% случаев была достигнута острота зрения 20/35 (по таблице Снеллена), что соответствует 0,7 (по таблице Сивцева-Головина), у остальных 10% (5 глаз) к году послеоперационного наблюдения потребовалось провести кератопластику [26, 27]. Следует подчеркнуть, что в данном исследовании 36,8% пациентов имели дооперационную толщину роговицы, равную или превышающую 600 мкм, в то время как средняя дооперационная кератопахиметрия в группе пациентов, обследованных нами, составила 568 мкм. Толщина роговицы в нашей группе пациентов превышала 600 мкм лишь в 25% случаев.
В группу риска развития декомпенсации эндотелия роговицы попадают пациенты с предоперационно значимым эпителиальным отеком и ЦТР более 640 мкм [7]. По мнению Seitzman G. пределом ЦТР для выполнения изолированной факоэмульсификации является 640 мкм. К низкому риску послеоперационной декомпенсации эндотелия является параметр менее 620 мкм. По статистике данного автора, проведение факоэмульсификации при ЦТР в диапазоне 620-640 мкм приводит ко второму этапу – эндотелиальной кератопластике – в 30,8% случаев сроком до 6 мес. после операции [27].
Ответ на вопрос целесообразности выполнения фемтоассистированной факоэмульсификации у пациентов с нарушениями эндотелия в настоящее время является не очевидным. Так, у пациентов, находящихся в группах низкого и среднего риска по развитию декомпенсации в послеоперационном периоде, преимущества использования фемтолазерных систем не доказаны. В частности, при анализе 1638 глаз пациентов с катарактой Day A. с соавт. было установлено отсутствие преимуществ фемтоассистированной ФЭК [7]. В ряде случаев выполнение операционных разрезов при помощи лазера приводит к повышенной потере ЭК [3].
Известно, что после проведения ФЭК у пациентов без патологии эндотелия роговицы потеря ЭК в среднем варьирует от 7,5 до 10,8% к месяцу после проведенной операции [10, 20]. По данным Walkov T. процент потери клеток через 12 мес. после операции в среднем составляет 8,5%. Разницы в соотношении потери ЭК и риска развития декомпенсации роговицы между группами фемтоассистированной ФЭ и стандартной УЗ ФЭ не отмечено [29]. Стоит, однако, подчеркнуть, что возникновение приходящего отека роговицы было выше в группе фемтоассистированной хирургии, хотя при этом он успешно купировался медикаментозно в срок, равный 1,3±0,7 мес. Полученные нами результаты потери эндотелиальных клеток у пациентов с ЭДРФ после проведения УЗ-факоэмульсификации показывают, что основное снижение связано с проведением хирургического вмешательства. В дальнейшем потеря ЭК существенно снижается, но все же превышает физиологическую.
В исследовании Hayashi K. (2011) величина потери эндотелиальных клеток к 3-му мес. после операции УЗ-факоэмульсификации у пациентов с ЭДРФ составила 5,1%. По данным Yamazoe K. (2011) и Xie L.X. (2003) на том же сроке наблюдения – 11,5 и 16,2% соответственно [32, 33]. Это меньше показателей, полученных нами (21%). Возможно, что такую разницу в результатах возможно объяснить спецификой исходного состояния оперированных глаз, а также методикой оперативного лечения пациентов. В то же время, мы считаем, что в целом более значимая потеря ЭК у пациентов с ЭДРФ после ФЭК связана с их исходным статусом и большей подверженностью негативным интра- и постоперационным факторам по сравнению со здоровыми эндотелиальными клетками.
Выводы
1. Анализируя полученные результаты лечения пациентов с катарактой и начальной стадией ЭДРФ, следует отметить, что у 91,3% (21 пациент) пролеченных больных отмечена высокая острота зрения на всех сроках наблюдения. Незначительная отрицательная динамика увеличения центральной толщины роговицы и потери эндотелиальных клеток не влияла на зрительный результат к сроку наблюдения до 2-х лет.
2. Представленные итоги клинического исследования дают основание утверждать, что проведение ФЭК с имплантацией гидрофобной модели ИОЛ является возможным и целесообразным для лечения пациентов с начальной стадией ДФ и катарактой. При этом необходимо применять наиболее щадящие УЗ и гидродинамические параметры, а также осуществлять максимальную протекцию эндотелиального слоя роговицы. В то же время следует иметь в виду, что пациенты с ЭДРФ относятся к группе риска по декомпенсации роговицы, что в нашем случае наблюдалось в 2 случаях, и это требует их динамического наблюдения в отдаленном послеоперационном периоде.
Источник