Что такое глаукома головного мозга
Филина Н.В., Мельников В.Я., Коноплёва Э.В.
Проблема глаукомы является одной из важнейших в современной офтальмологии. С каждым годом увеличивается количество больных с первичной открытоугольной глаукомой [35]. Связанно это и с определенными демографическими сдвигами. Население стареет – увеличивается распространенность данного заболевания [2].
Мировая статистика заболеваемости среди населения свидетельствует о росте частоты ПОУГ: по оценке ВОЗ, в 2010 г. численность больных глаукомой составляла около 60млн., а к 2010 г. она достигнет почти 80 млн. человек [35].
В Российской Федерации по данным статистики на 2012 г. более миллиона человек больны глаукомой и свыше 66 тысяч слепых вследствие глаукомного процесса [11].
До сих пор это заболевание является причиной необратимой слепоты и слабовидения, занимая одно из ведущих мест в перечне инвалидизирующих заболеваний органа зрения [7].
За последнее время в зарубежных публикациях можно встретить сравнение ПОУГ с болезнями Альцгеймера, Паркинсона и другими нейродегенеративными заболеваниями, поскольку у них имеется ряд схожих особенностей: рост заболеваемости с возрастом, избранное поражение одного вида нейронов, механизм гибели нервной клетки и т. д. Однако ранее офтальмологами в проводимых исследованиях изучались, в основном, сетчатка и зрительный нерв, и не уделялось внимание более высоким отделам зрительного анализатора. В связи с этим актуальным становится изучение структур зрительного пути при ПОУГ [1, 25, 33].
Роль митохондриальной патологии и других факторов в развитии глаукомы
Несмотря на многочисленные исследования этиологии и патогенеза первичной открытоугольной глаукомы, у большинства больных с длительным течением заболевания, происходит прогрессивное ухудшение зрительных функций с переходом заболевания в более тяжелую стадию. Причинами этого могут быть неизученные на сегодняшний день механизмы патогенеза и факторы прогрессирования глаукомы, в частности так называемая митохондриальная патология, на основе которой развиваются многие сочетанные заболевания, а некоторые из них протекают более тяжело [6].
Развитие нейродегенерации при глаукоме объединяет множество факторов и путей апоптоза ганглионарной клетки, но все они так или иначе связаны с митохондриями как основной единицей, ответственной за энергетические процессы в клетке и апоптоз [4, 8, 12, 20, 32].
В настоящее время доказанным считается тот факт, что наиболее ранние повреждения при глаукоме происходят в митохондриях аксонов ганглиозных клеток сетчатки (ГКС) [5]. Ведь именно митохондриям принадлежит особая роль в развитии нейродегенеративных заболеваний [2].
Предполагается, что целый ряд взаимодействующих факторов может вносить вклад в нейрональные повреждения при нейродегенеративных расстройствах, и одним из них является вторичная дисфункция митохондрий. Исходя из этого, прогрессирование глаукомы и появление глаукоматозной оптической нейропатии (ГОН), а затем и атрофии могут рассматриваться как митохондриальная патология [21].
Установлено также участие сульфгидрильных групп в процессах перекисного окисления липидных компонентов мембран, приводящих к развитию дегенеративных изменений тканей [16]. О нарушении окислительно-восстановительных процессов и тканевого дыхания может свидетельствовать также повышение уровня лактата в крови пациентов [16].
Значимым фактором прогрессирования нейродегенерации при данном заболевании считается наличие измененных протеинов: бета-амилоида и тау-белка [26, 34, 37, 40]. На культуре выделенных ганглионарных клеток сетчатки мышей было продемонстрировано нейротоксическое действие предшественника бета-амилоида в присутствии индуктора синтеза бета-амилоида. Дегенерация нейронов сетчатки была пропорциональна времени воздействия бета-амилоида и его концентрации. При добавлении в культуру клеток ингибитора синтеза бета-амилоида гибель клеток прекращалась [3, 31, 36].
По данным исследователей, тау-белок определяется и в сетчатке больных глаукомой, но в гораздо меньшем количестве. Однако при исследовании с моноклональными антителами AT8 выявления фосфорилированного тау-белка у больных глаукомой был выявлен гиперфосфорилированный тау-белок, который играет значимую роль в патогенезе болезни Альцгеймера [3, 29].
Глаукома как нейродегенеративное заболевание
Буквально до последнего времени первичную открытоугольную глаукому рассматривали как чисто глазное заболевание, основным проявлением которого является нарушение гидродинамики, приводящее к нарушениям микроциркуляции, ишемии с развитием глаукомной нейрооптикопатии. Однако со временем выяснилось, что распад зрительных функций все равно наступает, правда, существенно позже [7].
Первичная открытоугольная глаукома (ПОУГ) – заболевание, которое развивается с возрастом и характеризуется прогрессирующим течением даже на фоне нормализованного уровня офтальмотонуса [7, 35]. Как известно, механизм гибели клеток сетчатки и аксонов зрительного нерва при глаукоме, как и при всех нейродегенеративных расстройствах, – это физиологически запрограммированный апоптоз [1, 5, 10, 23, 35].
Глаукому можно отнести к заболеваниям нейродегенеративного генеза:
— эти заболевания имеют общий механизм гибели клетки; как известно гибель ганглионарных клеток сетчатки — это физиологически запрограммированная гибель клетки – апоптоз. Запуск апоптоза происходит при активации специфических протеаз – каспаз, которые, проникая в ядро клетки, разрушают ДНК. В свою очередь, активация каспаз напрямую связана с митохондриальной дисфункцией;
— отмечается гибель нейронов одного вида, нарушение межсинаптических связей, которые приводят к нарушению центральной функции; при глаукоме погибают волокна зрительного нерва и страдают зрительные функции, а при болезни Альцгеймера страдают лобные доли головного мозга и нарушаются когнитивные функции;
— нейродегенеративные заболевания развиваются с возрастом и имеют длительный хронический характер течения; также и распространенность глаукомы увеличивается в возрастной популяции, а прогрессирование заболевания происходит в течение нескольких лет [10].
Распространение дегенеративных изменений на структуры ЦНС при глаукомной оптической нейропатии (ГОН) можно объяснить с помощью процесса вторичной транссинаптической нейродегенерации, под которой понимают распро¬странение патологического процесса на здоровые нейроны, которые избежали первичного повреждения от повышенного ВГД, но прилежат к повреж¬денным нейронам, которые оказывают на них дегенеративное влияние [38, 39].
Нейродегенерация характеризуется повреждением клеток и межклеточного вещества, в результате чего происходит нарушение функции органа [3, 14]. Нейродегенеративные заболевания – это заболевания, которые возникают в результате прогрессирующей дегенерации и гибели нейронов, входящих в определенные структуры ЦНС, приводят к разрыву связей между отделами ЦНС и дисбалансу синтеза соответствующих нейромедиаторов и, как следствие, к нарушению памяти, координации движений и мыслительных способностей и т.д. [8, 20, 22, 24, 25, 27, 28].
Причиной отрицательной динамики глаукомного процесса, характеризующейся быстрым распадом зрительных функций, могут быть неизученные на сегодняшний день механизмы патогенеза и факторы прогрессирования данного заболевания, к которым относятся нарушения процессов тканевого дыхания, окислительно-восстановительных реакций и процесса перекисного окисления липидов, а также состояние митохондрий клеток сетчатки, зрительного нерва и других структур зрительного тракта. Установлено, что за процессы тканевого дыхания и трофическую регуляцию на микроциркуляторном уровне через свободные недоокисленные сульфгидрильные группы отвечают тиоловые соединения [16].
Изучение причин и механизмов развития и прогрессирования ПОУГ является необходимым условием для патогенетического обоснования лечения и профилактики прогрессирования ГОН. Развитие нейродегенерации при глаукоме может происходить вследствие множества причин, приводящих разными путями к апоптозу ганглионарной клетки. Но все они так или иначе связаны с митохондрией, основной единицей, ответственной за энергетические процессы в клетке и апоптоз. Гибель клетки в результате апоптоза происходит при всех нейродегенеративных заболеваниях [10].
Многие проведенные исследование позволили выявить грубые дегенеративные изменения на протяжении всех отделов проводящих путей зрительного анализатора, особенно на уровне наружных коленчатых тел и коркового отдела в области шпорной борозды. Данные изменения в центральной нервной системе, зарегистрированные у больных ПОУГ, имеют ряд схожих особенностей с другими нейродегенеративными заболеваниями [1].
С целью изучения патогенетического значения апоптоза при первичной открытоугольной глаукоме (ПОУГ) проведено исследование его маркеров у пациентов с глаукомой различных стадий и с подозрением на ее наличие в сыворотке крови и слезной жидкости. Выявлены характерные особенности в состоянии системы Fas/FasL, связанные со стадией глаукоматозного процесса и коррелирующие с некоторыми клинико-функциональными (периметрическими) показателями, что важно как для понимания патогенеза ПОУГ, так и для прогнозирования течения заболевания [19].
Новые методы диагностики глаукомы
Новое понимание процессов развития глаукоматозного процесса дает возможность искать новые средства диагностики данной патологии и прогноза ее развития. Так, важной становится оценка функций митохондрий. Для этого в настоящее время используют клинические, морфологические (гистохимическое изучение активности ферментов митохондрии и распределение в ней различных субстратов – липидов, гликогена, солей кальция – в биоптатах тканей), биохимические (оценка уровней лактата и пирувата, антиоксидантной активности, продуктов перекисного окисления липидов крови) и молекулярно-генетические методы (выявление мутаций митохондриальной ДНК и ядерных мутаций, приводящих к нарушению синтеза митохондриальных белков) [9, 21].
Предложен метод функциональной диагностики, основанный на анализе суммарной биоэлектрической активности головного мозга с помощью диагностического аппарата «Магнитоэнцефалограф индукционный МЭГИ-01». Этот метод позволяет подойти к выявлению заболевания на стадии доморфологических изменений. Таким образом, исследовав при помощи магнитоэнцефалографии суммарную биоэлектрическую активность головного мозга при глаукоме, они обнаружили отклонения, отражающие основные патогенетические звенья развития данного заболевания. Они заключались в усилении симпатических влияний на глаз вегетативной нервной системы, застое в венозной системе глаза, ослабление трофической функции парасимпатической нервной системы на глаз. У офтальмологически здоровых пациентов таких изменений зарегистрировано не было [17].
Изучены закономерности изменений суммарной биоэлектрической активности головного мозга при первичной открытоугольной глаукоме с помощью индукционной магнитной энцефалографии. Выявлены специфичные для первичной открытоугольной глаукомы изменения диффузной биоэлектрической активности головного мозга: нарушение работы адренорецепторных структур глаза, ослабление парасимпатического влияния на нервно-рецепторный аппарат, отличающийся богатством и разнообразием форм рецепторных элементов, сконцентрированных на границе цилиарного тела и дренажной зоны глаза [18].
Подводя итог, необходимо отметить, что глаукома действительно может рассматриваться как нейродегенеративный процесс, так как имеет много общего с такими заболеваниями, как болезнь Альцгеймера и болезнь Паркинсона [30]. Теперь становится ясным, что воздействовать надо не только на внутриглазное давление, но и на другие звенья патогенеза глаукомной нейропатии, такие как эксайтотоксичность, оксидативный стресс, митохондриальная дисфункция, аксонопатия и протеинопатия. Только в совокупности гипотензивного лечения с нейропротективным удастся достигнуть благоприятного результата и остановить прогрессирование дегене¬ративного процесса при глаукоме [13].
Источник
Глаукома – хроническая патология глаз, характеризующаяся повышением внутриглазного давления, развитием оптической нейропатии и нарушениями зрительной функции. Клинически глаукома проявляется сужением полей зрения, болью, резью и ощущением тяжести в глазах, затуманиванием зрения, ухудшением сумеречного зрения, в тяжелых случаях слепотой. Диагностика глаукомы включает в себя периметрию, тонометрию и тонографию, гониоскопию, оптическую когерентную томографию, лазерную ретинотомографию. Лечение глаукомы требует использования антиглаукомных капель, применения методов лазерной хирургии (иридотомии (иридэктомии) и трабекулопластики) или проведения антиглаукоматозных операций (трабекулэктомии, склерэктомии, иридэктомии, иридоциклоретракции и др.).
Общие сведения
Глаукома – одно из самых грозных заболеваний глаз, приводящих к потере зрения. Согласно имеющимся данным, глаукомой страдают около 3 % населения, а у 15% незрячих людей во всем в мире глаукома послужила причиной слепоты. В группе риска по развитию глаукомы находятся люди старше 40 лет, однако в офтальмологии встречаются такие формы заболевания, как юношеская и врожденная глаукома. Частота заболевания значительно увеличивается с возрастом: так, врожденная глаукома диагностируется у 1 из 10-20 тыс. новорожденных; в группе 40-45-летних людей – в 0,1% случаев; у 50-60-летних – в 1,5% наблюдений; после 75 лет – более чем в 3% случаев.
Под глаукомой понимают хроническое заболевание глаз, протекающее с периодическим или постоянным повышением ВГД (внутриглазного давления), расстройствами оттока ВГЖ (внутриглазной жидкости), трофическими нарушениями в сетчатке и зрительном нерве, что сопровождается развитием дефектов поля зрения и краевой экскавации ДЗН (диска зрительного нерва). Понятием «глаукома» сегодня объединяют около 60 различных заболеваний, имеющих перечисленные особенности.
Глаукома
Причины развития глаукомы
Изучение механизмов развития глаукомы позволяет говорить о мультифакторном характере заболевания и роли порогового эффекта в ее возникновении. То есть для возникновения глаукомы необходимо наличие ряда факторов, которые в сумме вызывают заболевание.
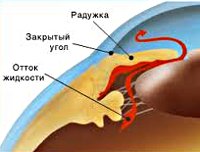
Патогенетический механизм глаукомы связан с нарушением оттока внутриглазной жидкости, играющей ключевую роль в обмене веществ всех структур глаза и поддержании нормального уровня ВГД. В норме вырабатываемая ресничным (цилиарным) телом водянистая влага скапливается в задней камере глаза – щелевидном пространстве, расположенным позади радужки. 85-95% ВГЖ через зрачок перетекает в переднюю камеру глаза – пространство между радужкой и роговицей. Отток внутриглазной жидкости обеспечивается особой дренажной системой глаза, расположенной в углу передней камеры и образованной трабекулой и шлеммовым каналом (венозным синусом склеры). Через эти структуры ВГЖ оттекает в склеральные вены. Незначительная часть водянистой влаги (5-15%) оттекает дополнительным увеосклеральным путем, просачиваясь через ресничное тело и склеру в венозные коллекторы сосудистой оболочки.
Для поддержания нормального ВГД (18-26 мм рт. ст.) необходим баланс между оттоком и притоком водянистой влаги. При глаукоме это равновесие оказывается нарушенным, в результате чего в полости глаза скапливается избыточное количество ВГЖ, что сопровождается повышением внутриглазного давления выше толерантного уровня. Высокое ВГД, в свою очередь, приводит к гипоксии и ишемии тканей глаза; компрессии, постепенной дистрофии и деструкции нервных волокон, распаду ганглиозных клеток сетчатки и в конечном итоге – к развитию глаукомной оптической нейропатии и атрофии зрительного нерва.
Развитие врожденной глаукомы обычно связано с аномалиями глаз у плода (дисгенезом угла передней камеры), травмами, опухолями глаз. Предрасположенность к развитию приобретенной глаукомы имеется у людей с отягощенной наследственностью по данному заболеванию, лиц, страдающих атеросклерозом и сахарным диабетом, артериальной гипертонией, шейным остеохондрозом. Кроме этого, вторичная глаукома может развиваться вследствие других заболеваний глаз: дальнозоркости, окклюзии центральной вены сетчатки, катаракты, склерита, кератита, увеита, иридоциклита, прогрессирующей атрофии радужки, гемофтальма, ранений и ожогов глаз, опухолей, хирургических вмешательств на глазах.
Классификация глаукомы
По происхождению различают первичную глаукому, как самостоятельную патологию передней камеры глаза, дренажной системы и ДЗН, и вторичную глаукому, являющуюся осложнением экстра- и интраокулярных нарушений.
В соответствии с механизмом, лежащим в основе повышения ВГД, выделяют закрытоугольную и открытоугольную первичную глаукому. При закрытоугольной глаукоме имеет место внутренний блок в дренажной системе глаза; при открытоугольной форме – угол передней камеры открыт, однако отток ВГЖ нарушен.
В зависимости от уровня ВГД глаукома может протекать в нормотензивном варианте (с тонометрическим давлением до 25 мм рт. ст.) или гипертензивном варианте с умеренным повышением тонометрического давления (26-32 мм рт. ст.) либо высоким тонометрическим давлением (33 мм рт. ст. и выше).
По течению глаукома может быть стабилизированной (при отсутствии отрицательной динамики в течение 6 месяцев) и нестабилизированной (при тенденции к изменениям поля зрения и ДЗН при повторных обследованиях).
По выраженности глаукомного процесса различают 4 стадии:
- I (начальная стадия глаукомы) – определяются парацентральные скотомы, имеется расширение оптического диска, экскавация ДЗН не доходит до его края.
- II (стадия развитой глаукомы) – поле зрения изменено в парцентральном отделе, сужено в нижне- и/или верхневисочном сегменте на 10° и более; экскавация ДЗН носит краевой характер.
- III (стадия далеко зашедшей глаукомы) – отмечается концентрическое сужение границ поля зрения, выявляется наличие краевой субтотальной экскавации ДЗН.
- IV (терминальная стадия глаукомы) – имеет место полная утрата центрального зрения либо сохранность светоощущения. Состояние ДЗН характеризуется тотальной экскавацией, деструкцией нейроретинального пояска и сдвигом сосудистого пучка.
В зависимости от возраста возникновения выделяют глаукому врожденную (у детей до 3-х лет), инфантильную (у детей от 3-х до 10-ти лет), ювенильную (у лиц в возрасте от 11-ти до 35-ти лет) и глаукому взрослых (у лиц старше 35-ти лет). Кроме врожденной глаукомы, все остальные формы являются приобретенными.
Симптомы глаукомы
Клиническое течение открытоугольной глаукомы, как правило, бессимптомное. Сужение поля зрения развивается постепенно, иногда прогрессирует в течение нескольких лет, поэтому нередко пациенты случайно обнаруживают, что видят только одним глазом. Иногда предъявляются жалобы на затуманивание взгляда, наличие радужных кругов перед глазами, головную боль и ломоту в надбровной области, снижение зрения в темноте. При открытой глаукоме обычно поражаются оба глаза.
В течении закрытоугольной формы заболевания выделяют фазу преглаукомы, острого приступа глаукомы и хронической глаукомы.
Преглаукома характеризуется отсутствием симптоматики и определяется при офтальмологическом обследовании, когда выявляется узкий или закрытый угол передней камеры глаза. При преглаукоме больные могут видеть радужные круги на свету, ощущать зрительный дискомфорт, кратковременную потерю зрения.
Острый приступ закрытоугольной глаукомы обусловлен полным закрытием угла передней камеры глаза. ВГД может достигать при этом 80 мм. рт. ст. и выше. Приступ может провоцироваться нервным напряжением, переутомлением, медикаментозным расширением зрачка, длительным пребыванием в темноте, долгой работой со склоненной головой. При приступе глаукомы появляется резкая боль в глазу, внезапное падение зрения вплоть до светоощущения, гиперемия глаз, потускнение роговицы, расширение зрачка, который приобретает зеленоватый оттенок. Именно поэтому типичному признаку заболевание получило свое название: «glaucoma» переводится с греческого как «зеленая вода». Приступ глаукомы может протекать с тошнотой и рвотой, головокружением, болями в сердце, под лопаткой, в животе. На ощупь глаз приобретает каменистую плотность.
Острый приступ закрытоугольной глаукомы является неотложным состоянием и требует скорейшего, в течение нескольких ближайших часов, снижения ВГД медикаментозным или хирургическим путем. В противном случае больному может грозить полная необратимая потеря зрения.
Со временем глаукома принимает хроническое течение и характеризуется прогрессирующим увеличение ВГД, рецидивирующими подострыми приступами, нарастанием блокады угла передней камеры глаза. Исходом хронической глаукомы служит глаукомная атрофия зрительного нерва и потеря зрительной функции.
Диагностика глаукомы
Раннее выявление глаукомы имеет важное прогностическое значение, определяющее эффективность лечения и состояние зрительной функции. Ведущее значение в диагностике глаукомы играет определение ВГД, детальное изучение глазного дна и ДЗН, исследование поля зрения, обследование угла передней камеры глаза.
Основными методами измерения внутриглазного давления служит тонометрия, эластотонометрия, суточная тонометрия, отражающая колебания ВГД в течение суток. Показатели внутриглазной гидродинамики определяются с помощью электронной тонографии глаза.
Неотъемлемой частью обследования при глаукоме является периметрия – определение границ поля зрения с помощью различных методик – изоптопериметрии, кампиметрии, компьютерной периметрии и др. Периметрия позволяет выявить даже начальные изменения полей зрения, которые не замечаются самим пациентом.
С помощью гониоскопии при глаукоме офтальмолог имеет возможность оценить строение угла передней камеры глаза и состояние трабекулы, через которую происходит отток ВГЖ. Информативные данные помогает получить УЗИ глаза.
Состояние ДЗН является важнейшим критерием оценки стадии глаукомы. Поэтому в комплекс офтальмологического обследования включается проведение офтальмоскопии — процедуры осмотра глазного дна. Для глаукомы характерно углубление и расширение сосудистой воронки (экскавации) ДЗН. В стадии далеко зашедшей глаукомы отмечается краевая экскавация и изменение цвета диска зрительного нерва.
Более точный качественный и количественный анализ структурных изменений ДЗН и сетчатки проводится с помощью лазерной сканирующей офтальмоскопии, лазерной поляриметрии, оптической когерентной томографии или гейдельбергской лазерной ретинотомографии.
Лечение глаукомы
Существует три основных подхода к лечению глаукомы: консервативный (медикаментозный), хирургический и лазерный. Выбор лечебной тактики определяется типом глаукомы. Задачами медикаментозного лечения глаукомы служат снижение ВГД, улучшение кровоснабжения внутриглазного отдела зрительного нерва, нормализация метаболизма в тканях глаза. Антиглаукомные капли по своему действию делятся на три большие группы:
- Препараты, улучшающие отток ВГЖ: миотики (пилокарпин, карбахол); симпатомиметики (дипивефрин); простагландины F2 альфа – латанопрост, травопрост).
- Средства, ингибирующие продукцию ВГЖ: селективные и неселективные ß-адреноблокаторы (бетаксолол, бетаксолол, тимолол и др.); a- и β-адреноблокаторы (проксодолол).
- Препараты комбинированного действия.
При развитии острого приступа закрытоугольной глаукомы требуется незамедлительное снижение ВГД. Купирование острого приступа глаукомы начинают с инстилляции миотика — 1% р-ра пилокарпина по схеме и р-ра тимолола, назначения диуретиков (диакарба, фуросемида). Одновременно с лекарственной терапией проводят отвлекающие мероприятия – постановку банок, горчичников, пиявок на височную область (гирудотерапию), горячие ножные ванны. Для снятия развившегося блока и восстановления оттока ВГЖ необходимо проведение лазерной иридэктомии (иридотомии) или базальной иридэктомии хирургическим методом.
Методы лазерной хирургии глаукомы довольно многочисленны. Они различаются типом используемого лазера (аргонового, неодимового, диодного и др.), способом воздействия (коагуляция, деструкция), объектом воздействия (радужка, трабекула), показаниями к проведению и т. д. В лазерной хирургии глаукомы широкое распространение получили лазерная иридотомия и иридэктомия, лазерная иридопластика, лазерная трабекулопластика, лазерная гониопунктура. При тяжелых степенях глаукомы может выполняться лазерная циклокоагуляция.
Не потеряли своей актуальности в офтальмологии и антиглаукоматозные операции. Среди фистулизирующих (проникающих) операций при глаукоме, наиболее распространены трабекулэктомия и трабекулотомия. К нефистулизирующим вмешательствам относят непроникающую глубокую склерэктомию. На нормализацию циркуляции ВГЖ направлены такие операции, как иридоциклоретракция, иридэктомия и др. С целью снижения продукции ВГЖ при глаукоме проводится циклокриокоагуляция.
Прогноз и профилактика глаукомы
Необходимо понимать, что полностью излечиться от глаукомы невозможно, однако данное заболевание можно держать под контролем. На ранней стадии заболевания, когда еще не произошли необратимые изменения, могут быть достигнуты удовлетворительные функциональные результаты лечения глаукомы. Бесконтрольное течение глаукомы приводит к необратимой потере зрения.
Профилактика глаукомы заключается в регулярных осмотрах окулистом лиц групп риска — с отягощенным соматическим и офтальмологическим фоном, наследственностью, старше 40 лет. Пациенты, страдающие глаукомой, должны находиться на диспансерном учете у офтальмолога, регулярно каждые 2-3 месяца посещать специалиста, пожизненно получать рекомендуемое лечение.
Источник


